总胆红素(TBIL)测定试剂盒(化学氧化法)产品技术要求百奥泰康
总胆红素(TBIL)测定试剂盒(重氮法)产品技术要求百奥泰康

总胆红素(TBIL)测定试剂盒(重氮法)适用范围:该试剂盒用于体外定量测定人血清中总胆红素的浓度。
1.1 产品规格1.2 组成成分该试剂盒由试剂1(R1)、试剂2(R2)和校准品(选配)组成。
1.2.1试剂组成试剂1: 对氨基苯磺酸≥10.0mmol/L 十六烷基三甲基溴化铵≥5.0mmol/L试剂2: 亚硝酸钠≥1.0mmol/L 1.2.2 校准品组成牛血清总胆红素目标浓度:200μmol/L该校准品为牛血清基质冻干品2.1 外观a) R1应为无色溶液,无混浊,无未溶解物。
b) R2应为无色溶液,无混浊,无未溶解物。
c) 校准品应为白色至淡黄色固体。
2.2 净含量液体组分不少于标示值。
2.3 试剂空白2.3.1试剂空白吸光度应不大于0.050。
2.4 分析灵敏度TBIL试剂盒测定浓度100.0μmol/L的被测物时,吸光度差值(ΔA)应不小于0.050。
2.5 准确度用纯品测定回收率,应在85%-115%之间。
2.6 精密度2.6.1重复性变异系数应不大于5%。
2.6.2批间差批间相对极差(R)应不大于10%。
2.6.3校准品批内瓶间差测试校准品,所得结果的批内瓶间差应不大于5%。
2.7 线性在(0,427.0]μmol/L范围内,TBIL试剂盒的线性相关系数r应不低于0.9900;在(0,50.0]范围内绝对偏差应不超过5.0μmol/L,在(50.0,427.0]范围内相对偏差应不超过±10%。
2.8校准品溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品控制物质赋值的计量学溯源性》及有关规定提供总胆红素校准品的来源、赋值过程以及测量不确定度等内容。
校准品溯源至国家参考物质GBW(E)090002。
2.9稳定性2.9.1校准品复溶稳定性校准品复溶后,在2℃~8℃密封保存24小时,测试试剂盒准确度,应符合2.5的要求。
2.9.2 试剂盒稳定性原包装的TBIL试剂盒在2℃~8℃避光保存,有效期为18个月。
总胆红素(T—BIL)测定试剂盒(化学氧化法)产品技术要求深圳锦瑞

医疗器械产品技术要求编号:
总胆红素(T-BIL)测定试剂盒
(化学氧化法)
2.性能指标
2.1外观和性状
试剂R1应为无色澄清液体,R2应为无色澄清液体,均无沉淀、悬浮物和絮状物。
2.2装量
液体试剂的净含量应不少于试剂盒上的标示值。
2.3试剂空白度
<0.1A。
试剂以蒸馏水为空白时,在37 ℃ 1 ℃下,吸光度A
450 nm(光径1cm)
2.4分析灵敏度
试剂(盒)测试15 μmol/L被测物时,吸光度值差值(△A)应不小于0.02A。
2.5线性范围
2.5.1试剂盒在(2~685.0)μmol/L范围内,其回归系数r≥0.990。
2.5.2线性的相对偏差或绝对偏差应符合表 2 要求。
表1 相对偏差或绝对偏差
2.6测量精密度
2.6.1试剂重复性的变异系数:CV ≤ 4%。
2.6.2试剂盒批间差相对偏差(R)≤ 5%。
2.7准确度
相对偏差应≤±10%。
— 1 —。
总胆红素测定试剂盒(钒酸盐氧化法)产品技术要求meigaoyi

总胆红素测定试剂盒(钒酸盐氧化法)适用范围:用于体外定量检测人血清中总胆红素的浓度。
1.1包装规格a) 试剂1:2×60ml,试剂2:2×15ml;b) 试剂1:4×60ml,试剂2:4×15ml;c) 试剂1:3×80ml,试剂2:3×20ml;d) 试剂1:2×40ml,试剂2:2×10ml;e)试剂1:2×400ml,试剂2:2×100ml;f)试剂1:2×72ml,试剂2:2×18ml;g)试剂1:12×16ml ,试剂2:12×4ml;h)试剂1:1×40ml,试剂2:1×10ml。
1.2主要组成成分试剂1主要成成组分试剂2主要组成成分2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2 试剂1应为无色或淡黄色透明溶液;试剂2应为无色或淡黄色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白吸光度在450nm波长下,测定试剂空白吸光度,应≤0.05。
2.4 分析灵敏度测试550 umol/L的被测物时,吸光度变化(ΔA)应不低于0.15。
2.5 准确度测定国家标准品(YY90377),测定值与靶值相对偏差不超过±10%。
2.6 精密度2.6.1批内精密度批内精密度应不大于5%。
2.6.2批间差抽取3个不同批号试剂,对两个浓度样品进行重复检测,批间差应不大于10%。
2.7 线性2.7.1 在[3,628]umol/L区间内,线性回归的相关系数(r)应不低于0.990;2.7.2 (50,628]umol/L区间内,相对偏差不超过±15%。
2.7.3 [3,50]umol/L区间内,绝对偏差不超过±7.5umol/L。
2.8 稳定性该产品在2℃~8℃条件下贮存有效期为18个月,取效期末的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6.1、2.7之规定。
总胆红素测定试剂盒(钒酸盐氧化法)产品技术要求

医疗器械产品技术要求编号:总胆红素测定试剂盒(钒酸盐氧化法)1.产品型号/规格及划分说明1.1包装规格试剂1:60mL×8、试剂2:60mL×2;试剂1:68mL×3、试剂2:51mL×1;试剂1:50mL×4、试剂2:25mL×2;试剂1:60mL×1、试剂2:15mL×1;试剂1:68mL×3、试剂2:17mL×3;试剂1:60mL×3、试剂2:45mL×1;试剂1:60mL×6、试剂2:45mL×2;试剂1:20mL×1、试剂2:5mL×1;1200测试/盒(试剂1:68mL×2、试剂2:17mL×2);2400测试/盒(试剂1:68mL×4、试剂2:17mL×4);1750测试/盒(试剂1:100mL×2、试剂2:25mL×2);1050测试/盒(试剂1:20mL×6、试剂2:10mL×3);1680测试/盒(试剂1:48mL×4、试剂2:12mL×4);1260测试/盒(试剂1:48mL×3、试剂2:36mL×1);800测试/盒(试剂1:24mL×2、试剂2:6mL×2);1000测试/盒(试剂1:50mL×4、试剂2:24mL×2);1800测试/盒(试剂1:68mL×3、试剂2:50mL×1);750测试/盒(试剂1:60mL×1、试剂2:14mL×1);2200测试/盒(试剂1:72mL×4、试剂2:23mL×4)。
1.2组成成分试剂1:酒石酸缓冲液(pH=3.0)100mmol/L试剂2:磷酸缓冲液(pH=7.0)10mmol/L偏钒酸钠 3.5mmol/L1.3适用范围仅供定量测定人血清中总胆红素的浓度。
总胆红素(TBIL)测定试剂盒(重氮盐法)产品技术要求lideman

总胆红素(TBIL)测定试剂盒(重氮盐法)适用范围:本产品用于体外定量测定人血清中总胆红素的含量。
1.1规格试剂1(R1):4×80mL,试剂2(R2):1×16mL;试剂1(R1):5×60mL,试剂2(R2):1×16mL;试剂1(R1):3×40mL,试剂2(R2):1× 6mL;试剂1(R1): 4×80mL,试剂2(R2):4×16mL;试剂1(R1):5×60mL,试剂2(R2):5×12mL;试剂1(R1):4×80mL,试剂2(R2):4×20mL;试剂1(R1):4×60mL,试剂2(R2):4×20mL;试剂1(R1):5×60mL,试剂2(R2):5×15mL;试剂1(R1):1×20mL,试剂2(R2):1×3mL。
1.2 组成表1 试剂组成2.1 外观液体双试剂:试剂1(R1)为无色澄清液体,试剂2(R2)为无色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度在37℃、(546 nm±10%范围内的)波长、1cm光径条件下,试剂空白吸光度应<0.1 ABS。
2.4 分析灵敏度浓度为84.9μmol/L时,吸光度变化范围在(0.2-0.5)之间。
2.5 线性范围在[0 -340]μmol/L线性范围内,线性相关系数r2 ≥0.996。
在(100–340]μmol/L范围内的相对偏差≤10%;测定结果[0-100]μmol/L时绝对偏差≤10μmol/L。
2.6 精密度试剂盒测试项目精密度 CV< 6%。
2.7 批间差不同批号之间测定结果的相对极差应< 10%。
2.8 准确度相对偏差:用参考物质配制一定浓度的溶液作为样本进行检测,其测量结果在(100–340]μmol/L范围内的相对偏差≤10%,在[0-100]μmol/L范围内的绝对偏差≤10μmol/L。
【2017年整理】总胆红素(TBIL)钒酸盐氧化法

目录1. 检测原理2. 标本采集与处理2.1 受检者的准备2.2 静脉采血2.3 抗凝剂2.4 标本处理3. 试剂3.1 试剂3.2 校准血清3.3 试剂与校准血清的稳定性4. 仪器5. 操作6. 计算7. 操作性能7.1 精密度7.2 准确度7.3 灵敏度7.4 可报告范围7.5 特异性7.6 干扰8. 参考值9. 临床意义附录A: 参数1. 检测原理钒酸盐测定钒酸盐作用前后吸光度差异,可求得样品中的直接胆红素的浓度。
胆红素————胆绿素pH 3.02. 标本采集与处理2.1 受检者的准备:病人空腹12h,不饮酒24h后采集血样。
体检对象抽血前应有两周的的正常状况记录。
注意有无应用影响测试项目的药物。
此外,对于体检者,采血的季节都应做相关记录,因为样本中各项目的含量有季节性变动,为了前后比较应在每年同一季节检验。
应嘱体检对象在抽血前24小时内不做剧烈运动。
2.2 静脉采血:除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,会影响测试项目的浓度。
在采血前至少应静坐5分钟,一般从肘静脉取血,使用止血带的时间不超过1分钟,穿刺成功后立即松开止血带。
2.3 抗凝剂:血浆多主张用EDTANa2(1mg/mL)抗凝。
2.4 标本处理:血标本室温放置30min~45min后离心分离血清或血浆,在两小时内检测完毕;如两小时内不能检测完毕,将离心分离血清或血浆置洁净试管加盖2-8℃保存。
3.试剂3.1 试剂:本科使用湖南永和阳光科技有限责任公司TBIL试剂盒,为液体双试剂,各组分如下:3.2 校准血清:使用湖南永和阳光科技有限责任公司提供的40项校准血清。
校准频次:空白定标:每日需做试剂空白定标。
全点定标:试剂换批号使用时或质控结果超过规定的2SD范围,需要全点定标。
3.3 试剂与校准血清的稳定性:原包装试剂储存在2-8℃至标签所示失效日期。
试剂开瓶后,在仪器中至少可保存30天。
试剂储存在18-22℃稳定28天,试剂应避免污染。
总胆红素(TBIL)含量检测试剂盒说明书__ 可见分光光度法UPLC-MS-6031
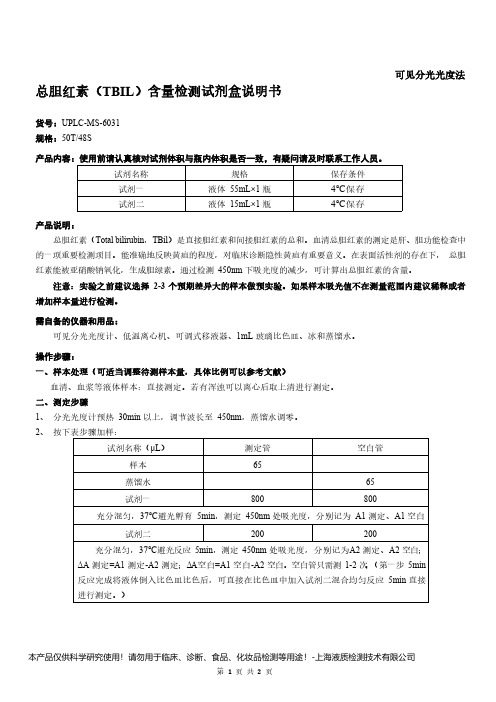
可见分光光度法总胆红素(TBIL)含量检测试剂盒说明书货号:UPLC-MS-6031规格:50T/48S产品内容:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系工作人员。
试剂名称规格保存条件试剂一液体55mL×1瓶4℃保存试剂二液体15mL×1瓶4℃保存产品说明:总胆红素(Total bilirubin,TBil)是直接胆红素和间接胆红素的总和。
血清总胆红素的测定是肝、胆功能检查中的一项重要检测项目。
能准确地反映黄疸的程度,对临床诊断隐性黄疸有重要意义。
在表面活性剂的存在下,总胆红素能被亚硝酸钠氧化,生成胆绿素。
通过检测450nm下吸光度的减少,可计算出总胆红素的含量。
注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计、低温离心机、可调式移液器、1mL玻璃比色皿、冰和蒸馏水。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)血清、血浆等液体样本:直接测定。
若有浑浊可以离心后取上清进行测定。
二、测定步骤1、分光光度计预热30min以上,调节波长至450nm,蒸馏水调零。
2、按下表步骤加样:试剂名称(μL)测定管空白管样本65蒸馏水65试剂一800800充分混匀,37℃避光孵育5min,测定450nm处吸光度,分别记为A1测定、A1空白试剂二200200充分混匀,37℃避光反应5min,测定450nm处吸光度,分别记为A2测定、A2空白;ΔA测定=A1测定-A2测定;ΔA空白=A1空白-A2空白。
空白管只需测1-2次。
(第一步5min反应完成将液体倒入比色皿比色后,可直接在比色皿中加入试剂二混合均匀反应5min直接进行测定。
)三、TBIL含量计算1、计算公式TBIL含量(μmol/L)=491.98×(ΔA测定-ΔA空白)+18.478注意事项:1、胆红素见光易分解,测定时要尽量避光。
总胆红素检测试剂盒

◆许可证号:浙食药监械生产许20090029号 ◆产品注册号: ◆产品标准号: -20093.4~21.7μmol/L(参照《全国临床检验操作规程》,建议各实验室建立自己的参考范围)检验结果的解释本法的检测范围为0~400μmol/L ,当样品测定值超过上限,应将样品用生理盐水进行稀释,重新测定,结果乘以稀释倍数。
检验结果的局限性1、当样品中抗坏血酸浓度≥1704μmol/L ,血红蛋白浓度≥4.0g/L ,甘油三酯浓度≥20mmol/L 时对测定结果又干扰。
2、血清中TBIL 的测定只是临床医师对患者进行诊断的指标之一,临床医师还要根据患者的体症、病史以及其他诊断项目、诊断手段进行综合判断。
产品性能指标1、线性范围:0~400μmol/L (相关系数r ≥0.99)2、重复性:测量精密度CV ≤4%、批间差≤8%3、准确度:相对偏差<10%注意事项1、试剂盒样品用量可因仪器要求不同,按比例增减,计算公式不变。
2、本试剂仅供体外诊断用,试剂产生的废液及使用后难以降解的包装材料应集中收集后交当地废物处理站处理。
3、试剂使用后立即盖紧瓶盖,避免污染。
4、不同方法学试剂的质量控制结果之间会存在差异,使用时请确保质控选择与试剂的方法学保持一致。
5、不同批号的试剂不建议混用,如混用应重新校准。
参考文献1、叶应妩,王毓三.全国临床检验操作规程[M],3版.南京:东南大学出版社.,2006:452-457.2、德田邦明,古本和仁:临床化学22(2),116-122(1993)。
总胆红素检测试剂盒说明书(氧化法)企业名称:温州市维日康生物科技有限公司 生产地址:温州市瓯海区娄桥工业园园一路邮政编码:325000 电话:0577- 86585999 86585666 传真:0577- 86581858 网址: 邮箱:weirikan@感谢您使用我们的产品,使用前请仔细阅读此说明书总胆红素检测试剂盒说明书(氧化法)产品名称1、中文名称:总胆红素检测试剂盒(氧化法)2、英文名称:Total Bilirubin Determine Reagent Kit(Oxidation method)3、英文缩写:TBIL或TB包装规格预期用途本试剂盒用于体外定量检测人血清中总胆红素(TBIL)的含量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
总胆红素(TBIL)测定试剂盒(化学氧化法)
适用范围:该试剂盒用于体外定量测定人血清中总胆红素的浓度。
1.1 产品规格
1.2 组成成分
该试剂盒由试剂1(R1)、试剂2(R2)和校准品(选配)组成。
1.2.1试剂组成
试剂1: 磷酸盐缓冲液≥100.0mmol/L 表面活性剂≥1.0mL/L
试剂2: 磷酸盐缓冲液(pH7.00)≥10.0mmol/L
化学氧化剂≥10.0mmol/L 1.2.2 校准品组成
牛血清
总胆红素目标浓度:200μmol/L
该校准品为牛血清基质冻干品
2.1 外观
a) R1应为无色溶液,无混浊,无未溶解物。
b) R2应为无色溶液,无混浊,无未溶解物。
c) 校准品应为白色至淡黄色固体
2.2 净含量
液体组分不少于标示值。
2.3 试剂空白
2.3.1试剂空白吸光度
应不大于0.050。
2.4 分析灵敏度
TBIL试剂盒测定浓度100.0μmol/的被测物时,吸光度差值(ΔA)应不小于0.050。
2.5 准确度
测试参考物质,测定结果的相对偏差应不超过±10%。
2.6 精密度
2.6.1重复性
变异系数应不大于5%。
2.6.2批间差
批间相对极差(R)应不大于10%。
2.6.3校准品批内瓶间差
测试校准品,所得结果的批内瓶间差应不大于5%。
2.7 线性
在(0,684.0]μmol/L范围内,TBIL试剂盒的线性相关系数r应不低于0.9900;在(0,50.0]范围内绝对偏差应不超过5.0μmol/L,在(50.0,684.0]范围内相对偏差应不超过±10%。
2.8校准品溯源性
依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品控制物质赋值的计量学溯源性》及有关规定提供总胆红素校准品的来源、赋值过程以及测量不确定度等内容。
校准品溯源至国家参考物质GBW(E)090002。
2.9稳定性
2.9.1校准品复溶稳定性
校准品复溶后,在2℃~8℃密封保存24小时,测试试剂盒准确度,应符合2.5的要求。
2.9.2试剂盒稳定性
原包装的TBIL试剂盒在2℃~8℃避光保存,有效期为18个月。
试剂在规定的条件下保存到有效期末,产品的性能应符合2.3、2.4、2.5、2.6.1和2.7的要求。
