同时蒸馏萃取使用说明方法
蒸馏和萃取

化学实验基本方法 —— 萃取和分液
1.检验自来水中的Cl-时,可先用稀盐酸酸化,再加
AgNO3溶液.
(
)
)
2.蒸发和蒸馏都是利用了混合物各组分沸点的不同.( 3.分液时,两层液体可先后从下端流到两容器中.
(
)
4 .分液时,将分液漏斗上口的玻璃塞打开的目的是为了平 衡分液漏斗内外的气压,便于液体流下. (
)
5.食盐水的蒸发和自来水的蒸馏都能用到的仪器有铁架台、 酒精灯、石棉网等. (
)
)
6.使用分液漏斗前必须先查漏.
(
[例1] 在蒸馏实验中,下列说法不正确的是 . A.温度计的水银球应放在蒸馏烧瓶的支管口处 B.冷凝管中冷却水的流向是从上向下流 C.加入沸石的作用是防止液体暴沸
(
)
D.加热时,蒸馏烧瓶下面要垫石棉网
化学实验基本方法 —— 萃取和分液
4.自来水中Cl-的检验
(1)试剂: 稀HNO3和AgNO3溶液 ; (2)现象:生成 白色沉淀 ; (3)化学方程式(如向NaCl溶液中滴加AgNO3溶液): NaCl+AgNO3===AgCl↓+NaNO3 ; (4)某溶液 白色沉淀
沉淀 不消失 ,证明原溶液中
实验过程
6. 旋开活塞,用烧杯接 收溶液
7. 将分液漏斗上口倒出 上层水溶液
现象
液体分层 上层液体显(黄或无 )色 下层液体显(紫红 )色
分析讨论
1、上层液体中的溶剂是( H2O ),下层液体 中溶剂是( CCl4) 2、碘单质(I2)在哪种溶剂中的溶解度大? 四氯化碳(CCl4) 3、 CCl4与H2O比较有何异同?
化学实验基本方法 —— 萃取和分液
高中化学蒸馏与萃取实验操作口诀

高中化学蒸馏与萃取实验操作口诀
蒸馏操作实验
隔网加热冷管倾,上缘下缘两相平。
需加碎瓷防暴沸,热气冷水逆向行。
解释:
1. 隔网加热冷管倾:" 冷管" 这冷凝管。
意思是说加热蒸馏烧瓶时要隔石棉网(防止蒸馏烧瓶因受热不均匀而破裂),在安装冷凝管时要向下倾斜。
2. 上缘下缘两相平:意思是说温度计的水银球的上缘要恰好与蒸馏瓶支管接口的下缘在同一水平线上。
萃取操作实验
萃剂原液互不溶,质溶程度不相同。
充分振荡再静置,下放上倒切分明。
解释:
1. 萃剂原液互不溶,质溶程度不相同:“萃剂”指萃取剂;“质”指溶质。
这两句的意思是说在萃取操作实验中,选萃取剂的原则是:萃取剂和溶液中的溶剂要互不相溶,溶质在萃取剂和原溶剂中的溶解度要不相同(在萃取剂中的溶解度要大于在原溶液中的溶解度)。
2. 充分振荡再静置:意思是说在萃取过程中要充分震荡,使萃取充分,然后静置使溶液分层。
3. 下放上倒切分明:这句的意思是说分液漏斗的下层液从漏斗脚放出,而上层液要从漏斗口倒出。
热气冷水逆向行:意思是说冷却水要由下向上不断流动,与热的蒸气的流动的方向相反。
蒸发蒸馏萃取的操作方法

蒸发蒸馏萃取的操作方法蒸发蒸馏和萃取是常用的分离和纯化技术,在化学实验和工业生产中都得到了广泛应用。
下面我将详细介绍蒸发蒸馏和萃取的操作方法。
一、蒸发蒸馏操作方法:1. 样品制备:首先,需要准备待分离的混合物样品。
根据实验要求,可以选择固体-固体、固液或液体-液体混合物进行分离。
2. 蒸发装置准备:将蒸发瓶或烧瓶放在蒸发装置内,将冷凝管连接在瓶口上方,通过橡胶塞使两者紧密连接。
3. 设置加热设备:将蒸发瓶或烧瓶放在加热器上,根据需要设置和调整加热温度。
4. 开始蒸发:将待分离混合物溶液倒入蒸发瓶或烧瓶中,轻轻加热,使混合物开始蒸发。
在这个过程中,挥发性成分会蒸发,而非挥发性成分则会残留在容器中。
5. 冷凝收集:蒸发的挥发性成分会通过冷凝管冷凝成液体,并滴入冷凝瓶中。
这样,我们就可以将分离出来的纯化溶液进行收集。
6. 冷凝水槽:为了增加蒸发的效果,可以在冷凝管附近设置一个水槽,用冷水冷却冷凝管,提高冷凝效果。
二、萃取操作方法:1. 提取溶剂:首先,准备一种合适的溶剂,能够与待提取物质有较好的溶解性,且与其他杂质不溶,并且容易挥发或蒸馏。
常用的溶剂有醚类、酯类、醇类等。
2. 样品制备:将待提取的混合物溶液倒入一个漏斗或分液漏斗中,加入一定量的提取溶剂。
3. 摇匀:轻轻摇动漏斗,使混合物中的成分充分接触和混合。
摇匀的时间一般为1-2分钟。
4. 混合物分离:停止摇匀后,将漏斗放置在一个支架上,使其静置一段时间,等待混合物中的液相和固相发生分离。
5. 分离两相:打开漏斗的开关,将分液漏斗中的底层液相慢慢放出。
需要注意的是,在放液的过程中,要停下来,观察提取溶剂是否已经滴干,并视情况控制分离速度。
6. 溶剂回收:将分离得到的上层液相转移到一只锥形瓶中,使用适当的方法回收提取溶剂。
回收的溶剂可以进行进一步使用。
以上就是蒸发蒸馏和萃取的操作方法。
蒸发蒸馏通过加热和冷凝的方法,实现了挥发性成分和非挥发性成分的分离。
高一化学,化学实验方法-蒸馏、萃取和分液

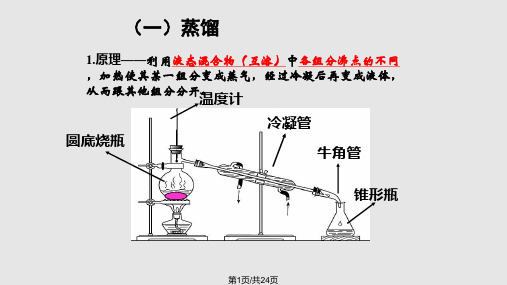
化学实验方法-蒸馏、萃取和分液一、蒸馏1.蒸馏实验原理:蒸馏是利用液体混合物各组分的沸点不同指把液体加热至沸腾,使液体变为蒸气,再重新冷凝成液体的过程。
2.实验室制取蒸馏水(1)下图为实验室制取蒸馏水的装置图(注意各仪器的名称):((3)实验结论:自来水中含有Cl,蒸馏水中不含有Cl。
(4)实验注意事项:①蒸馏装置的连接顺序是由下到上、由左到右。
②圆底烧瓶中所盛液体体积一般应介于其容积的1/3~2/3之间,不可将溶液蒸干。
③蒸馏时在蒸馏烧瓶中加入少量碎瓷片或沸石是为了防止液体暴沸。
④冷凝管中的冷却水从下口进(填“上口”或“下口”),从上口出,这样操作的好处是能使冷凝管中的冷水充满且冷水的流向与气流方向相反,气流由上至下所处温度越来越低,冷凝效果好。
⑤圆底烧瓶加热时要垫上石棉网。
(5)实验装置的改进:①温度计的作用是控制收集沸点不同的馏分。
②温度计水银球要与蒸馏烧瓶支管口相平。
思考:①制取蒸馏水不使用温度计是因为水的沸点是100℃,加热至沸腾即可。
②蒸馏与蒸发有何联系与区别?(可从实验原理、实验操作仪器、实验目的等角度进行分析)蒸馏的目的是使液体中的某些组分挥发再冷凝收集,而蒸发的目的一般是提取溶液中的溶质,通常不再回收挥发出来的组分。
4.蒸馏操作在化学实验中的应用:(1)分离液体混合物,当液体混合物中各成分的沸点有较大的差别时才能达到较有效的分离。
(2)测定纯物质的沸点。
(3)提纯,通过蒸馏含有少量杂质的物质,提高其纯度。
(4)回收溶剂,或蒸出部分溶剂以浓缩溶液。
二、萃取和分液1.萃取和分液的原理:(1)萃取是利用溶质在互不相溶的溶剂里溶解度的不同,用一种溶剂把物质从它与另一种溶剂所组成的溶液里提取出来的方法。
加入的溶剂称为萃取剂。
萃取过程属于物理变化(填“物理”或“化学”)。
(2)分液是利用分液漏斗把互不相溶的两种液体分开的操作。
分液操作一般与萃取结合使用。
2.用四氯化碳萃取碘水中的碘:(1)装液:用量筒量取10mL碘的饱和水溶液,倒入分液漏斗中,然后再注入4mL四氯化碳(CCl4),改好玻璃塞。
同时蒸馏萃取使用说明方法

引言概述:同时蒸馏萃取是一种常用的分离提取技术,广泛应用于化学、制药、食品等领域。
本文旨在详细介绍同时蒸馏萃取的使用方法,包括实验条件的选择、设备的操作要点以及常见问题的解决方法。
通过掌握同时蒸馏萃取的技巧和注意事项,能够提高提取效率和纯度,从而有效提升实验结果和产品质量。
正文内容:一、实验条件的选择1.1 选择合适的溶剂组合:同时蒸馏萃取常采用两种或多种溶剂进行混合,以提高对目标物质的溶解度。
在选择溶剂组合时,需考虑目标物质的溶解性、它们与待萃取物的相容性以及酸碱性等因素。
1.2 控制蒸馏温度和压力:蒸馏温度和压力的选择直接关系到萃取效率和目标物质的稳定性。
需根据待萃取物的性质和沸点范围选择适宜的温度和压力。
二、设备的操作要点2.1 确保设备的密封性:同时蒸馏萃取需要采用密封的设备,在操作前需检查设备的密封性,确保实验过程不会出现泄漏,以免影响提取效果。
2.2 控制加热速度:加热时应缓慢升温,避免温度过高引起剧烈沸腾,导致提取物的损失或设备受损。
2.3 合理调节混合比例:同时蒸馏萃取的混合比例对提取效果有重要影响。
需根据目标物质的溶解性和挥发性调节混合比例,以达到最佳提取效果。
2.4 控制流速和收集方式:控制流速可以影响提取物的纯度和收率。
通常情况下,流速不宜过大,以保证提取物的充分接触。
在收集提取物时,应选择适当的收集方式,如冷凝、减压或其他方式。
三、常见问题的解决方法3.1 溶剂挥发过快:若溶剂挥发速度过快,可采取降低温度、增加溶液浓度或使用减压等方法来控制挥发速度。
3.2 混合比例不当:混合比例不当可能导致提取效果不佳,应根据实际情况进行调整。
可通过改变溶剂的体积比例或更换溶剂组合来改善提取效果。
3.3 提取物纯度低:若提取物纯度低,可考虑增加提取步骤、改变萃取时间或使用分离纯化技术等方法来提高纯度。
四、注意事项4.1 安全操作:同时蒸馏萃取涉及高温和有机溶剂,操作时需保持安全意识,穿戴实验室安全防护用具,严禁近火源和烟草。
蒸馏萃取知识点总结归纳

蒸馏萃取知识点总结归纳在蒸馏萃取中,有很多关键的知识点需要了解,包括其原理、设备、操作方法以及应用等方面。
下面就对这些知识点进行详细的总结归纳。
一、蒸馏萃取的原理蒸馏萃取的原理是利用不同物质在特定温度下的沸点差异来实现分离。
当混合物在加热的过程中,具有较低沸点的成分首先蒸发,并在冷凝器中凝结成液体,然后通过收集器收集到不同的容器中。
这样就实现了混合物中不同组分的分离。
二、蒸馏萃取的设备1. 蒸馏设备:蒸馏设备通常包括蒸馏烧瓶、加热设备、冷凝器、收集容器等部分。
蒸馏烧瓶是用来容纳混合物并进行加热的,加热设备可以是火焰或者加热板,冷凝器用来将蒸发的液体冷凝成液体,收集容器则用来收集不同组分的物质。
2. 萃取设备:常见的萃取设备有分液漏斗、萃取柱、离心机等。
分液漏斗通常用于水相和有机相的分离,萃取柱用于提取目标物质,离心机则用于快速分离悬浊液体。
三、蒸馏萃取的操作方法1. 简单蒸馏:简单蒸馏是最基本的蒸馏方法,适用于沸点差异较大的物质。
操作时,将混合物加热至其中一个成分的沸点,然后冷凝该成分并进行收集。
2. 分馏蒸馏:分馏蒸馏适用于沸点差异不大的物质,在蒸馏设备中通常加入填料,增加表面积以增加沸点差异。
3. 萃取:萃取是将目标物质从混合物中提取出来的方法,通常以有机溶剂为萃取剂,将目标物质从混合物中转移到有机相中。
四、蒸馏萃取的应用1. 化工领域:蒸馏萃取是化工领域中重要的分离和提取方法之一,广泛应用于石油化工、医药化工、有机合成等领域。
2. 生物化学:生物化学中常用蒸馏萃取来提取天然产物,例如植物精油、药用成分等。
3. 食品工业:在食品工业中,蒸馏萃取用于提取香料成分、天然色素等。
以上就是对蒸馏萃取知识点的总结归纳,通过了解蒸馏萃取的原理、设备、操作方法以及应用,可以更好地掌握和应用这一重要的化工技术。
同时蒸馏萃取使用说明方法

同时蒸馏萃取使用说明方法蒸馏萃取是一种常用的化学分离技术,通过利用物质的不同沸点将混合物中的成分分离出来。
与传统的蒸馏方式不同,同时蒸馏萃取是将蒸馏和萃取两种操作同时进行,使得萃取效率更高、操作更简便。
本文将介绍同时蒸馏萃取的使用方法及注意事项。
一、准备工作在进行同时蒸馏萃取之前,首先需要准备好实验器材和试剂。
具体的准备工作包括:1. 实验器材:蒸馏容器、加热设备、冷凝器、收集容器等。
2. 试剂:混合物样品、萃取剂等。
二、操作步骤1. 将混合物样品倒入蒸馏容器中,并加入适量的萃取剂。
2. 将蒸馏容器与冷凝器连接好,并确保密封性良好。
3. 开启加热设备,逐渐升温,使混合物样品沸腾。
4. 同时,通过冷凝器的冷却作用,使混合物蒸气在冷凝器中凝结。
5. 蒸馏过程中,收集冷凝器中凝结的液体,即为所需的蒸馏产物。
三、注意事项1. 安全操作:同时蒸馏萃取需要使用加热设备,要注意火源的安全,避免发生火灾事故。
2. 选择合适的萃取剂:根据混合物的成分和性质选择合适的萃取剂,以提高蒸馏的效率。
3. 控制加热温度:适当控制加热温度,以避免过高温度造成混合物烧焦或有害气体释放。
四、常见问题解答1. 同时蒸馏萃取与传统的蒸馏方式有何区别?同时蒸馏萃取是将蒸馏和萃取两种操作同时进行,使得萃取效率更高、操作更简便。
传统的蒸馏方式需要分开进行这两个过程。
2. 为什么要使用萃取剂?萃取剂能够提高目标物质的浓度,降低其他杂质的含量,以便更好地提取目标物质。
3. 如何选择合适的萃取剂?选择合适的萃取剂需要考虑混合物的成分和性质,以及目标物质的溶解性和选择性。
总结:同时蒸馏萃取是一种高效、简便的化学分离技术,能够快速地将混合物中的成分分离出来。
在使用同时蒸馏萃取时,我们需要进行一些准备工作,并按照操作步骤进行实验。
同时,安全操作和合理选择萃取剂也是非常重要的。
相信通过本文的介绍,读者对同时蒸馏萃取的使用方法已有了一定的了解。
高中化学必修一蒸馏与萃取PPT课件
第17页/共24页
[ 思考与讨论] 1、根据实验1-4分析,请分总结CCl4性质?
①无色液体,不溶于H2O ②ρ(CCl4)>ρ(H2O)
2、将实验1-4中的萃取剂换为酒精是否可以? 请说明原因。 不可以,酒精与水互溶。
碘的萃取剂:汽油、煤油、苯、四氯化碳等。
举例
分离酒精和水 的混合物;用 自来水制取蒸 馏水
四氯化碳(苯 )把溶于水里 的碘萃取出来
现需要分离下列物质,请用直线将分离实例、 分离方法和选择分离方法的依据连接起来。
实例
分离方法 选择的依据
除去澄清石灰水中的碳酸钙
蒸馏 溶解度随温度变化的差异
用CCl4提取溴水中溴单质
过滤 在不同溶剂中溶解度的差异
第18页/共24页
分液漏斗 注意:有两个塞子(旋塞和上口塞子) 分液漏斗使用注意事项:
①分液漏斗使用前要将漏斗颈上的旋塞芯取出,涂 上凡士林,插入塞槽内转动使油膜均匀透明,且转 动自如。 ②检查是否漏水(旋塞和上口塞子)
③漏斗内加入的液体量不能超过容积的2/3 ④放液时,上口塞子的凹槽和漏斗口颈上的小空要对准;
分液 分离醋酸(沸点118℃)与乙醇(沸点78.5℃)
沸点的差异较大
分离汽油和水
结晶
两溶剂互不相溶
从含有氯化钠的硝酸钾溶液中提取硝酸钾 萃取 物质在水中溶解度的不同
第23页/共24页
感谢您的观看!
第24页/共24页
(三)萃取 a.定义 液体混合物中一种溶质在互不相溶的溶剂里溶
解性不同,用一种溶剂(萃取剂)把溶质从它与另一溶
剂(原溶剂)所组成的溶液中提取出来。
【概念分析】
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
同时蒸馏萃取装置使用说明书
同时蒸馏萃取装置结构示意图如上所示:
①冷凝水或冷却介质(如煤油等)从A流入,从B流出。
②蒸馏时C处接所测样品的水溶液,D处接比水密度大的萃取液(如二氯甲烷等)
③D处用水浴锅加热,若用二氯甲烷作萃取剂,则温度恒定在65℃左右。
C处用电热套加热。
④加热时E处关闭,先让水浴锅升温,则U型管中冷凝后的萃取剂将会缓慢上升,当萃
取剂上升至图中蓝线处时,C处电热套中的样品溶液应该开始沸腾。
⑤蒸馏萃取时,让萃取剂和水的分界线保持在图中的蓝色线和绿色线之间为最佳(通过
调节C和D处的加热强度实现),这样冷凝下来的萃取剂和水将会顺利的回流至各自的烧瓶中。
⑥F处不接任何东西,让其排空。
⑦萃取结束时,让C、D两边冷却,然后取下D处的烧瓶,缓慢旋开E,让U型管下部
的萃取剂流入烧瓶中
⑧使萃取剂浓缩后定容
同时蒸馏萃取,英文:simultaneous distillation extraction 简称SDE. 是通过同时加热样品液相与有机溶剂至沸腾来实现的,试验装置如右图,它是把样品的浆液置于一圆底烧瓶中,连接于仪器右侧,以另一烧瓶盛装溶剂,连接于仪器左侧,两瓶分别水浴加热,水蒸气和溶剂蒸气同时在仪器中被冷凝下来,水和溶剂不相混溶,在仪器U形管中被分开来,分别流向两侧的烧瓶中,结果蒸馏
和提取同时进行,只需要少量溶剂就可提取大量样品,香气成分得到浓缩。
同时蒸馏萃取作为一种前处理技术,同固相微萃取、顶空进样等相比,具有良好的重复性和较高的萃取量,而且操作简便、定性定量效果好,是一种行之有效的前处理方法。
但由于香精组分复杂,当蒸馏温度过高时,样品可能发生水解、氧化、酯化或热分解,同时高沸点的组分也难以随水蒸气一起蒸出来,所以对香精香料挥发性成分的检验不是很全面。
