晶体结构
第一章晶体的结构

求晶面指数的方法
OA1 ra1, OA2 sa2 , OA3 ta3
h1 : h2 : h3 1 1 1 : : r s t
n
N
a3
O
d
a2
A2 A1
a1
设 a 1 , a 2 , a 3的末端上的格点分别在离原点距离h1d、h2d、
h3d的晶面上,这里 h1、h2、h3为整数 。 基矢
格点只在顶角上,内部和面上都不包含其他格点,整个原胞 只包含一个格点。
3、晶胞
原胞往往不能反映晶体的对称性
晶胞:能反映晶体对称性的最小结构重复单元
是原胞的数倍。晶胞的基矢用 a b c
原胞:
表示
a1 a2 a3
*几种典型晶体结构的原胞和晶胞
每种原子都各自构成一种相同的Bravais格子,这些Bravais 格子相互错开一段距离,相互套构而形成的格子。即复式 格子是由若干相同的Bravais格子相互位移套构而成的。
*几种典型的复式晶格
NaCl结构(Sodium Chloride structure ) 复式面心立方
例:MgO、KCl、AgBr 等
用来描述晶体中原子排列的紧密程度,原子排 列越紧密,配位数越大
简单立方(简立方)(simple cubic, sc)
配位数
6
晶胞内有 1 个原子
体心立方( body-centered cubic, bcc )
排列:ABABAB……
配位数
8
晶胞内有 2 个原子 具有体心立方结构的金属晶体:LI、Na、K、Fe等
重复周期为二层。形成AB AB AB· · · · · · 方式排列。
具有六角结构的金属: Mg,Co,Zn等
14种晶体结构

14种晶体结构晶体是由原子、分子或福隔离子按照一定的空间规则排列而成的有序固体。
晶体结构是指晶体中原子、离子或分子排列的规则和顺序。
在固体物质中,晶体结构的种类有很多种,其中比较常见的有以下14种:1. 立方晶体结构:最简单的晶体结构之一,具有三个等长的边和六个等角,包括简单立方、体心立方和面心立方三种类型。
2. 六方晶体结构:其晶胞的基本结构是六方密堆,其中最典型的就是六方晶体和螺旋晶体。
3. 正交晶体结构:晶胞具有三个不相互垂直的晶轴,分别被称为a、b 和c 轴,是最常见的晶体结构之一。
4. 单斜晶体结构:晶胞具有两个不相互垂直的晶轴,是晶体结构中的一种。
5. 三方晶体结构:具有三个相等的轴,夹角为60度,最常见的晶体结构之一是石英。
6. 菱晶体结构:晶胞内部有四面体结构,是一种简单的晶体结构。
7. 钙钛矿晶体结构:一种具有钙钛矿结构的晶体,包括钙钛矿结构和螺旋钙钛矿结构。
8. 蜗牛晶体结构:晶胞的形状像一只蜗牛的壳,是晶体结构中的一种。
9. 立方密排晶体结构:晶胞的结构是立方密排,是晶体结构中的一种。
10. 体心立方晶体结构:晶体结构的晶胞中有一个原子位于晶体的中心,是晶体结构中的一种。
11. 面心立方晶体结构:晶体结构的晶胞的各个面的中心有一个原子,是晶体结构中的一种。
12. 钻石晶体结构:晶体结构的晶胞构成了一种钻石结构,是晶体结构中的一种。
13. 银晶体结构:晶体结构的晶胞构成了一种银结构,是晶体结构中的一种。
14. 锶钛矿晶体结构:晶体结构的晶胞构成了一种锶钛矿结构,是晶体结构中的一种。
晶体结构的种类繁多,每种晶体结构都有其独特的结构特点和性质,对晶体的物理和化学性质有着重要的影响。
研究晶体结构不仅可以帮助我们更好地了解晶体的构成和性质,还有助于我们在材料科学、物理化学等领域的应用和研究。
因此,对晶体结构的研究具有重要的科学意义和应用价值。
晶体结构

晶体结构和布拉菲格子的区别
晶体结构和布拉菲格子的区别
基矢 原胞 晶胞(单胞)
初基元胞 点阵的基本 平移矢量。
有多种取法。
12面体
14面体
布拉伐格子 晶向 晶面
标志?
互质的整数(h1h2h3)-----晶面指数
若以单胞的棱a,b,c为坐标系对应的指数(h1h2h3)----miller index
33 23
13
32 22 12
31
33 11
21 31 13;32 12 32 0
11
23 21 21 0
同样若沿Z轴作对称操作-转动900
0 1 0 A 1 0 0
0 0 1
A1A
22
0
0
11
0
13
11
0
0
22
13
0
0 31 33
31 0 33
7晶系14种Bravais Lattice介绍
可以证明,由于对称性的要求,共有14种Bravais Lattice, 分为7个晶系(点阵只有7种点群)。 对称操作群{D/t} D--点(宏观)对称操作; t--平移对称操作. 点阵点群-------{D/t=0}7个7个晶系 点阵空间群-------{D/t}14个14 lattices
绪论
������ 固体物理是研究固体的结构和其组成粒子之间的相互作用 及运动规律,以阐明其性能和用途的学科。
固体的分类 晶体(晶态):原子按一定的周期规则排列的固体(长程有序)。 非晶体(非晶态):原子排列没有明确的周期性(短程有序)。
晶体结构

形成 6 个六元环。
5.在金刚石晶体中碳原子个数与C-C共价键个数之
比是 1 ︰ 2 6.在金刚石晶胞中占有的碳原子数 8个
二氧化硅的晶体结构
Si
O
180º
109º28´
共价键
小结:
1. 在SiO2晶体中,每个硅原子与 4 个氧原子
结晶合体;中每硅个原氧子原与子 氧与 原子2个个数硅之原比子是结合1;:在2 S。iO2
2. 在SiO2 晶体中,每个硅原子形成 4 个共
价键;每个氧原子形成 2 个共价键; 3. 在SiO2 晶体中,最小环为 12 元环。 4.1molSiO2晶体含共价键 4mo。l
石墨的晶体结构模型
石墨的晶体结构
石墨晶体是层状结构,在每一层内,碳原 子排成六边形,每个碳原子都与其他3个 碳原子以共价键结合,形成平面的网状结 构。在层与层之间,是以分子间作用力相 结合的。由于同一层的碳原子间以较强的 共价键结合,使石墨的熔点很高。但由于 层与层之间的分子间作用力较弱,容易滑 动,使石墨的硬度很小。像石墨这样的晶 体一般称为过渡型晶体或混合型晶体。
2、根据氯化钠的结构模型确定晶胞,并分
析其构成。每个晶胞中有 4 个Cl- 4
Na+,有
3、在每个Na+周围与它最近的且距离相等 的Na+有 12 个
4、在每个Na+周围与它最近的且距离相等 的Cl-所围成的空间结构为 正八面体 体
图氯 化 铯 晶 体 结 构 示 意
氯化铯的晶胞
【 CsCl 型 】
六方最密堆积分解图
第三层的另一种排列 方式,是将球对准第一层 的 2,4,6 位,不同于 AB 两层的位置,这是 C 层。
晶体的结构与晶格常数

晶体的结构与晶格常数晶体是由具有规则的、无序的、周期性重复的排列方式组成的固体材料。
它的结构是由晶格和晶体结构单元组成的。
晶格是指晶体中的原子、离子或分子按照规则、有序的方式排列成的一个平行于晶体表面、经过晶体内部的无限重复网格。
晶格常数是指晶体中晶胞平衡状态下,晶胞沿各个晶胞轴的最小长度,用a、b和c表示。
不同的晶体具有不同的结构和晶格常数。
下面将介绍几种常见的晶体结构及其对应的晶格常数。
1. 立方晶系立方晶系是最简单的晶体结构之一,其晶格常数在三个晶胞轴上相等。
具体包括以下几种类型:- 体心立方结构(BCC):其晶格常数a=4R/√3,其中R为原子半径。
- 面心立方结构 (FCC):其晶格常数a=2R/√2。
- 简单立方结构 (SC):其晶格常数a=2R。
2. 正交晶系正交晶系的晶体结构具有与立方晶系类似的特点,但其晶胞轴长度不相等。
其晶格常数表达为:- a轴:a=2R。
- b轴:b=2R。
- c轴:c=2R。
3. 单斜晶系单斜晶系的晶格常数也具有不同的长度。
其中a轴、b轴和c轴的长度分别为:- a轴:a=2R。
- b轴:b=2R。
- c轴:c=2R。
4. 菱面晶系菱面晶系的晶胞具有菱形形状,晶胞轴长度如下:- a轴:a=2R。
- b轴:b=2R。
- c轴:c=2R。
5. 六方晶系六方晶系的晶胞具有六角形形状,a轴和c轴的长度为:- a轴:a=2R。
- c轴:c=2R。
以上仅是几种常见的晶体结构及其晶格常数的示例,实际晶体的结构和晶格常数还可能受到其他因素的影响,如晶体的成分、原子尺寸等。
总结起来,晶体的结构与晶格常数密切相关,不同的晶体结构及其晶格常数决定了晶体的物理性质和化学性质。
通过深入研究晶体的结构与晶格常数,可以更好地理解晶体的性质,并为材料科学和应用提供基础。
晶体结构
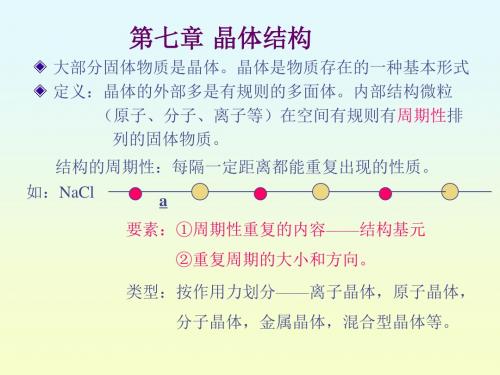
1、点阵:按连接其中任意两点的向量进行平移后,均能复原
的一组点。 如 等径密置球
. a. . . . . . . .
3a
特点:①点阵是由无限多个点组成;
②每个点周围的环境相同;
③同一个方向上相邻点之间的距离一样.
晶体结构 = 点阵+结构基元
1、直线点阵:一维点阵 如:结构 结构基元:
点阵
.
a
.
2a
六、晶面指标(符号)和有理指数定律: 由于不同方向的晶面结构微粒排列的情况不同,导致物理 性质不一样——各向异性。
用晶面表示不同的平面点阵组,那晶面在三个晶轴上的倒
易截数之比——晶面指标。 如图 某晶面在坐标轴上的截面 截距
z
4c
2a , 3b , 4c
y
c b 2 3 4 截数 a 3b 1 1 1 2a 倒易截数 (643) 2 3 4 x 倒易截数之比:1/2:1/3:1/4 = 6:4:3 ,为整数 1 1 1 符号化—倒易截数之比: : : h : k : l hkl 为晶面指标 r s t
a b c , 900
一个 6 或 6
一个 4 或 4 一个 3 或 3 三个 2 一个 2 无(仅有i )
1200
a b c, 900
a b c, 900
a b c, 900
C2V , D2 , D2 h
, , ;
V , M r , Z , DC 等
Beq ,U eq
原子坐标及等效温度因子: x , y , z;
分子结构参数:键长,键角,最小二乘平面等 绘出分子结构图,晶胞堆积图等 分析结构特征,解释结构与性能之间的关系。
晶体结构(共78张PPT)

山东大学材料科学基础
共价键结合,有方 向性和饱和性,键 能约80kJ/mol
Si,InSb, PbTe
金属键结合, 无方向性,配 位数高,键能 约80kJ/mol
Fe,Cu,W
范得华力结合 ,键能低, 约 8-40 kJ /mol
Ar,H2,CO2
熔点高
强度和硬度由中到 高,质地脆
闪锌矿〔立方ZnS〕结构 S
Zn
属于闪锌矿结构的晶体有β-SiC,GaAs,AlP,InSb
山东大学材料科学基础
•
•
•
•
萤石〔CaF2〕型结构
立方晶系Fm3m空间群,
a0=0.545nm, Z=4。 AB2型化合物, rc/ra>0.732〔0.975〕 配位数:8:4
Ca2+作立方紧密堆积,
F-填入全部四面体 空隙中。 注意:所有八面 体空隙都未被占据。
山东大学材料科学基础
钙钛矿〔CaTiO3〕结构
Ti
ABO3型
立方晶系:以
•
一个Ca2+和3个
O2-作面心立方
Ca
密堆积,
Ti4+占1/4八面体C空aT隙iO3。晶胞 配位多面体连接与Ca2+配位数
Ti4+配位数6,rc/ra=0.436(0.414-0.732)
Ca2+配位数12,rc/ra=0.96
O2-配位数6;
取决温度、组成、掺杂等条件,钙钛矿结构呈现立方、
四方、正交等结构形式。
山东大学材料科学基础
许多化学式为ABO3型的化合物,其中A与B两种阳 离子的半径相差颇大时常取钙钛矿型结构。在钙钛矿 结构中实际上并不存在一个密堆积的亚格子,该结构 可以看成是面心立方密堆积的衍生结构。较小的B离 子占据面心立方点阵的八面体格位,其最近邻仅是氧 离子。
晶体结构

第五章 晶体结构安徽师范大学化学与材料科学学院§51晶体的点阵理论晶体具有按一定几何规律排列的内部结构,即晶 体由原子(离子、原子团或离子团)近似无限地、在三 维空间周期性地呈重复排列而成。
这种结构上的长 程有序,是晶体与气体、液体以及非晶态固体的本 质区别。
晶体的内部结构称为晶体结构。
1. 晶体的结构特征(1)均匀性(2) 各向异性(3) 自发形成多面体外形(4) 具有确定的熔点(5) 对称性(6) X射线衍射2.周期性下面两个图形均表现出周期性:沿直线方向,每 隔相同的距离,就会出现相同的图案。
如果在图形 中划出一个最小的重复单位(阴影部分所示),通 过平移,将该单位沿直线向两端周期性重复排列, 就构成了上面的图形。
最小重复单位的选择不是唯一的,例如,在图(a) 中,下面任何一个图案都可以作为最小的重复单位。
点的位置可以任意指定,可以在单位中或边缘的任 何位置,但一旦指定后,每个单位中的点的位置必须 相同。
如,不论点的位置如何选取,最后得到的一组点在空间 的取向以及相邻点的间距不会发生变化。
3.结构基元在晶体中,原子(离子、原子团或离子团)周期性地重 复排列。
上面我们在图形找出了最小的重复单位,类似 的,可以在晶体中划出结构基元。
结构基元是指晶体中 能够通过平移在空间重复排列的基本结构单位。
【例1】一维实例:在直线上等间距排列的原子。
一个原子组成一个结构基元,它同时也是基本的化学组成单位。
结构基元必须满足如下四个条件:化学组成相同;空间结构相 同;排列取向相同;周围环境相同。
【例2】一维实例:在伸展的聚乙烯链中,CH2CH2组成一个 结构基元,而不是CH2。
【例3】二维实例:层状石墨分子,其结构基元由两个C原子组 成(相邻的2个C原子的周围环境不同)。
结构基元可以有不同的选法,但其中的原子种类和数目应保 持不变。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(三)金属晶体特点
多数采面心立方或六方密堆积,配位 数高(12)、熔、沸点高。 少数例外:Na、K、Hg。
二、离子晶体
(一)离子晶体的基本特征 1. 占据晶格结点的质点:正、负离子; 质点间互相作用力:静电引力(离子键) 2. 整个晶体的无限分子: NaCl、CaF2 、 KNO3…为最简式。 3. 晶格能U↑,熔、沸点↑ (掌握玻恩-哈伯计算) 4. 熔融或溶于水导电。
↓
例:NaCl(面心立方)晶体(教材P.219图9-16)
令
r 1,则 ac 4r 4 ,
ab bc 2r 2r 2 2r
据勾股定理: ab bc
2
2
ac
得:
2
r 0.414
2( 2 2 r ) 2 4 2
五、混合型晶体
例1:石墨(graphite)
C单质
金刚石 (diomord) (原子晶体) 石墨 ( graphite) (混合型晶体) 富勒烯 分子晶体
石墨晶体:层状结构(教材P。224图9-22) 每层内:每个C作sp 2杂化,与另3个C以共价键结合,并有离域 键(整层上、下) 层与层之间:以范德华力结合 过渡型晶体 导电率:沿层的方向高、垂直于层的方向低。 可作润滑剂。
原因:d 电子云“发散”,对核电荷屏蔽不完全,使 Z *↑, 对异号离子极化作用↑。 考虑d区,ds区离子极化力时,用 Φ *↑更恰当。
(二)影响离子变பைடு நூலகம்性因素
离子电荷、离子半径、外层电子构型3个因素。 可用极化率α 表示,α ↑,变形性↑。
半径比规则(续)说明:
3. 值位于“边界”位置附近时,相应化合物 有2种构型。 例:GeO2 r + / r - = 53 pm / 132 pm = 0.40. 立方ZnS NaCl 两种晶体空间构型均存在. 4.离子晶体空间构型除了与r + / r -有关外,还 与离子的电子构型、离子互相极化作用(如 AgI)以至外部条件(如温度)等有关。
一、离子极化作用
离子极化作用(教材P.220图9-18) 离子极化力(Polarizing主动) 离子变形性 ( Polarizability, Polarized被动) 在异号离子电场作用下,离子的电子云发生变形, 正、负电荷重心分离,产生“诱导偶极”,这个过程 称为“离子极化”。 阳离子、阴离子既有极化力,又有变形性。 通常阳离子半径小,电场强,“极化力”显著。 阴离子半径大,电子云易变形,“变形性”显著。
(三)半径比规则(续)
即
r / r 0.414 / 1 0.414
时:
①正、负离子互相接触 ②负离子两两接触 则负离子互相接触(排斥力↑),而正、负离子接触 不良,迫使晶体转为较小的配位数,如 4:4配位(立 方ZnS型); 2.若 r / r 0.414 0.732 (NaCl型面心立方, 6:6配位) 3.若 r / r 0.732 正离子周围可以接触上更多的负离子,使配位数转 为8:8(CsCl型简单立方)
底面对角线平方 垂直边长平方
2
斜边平方
得:
3a 2 16 r 2 3 r a 4
(二)空间利用率计算(续)
(3)空间利用率
= 晶胞含有原子的体积 / 晶胞体积 100%
=
4 4 3 3 2 r 3 2 ( a) 3 3 4 100 % 68% 3 3 a a
(三)半径比规则(续)说明:
1.―半径比规则”把离子视为刚性球,适用于离子 性很强的化合物,如NaCl、CsCl等。否则,误差大。 例:AgI(c) r + / r - = 0.583. 按半径比规则预言为NaCl型,实际为立方ZnS型。 原因:Ag+与I-强烈互相极化,键共价性↑,晶型转 为立方ZnS(C.N.变小,为4:4,而不是NaCl中的6:6) 2.经验规则,例外不少。 例:RbCl(c),r / r 147 pm / 184 pm 0.80 0.732 预言CsCl型,实为NaCl型。
8少
12 多
68
74
六方密堆积(hcp) 六方 AB.AB
12多
74
一、金属晶体(续)
(一)堆积方式 简单立方堆积: A.A 体心立方堆积: AB.AB 百心立方密堆积: ABC.ABC 六方密堆积: AB.AB A层六角形,B层三角形, 不同于体心立方堆积中的正方形。
(二)空间利用率计算
第七章 晶体结构
固体
solids
晶体 crystals 无定形体 amorphous solids
8.1 晶体的特征 8.2 晶体的基本类型及其结构 8.3 离子的极化
8.1 晶体的特征
一、宏观特征 (一)规则外形(指天然或从溶液中生长的 晶体,未经人工加工); (二)固定熔点; (三)各向异性:导热、导电、膨胀系数、 折射率等物理性质。 作为对比:无定形体(玻璃、沥青、石蜡等) 冷却凝固时无规则外形、无固定熔点、物理性 质是各向同性。
例1:体心立方晶胞中金属原子的空间利用 率计算 (教材P.213, 图9-10) (1)计算每个晶胞含有几个原子:
1 + 8 × 1/8
= 2
体心立方晶胞:中心有1个原子, 8个顶点各1个原子,每个原子被8个 晶胞共享。
(二)空间利用率计算(续)
(2)原子半径r 与晶胞边长a 的关系: 勾股定理: 2a 2 + a 2 = (4r)
(二) 5种最常见类型离子晶体的空间结 构特征 (教材P. 218图9-15)
类型 负离子 晶格 正离子 占据空隙
八面体 (也是简单立 方晶格)
C.N.
每个晶胞含 有
CsCl
简单立方
Cs+ 8 Cl- 8
Cs+:Cl= 1:1 Na+:Cl= 4:4 Zn2+:S2= 4:4
NaCl
面心立方
八面体 (也是面心
8.1 晶体的特征(续)
二、结构特征(微观) ——晶体夹角守恒定律:一个确定的晶体的 表面夹角( , , ,简称晶角)保持不 变,不管其形成条件和宏观外形是否有缺陷。 晶胞参数: (教材P.208图9-1) 3个边长(a, b, c) 3个晶面夹角( , , )
三、晶体7种晶系和14种晶格(点阵)
例2:求面心立方晶胞的空间利用率
解:晶胞边长为a,原子半径为r. 据勾股定理: a 2 + a 2 = (4r)2 a = 2.83 r 每个面心立方晶胞含原子数目: 8 1/8 + 6 ½ = 4
8个顶点各1个原子,为8个晶胞共享; 6个面心,各1个原子,为2个晶胞共享. % = (4 4/3 r 3) / a 3 = (4 4/3 r 3) / (2.83 r ) 3 100 = 74
四、晶体的内部结构
(一)晶格(Crystal lattice)(几何概念) ——指组成晶体的质点,(原子、分子、离子、原子 团等)在空间作有规则的周期性排列所组成的格子。 共14种晶格(见上),分属于7种晶系 (二)晶胞(Cell) ——能表达晶体结构的最小重复单位。 换言之:胞晶在三维空间有规则地重复排列组成了晶 体。 (三)结点 ——即晶格结构中固定的点。
按晶体对称性划分,把晶体分为7种晶系,每种晶系又 分为若干种晶格,共14种晶格。 教材P.209, 表9.1 (补充“晶格”一栏):
晶格(点阵, Bravias ,教材P.210 图9-5) 3 2 4 2 1 1 1 14
晶系 立方 四方 正交 单斜 三斜 六方 三方 小计: 7
8:8 6:6
立方晶格)
立方ZnS
(闪锌矿)
面心立方
1/2的四面体空 隙 (也是面 心立方晶格)
4:4
(二) 5种最常见类型离子晶体的空间结 构特征(续) (教材P. 218图9-15)
类型 负离子晶格 正离子 占据空隙 C.N. 每个晶胞含有
CaF2 萤石 TiO2 金红石
简单立方
½ 的立方体 空隙 (Ca2+呈面心 立方晶格)
离子电荷相同,半径相近时,电子构型对极化力的影响: 极化力:
18e (18 2)e, 2e (9 ~ 17)e 8e
Li+ Sn2+,Pb2+ Bi3+ Be2+
Cu+, Ag+, Au+ Zn2+,Cd2+, Hg2+
Na+ Mn2+,Fe2+,Co2+ Ni2+,Cr3+ Ca2+ Al3+
四、原子晶体(共价晶体)
(一)占据晶格结点的质点:原子 (二)质点间互相作用力:共价健 熔沸点高,硬度大,延展性差。 (三)整个晶体为一大分子 (四)空间利用率低(共价健有方向性、饱和性) 金刚石 (C的C.N.= 4),空间利用率仅34%。 C 用sp 3杂化,与另4个C形成共价单键, 键能达400 kJ•mol-1 (教材P。222图9-20) 其他例子:金刚砂(SiC),石英(SiO2)
