化学反应速率化学动力学简史与诺贝尔化学奖1850威廉
诺贝尔化学奖得主及获奖理由盘点

诺贝尔化学奖得主及获奖理由盘点文件管理序列号:[K8UY-K9IO69-O6M243-OL889-F88688]得主及获奖理由盘点诺贝尔化学奖是以瑞典着名化学家、硝化甘油炸药发明人阿尔弗雷德·贝恩哈德·诺贝尔(1833-1896)的部分遗产作为基金创立的5项奖金之一。
诺贝尔化学奖由瑞典皇家科学院从1901年开始负责颁发,总共被颁发了107次。
期间只有1916、1917、1919、1924、1933、1940、1941和1942八年没有颁发。
诺贝尔奖奖项空缺,除了受到两次世界大战影响之外,还受到了诺贝尔奖组委会“宁缺毋滥”的评奖理念的影响。
到目前为止,诺贝尔化学奖共有172位获奖者。
其中英国生物化学家弗雷德里克·桑格(FrederickSanger)在1958年和1980年两次获得诺贝尔奖,因此历史上获得诺贝尔奖的总共只有171人。
诺贝尔化学奖获奖者的平均年龄是58岁。
其中有32人获奖年龄介于50岁和54岁之间,几乎占到了总获奖人数的20%。
历届诺贝尔化学奖得主及其获奖原因1901年--1910年1901年:雅克布斯范特霍夫(荷)发现了化学动力学法则和溶液渗透压。
1902年:赫尔曼费歇尔(德)合成了糖类和嘌呤衍生物。
1903年:阿累尼乌斯(瑞典)提出了电离理论,促进了化学的发展。
1904年:威廉拉姆齐爵士(英)发现了空气中的稀有气体元素,并确定他们在周期表里的位置。
1905年:阿道夫拜耳(德)对有机染料以及氢化芳香族化合物的研究促进了有机化学与化学工业的发展。
1906年:穆瓦桑(法)研究并分离了氟元素,并且使用了后来以他名字命名的电炉。
1907年:爱德华毕希纳(德)对酶及无细胞发酵等生化反应的研究。
1908年:欧内斯特卢瑟福爵士(新西兰)对元素的蜕变以及放射化学的研究。
1909年:威廉奥斯特瓦尔德(德)对催化作用,化学平衡以及化学反应速率的研究。
1910年—1919年1910年:奥托瓦拉赫(德)在脂环类化合物领域的开创性工作促进了有机化学和化学工业的发展的研究。
1909年诺贝尔化学奖

【1909年诺贝尔化学奖】
物理化学之父
湖北省石首市文峰中学刘涛 434400
1909年诺贝尔化学奖授予德国物理化学家威廉•奥斯特瓦尔德,以表彰他在催化剂的作用、化学平衡、化学反应速率方面研究的突出贡献。
奥斯特瓦尔德主要从事化学反应动力学研究。
1888年提出了稀释定律,并通过大量实验数据进行了验证,还将质量作用定律应用于电解质的电离,引入了离解常数和溶度积概念,这些定律和概念对物理化学的学科发展有着重要作用。
1891年又使用电离理论成功解释了酸碱指示剂的原理。
1900年左右对溶液粘度性质的测量时,发明了奥斯特瓦尔德黏度计,至今仍然被广泛使用。
1901年发表了现代催化剂概念,将化学热力学原理引入结晶学和催化现象的研究中,对大量现象给予了解释,并成功完成了催化剂的工业应用。
1902年提出奥斯特瓦尔德过程,成功地使氨在铂上氧化转变成一氧化氮,研制成用氨制硝酸并获得专利,具有重大的工业价值,为现代硝酸工业化发展奠定了基础。
他一直坚持结合物理手段与化学分析来进行科学研究,创办了世界第一种物理化学期刊,努力将物理化学从有机化学和分析化学中独立出来,使得物理化学得以成为一门独立的科学和其他化学的理论基础,从此以后,物理化学这一分支学科开始形成和发展,由于一生对物理化学学科的建立作出了重要贡献,认为他是古典物理化学的创立者之一,后人常尊称奥斯特瓦尔德为“物理化学之父”。
化学动力学简史与诺贝尔化学奖精编

化学动力学简史与诺贝尔化学奖精编Document number:WTT-LKK-GBB-08921-EIGG-22986一、化学动力学简史与诺贝尔化学奖1850威廉米(Ludwig Ferdinand Wilhelmy, 1812-1864, 德国物理学家) 研究在酸性条件下蔗糖分解(水解为D-(+)-果糖和D-(-)-果糖)的反应速率,发现反应速率正比于蔗糖和酸的浓度。
1864古德博格(Cato Maximillian Guldberg, 1836-1902, 挪威数学家,理论化学家) 和瓦格(Peter Waage, 1833-1900,挪威化学家) 给出“质量作用定律”的公式。
按照这个公式,反应“推动力”正比于反应物浓度的乘积:K=[R]r[S]s/([A]a [B]b)其中,a, b, r, s分别为化学反应A+B = R+S的整比系数。
因此,前向反应速率正比于[A]a [B]b,而后向反应速率整比于[R]r [S]s。
1865Harcourt 和 Esson (英) 分析了 H2O2和 HI、KMnO4和(COOH)2的反应。
他们写出了相应的微分方程,通过积分得到浓度-时间关系。
他们也提出了反应速率与温度的关系式k = A T C1884范特霍夫(Jacobus Henricus van’t Hoff,1852-1911, 荷兰物理化学家。
提出碳原子价键的空间结构学说;提出稀溶液理论。
)的《化学动力学研究》(“Studies of Chemical Dynamics”,“études de dynamique chimique”)出版。
在这本书中,van’tHoff 推广和继续发展了Wilhelmy, Harcourt 和Esson 的工作。
特别是,他引入了微分解析方法。
他也分析了平衡常数以及正向、反向反应速度与温度的依赖关系。
(平衡常数与温度的关系现在称为van’t Hoff 方程)。
化学反应速率化学动力学简史与诺贝尔化学奖1850威廉

首页→第七章化学反应速率一、化学动力学简史与诺贝尔化学奖1850威廉米(Ludwig Ferdinand Wilhelmy, 1812-1864, 德国物理学家) 研究在酸性条件下蔗糖分解(水解为D-(+)-果糖和D-(-)-果糖)的反应速率,发现反应速率正比于蔗糖和酸的浓度。
1864古德博格(Cato Maximillian Guldberg, 1836-1902, 挪威数学家,理论化学家) 和瓦格(Peter Waage, 1833-1900,挪威化学家) 给出“质量作用定律”的公式。
按照这个公式,反应“推动力”正比于反应物浓度的乘积:K=[R]r [S]s/([A]a [B]b)其中,a, b, r, s分别为化学反应A+B = R+S的整比系数。
因此,前向反应速率正比于[A]a[B]b,而后向反应速率整比于[R]r [S]s。
1865Harcourt 和Esson (英) 分析了H2O2和HI、KMnO4和(COOH)2的反应。
他们写出了相应的微分方程,通过积分得到浓度-时间关系。
他们也提出了反应速率与温度的关系式k = A T C1884范特霍夫(Jacobus Henricus van’t Hoff, 1852-1911, 荷兰物理化学家。
提出碳原子价键的空间结构学说;提出稀溶液理论。
)的《化学动力学研究》(“Studies of Chemical Dynamics”,“Études de dynamique chimique”)出版。
在这本书中,van’t Hoff 推广和继续发展了Wilhelmy, Harcourt 和Esson 的工作。
特别是,他引入了微分解析方法。
他也分析了平衡常数以及正向、反向反应速度与温度的依赖关系。
(平衡常数与温度的关系现在称为van’t Hoff 方程)。
van’t Hoff由于对化学动力学和溶液渗透压的首创性研究而荣获了1901年的首届诺贝尔化学奖1887奥斯特瓦尔德(Wilhelm Ostwald, 1853-1932, 生于拉脱维亚的德国化学家,唯能论者。
化学反应动力学的发展和应用

化学反应动力学的发展和应用化学反应动力学是研究化学反应机理和速率的学科,是化学的基础。
随着科技的不断发展,化学反应动力学也不断发展,并应用于各个领域。
本文将探讨化学反应动力学的发展和应用。
一、化学反应动力学的发展化学反应动力学理论的起源可以追溯到19世纪下半叶。
瑞士化学家H. Wurtz在1850年提出了某些反应需要时间才能完成的想法,这标志着化学反应动力学的诞生。
此后,许多化学家在这个领域做出了巨大贡献,如瑞典化学家Arrhenius在1889年提出了Arrhenius方程,用于描述温度对反应速率的影响。
紧接着,荷兰物理学家Vant Hoff在1897年引入了化学动力学的热力学理论,这使得化学反应动力学有了更加深入的研究。
20世纪初期,英国化学家Brönsted和德国化学家Lowry提出了酸碱理论,这奠定了化学反应动力学的基础。
此外,地球化学家Urey还建立了正电子电离器质谱法,该方法能够揭示化学反应的分子机制。
这些成果促进了化学反应动力学的发展。
20世纪中期,芝加哥大学化学家Pauling提出了量子力学的概念,从而深化了化学反应动力学的理论。
随后,美国化学家Marcus提出了热电子迁移理论,用于解释电子传递反应。
此外,化学家们还研究了各种反应动力学模型,如扩散反应模型、催化反应模型等。
二、化学反应动力学的应用1、工业生产化学反应动力学在工业生产中有着广泛的应用。
例如,在合成水合肼的过程中,需要控制反应速率,使得反应能够充分完成并且副产物产生率尽可能小。
此时,化学反应动力学可以提供工业界所需的反应条件,如温度、压力、反应物物质浓度等。
此外,石油工业中的各种化学反应也需要掌握动力学性质。
当我们需要提高石油转化率或者降低催化剂的消耗时,就需要深入了解化学反应动力学。
2、环保和食品工业化学反应动力学在环保和食品工业中也有所应用。
例如,在水处理中,了解化学反应动力学可以帮助我们控制水质,加速水中污染物的分解和降解。
历年诺贝尔化学奖汇总.

从事分子内原子化合价的研究
致力于原子量的研究,精确地测 定 了许多元素的原子量
1915 R. 威尔斯泰特(德国人) 1916---1917年 未颁奖 1918 F. 哈伯(德国人) 1919年 未颁奖
从事植物色素(叶绿素国人) 从事电化学和热动力学方面的研究
1926 T. 斯韦德贝里(瑞典人) 从事胶体化学中分散系统的研究
1927 H.O. 维兰德(德国人)
研究确定了胆酸及多种同类物质的化学 结构
1928 A. 温道斯(德国人)
研究出一族甾醇及其与维生素的关系
1929 A. 哈登(英国人) 冯·奥伊勒 - 歇尔平(瑞典人) 阐明了糖发酵过程和酶的作用
1930 1931
西蒙诺夫【苏联】(N.N.Semyonov) 对动力学理论和链反应的研究
1957 塔德【英国】(A.R.Todd)
对核苷酸和核苷酸辅酶等的研究
1958 桑格【英国】(F.Sanger)
确定了胰岛素的分子结构
1959 海洛夫斯基【捷克斯洛伐克】 (H.Heyrovsk)
发明并改进极谱分析法
1960 W.F. 利时(美国人)
1932 1933 1934 1935
1936 1937
1938 1939
H. 非舍尔(德国人)
从事血红素和叶绿素的性质及结构方面的研究
C. 博施(德国人) F.贝吉乌斯 (德国人)
发明和开发了高压化学方法
I. 兰米尔 (美国人)
创立了表面化学
未颁奖
H.C. 尤里(美国人)
发现重氢
J.F.J. 居里 I.J. 居里(法国人)
1950 O.P.H. 狄尔斯、K.阿尔德(德国人) 发现狄尔斯 - 阿尔德反应及其应 用
历届诺贝尔化学奖得主(1901-2014)

历届诺贝尔化学奖得主 (1901-2014)年份获奖者 国籍 获奖原因 1901年 雅各布斯·亨里克斯·范托夫荷兰 “发现了化学动力学法则和溶液渗透压” 1902年 赫尔曼·费歇尔 德国“在糖类和嘌呤合成中的工作” 1903年 斯凡特·奥古斯特·阿伦尼乌斯瑞典 “提出了电离理论” 1904年 威廉·拉姆齐爵士英国 “发现了空气中的惰性气体元素并确定了它们在元素周期表里的位置” 1905年 阿道夫·冯·拜尔德国 “对有机染料以及氢化芳香族化合物的研究促进了有机化学与化学工业的发展” 1906年 亨利·莫瓦桑法国 “研究并分离了氟元素,并且使用了后来以他名字命名的电炉” 1907年 爱德华·比希纳德国 “生物化学研究中的工作和发现无细胞发酵” 1908年 欧内斯特·卢瑟福英国 “对元素的蜕变以及放射化学的研究” 1909年 威廉·奥斯特瓦尔德德国 “对催化作用的研究工作和对化学平衡以及化学反应速率的基本原理的研究” 1910年 奥托·瓦拉赫德国 “在脂环族化合物领域的开创性工作促进了有机化学和化学工业的发展的研究” 1911年 玛丽·居里波兰 “发现了镭和钋元素,提纯镭并研究了这种引人注目的元素的性质及其化合物” 1912年 维克多·格林尼亚 法国 “发明了格氏试剂” 保罗·萨巴捷法国 “发明了在细金属粉存在下的有机化合物的加氢法” 1913年 阿尔弗雷德·维尔纳瑞士 “对分子内原子连接的研究,特别是在无机化学研究领域” 1914年 西奥多·威廉·理查兹美国 “精确测定了大量化学元素的原子量” 1915年 里夏德·维尔施泰特德国 “对植物色素的研究,特别是对叶绿素的研究” 1916年 未颁奖1917年 未颁奖1918年 弗里茨·哈伯德国 “对从单质合成氨的研究” 1919年 未颁奖1920年 瓦尔特·能斯特德国 “对热化学的研究” 1921年 弗雷德里克·索迪英国 “对人们了解放射性物质的化学性质上的贡献,以及对同位素的起源和性质的研究” 1922年 弗朗西斯·阿斯顿英国 “使用质谱仪发现了大量非放射性元素的同位素,并且阐明了整数法则” 1923年 弗里茨·普雷格尔奥地利 “创立了有机化合物的微量分析法” 1924年 未颁奖1925年 里夏德·阿道夫·席格蒙迪 德国“阐明了胶体溶液的异相性质,并创立了相关的分析法” 1926年 特奥多尔·斯韦德贝里 瑞典 “对分散系统的研究”1927年 海因里希·奥托·威兰 德国 “对胆汁酸及相关物质的结构的研究”1928年 阿道夫·温道斯 德国 “对甾类的结构以及它们和维他命之间的关系的研究”1929年 阿瑟·哈登 英国 “对糖类的发酵以及发酵酶的研究” 汉斯·冯·奥伊勒-切尔平 德国1930年 汉斯·费歇尔 德国 “对血红素和叶绿素的组成的研究,特别是对血红素的合成的研究”1931年 卡尔·博施 德国 “发明与发展化学高压技术” 弗里德里希·贝吉乌斯 德国1932年 欧文·兰米尔 美国 “对表面化学的研究与发现”1933年 未颁奖1934年 哈罗德·克莱顿·尤里 美国 “发现了重氢”1935年 弗雷德里克·约里奥-居里 法国 “合成了新的放射性元素” 伊伦·约里奥-居里 法国1936年 彼得·德拜 荷兰 “通过对偶极矩以及气体中的X 射线和电子的衍射的研究来了解分子结构”1937年 沃尔特·霍沃思 英国 “对碳水化合物和维生素C 的研究”保罗·卡勒 瑞士 “对类胡萝卜素、黄素、维生素A 和维生素B2的研究”1938年 里夏德·库恩 德国 “对类胡萝卜素和维生素的研究”1939年 阿道夫·布特南特 德国 “对性激素的研究” 拉沃斯拉夫·鲁日奇卡 瑞士 “对聚亚甲基和高级萜烯的研究”1940年 未颁奖1941年 未颁奖1942年 未颁奖1943年 乔治·德海韦西 匈牙利 “在化学过程研究中使用同位素作为示踪物” 1944年 奥托·哈恩 德国 “发现重核的裂变”1945年 阿尔图里·伊尔马里·维尔塔宁 芬兰 “对农业和营养化学的研究发明,特别是提出了饲料储藏方法”1946年 詹姆斯·B·萨姆纳 美国 “发现了酶可以结晶”约翰·霍华德·诺思罗普 美国 “制备了高纯度的酶和病毒蛋白质” 温德尔·梅雷迪思·斯坦利 美国1947年 罗伯特·鲁宾逊爵士 英国 “对具有重要生物学意义的植物产物,特别是生物碱的研究”1948年 阿尔内·蒂塞利乌斯 瑞典 “对电泳现象和吸附分析的研究,特别是对于血清蛋白的复杂性质的研究”1949年 威廉·吉奥克 美国 “在化学热力学领域的贡献,特别是对超低温状态下的物质的研究”1950年 奥托·迪尔斯 西德 “发现并发展了双烯合成法” 库尔特·阿尔德 西德1951年 埃德温·麦克米伦 美国 “发现了超铀元素” 格伦·西奥多·西博格 美国1952年 阿彻·约翰·波特·马丁 英国 “发明了分配色谱法” 理查德·劳伦斯·米林顿·辛英国格1953年 赫尔曼·施陶丁格 西德 “在高分子化学领域的研究发现”1954年 莱纳斯·鲍林 美国 “对化学键的性质的研究以及在对复杂物质的结构的阐述上的应用”1955年 文森特·迪维尼奥 美国 “对具有生物化学重要性的含硫化合物的研究,特别是首次合成了多肽激素”1956年 西里尔·欣谢尔伍德爵士 英国 “对化学反应机理的研究” 尼古拉·谢苗诺夫 苏联1957年 亚历山大·R·托德男爵 英国 “在核苷酸和核苷酸辅酶研究方面的工作”1958年 弗雷德里克·桑格 英国 “对蛋白质结构组成的研究,特别是对胰岛素的研究”1959年 雅罗斯拉夫·海罗夫斯基 捷克 “发现并发展了极谱分析法”1960年 威拉得·利比 美国 “发展了使用碳14同位素进行年代测定的方法,被广泛使用于考古学、地质学、地球物理学以及其他学科”1961年 梅尔文·卡尔文 美国 “对植物吸收二氧化碳的研究”1962年 马克斯·佩鲁茨 英国 “对球形蛋白质结构的研究” 约翰·肯德鲁 英国1963年 卡尔·齐格勒 西德 “在高聚物的化学性质和技术领域中的研究发现” 居里奥·纳塔 意大利1964年 多萝西·克劳福特·霍奇金 英国 “利用X 射线技术解析了一些重要生化物质的结构” 1965年 罗伯特·伯恩斯·伍德沃德 美国 “在有机合成方面的杰出成就”1966年 罗伯特·S·马利肯 美国 “利用分子轨道法对化学键以及分子的电子结构所进行的基础研究”1967年 曼弗雷德·艾根 西德“利用很短的能量脉冲对反应平衡进行扰动的方法,对高速化学反应的研究”罗纳德·乔治·雷伊福特·诺里什 英国 乔治·波特 英国1968年 拉斯·昂萨格 美国 “发现了以他的名字命名的倒易关系,为不可逆过程的热力学奠定了基础”1969年 德里克·巴顿 英国 “发展了构象的概念及其在化学中的应用” 奥德·哈塞尔 挪威1970年 卢伊斯·弗德里科·莱洛伊尔 阿根廷 “发现了糖核苷酸及其在碳水化合物的生物合成中所起的作用”1971年 格哈德·赫茨贝格 加拿大 “对分子的电子构造与几何形状,特别是自由基的研究”1972年 克里斯蒂安·B·安芬森 美国 “对核糖核酸酶的研究,特别是对其氨基酸序列与生物活性构象之间的联系的研究” 斯坦福·摩尔 美国 “对核糖核酸酶分子的活性中心的催化活性与其化学结构之间的关系的研究”威廉·霍华德·斯坦 美国 1973年 恩斯特·奥托·菲舍尔 西德 “对金属有机化合物,又被称为夹心化合物,的化学性质的开创性研究”杰弗里·威尔金森 英国 1974年 保罗·弗洛里 美国 “高分子物理化学的理论与实验两个方面的基础研究”1975年 约翰·康福思 英国 “酶催化反应的立体化学的研究” 弗拉迪米尔·普雷洛格瑞士 “有机分子和反应的立体化学的研究” 1976年 威廉·利普斯科姆 美国 “对硼烷结构的研究,解释了化学成键问题”1977年 伊利亚·普里高津 比利时 “对非平衡态热力学的贡献,特别是提出了耗散结构的理论”1978年 彼得·米切尔 英国 “利用化学渗透理论公式,为了解生物能量传递作出贡献”1979年 赫伯特·布朗 美国 “分别将含硼和含磷化合物发展为有机合成中的重要试剂”格奥尔格·维蒂希 西德 1980年 保罗·伯格 美国 “对核酸的生物化学研究,特别是对重组DNA 的研究” 沃特·吉尔伯特 美国 “对核酸中DNA 碱基序列的确定方法” 弗雷德里克·桑格 英国1981年 福井谦一 日本 “通过他们各自独立发展的理论来解释化学反应的发生”罗德·霍夫曼 美国 1982年 阿龙·克卢格 英国 “发展了晶体电子显微术,并且研究了具有重要生物学意义的核酸-蛋白质复合物的结构”1983年 亨利·陶布 美国 “对特别是金属配合物中电子转移反应机理的研究”1984年 罗伯特·布鲁斯·梅里菲尔德美国 “开发了固相化学合成法” 1985年 赫伯特·豪普特曼 美国 “在发展测定晶体结构的直接法上的杰出成就” 杰尔姆·卡尔 美国1986年 达德利·赫施巴赫 美国“对研究化学基元反应的动力学过程的贡献” 李远哲 中国台湾约翰·查尔斯·波拉尼 加拿大1987年 唐纳德·克拉姆 美国 “发展和使用了可以进行高选择性结构特异性相互作用的分子” 让-马里·莱恩 法国 查尔斯·佩德森 美国1988年 约翰·戴森霍费尔 西德“对光合反应中心的三维结构的测定”罗伯特·胡贝尔 西德 哈特穆特·米歇尔 西德1989年 悉尼·奥尔特曼 加拿大 “发现了RNA 的催化性质” 托马斯·切赫 美国1990年 艾里亚斯·詹姆斯·科里 美国 “发展了有机合成的理论和方法学”1991年 理查德·恩斯特 瑞士 “对开发高分辨率核磁共振(NMR )谱学方法的贡献” 1992年 鲁道夫·马库斯 美国 “对化学体系中电子转移反应理论的贡献”1993年 凯利·穆利斯 美国 “发展了以DNA 为基础的化学研究方法,开发了聚合酶链锁反应(PCR )”迈克尔·史密斯 加拿大 “发展了以DNA 为基础的化学研究方法,对建立寡聚核苷酸为基础的定点突变及其对蛋白质研究的发展的基础贡献”1994年 乔治·安德鲁·欧拉 美国 “对碳正离子化学研究的贡献”1995年 保罗·克鲁岑 荷兰 “对大气化学的研究,特别是有关臭氧分解的研究”马里奥·莫利纳美国 弗兰克·舍伍德·罗兰美国 1996年 罗伯特·柯尔美国 “发现富勒烯” 哈罗德·克罗托爵士英国 理查德·斯莫利美国 1997年 保罗·博耶美国 “阐明了三磷酸腺苷(ATP )合成中的酶催化机理” 约翰·沃克英国 延斯·克里斯蒂安·斯科丹麦 1998年 沃尔特·科恩 美国 “创立了密度泛函理论” 约翰·波普英国 发展了量子化学中的计算方法 1999年 亚米德·齐威尔埃及 “用飞秒光谱学对化学反应过渡态的研究” 2000年 艾伦·黑格美国 “发现和发展了导电聚合物” 艾伦·麦克德尔米德美国 白川英树日本 2001年 威廉·斯坦迪什·诺尔斯美国 “对手性催化氢化反应的研究”野依良治日本 巴里·夏普莱斯美国 “对手性催化氧化反应的研究” 2002年约翰·贝内特·芬恩美国 “发展了对生物大分子进行鉴定和结构分析的方法,建立了软解析电离法对生物大分子进行质谱分析” 田中耕一日本 库尔特·维特里希 瑞士 “发展了对生物大分子进行鉴定和结构分析的方法,建立了利用核磁共振谱学来解析溶液中生物大分子三维结构的方法”2003年 彼得·阿格雷 美国 “对细胞膜中的离子通道的研究,发现了水通道” 罗德里克·麦金农 美国 “对细胞膜中的离子通道的研究,对离子通道结构和机理的研究”2004年 阿龙·切哈诺沃 以色列“发现了泛素介导的蛋白质降解”阿夫拉姆·赫什科 以色列 欧文·罗斯 美国2005年 伊夫·肖万 法国“发展了有机合成中的复分解法”罗伯特·格拉布 美国 理查德·施罗克 美国2006年 罗杰·科恩伯格 美国 “对真核转录的分子基础的研究” 2007年 格哈德·埃特尔 德国 “对固体表面化学进程的研究”2008年 下村脩 美国“发现和改造了绿色荧光蛋白(GFP )”马丁·查尔菲 美国 钱永健 美国2009年 文卡特拉曼·拉马克里希南 英国 “对核糖体结构和功能方面的研究” 托马斯·施泰茨 美国阿达·约纳特 以色列2010年 理查德·赫克 美国“对有机合成中钯催化偶联反应的研究”根岸英一 日本 铃木章 日本2011年 丹·谢赫特曼 以色列 “准晶体的发现”2012年罗伯特·莱夫科维茨[2]美国“对G蛋白偶联受体的研究”2013年马丁·卡普拉斯美国[3]给复杂化学体系设计了多尺度模型[4]迈克尔·莱维特亚利耶·瓦谢尔2014年埃里克·白兹格(EricBetzig)美国“在超分辨率荧光显微技术领域取得的成就”威廉姆·艾斯科·莫尔纳尔(William E. Moerner)美国斯特凡·W·赫尔(Stefan W.Hell)德国。
历年诺贝尔化学奖获得者1901-2005
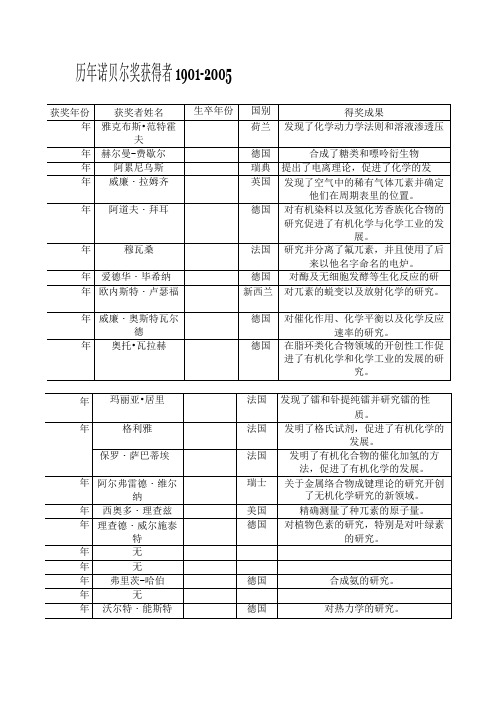
玛丽亚•居里
法国
发现了镭和钋提纯镭并研究镭的性
质。
年
格利雅
法国
发明了格氏试剂,促进了有机化学的发展。
保罗・萨巴蒂埃
法国
发明了有机化合物的催化加氢的方法,促进了有机化学的发展。
年
阿尔弗雷德・维尔纳
瑞士
关于金属络合物成键理论的研究开创了无机化学研究的新领域。
年
西奥多・理查兹
美国
精确测量了种兀素的原子量。
年
理查德・威尔施泰特
德国
对植物色素的研究,特别是对叶绿素的研究。
年
无
年
无
年
弗里茨-哈伯
德国
合成氨的研究。
年
无
年
沃尔特・能斯特
德国
对热力学的研究。
年
弗雷德里克・索迪
英国
对放射性物质以及同位素的研究。
年
弗朗西斯・阿斯顿
英国
使用质谱仪发现了非放射性兀素的同位素并且阐明了整数法则。
年
弗里茨•普雷格尔
奥地利
创立了有机化合物微量分析法。
保罗・博耶
美国
阐明了三磷酸腺苷合成酶的机理。
约翰•沃克尔1
英国
年
沃特•科恩
美籍奥地利
密度泛函理论的研究
约翰•波普
英国
量子化学计算方法的研究
年
艾哈迈德・兹韦勒
美籍埃及
用飞秒激光光谱对化学反应中间过程的研究
年
艾伦-黑格
美国
对导电聚合物的研究
艾伦•马克迪尔米德
美国
白川英树
日本
年
威廉・诺尔斯
美国
手性催化还原反应
梅尔温・卡尔文
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
首页→第七章化学反应速率
一、化学动力学简史与诺贝尔化学奖
1850威廉米(Ludwig Ferdinand Wilhelmy, 1812-1864, 德国物理学家) 研究在酸性条件下蔗糖分解(水解为D-(+)-果糖和D-(-)-果糖)的反应速率,发现反应速率正比于蔗糖和酸的浓度。
1864
古德博格(Cato Maximillian Guldberg, 1836-1902, 挪威数学家,理论化学家) 和瓦格(Peter Waage, 1833-1900,挪威化学家) 给出“质量作用定律”的公式。
按照这个公式,反应“推动力”正比于反应物浓度的乘积:K=[R]r [S]s/([A]a [B]b)
其中,a, b, r, s分别为化学反应A+B = R+S的整比系数。
因此,前向反应速率正比于[A]a[B]b,而后向反应速率整比于[R]r [S]s。
1865
Harcourt 和Esson (英) 分析了H2O2和HI、KMnO4和(COOH)2的反应。
他们写出了相应的微分方程,通过积分得到浓度-时间关系。
他们也提出了反应速率与温度的关系式k = A T C
1884
范特霍夫(Jacobus Henricus van’t Hoff, 1852-1911, 荷兰物理化学家。
提出碳原子价键的空间结构学说;提出稀溶液理论。
)的《化学动力学研究》(“Studies of Chemical Dynamics”,“Études de dynamique chimique”)出版。
在这本书中,van’t Hoff 推广和继续发展了Wilhelmy, Harcourt 和Esson 的工作。
特别是,他引入了微分解析方法。
他也分析了平衡常数以及正向、反向反应速度与温度的依赖关系。
(平衡常数与温度的关系现在称为van’t Hoff 方程)。
van’t Hoff由于对化学动力学和溶液渗透压
的首创性研究而荣获了1901年的首届诺贝尔化学
奖
1887
奥斯特瓦尔德(Wilhelm Ostwald, 1853-1932, 生于拉脱维亚的德国化学家,唯能论者。
发现电解质解离的稀化定律。
长期反对原子论,但终于公开认输。
)在他的著作《Lehrbuch der allgemeinen Chemie》的引入“反应级数”和“半衰期”的概念。
1909年,Ostwald因研究催化和化学平衡、反应速率的基本原理而荣获诺贝尔化学奖,并被人们誉为“物理化学之父”。
1889
阿伦尼乌斯(Svante August Arrhenius, 1859-1927, 瑞典化学家,物理学家。
建立电解质电离的理论。
) 进一步分析了反应速率对温度的依赖关系,k=A exp(-B/T),并提出一个“能垒”解释;这个方程后来被称为Arrhenius 方程。
1903年,Arrhenius因提出电离学说获得了第3届诺贝尔化学奖。
在20世纪,化学动力学理论有了显著的发展(从“第一原理”确定速率常数和反应级数)。
但是,目前还不能预测实际化学过程的动力学参数。
1913Chapman (英) 创立、Bodenstein (德) 发展了链反应中的稳态近似理论。
按照这个理论,中间产物的速率变化可以忽略不计。
1917
Trautz (德) 和Lewis (英) 分别独立发现反应速率取决于分子碰撞频率。
现在,被称为化学反应动力学的“碰撞理论”。
1920s
朗格缪尔(Irving Langmuir, 1881-1957, 美国化学家。
提出气体在固体表面上的吸附理论。
) 研究了表面反应动力学,得到被后人命名为“Langmuir 等温线”的基本理论。
后来,Hinshelwood(英)进一步发展了这个理论,成为多相催化反应的“Langmuir-Hinshelwood机理”。
1934
赖斯(Rice,美国) 和赫兹菲尔德(Herzfeld, 美国) 证明:与自由基有关的链式反应(用稳态近似求得浓度)是引起有机化合物热分解反应(例如,乙烷和乙醛)反应级数变化的主要原因。
1935
艾林(Eyring, 美国) 发展了一个统计处理方法,称为“绝对反应速率理论”或“过渡态理论”。
按照这个理论,化学反应有两个步骤:
(a) 反应物平衡转化为“活化复合物”
(b)上述复合物的分解(有限速率步骤)。
1950s
Eigen创建了化学弛豫方法。
该方法极大地提高了测量化学反应时间的分辨率,可以对反应时间仅为10-8s的快速反应进行研究,成为液相快速反应动力学研究的有效方法。
Norrish和Porter则发展了闪光光解法,使寿命短至μs量级的激发态中间物种也能被发现。
现在弛豫法和闪光光解法已成为测定快速反应的有效手段,为反应机理的研究提供了有效的研究方法。
Eigen、Norrish和Porter也因通过极短能量脉冲导致平衡移动来研究快速的
化学反应而获得了1967年度的诺贝尔化学奖。
1960s
Herschbach和李远哲等人实现了在单次碰撞下研究单个分子间发生的反应机理的设想,使化学家有可能在电子、原子、分子和量子层次上研究化学反应所出现的各种动态,以探究化学反应和化学相互作用的微观机理和作用机制,揭示化学反应的基本规律(分子反应动力学的核心所在)。
Polanyi则开创了红外化学发光的研究。
1986年,Herschbach、李远哲和Polanyi因对化学基元过程动力学的贡献¨而分享了诺贝尔化学奖。
这也标志着国际学术界对此领域的重视以及对1955~1986年期间取得成就的肯定,是分子反应动力学发展的又一重要里程碑。
1970s
基于快速激光脉冲的飞秒光谱技术发展十分
迅速,时间标度达到了飞秒数量级。
随之发展起来
的飞秒化学(Femtochemistry)有着极其重要的理论
意义和研究价值。
Zewail从20世纪80年代开始,
利用超短激光创立了飞秒化学,从而使人们对过渡
态的研究有了可靠的手段。
Zewail也因用飞秒化学
研究化学反应的过渡态而获得了1999年度的诺贝
尔化学奖。
二、化学动力学与治疗药物监测
药物是治疗疾病的主要手段之一,药物进入生物体内通过调整失调的内源性活性物质或生理生化过程,杀灭抑制病原体达到治疗疾病的目的。
显然,治疗药物在作用部位的浓度或质量不足或过多便会起不到治疗作用或产生新的不良作用,甚至引起药源性疾病乃至危及生命。
因此20世纪60年代治疗药物监测(therapeutic drug monitoring.TDM)作为一门新兴的学科得以诞生和发展。
TDM的主要任务是通过灵敏可靠的检测方法,获得病人血液或其它生物材料中药物的浓度,获取有关药动学参数,利用动力学的相关理论,指导临床合理用药方案的制定和调整,并对药物中毒进行诊断和治疗,从而使药物治疗具有有效性和安
全性。
目前TDM在欧美发达国家已成为临床化学实验室的主要常规工作之一。
药物代谢动力学研究为TDM提供了基础,以药物代谢的消除动力学模型为例予以说明。
消除动力学(elimination kinetics)研究体内药物浓度变化速率的规律,可用下列微分方程表示:
dc/dt =-kc n
式中c为药物浓度,t为时间,k为消除速率常数,n代表消除动力学级数。
当n=1时即为一级消除动力学,n=0时则为零级消除动力学。
药物消除动力学模型即指这两种。
1、一级消除动力学
一级消除动力学(first order elimination kinetics)的表达式为:
dc/dt =- kc
积分得c t=c0 e-kt
由上指数方程可知,一级消除动力学的最主要特点是药物浓度按恒定的比值减少,即恒比消除。
2、零级消除动力学
零级消除动力学(zero order elimination kinetics)时,由于n=0,因此其微分表达式为:
dc/dt =- k
积分得c t=c0- kt
由此可知,零级消除动力学的最基本特点为药物浓度按恒量减少,即恒量消除。
必须指出,药物并不是固定按一级或零级动力学消除。
任何药物当其在体内量较少,未达到机体最大消除能力时(主要是未超出催化生物转化的酶的饱和限时),都将按一级动力学方式消除;而当其量超过机体最大消除能力时,将只能按最大消除能力这一恒量进行消除,变为零级消除动力学方式,即出现消除动力学模型转换。
苯妥英钠、阿司匹林、氨茶碱等常用药,在治疗血药浓度范围内就存在这种消除动力学模型转移,在TDM工作中尤应注意。
从药物代谢的消除动力学模型研究可以看到:化学动力学为TDM的开展提供了必备的基础理论,为临床合理用药提供了保障。
