多组分系统热力学小结
第4章 多组分热力学

前面所讨论的是:单组分单相(两相)系统或多 组分组成恒定的系统。 但常见系统绝大部分是:多组分变组成系统。因 此必须研究处理多组分系统。
多组分系统除了两个变量之外,还需确定各组分 的物质的量才能确定系统的状态。 多组分系统分为:单相、多相
本章主要讨论多组分单相系统。
1
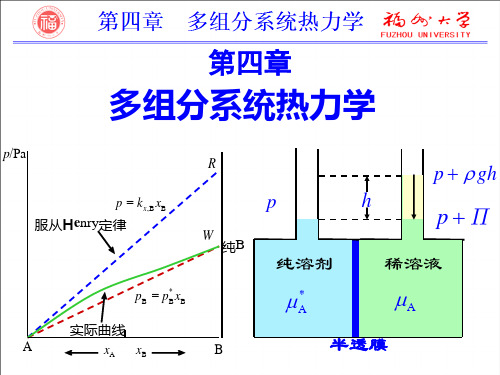
第四章 多组分系统热力学
B
dA SdT pdV BdnB
B
•适用条件 W ' 0 ,单相系统
31
2.多组分单相系统的热力学公式
•广义定义
B
U nB
S ,V ,nC
H nB
S , p,nC
A nB
T ,V ,nC
G nB
T , p,nC
保持特征变量和除B以外其它组分不变,某热力
学函数随其物质的量 nB的变化率称为化学势。
2 偏摩尔量相对于某一组分而言,本身是强度量;
3 偏摩尔量与浓度有关,与系统的总量无关。
4 偏摩尔量 X B ( nX,B )下T ,标p,n必C 须是
。T , p, nC
15
2.偏摩尔量
•偏摩尔量的物理意义
•两种理解 1 在恒温恒压下,于极大量的某恒定组成的系统中加
入1mol组分B时所引起系统广度量X的改变量。
混合物的摩尔体积:
Vm
xB M B /
B
Vm xBVB
B
21
5.吉布斯—杜亥姆方程
X
X
dX
( T
) p,nB
dT
(
p
)T ,nB
dp
B
X BdnB
•恒温恒压多组分系统
dX X BdnB
B
物理化学:第4章_多组分系统热力学_
真实混合物:实曲线
Vm xBVB xCVC VB (VC VB)xC
当混合物组成改变时,两组 分偏摩尔体积随之改变,且二者 变化相互关联。
组成接近某纯组分,其偏摩 尔体积也接近该纯组分摩尔体积。
5. 吉布斯 − 杜亥姆方程
对广度量 X (T , p, nB, nC , nD ,) 求全微分:
dX
X T
p,nB
dT
X p
T ,nB
dp
B
X nB
dnB T , p,nC
恒温、恒压
另一方面,由加和公式
,恒温恒压下求导:
比较两式,得
或
或
吉布斯-杜亥姆方程--在一定温度压力下,当混合物
组成变化时,各组分偏摩尔量变化的相互依赖关系。
➢ 系统中各组分的偏摩尔量并非完全独立,而是相 互依存的。
➢ 例:固体溶解、过饱和溶液析出、…
组分B在α、β两相中迁移达平衡的条件:该组分
在两相中的化学势相等。
➢ 物质总是从其化学势高的相向化学势低的相迁移, 直至物质迁移达平衡时为止,此时系统中每个组分在 其所处的相中的化学势相等。
化学势 判据
② 化学平衡
<0:自发不可逆; =0:平衡、可逆
任一化学反应,假定系统已处于相平衡,
任一组分B在每个相中的化学势都相等: Bα B
B
B
整个系统中B组分物质的量的变化量: dnBα dnB
α
BdnB
B
化学平衡时
平衡条件:与化学反应达到平衡的方式无关。
§4.3 气体组分的化学势
1、纯理想气体的化学势 2、理想气体混合物中任一组分的化学势 3、纯真实气体的化学势 4、真实气体混合物中任一组分的化学势
多组分系统热力学 读书笔记

第四章多组分系统热力学主要公式及其适用条件基本概念1. 溶剂和溶质如果组成溶液的物质有不同的状态,通常将液态物质称为溶剂,气态或固态物质称为溶质。
如果都是液态,则把含量多的一种称为溶剂,含量少的称为溶质。
2. 溶液广义地说,两种或两种以上物质彼此以分子或离子状态均匀混合所形成的体系称为溶液。
溶液以物态可分为气态溶液、固态溶液和液态溶液。
根据溶液中溶质的导电性又可分为电解质溶液和非电解质溶液。
3. 混合物多组分均匀体系中,溶剂和溶质不加区分,各组分均可选用相同的标准态,使用相同的经验定律,这种体系称为混合物,也可分为气态混合物、液态混合物和固态混合物。
1. 偏摩尔量的定义偏摩尔量的物理意义:在定温定压条件下,往无限大的系统中(可以看作其浓度不变)加入1 mol 物质B 所引起的系统中某个(容量性质的)热力学量X 的变化。
几点注意事项:只有在定温和定压条件下才有偏摩尔量。
只有广度性质才有偏摩尔量,而偏摩尔量是强度性质。
纯物质的偏摩尔量就是它的摩尔量。
任何偏摩尔量都是T,p和组成的函数。
化学势定义保持温度、压力和除B以外的其它组分不变,体系的G自由能随nB的变化率称为化学势,所以化学势就是偏摩尔G自由能。
化学势在判断相变和化学变化的方向和限度方面有重要作用。
化学势的物理意义:是决定物质传递方向和限度的强度因素。
多相和多组分体系的热力学基本方程多组分系统多相平衡的条件为:除系统中各相的温度和压力必须相同以外,各物质在各相中的化学势必须相等。
如果某物质在各相中的化学势不等,则该物质必然从化学势较大的相向化学势较小的相转移。
由于考虑了系统中各组分物质的量的变化对热力学状态函数的影响。
因此该方程不仅能应用于封闭系统,也能应用于开放系统。
拉乌尔定律和亨利定律乌拉尔定义:一定温度时,溶液中溶剂的蒸气压pA与溶剂在溶液中的物质的量分数xA成正比,其比例系数是纯溶剂在该温度时的蒸气压pA*。
拉乌尔定律只适用于稀溶液中的溶剂1. 在稀溶液中,溶剂分子之间的引力受溶质分子的影响很小,即溶剂分子周围的环境与纯溶剂几乎相同。
4 多组分系统热力学

( p p* H 2 O ) 0.40 (105.4 7.33) 0.40kPa 39.23kPa
p N2 p p * H 2 O p H 2 (105.4 7.33 39.23) kPa 58.84kPa
M H 2 2.0158, x H2 pH2 k x,H2 M N 2 28.0134 mH2 / M H 2 m H 2O / M H 2O m H 2 / M H 2 m N 2 / M N 2 mH 2 / M H 2 m H 2O / M H 2O
* p甲苯 y苯
p p
* 苯
* 甲苯
y苯 p y苯
* 苯
38.7 0.3 0.142 ; x甲苯 1 x苯 0.858 100 38.7 0.3 100 0.3
4-6 在 18℃,气体的压力为 101.325kPa 下,1dm3 的水中能 溶解 O20.045g,能溶解 N20.02g。现 1dm3 将被 202.65kPa 空气饱 和了的水溶液加热沸腾,赶出所溶解 O2 的和 N2,并干燥之,求此 干燥气体在 101.325kPa、18℃下的体积及组成。设空气为理想 气体混合物,其组成(体积百分数)为: (O 解: M
x 2 d 2 RTdx2 x1 d 1 x 2 d 2
x 1 d 1 RTdx 2 RTd (1 x1 ) RTdx1
d1 RTdx1 / x1
1
1
d 1 RT d ln x1
x1 1
x1
1 1 RT ln x1 1 ( pg ) RT ln( p1* / p ) RT ln x1 1 1 ( pg ) RT ln( p1 / p )
多组分体系热力学解析

体系中的组分对某热力学性质的贡献.
三.
化学势
• 定义: 偏摩尔吉布斯自由能为化学势 (chemical potential)
•
i=(G/ni)T,p,n(j≠i) (5)
• i : i物质的化学势. • 化学势也是一种偏摩尔量, 因为G的偏摩 尔量在化学中特别重要, 在计算中常常出 现, 故人们特意定义它为化学势.
(1)
•求Z的全微分: • dZ=(Z/T)dT+(Z/p)dp+∑(Z/ni)T,p,n(j≠i)dni •对于恒温, 恒压过程, 上式变为: •
Z dZ dni i ni T , p ,n ji
dT=0 dp=0
• 定义: •
Zi,m= (Z/ni)T,p,n(j≠i)
=TdS-pdV+∑idni
• 比较(7)式和上式, 可得:
•
i=(U/ni)S,V,n(j≠i)
• 上式也是化学势的定义式, 与(5)是等价的.
• 多组分体系的Gibbs关系式 :
• (适用于达力平衡, 热平衡,只作体积
功的均相体系) • dU=TdS-pdV+∑idni (8)
•
• •
dH=TdS+Vdp+∑idni
dF=-SdT-pdV+∑idni dG=-SdT+Vdp+∑idni (11)
(9)
(10)
• 化学势的四个等价的定义式: •
• • •
i=(U/ni)S,V,n(j≠i) (12)
i=(H/ni)S,p,n(j≠i) (13) i=(F/ni)T,V,n(j≠i) (14) i=(G/ni)T,p,n(j≠i) (15)
多组分系统热力学总结

在25℃时,CH4(g)的溶解度在水和苯中的亨 利系数分别为k1和k2,且k1 > k2,则在相同的
平衡分压p(CH4)下,CH4(g)在水中的溶解度
( )在苯中的溶解度。
• A. >
B. <
C. =
D. 无法比较
理想液态混合Βιβλιοθήκη 的混合性质 (1)ΔmixH = 0 (2) ΔmixV = 0 (3) ΔmixS = -R(nBlnxB + nClnxC)>0 (4) ΔmixG = RT(nBlnxB + nClnxC)<0
例:0.01 mol· -1的尿素溶液 (CO(NH2)2)、0.01 mol· -1 L L 的CaCl2溶液和0.01 mol· -1的NaCl溶液同时放到冰箱 L 里,令冰箱从0 oC起缓慢降温,则以下说法正确的为 : ( ) A) 尿素最早结冰 B) CaCl2和尿素同时结冰 C) NaCl最晚结冰 D) 三种溶液同时结冰 例:伤口上撒盐为什么会疼?往水蛭身上撒盐为什 么会令其死亡?
多组分系统热力学总结
化学势:偏摩尔吉布斯函数
是温度、压力以及组成的函数
298K、101.325kPa下,将50ml与100ml浓度均为 1mol· -3 萘的苯溶液混合,混合液的化学势μ为: dm
• • • •
(A) μ = μ1 + μ2 ; (B) μ = μ1 + 2μ2 ; (C) μ = μ1 = μ2 ; (D) μ = ⅓μ1 + ⅔μ2 。
在恒温密封容器中有A、B两杯稀盐水溶液,盐的 浓度分别为cA和cB(cA > cB),放置足够长的时间后: (A) A杯盐的浓度降低,B杯盐的浓度增加 ; (B) A杯液体量减少,B杯液体量增加 ; (C) A杯盐的浓度增加,B杯盐的浓度降低 ; (D) A、B两杯中盐的浓度会同时增大 。
物理化学 第四章 多组分系统热力学

Vm
T,p一定
V*m,C VC
V*m,B VB
d c· b·
0 B
a xC
C
图4.1.2 二组分液态混合物的 偏摩尔体积示意图
若B,C形成真实液态混合物: 则混合物体积为由V*m,B至V*m,C的曲线。对于任一 组成a时,两组分的偏摩尔体积可用下法表示: 过组成点a所对应的系统体积点d作Vm-xC曲线的 切线,此切线在左右两纵坐标上的截距即分别 为该组成下两组分的偏摩尔体积VB,VC。
B
系统中各广度量的偏摩尔量: 对于多组分系统中的组分B,有: 偏摩尔体积: VB=(ƽV/ƽnB)T,p,n C 偏摩尔热力学能: UB=(ƽU/ƽnB)T,p,n C 偏摩尔焓: HB=(ƽH/ƽnB)T,p,n C 偏摩尔熵: SB=(ƽS/ƽnB)T,p,n C 偏摩尔亥姆霍兹函数:AB=(ƽA/ƽnB)T,p,n C 偏摩尔吉布斯函数: GB=(ƽG/ƽnB)T,p,n
C
几点说明: (1)偏摩尔量为两个广度性质之比,所以为强度 性质; (2)偏摩尔量的定义中明确是在恒温、恒压及系 统组成不变的条件下,偏导数式的下标为T,p 时才是偏摩尔量; (3)同一物质在相同温度、压力但组成不同的多 组分均相系统中,偏摩尔量不同; (4)若系统为单组分系统,则该组分的偏摩尔量 与该组分的摩尔量相等,即: XB=X*B,m
C
=VB (数学知识:二阶偏导与求导的顺序无关) 得证。
4.2化学势 4.2化学势
1.化学势的定义 混合物(或溶液中)组分B的偏摩尔吉布斯函数GB 定义为B的化学势,用符号μB表示:
μB = GB=(ƽG/ƽnB)T,p,n
def
C
对于纯物质,其化学势等于它的摩尔吉布斯函 数。
多组分系统热力学小结

多组分系统热力学小结1. 引言多组分系统热力学研究了由多个组分组成的热力学系统的性质和行为。
在这篇文档中,我们将总结多组分系统热力学的一些重要概念和理论,并讨论其在应用中的一些关键应用。
2. 多组分系统的基本概念在多组分系统中,每个组分都有自己的化学组成和性质。
这些组分可以是单一物质或混合物。
多组分系统研究的核心是了解混合物内各组分的相互作用和行为。
多组分系统中的组分可以通过化学势来描述。
化学势是衡量组分在系统中存在的倾向的度量。
对于一个多组分系统,其总能量和组分的化学势之间存在一定的关系,这在热力学理论中被称为Gibbs-Duhem方程。
3. 多组分系统的相平衡在多组分系统中,相平衡是重要的概念。
相平衡指的是不同组分之间达到了平衡状态,可以通过化学势来描述。
当系统达到相平衡时,每个组分的化学势相等。
根据Gibbs相律,对于多组分系统,相平衡条件可以表示为:$\\sum_i \\mu_i dx_i=0$,其中$\\mu_i$表示第i个组分的化学势。
这个方程表明,在相平衡条件下,各组分的化学势满足一定的平衡关系。
4. 多组分系统的热力学性质多组分系统的热力学性质包括混合熵、混合焓和混合自由能等。
这些性质可以通过计算混合物的热力学函数来获得。
4.1 混合熵混合熵指的是混合物的熵减去各组分的熵的总和。
根据熵的定义,混合熵可以通过计算每个组分的摩尔熵和摩尔分数来求得。
4.2 混合焓混合焓指的是混合物的焓减去各组分的焓的总和。
根据焓的定义,混合焓可以通过计算每个组分的摩尔焓和摩尔分数来求得。
4.3 混合自由能混合自由能指的是混合物的自由能减去各组分的自由能的总和。
根据自由能的定义,混合自由能可以通过计算每个组分的摩尔自由能和摩尔分数来求得。
5. 多组分系统的关键应用多组分系统热力学在很多领域中有着重要的应用,以下是其中几个典型的应用:5.1 相平衡计算根据相平衡条件的方程,可以使用多组分系统热力学的理论和方法来计算系统中各相的成分和分布。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
多组分系统热力学小结
一、重要概念
混合物(各组分标准态相同)与溶液(分溶剂与溶质,标准态不同),
组成表示:物质B的摩尔分数x B、质量分数w B、(物质的量)浓度c B、质量摩尔浓度b B,
理想稀溶液,理想液态混合物,偏摩尔量,化学势,稀溶液的依数性,逸度与逸度系数,活度与活度系数
二、重要定理与公式
1.稀溶液的性质
(1)拉乌尔定律:稀溶液的溶剂:p A=p A*x A
(2)亨利定律:稀溶液的溶质:p B=k x、B x B , p B=k B、C C B , p B=k b、B b B
(3)Nernst分配定律:
(4)依数性:溶剂蒸气压降低:∆p A=p A*x B
凝固点降低: ∆T f=K f b B
沸点升高: ∆T b=K b b B
渗透压: ∏B=c B RT
2.理想混合物
定义:任一组分在全部组成范围内符合拉乌尔定律的液态混合物。
性质:d p=0, d T=0 混合
(1) ∆mix V=0 (2) ∆mix H=0(3) ∆mix S=-nR∑x B ln x B
(4) ∆mix G=∆mix H-T∆mix S=nRT∑x B ln x B
3.偏摩尔量
定
义:X B=(X/
n B)T,p,nc≠nB 性质:恒温恒压下:
4.化学势
(1)定义:
B=G B=(G/
n B)T,p,nc'≠n B
自发:朝化学势小的方向
(3)化学势的表达式
理想气体:μB=μB*(T,p,y c)=μB(T)+RT ln(py B/p)
实际气体:μB=μB*(T,p,y c)=μB(T)+RT ln(p B/p)
逸度 :有效压力逸度系数:ϕB= /p B= /py B 理想液态混合物:μB=μB*+RT ln(x B)
真实液态混合物:μB=μB*+RT ln(αB)
活度α=f B x B
在常压下,压力影响可忽略不计,故
μB=μBθ+RT ln(αB)
若气相为理想气体,则活度的计算式:
αB=p B/p B*
f B=αB/x B=p B/p B*x B
稀溶液:溶剂或溶质:μA=μA+RT ln(x A)
真实溶液
溶剂: μA=μA+RT ln(αA)
溶质:采用质量摩尔浓度时:μB=μB,b+RT ln(αb,B)
采用浓度时μB=μc,B+RT ln(αc,B)
5、 多组分系统的热力学基本方程
三、常见的计算题型
1.根据稀溶液的性质作依数性等方面的计算
2.在相平衡一章中常用拉乌尔定律与亨利定律。
3.典型题型
例题:香烟中主要含有尼古丁(Nicotine),就是致癌物质。
经元素分析得知其中含 9、3% 的 H,72% 的 C 与 18、7% 的 N 。
现将 0、6 克尼古丁溶于 12、0 克的水中,所得溶液在101325Pa 下的凝固点为 -0、62℃,求出该物质的摩尔质量M B 并确定其分子式(已知水的摩尔质量凝固点降低常数为 1、86 K ·kg ·mol -1)。
解:假设尼古丁的摩尔质量为M B ,根据凝固点下降公式 △T f =K f b B
则有 kg 012.0kg/-106mol kg K 86.1K 62.0B 41
M ⨯⨯⋅⋅=- M B = 150 g ·mol -1
可算出各原子数
C:M r (B) w (C)/M (C)= 150×0、72/12 = 9、0
N:M r(B) w(N)/M(N)= 150×0、1870/14 = 2、0
H:M r(B) w(H)/M(H)= 150×0、093/1 = 13、9
所以分子式为(C9N2H14)
例题: 在293K时将6、84g蔗糖(C12H22O11)溶于1kg的水中。
已知293K时此溶液的密度为1、02g·cm-3,纯水的饱与蒸气压为2、339kPa,试求:
(1) 此溶液的蒸气压;
(2) 此溶液的沸点升高值。
已知水的沸点升高常数K b=0、52K·mol-1·kg 。
(3) 此溶液的渗透压。
解:(1)蔗糖的摩尔质量为342g,
x蔗糖= (6、84/342)/[(6、84/342)+1000/18、2]=0、0004
p= p*(1- x蔗糖)= 2、339kPa*(1-0、0004)=2、338kPa
(2) b蔗糖= (6、84/342)mol/1kg = 0、02 mol·kg-1
∆T b =K b b蔗糖= (0、52*0、02)K = 0、01K
(3) c = n蔗糖/V = (6、84/342)mol/(1、00684kg/1、02kg·dm-3)=0、02026mol·dm-3
∏=cRT= 0、02026mol·1000 m -3 * 8、3145J·mol-1·K-1*293K = 49356Pa=49、4kPa。
