国家食品药品监督管理局公告2012年第70号――药品GLP认证公告(第28号)
国家食品药品监督管理总局公告2014年第37号――药品GMP认证公告(第27号)

国家食品药品监督管理总局公告2014年第37号――
药品GMP认证公告(第27号)
文章属性
•【制定机关】国家食品药品监督管理总局(已撤销)
•【公布日期】2014.08.19
•【文号】国家食品药品监督管理总局公告2014年第37号
•【施行日期】2014.08.19
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家食品药品监督管理总局公告
(2014年第37号)
药品GMP认证公告(第27号)
按照《药品生产质量管理规范认证管理办法》的规定,经现场检查和审核批准,陕西秦龙济康药业有限责任公司等25家药品生产企业符合《药品生产质量管理规范(2010年修订)》要求,发给《药品GMP证书》。
特此公告。
附件:药品GMP认证目录(第27号)
国家食品药品监督管理总局
2014年8月19日附件
药品GMP认证目录(第27号)。
nmpa 药物glp认证要求

一、简介国家药品监督管理局(NMPA)是我国国家药品监管部门,负责对药品的生产、流通和使用进行监管。
GLP(Good Laboratory Practice)是一种国际通用的实验室管理质量体系,旨在确保实验室测试数据的可靠性和可复制性。
药物GLP认证要求是指药品生产企业在进行实验室测试时,必须遵循GLP要求,保证测试结果的准确性和可信度。
二、药物GLP认证的意义1. 提高药品质量:药品生产企业通过遵循GLP认证要求,能够提高实验室测试数据的准确性,从而保证药品质量的稳定性和可靠性。
2. 增强国际竞争力:国际上许多国家都要求药品生产企业进行GLP 认证,通过获得GLP认证,企业能够增强国际市场竞争力,提升药品的国际声誉。
3. 保障公众健康:药品的质量和安全直接关系到公众的健康,药品生产企业通过严格遵守GLP认证要求,能够保障公众健康和安全。
三、药物GLP认证的要求1. 实验室管理体系要求:药品生产企业应建立健全的实验室管理体系,包括实验室设施和设备的管理、实验室人员的培训和管理、实验室技术文件的管理等。
2. 实验室测试方法要求:药品生产企业应制定合理有效的实验室测试方法,确保测试数据的准确性和可复制性。
3. 实验室测试记录要求:药品生产企业应完整记录实验室测试数据,并进行及时、准确的数据分析和记录,保证数据的真实性和可信度。
4. 实验室质量控制要求:药品生产企业应建立健全的实验室质量控制体系,包括质量控制文件的管理、质量控制程序的执行和质量稽核等。
四、药物GLP认证的申请流程1. 提交申请材料:药品生产企业需向NMPA提交GLP认证申请材料,包括申请表、实验室管理体系文件、实验室测试方法文件、实验室测试记录文件、实验室质量控制文件等。
2. 审核和评估:NMPA对申请材料进行审核和评估,对实验室进行现场核查和评审,确保实验室管理和实验室测试符合GLP认证要求。
3. 发放认证证书:经过审核和评估合格的药品生产企业将获得NMPA颁发的GLP认证证书,证明实验室管理和实验室测试符合GLP 认证要求。
国家食品药品管理局发布2012年第2期国家药品质量公告
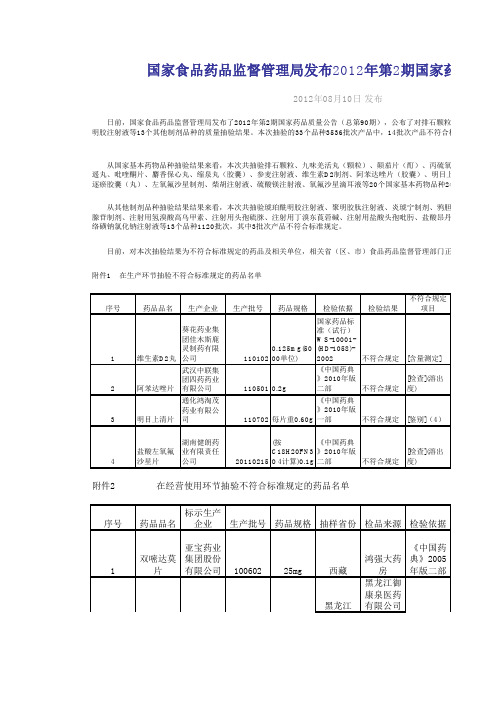
序号药品品名生产企业生产批号药品规格检验依据检验结果不符合规定项目1维生素D2丸葵花药业集团佳木斯鹿灵制药有限公司1101020.125mg(5000单位)国家药品标准(试行)WS-10001-(HD-1058)-2002不符合规定[含量测定]2阿苯达唑片武汉中联集团四药药业有限公司1105010.2g 《中国药典》2010年版二部不符合规定[检查](溶出度)3明目上清片通化鸿淘茂药业有限公司110702每片重0.60g 《中国药典》2010年版一部不符合规定[鉴别](4)4盐酸左氧氟沙星片湖南健朗药业有限责任公司20110215(按C18H20FN3O4计算)0.1g 《中国药典》2010年版二部不符合规定[检查](溶出度)1双嘧达莫片亚宝药业集团股份有限公司10060225mg 西藏鸿强大药房《中国药典》2005年版二部黑龙江黑龙江御康泉医药有限公司序号药品品名标示生产企业生产批号药品规格抽样省份检品来源检验依据丸和制药有限公司典》2005年版一部 从国家基本药物品种抽验结果来看,本次共抽验排石颗粒、九味羌活丸(颗粒)、颠茄片(酊)、丙硫氧嘧逍遥丸、吡喹酮片、麝香保心丸、缩泉丸(胶囊)、参麦注射液、维生素D2制剂、阿苯达唑片(胶囊)、明目上清片、双血府逐瘀胶囊(丸)、左氧氟沙星制剂、柴胡注射液、硫酸镁注射液、氧氟沙星滴耳液等20个国家基本药物品种2416批次规定。
国家食品药品监督管理局发布2012年第2期国家药品质量2012年08月10日 发布 日前,国家食品药品监督管理局发布了2012年第2期国家药品质量公告(总第90期),公布了对排石颗粒等20个国家基酰明胶注射液等13个其他制剂品种的质量抽验结果。
本次抽验的33个品种3536批次产品中,14批次产品不符合标准规定。
从其他制剂品种抽验结果结果来看,本次共抽验琥珀酰明胶注射液、聚明胶肽注射液、炎琥宁制剂、鸦胆子磷腺苷制剂、注射用氢溴酸高乌甲素、注射用头孢硫脒、注射用丁溴东莨菪碱、注射用盐酸头孢吡肟、盐酸昂丹司琼注射液、卡络磺钠氯化钠注射液等13个品种1120批次,其中3批次产品不符合标准规定。
GLP的基本介绍

GLP的基本介绍GLP(Good Laboratory Practice)是一种实验室规范,旨在确保实验室研究结果的可靠性和可重复性。
它是许多科学研究领域的基本要求,涉及药物、化学品、农药、化妆品等各个行业。
本文将详细介绍GLP的背景、目的、原则和实施细节。
背景:20世纪60年代,世界各国开始引入一系列规范和标准来约束实验室研究的质量和可靠性,推动实验室工作的标准化和规范化发展。
GLP标准产生于1970年代初的美国,随后迅速传播到全球范围。
目前,许多国家和地区都制定了自己的GLP法规和指南。
目的:GLP的主要目标是确保实验室研究结果的可靠性和可重复性。
通过制定规范和标准,GLP可以提供一种系统性的方法来设计、进行和报告实验室研究,以确保产生准确、可靠的数据,并确保结果可以在不同研究实验室之间得到复制。
这有助于减少错误和误解,并增加对决策和政策制定者的信任。
原则:GLP遵循以下基本原则:1.组织与管理:实验室应建立一套完善的管理体系,负责实验室研究的全面规划、组织和监督。
管理者应具备相应的专业知识和技能,以确保实验室工作的高效运行。
2.资质和培训:实验室应拥有合适的设备、设施和人员,并对实验人员进行培训,使其熟悉实验室操作规程和质量管理要求。
同时,实验人员应具备相关的资质和经验。
3.样品管理:实验室应建立样品接收、储存和处理的规程,确保样品的准确性和完整性。
实验室还应制定一套样品追踪和标识系统,以确保样品的追溯性。
4.实验设计和操作:实验室应制定详细的实验设计和操作规程,以确保实验过程的一致性。
实验记录应详尽完整,并包含所有必要的数据和观察结果。
5.质量控制和保证:实验室应制定一套质量控制和质量保证体系,包括校准和验证方法、实验中的质量控制程序等,以确保实验结果的准确性和可重复性。
6.数据归档和报告:实验室应建立一套完整的数据管理和归档系统,以确保数据的安全和可追溯性。
实验结果的报告应符合一定的格式和标准,包括结果的描述、结论和建议等。
药品管理立法

超过有效期的。
直接接触药品的包装材料和容器未经批准。
擅自添加着色剂、防腐剂、香料、矫味剂及辅料的。
二、药品包装的管理
材料和容器的规定 直接接触药品的包材 医院制剂 中药材(5)
(1) 应有项目 (2) 特定标志 (3) 中药饮片 (4)禁止有关宣传
2. 标签和说明书
药品价格和广告管理
4 . 禁止回扣
(二)药品广告管理
B
D
F
A
C
E
批
省局(药品广告批准文号)
{横向备案:发布地省局
批准:生产企业所地省局,进口代理机构地
备案:{纵向备案:国家局
处方药
实,合法 四不得:虚构、保证性广告、记忆性广告、 冒充药品的宣传
广告审查机关: 省局 (1)处理建议 (2)撤销批准文号 (3)责令停止 广告监督机关:各级工商局 (行政处罚)
1.熟悉药品监督的相关规定 2.了解药品管理法中的法律责任 3.掌握生产销售假药,劣药法律责任
第五节 药品监督和法律责任 教学目的要求:
药品质量抽查检验 药品行政强制措施 生产销售假药,劣药法律责任
(一)药品监督检查 (1)行政主体 (2)行政相对方(相对人) (3)内容 (4)义务
审批: 省级药品监督管理部门形式审查, SFDA技术审查通过后发给药品批准文号。
(1)审批:SFDA;注册证 (2)条件 (3)进口程序 口岸 口岸药检所? (备案-通关单-逐批抽检)
(二)、国家药品标准
强制性
制订机构
05
03
01
04
02
(三)、 国家药品审评;再评价/淘汰的对象
生产、销售假药的,没收违法生产、销售的药品和违法所得,并处违法生产、销售药品货值金额二倍以上五倍以下的罚款;有药品批准证明文件的予以撤销,并责令停产、停业整顿;情节严重的,吊销《药品生产许可证》、《药品经营许可证》或者《医疗机构制剂许可证》。
卫生部关于立即查处违法添加药物的“糖济可胶囊”等14种保健食品的通知

卫生部关于立即查处违法添加药物的“糖济可胶囊”等14种保健食品的通知文章属性•【制定机关】卫生部(已撤销)•【公布日期】2005.11.27•【文号】卫监督发[2005]469号•【施行日期】2005.11.27•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文卫生部关于立即查处违法添加药物的“糖济可胶囊”等14种保健食品的通知(卫监督发[2005]469号)各省、自治区、直辖市卫生厅局、新疆生产建设兵团卫生局,卫生部卫生监督中心,中国疾病预防控制中心:根据2005年食品专项整治工作安排,我部组织部卫生监督中心和有关省份对调节血糖类保健食品添加化学药品情况进行专项监督检查,发现“糖济可胶囊”等14种产品含有格列美脲、苯乙双胍等化学药品(具体名单见附件)。
以上产品对消费者身体健康构成严重危害,违反《食品卫生法》和《保健食品管理办法》的规定。
为保障消费者身体健康,根据食品卫生法有关规定,现紧急通知如下:一、上述生产企业所在地的省级卫生行政部门要立即组织对这些生产企业进行监督检查,依法对这些单位违法生产经营行为予以严肃查处,责令其公告收回所有保健食品,在调查取证后吊销其相关卫生许可证明。
同时,要核查其生产情况和产品流向,及时向各相关省份卫生行政部门通报查处结果。
对涉嫌触犯刑法的,要依法及时向公安部门移送。
二、各地卫生行政部门要立即通知本辖区内食品经营单位停止销售这些产品,责令其公告收回已售出产品。
对不按要求收回和仍在违法经营这些产品的行为,要依法予以行政处罚,情节严重的,吊销相应卫生许可证明。
三、各地卫生行政部门要加强对保健食品生产经营活动的卫生许可和监督检查工作,依法查处违法生产经营行为,并及时向社会通报。
同时,请将有关情况及时函报我部监督司。
联系人:张旭东、房军联系电话:68792594,68792407 传真:68792408附件:添加化学药品的部分调节血糖类保健食品二〇〇五年十一月二十七日附件:添加化学药品的部分调节血糖类保健食品┌─┬─────┬──┬─────┬─────┬────────┬─────────┬───┐││标示的产品│商标│规格│生产日期或│标示的批准文号│标示的生产单位│添加的│││名称│││批号│││ 药物│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│1 │糖济可胶囊│九郡│0.5g/粒× │050228/050│国食健字G20040│陕西天福保健品有限│格列美│││││48粒│208│726│责任公司(委托生产│ 脲、││││││││:内蒙古五原九郡药│苯乙双││││││││业有限责任公司)│胍│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│2 │康立舒胶囊││0.5g/粒× │20041005│卫食健字(2000)│陕西利威尔制药有限│格列本│││(口服植物││42粒│200410010 │第0065号│公司│脲│││胰岛素)│││││││├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│3 │玺圃利唐康│玺圃│0.5g/粒× │A001│国食健字G20040│北京玺圃环球生物医│苯乙双│││胶囊││40粒/瓶│2004/06/22│311│药技术有限公司│ 胍、│││││││││格列本│││││││││脲│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│4 │协和牌汉龙│协和│0.5克×36 │2005年03月│卫食健字(2002)│北京美诺保健食品厂│格列美│││胶囊││粒│03日│第0442号│、协和生物工程研究│脲││││││││所有限公司││├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│5 │同春堂苦瓜│同春│0.6g×30│041026/041│卫食健字(1999│北京同春堂生物科技│格列甲│││口含片│堂│片/瓶│001│)第107号│有限公司│嗪││├─────┼──┼─────┼─────┼────────┼─────────┼───┤││同春堂苦瓜│同春│0.6g×30│050101/050│卫食健字(1999│山东北京同春堂保健│格列甲│││口含片│堂│片/瓶│106│)第107号│食品有限公司│嗪│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│6 │一生唐乐舒│一生│0.3克×12 │20050423│卫食健字(2002)│北京唐康生物科技有│格列奇│││胶囊││粒×6板││第0546号│限公司、唐山市龙山│特││││││││药业有限公司│││├─────┼──┼─────┼─────┼────────┼─────────┼───┤││一生唐乐舒│一生│0.3克×12 │20050318│卫食健字(2002│北京唐康生物科技有│格列奇│││胶囊││粒×6板││)第0546号│限公司、唐山市龙山│特││││││││药业有限公司││├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│7 │唐新胶囊│唐新│0.4g×9粒│20041215│卫食健字(2002)│(山东省)蓬莱深奥│格列美│││││×2板││第0382号│生物科技研究所│ 脲、│││││││││格列本│││││││││脲│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│8 │绿因唐平口│绿因│0.8g/片× │20050301 1│卫食健字(2002│山东绿因药业有限公│格列甲│││含片│唐平│30片/盒│8│)第0573号│司│ 嗪、│││││││││格列本│││││││││脲│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│9 │苦乐康胶囊││0.45g/粒×│2004-09-13│卫食健字(2002│辽宁健康伟业生物科│格列奇│││││12粒/板×4│/│)第0588号│技有限公司│特│││││板/盒│20040903││││├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│10│美洛胰克绿││0.25g×12 │041008/│卫食健字(2001│嘉兴三立生物制品开│格列本│││如蓝唐宁胶││粒×2板│20041013│)第0088号│发中心│脲│││囊│││││││├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│11│糖安美片│三圣│0.6g/片× │2005.02.24│国食健字G20040│洛阳康华生物制品有│格列本││││宝│12片×3板││637│限公司│脲│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│12│安糖胶囊│平川│0.4g/粒× │20050301│卫食健字(2000)│中国哈尔滨平川药业│格列本││││康达│100粒││第0724号│股份有限公司│脲│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│13│唐胰安苦荞││3克/袋×10│20041213│卫食健字(1998│山西灵丘国威苦荞开│格列奇│││降糖茶││袋/盒│20041216│)第078号│发有限责任公司│ 特、│││││││││格列本│││││││││脲│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│14│神叶牌降糖│神叶│24袋×2.5g│200410061/│卫食健字(1998│江苏省金坛市神叶饮│格列本│││茶│││2004.10.06│)第308号│料有限公司│脲│└─┴─────┴──┴─────┴─────┴────────┴─────────┴───┘。
CDE老师带你梳理注射剂一致性评价中药学要求

CDE老师带你梳理注射剂一致性评价中药学要求仿制药(generic drug)是指具有与原研药品相同的活性成份、剂型、规格、适应证、给药途径和用法用量的原料药及其制剂,仿制药应与原研药品质量和疗效一致,可替代原研药品发挥相同的临床疗效。
仿制药在我国的临床用药中占主导地位,但由于历史的原因,我国早期批准的部分仿制药与原研药品确实存在一定的差距。
随着经济技术的高速发展,国内制药工业研发和制造水平提高,监管意识和能力增强,广大人民群众对优质药品的需求日益迫切,国务院于2012年1月正式印发《国家药品安全“十二五”规划》,提出对已上市的化学仿制药进行质量和疗效一致性评价(以下简称“一致性评价”)。
根据《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》,化学药品新注册分类实施前批准上市的仿制药,包括国产仿制药、进口仿制药和原研药品地产化品种,均须开展一致性评价。
一致性评价将加速我国化药仿制药的技术要求与国际接轨,是提高我国仿制药质量的一项重要工作。
注射剂(Injection)系指药物与适宜辅料制成的供注入机体内的无菌制剂,主要包括注射液、注射用无菌粉末和注射用浓溶液等。
因其直接注射入血管、组织或器官,吸收快,作用迅速,特别是静脉注射的注射剂,药物直接进入血液循环发挥药效,是临床使用中风险较高的剂型,其研发和生产的技术要求也相应更为严格。
本文从参比制剂选择、处方工艺研究、质量研究与控制、包材和稳定性研究等方面,结合国内外指导原则和相关政策文件,分析一致性评价要求下化药注射剂仿制药开发药学要求的变化。
需要指出的是,本文仅就普通注射剂进行讨论,特殊注射剂(如脂质体、胶束、微球、混悬型注射液、静脉乳剂等)还应结合其剂型特点和临床用法用量等进一步评价。
一、参比制剂选择参比制剂是仿制药研发的标杆,选择参比制剂是仿制药研发的开始,参比制剂选择是否正确决定仿制药的成败。
《药品注册管理办法(局令第28号)》定义仿制药为国内批准上市的已有国家标准的药品,在此阶段,原研品的地位没有得到充分的重视,监管机构没有对参比制剂进行统一规定。
国家食品药品监督管理局关于公布第二批停止使用化学药品地标品种名单的通知

国家食品药品监督管理局关于公布第二批停止使用化学药品地标品种名单的通知文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2003.05.07•【文号】国食药监安[2003]42号•【施行日期】2003.05.07•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局关于公布第二批停止使用化学药品地标品种名单的通知(国食药监安[2003]42号)各省、自治区、直辖市药品监督管理局:遵循化学药品地方品种再评价工作的原则、程序和要求,现公布第二批停止使用的化学药品地标品种名单(见附件)。
本通知公布停止使用的化学药品地标品种,由所在地省、自治区、直辖市药品监督管理局撤销该品种批准文号。
已在市场上流通的品种,由生产企业在6个月内自行收回销毁。
请各省、自治区、直辖市药品监督管理局监督执行。
特此通知附件:第二批停止使用的化学药品地标品种名单国家食品药品监督管理局二00三年五月七日附件:第二批停止使用的化学药品地标品种名单序号药品类别药品名称主要成分停止理由1非抗生素类吡哌酸缓释片吡哌酸剂型不合理(喹诺酮非时间依赖性,缓释道理不充分)2非抗生素类小儿吡哌酸干糖浆吡哌酸吡哌酸影响小儿发育3非抗生素类小儿吡哌酸片吡哌酸吡哌酸影响小儿发育4非抗生素类小儿呋喃唑酮片呋喃唑酮副作用大5非抗生素类呋喃唑酮散(痢特灵散)呋喃唑酮副作用大6非抗生素类止痢灵片(克尔利)呋喃唑酮,蟾酥,雄黄,朱砂等。
处方不合理7消化系统用药溃疡平胶囊(溃疡灵胶囊)呋喃唑酮,冰片,复方白芍干浸膏粉。
处方依据不合理8消化系统用药一粒丹呋喃唑酮,维生素B6,维生素K,盐酸普鲁卡因,甲氧氯普胺,颠茄浸膏。
处方依据不合理9非抗生素类抗痨息片(安痨息)二乙氧基二苯基硫脲安全性差10非抗生素类灭痨定片异烟肼,胺苯硫脲二药合用对肝脏损害大,处方不合理。
11非抗生素类乌洛托品注射液乌洛托品疗效不确12非抗生素类洗必泰碘酊碘,碘化钾,醋酸洗必泰等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
国家食品药品监督管理局公告2012年第70号――药品GLP
认证公告(第28号)
【法规类别】药品管理
【发文字号】国家食品药品监督管理局公告2012年第70号
【发布部门】国家食品药品监督管理局(原国家药品监督管理局)(已撤销)
【发布日期】2012.11.28
【实施日期】2012.11.28
【时效性】现行有效
【效力级别】XE0303
国家食品药品监督管理局公告
(2012年第70号)
药品GLP认证公告(第28号)
根据《中华人民共和国药品管理法》、《药物非临床研究质量管理规范》(GLP)和《药物非临床研究质量管理规范认证管理办法》的有关规定,国家食品药品监督管理局组织有关专家对江西省药物研究所(安全评价中心)等5家机构进行了检查。
经审核,该5家机构的单次和多次给药毒性试验(啮齿类)等试验项目符合GLP要求(见附件)。
特此公告。
附件:药品GLP认证目录
国家食品药品监督管理局
2012年11月28日
附件
药品GLP认证目录。
