大学物理化学实验数据记录与处理
物理化学实验报告.

《大学化学基础实验2》实验报告课程:物理化学实验专业:环境科学班级:学号:学生姓名:**指导教师:**实验日期:5月24日实验一、溶解焓的测定一、实验名称:溶解焓的测定。
二、目的要求:(1)学会用量热法测定盐类的积分溶解焓。
(2)掌握作图外推法求真实温差的方法。
三、基本原理:盐类的溶解通常包含两个同时进行的过程:一是晶格的破坏,为吸热过程;二是离子的溶剂化,即离子的水合作用,为放热过程。
溶解焓则是这两个过程热效应的总和,因此,盐类的溶解过程最终是吸热还是放热,是由这两个热效应的相应大小所决定的。
影响溶解焓的主要因素有温度、压力、溶质的性质以及用量等。
热平衡式:△sol H m=-[(m1C1+m2C2)+C]△TM/m2式中, sol H m 为盐在溶液温度及浓度下的积分溶解焓, J·mol , m1 , m2 分别为水和溶质的质量, M 为溶质的摩尔质量,kg·mol -1 ;C1 ,C 2 分别为溶剂水, kg; 溶质的比热容,J·kg -1;T 为溶解过程中的真实温差,K;C 为量热计的热容, J·K- 1 ,也称热量计常数.本实验通过测定已知积分溶解焓的标准物质 KCl 的 T ,标定出量热计热容 C 的值.四、实验主要仪器名称:NDRH-2S型溶解焓测定实验装置1套(包括数字式温度温差测量仪1台、300mL简单量热计1只、电磁搅拌器1台);250mL容量瓶1个;秒表1快;电子;蒸馏水天平1台;KCl;KNO3五、实验步骤:(1)量热计热容 C 的测定 ( 1 ) 将仪器打开 , 预热 . 准确称量 5.147g 研磨好的 KCl , 待用 .n KCl : n水 = 1: 200(2)在干净并干燥的量热计中准确放入 250mL 温室下的蒸馏水,然后将温度传感器的探头插入量热计的液体中.打开搅拌器开关,保持一定的搅拌速度,待温差变化基本稳定后,读取水的温度 T1 ,作为基温.(3)同时, 每隔30s就记录一次温差值,连续记录8 次后, 将称量好的 5.174g KCl 经漏斗全部迅速倒入量热计中,盖好.10s记录一次温度值,至温度基本稳定不变,再每隔 30s记录一次温度的数值,记录 8 次即可停止.(4)测出量热计中溶液的温度,记作 T2 .计算 T1 , T2 平均值,作为体系的温度.倒出溶液,取出搅拌子,用蒸馏水洗净量热计.KNO3 熔解热的测定:标准称量 3.513g KNO3 ,代替 KCl 重复上述操作.六、实验数据记录与处理KCl溶解过程中数据记录:KCl质量:5.1774g 平均温度18.295℃未加KCl之前:t=19.24℃由图可知: T=1.89℃:△sol Hm(KCl)=18933J/mol;C1=4200J/kg·℃C2=699000J/kg·℃;M(KCl)=0.0745kg/mol;m1=0.25kg;m2=0.0051774kg由△sol Hm=-[(m1C1+m2C2)+C]△TM/m2得:C=-4673.7898J/KKNO 3溶解过程中数据记录:KNO 3质量:3.510g 平均温度:18.735℃ 未加KNO 3之前:t=19.11℃加KNO 3后:由图可知: T=0.75℃;C=-1049.9943J/K;C1=4202J/kg ·℃C2=894900J/kg ·℃;M (KNO 3)=0.103kg/mol ;m1=0.25kg ;m2=0.0035112kg由△sol Hm=-[(m1C1+m2C2)+C]△TM/m2得:△sol Hm(KNO3)=23.45123kJ/mol七、实验问题讨论1.样品颗粒的大小和浓度,对溶解焓测定有什么影响?答:粒度太大不好溶解要受影响,溶解过程过长温差变化过小,就会产生误差;浓度太大也是影响到溶解速度的,时间太长温差数值变化过大,溶解焓的测定就不准了。
物理化学实验
实验1 燃烧热的测定1. 实验目的1.1掌握氧弹量热计的使用;用氧弹量热计测定萘的燃烧热;1.2掌握氧气钢瓶的使用。
2. 实验原理称取一定量的试样置于氧弹内,并在氧弹内充入1.5 ~ 2.0MPa的氧气,然后通电点火燃烧。
燃烧时放出的热量传给水和量热器,由水温的升高(△T)即可求出试样燃烧放出的热量:Q=K·△T式中K为整个量热体系(水和量热器)温度升高1℃所需的热量。
称为量热计的水当量。
其值由已知燃烧热的苯甲酸(标样)确定。
K =Q /△T式中△T应为体系完全绝热时的温升值,因而实测的△T须进行校正。
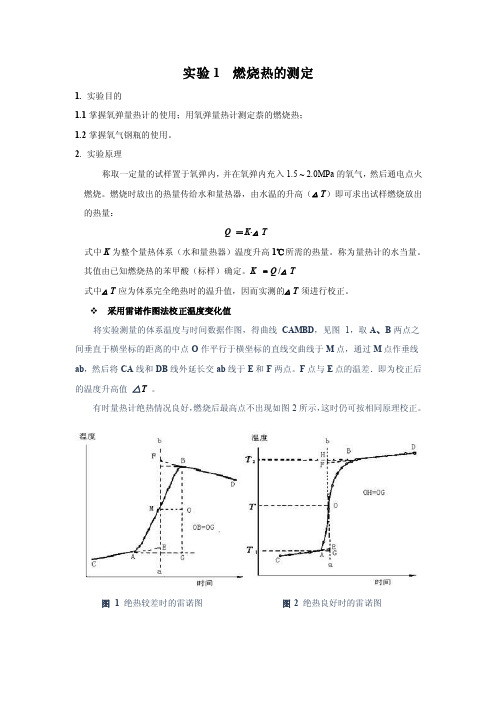
采用雷诺作图法校正温度变化值将实验测量的体系温度与时间数据作图,得曲线CAMBD,见图1,取A、B两点之间垂直于横坐标的距离的中点O作平行于横坐标的直线交曲线于M点,通过M点作垂线ab,然后将CA线和DB线外延长交ab线于E和F两点。
F点与E点的温差.即为校正后的温度升高值△T。
有时量热计绝热情况良好,燃烧后最高点不出现如图2所示,这时仍可按相同原理校正。
图 1 绝热较差时的雷诺图图2 绝热良好时的雷诺图3. 仪器与试剂3.1试剂:分析纯苯甲酸(QV=26480 J·g-1);待测样;引火丝(Ni-Cr丝,QV=8.4 J·cm -1)3.2仪器:HR-15A数显型氧弹量热计一台;压片机(苯甲酸和萘各用一台);精密贝克曼温差温度计(精确至0.01 ℃,记录数据时应记录至0.002 ℃);台秤一台;分析天平一台。
4. 实验步骤4.1水当量的测定(1)打开控制箱预热。
(2)量取10 cm引火丝并准确称重。
(3)在台秤上粗称试样1 g ~ 1.2 g;用压片机压片,同时将燃烧丝压入。
准确称重,减去引火丝重量后即得试样重量。
注意压片前后应将压片机擦干净;苯甲酸和待测试样不能混用一台压片机。
(4)将氧弹盖放在专用架上,将点火丝两端固定在氧弹电极上点火丝切勿接触坩锅,以防短路。
(5)取少量(~2 mL)水放入氧弹中(吸收空气中的N2燃烧而成的HNO3),盖好并拧紧弹盖,接上充气导管,慢慢旋紧减压阀螺杆,缓慢进气至表上指针为1.5 ~ 2.0 MPa。
教案物理化学实验热力学实验与数据处理

教案物理化学实验热力学实验与数据处理教案:物理化学实验-热力学实验与数据处理一、实验目的本实验旨在通过测量物质在不同温度下的热力学性质,掌握热力学实验的基本原理和实验方法,并学习数据处理和结果分析的基本技巧。
二、实验仪器与试剂1. 实验仪器:- 恒温水浴- 热电偶温度计- 热电偶电压测量仪- 温度控制器2. 试剂:- 实验样品(可根据实际情况自行选择)三、实验步骤1. 实验前准备:- 根据实验需要准备好试样,并将其保持在恒温条件下,确保其达到与实验环境相同的温度。
- 确保热电偶温度计、热电偶电压测量仪和温度控制器工作正常,并校准仪器。
2. 实验过程:1) 将试样放在恒温水浴中,待其温度稳定后,记录下初始温度并作为实验过程的起始温度。
2) 开始记录实验过程中试样的温度变化,并按实验计划逐渐改变温度。
可通过调节水浴温度或加入冷热介质来实现。
3) 在每个温度点上,等待试样温度稳定后,使用热电偶温度计测量试样的温度,并利用热电偶电压测量仪记录下相应的电压值。
4) 循环步骤3,直至完成全部预定温度点的测量。
3. 数据处理1) 温度与电压的记录数据可以通过电脑软件自动采集,也可以手动记录在表格中。
2) 根据热力学理论和实验结果,绘制温度与电压的曲线图。
可以使用Excel等软件进行数据处理和绘图。
3) 利用实验数据和绘制的曲线,可以计算出试样的热容量、热导率等热力学参数。
4) 将实验结果进行分析和讨论,与理论知识进行比较,得出结论并提出可能的误差来源和改进措施。
四、实验注意事项1. 实验操作时要注意安全,遵守实验室的相关规定。
2. 实验前准备工作要做到位,确保仪器和试剂的状态良好。
3. 实验过程中要严格控制温度变化的速度,以保证实验数据的准确性。
4. 在记录数据时要认真仔细,确保数据的准确性和完整性。
五、实验结果与讨论根据实验所得数据和绘制的曲线,我们可以得出试样的热容量、热导率等热力学参数。
通过与理论知识进行比较,我们可以评价实验结果的准确性,并分析可能存在的误差来源。
物理化学实验报告

物理化学实验报告篇一:物理化学------各个实验实验报告参考1燃烧热的的测定一、实验目的1.通过萘和蔗糖的燃烧热的测定,掌握有关热化学实验的一般知识和测量技术。
了解氧弹式热计的原理、构造和使用方法。
2.了解恒压燃烧热与恒容燃烧热的差别和相互关系。
3.学会应用图解法校正温度改变值。
二、实验原理燃烧热是指1mol物质完全燃烧时所放出的热量,在恒容条件下测得的燃烧热为恒容燃烧热(QV),恒压条件下测得燃烧热为恒压燃烧热(Qp)。
若把参加反应的气体和生成气体视为理想气体,则Qp?QV??nRT。
若测得Qp或QV中的任一个,就可根据此式乘出另一个。
化学反应热效应(包括燃烧热)常用恒压热效应(Qp)表示。
在盛有定量水的容器中,放入装有一定量样品和样体的密闭氧弹,然后使样品完全燃烧,放出热量使水和仪器升温,若仪器中水量为W(g),仪器热容W?,燃烧前后温度为t0和tn,则m(g)物质燃烧热QV?(Cw?w’)t(n?t0。
若水的比热容)C =1。
摩尔质量为M的物质。
其摩尔燃烧热为QMV??m(W?W?)(tn?t0),热容W?可用已知燃烧热的标准物质(苯甲酸,QV=26.434J?g?1)来标定。
将其放入量热计中,燃烧测其始末速度,求W?。
一般因每次水量相同,可作为一个定量来处理。
QMV?m(tn?t0) 三.实验步骤1热容W?的测定1)检查压片用的钢模,用电子天平称约0.8g苯甲酸,倒入模具,讲样品压片,除去样品表面碎屑,取一段棉线,在精密天平上分别称量样品和棉线的质量,并记录。
2)拧开氧弹盖,擦净内壁及电极接线柱,用万用表检查两电极是了解燃烧热的定义,水当量的含义。
压片要压实,注意不要混用压片机。
否通路,将称好的棉线绕加热丝两圈后放入坩埚底部,并将样品片压,在棉线上旋紧弹盖,并再次检查电极是否通路,将氧弹放在充氧架上,拉动扳手充氧。
充毕,再次检查电极。
3)将氧弹放入热量计内桶,称取适量水,倒入量热计内桶,水量以没氧弹盖为宜,接好电极,盖上盖子,打开搅拌开关,开始微机操作。
物理化学实验报告 - 乙酸乙酯皂化反应动力学

北京理工大学
物理化学实验报告
乙酸乙酯皂化反应动力学
班级:
实验日期:2013-4-27
一、实验目的
1)了解二级反应的特点。
答:该物理性质需要满足以下条件:
(1)易于测量,并能用数值表示;
(2)该性质在一定环境条件下是稳定的;
(3)该物理性质和反应物、产物的浓度之间有一个明确的推导公式。
1009
0.4406
2520.0
919
0.333
993
0.415
分别做25℃、35℃下以 对t作图得到如下图像:
从图像上可以看出来 与t呈现反相关,符合 的基本趋势,故接下来做25℃、35℃下以 对 的图像,并进行直线拟合,图像如下:
25℃ - 图像
35℃下 - 图像
可见 、 呈现线性关系。并且: 。故可以求得
七、思考题
1)在本实验中,使用DDSJ-308型电导率议测量溶液的电导率,可以不进行电极常数的校正,为什么?
答:因为本实验中,计算 值和 值时所需的数据都是等时间间距下测量的电导率值的拟合直线斜率,它只与等时间间距下电导率的差值有关。不进行常数校正,在等时间间距下测量到的电导率数据都有着相同的系统误差,而不会改变不同时间下电导率数据的差值。所以本实验无需进行电极常数的校正。
4) 用25ml移液管移取25ml NaOH溶液于50ml容量瓶中,定容待用。
k0测量
1)取一部分稀释的NaOH于洁净干燥的叉形管直管中,将用稀释的NaOH润洗后的电导电极放入叉形管直管中,在恒温槽中恒温10min,读取电导率。保留叉形管中溶液,用于35℃测量k0。
物化实验部分实验报告

。 n1
冲淡热 在恒温恒压下,1mol 溶剂加到某浓度的溶液中使之冲淡所产生的热效应。冲淡热也可 分为积分(或变浓)冲淡热和微分(或定浓)冲淡热两种。 积分冲淡热 在恒温恒压下, 把原含 1mol 溶质及 n01mol 溶剂的溶液冲淡到含溶剂为 n02 时的热效 应,亦即为某两浓度溶液的积分溶解热之差,以 Qd 表示。 微分冲淡热 在恒温恒压下,1mol 溶剂加入某一确定浓度的无限量的溶液中产生的热效应,以
图 1-3
恒温水浴灵敏度曲线示意图
Ts 为设定温度,波动最低温度为 T1,波动最高温度为 T2,则恒温水浴的灵敏度为:
物理化学实验 3 |
S
T2 T1 2
三、仪器与药品:
玻璃缸(配电加热圈和搅拌) 数字贝克曼温度计 蒸馏水 1个 1支 秒表 数字温控仪 1个 1台
四、实验步骤:
1. 将蒸馏水注入水浴槽中, 根据恒温水浴组装的原则按图 1-1 分别将所需各部件按要求装备好。 2. 使用数字温控仪设定水浴温度为 30℃,选择合适的回差。 3. 加热器功率调节为强,待水浴温度快速达到设定的温度后将功率调节为弱。 4. 将数字贝克曼温度计调制“温差”档位,设定基温为 40℃。 5. 使用秒表计时,每隔 15s 读取并记录数字贝克曼温度计的读数。读取 4 个温度波动的周期。 6. 将水浴温度设定为 40℃,按以上步骤读数并记录,该温度下读数间隔为 10s。
Q Q Q n n1 n n2 1 n2 2 n1
(6)
式(6ቤተ መጻሕፍቲ ባይዱ以 n2 除之
Q Q n1 Q n2 n1 n2 n 2 n 2 n1
物理化学实验报告

《大学化学基础实验2》实验报告课程:物理化学实验专业:环境科学班级:学号:学生姓名:邓丁指导教师:谭蕾实验日期:5月24日实验一、溶解焓的测定一、实验名称:溶解焓的测定。
二、目的要求:(1)学会用量热法测定盐类的积分溶解焓。
(2)掌握作图外推法求真实温差的方法。
三、基本原理:盐类的溶解通常包含两个同时进行的过程:一是晶格的破坏,为吸热过程;二是离子的溶剂化,即离子的水合作用,为放热过程。
溶解焓则是这两个过程热效应的总和,因此,盐类的溶解过程最终是吸热还是放热,是由这两个热效应的相应大小所决定的。
影响溶解焓的主要因素有温度、压力、溶质的性质以及用量等。
热平衡式:△sol H m=-[(m1C1+m2C2)+C]△TM/m2式中, sol H m 为盐在溶液温度及浓度下的积分溶解焓, J·mol , m1 , m2 分别为水和溶质的质量, M 为溶质的摩尔质量,kg·mol -1 ;C1 ,C 2 分别为溶剂水, kg; 溶质的比热容,J·kg -1;T 为溶解过程中的真实温差,K;C 为量热计的热容, J·K- 1 ,也称热量计常数.本实验通过测定已知积分溶解焓的标准物质 KCl 的 T ,标定出量热计热容 C 的值.四、实验主要仪器名称:NDRH-2S型溶解焓测定实验装置1套(包括数字式温度温差测量仪1台、300mL简单量热计1只、电磁搅拌器1台);250mL容量瓶1个;秒表1快;电子;蒸馏水天平1台;KCl;KNO3五、实验步骤:(1)量热计热容 C 的测定 ( 1 ) 将仪器打开 , 预热 . 准确称量 5.147g 研磨好的 KCl , 待用 .n KCl : n水 = 1: 200(2)在干净并干燥的量热计中准确放入 250mL 温室下的蒸馏水,然后将温度传感器的探头插入量热计的液体中.打开搅拌器开关,保持一定的搅拌速度,待温差变化基本稳定后,读取水的温度 T1 ,作为基温.(3)同时, 每隔30s就记录一次温差值,连续记录8 次后, 将称量好的 5.174g KCl 经漏斗全部迅速倒入量热计中,盖好.10s记录一次温度值,至温度基本稳定不变,再每隔 30s记录一次温度的数值,记录 8 次即可停止.(4)测出量热计中溶液的温度,记作 T2 .计算 T1 , T2 平均值,作为体系的温度.倒出溶液,取出搅拌子,用蒸馏水洗净量热计.KNO3 熔解热的测定:标准称量 3.513g KNO3 ,代替 KCl 重复上述操作.六、实验数据记录与处理KCl溶解过程中数据记录:KCl质量:5.1774g 平均温度18.295℃未加KCl之前:t=19.24℃由图可知: T=1.89℃:△sol Hm(KCl)=18933J/mol;C1=4200J/kg·℃C2=699000J/kg·℃;M(KCl)=0.0745kg/mol;m1=0.25kg;m2=0.0051774kg由△sol Hm=-[(m1C1+m2C2)+C]△TM/m2得:C=-4673.7898J/KKNO 3溶解过程中数据记录:KNO 3质量:3.510g 平均温度:18.735℃ 未加KNO 3之前:t=19.11℃加KNO 3后:由图可知: T=0.75℃;C=-1049.9943J/K;C1=4202J/kg ·℃C2=894900J/kg ·℃;M (KNO 3)=0.103kg/mol ;m1=0.25kg ;m2=0.0035112kg由△sol Hm=-[(m1C1+m2C2)+C]△TM/m2得:△sol Hm(KNO3)=23.45123kJ/mol七、实验问题讨论1.样品颗粒的大小和浓度,对溶解焓测定有什么影响?答:粒度太大不好溶解要受影响,溶解过程过长温差变化过小,就会产生误差;浓度太大也是影响到溶解速度的,时间太长温差数值变化过大,溶解焓的测定就不准了。
物理化学

实验二 凝固点下降法测定摩尔质量一、 实验目的:1.通过实验,熟悉用凝固点下降法测定溶质的摩尔质量的方法,加深对稀溶液依数性的理解;2.掌握溶液凝固点的测量技术。
二、 实验原理:溶液的液相与溶剂的固体成平衡时的温度称为溶液的凝固点。
在溶液浓度很稀时,溶液凝固点降低值仅取决于所含溶质分子的数目,凝固点下降是稀溶液依数性的一种表现。
凝固点下降法测定化合物的摩尔质量是一个简单而又较为准确的方法。
若一难挥发的非电解质物质溶于纯液体中形成一种稀溶液,则此液的凝固点降低值与溶质的质量摩尔浓度成正比,即:AB f Mm m K T T T 10000=-=∆ (5-1) 式中:T 0、T 分别为纯溶剂和溶液的凝固点;m B 、m A 分别为溶质、溶剂质量,M 为溶质的摩尔质量;K f 为溶剂的凝固点降低常数,其值与溶剂的性质有关,以水作溶剂,则为1.86。
由于过冷现象的存在,纯溶剂的温度要降到凝固点以下才析出固体,然后温度再回升到凝固点。
溶液冷却时,由于随着溶剂的析出,溶液浓度相应增大,故凝固点随溶剂的析出而不断下降,在冷却曲线上得不到温度不变的水平线段,一般地,溶液的凝固点应从冷却曲线上待温度回升后外推而得。
因此,测定过程中应设法控制适当的过冷程度。
二、 仪器和试剂:仪器和材料:数字式精密温差测定仪;凝固点测定管;800mL 、250mL 烧杯各一只,移液管50mL 、10mL 各一支;保温瓶(内有棉絮适量)一只;干燥器,放大镜一只,温度计(±20℃)一支。
药品:尿素(A.R.);NaCl 。
四、实验步骤:1.用分析天平称取0.250~0.300g 的尿素二份,置于干燥器内。
2.将适量食盐,碎冰及水放入大烧杯中混合为冷浴,准确汲取60mL 蒸馏水注入清洁干燥的凝固点管,并将其置于冷浴内。
3.按图装好搅拌器,数字式精密温差测定仪的探头应位于管中心,并保持冷浴温度在-2~-3℃左右。
4.调节温差测定仪,数字显示为“0”左右。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ParameterValueError
A-1.77405E-81.53016E-9
B8.5449E-53.47713E-6
燃烧焓的测定
时间t(×20s)
苯甲酸
萘
温度T(℃)
温度T(℃)
1
20.15
19.67
2
20.15
班级:化学092
希托夫法测定离子迁移数
数据处理与结果:
项目
阳极区
中间区
阴极区
锥形瓶质量/g
65.931
109.261
123.973
锥形瓶+溶液质量/g
141.797
141.061
194.387
溶液质量/g
75.866
34.800
79.414
锥形瓶质量/g
81.875
81.539
82.060
锥形瓶+10mL溶液质量/g
6.66
67
6.63
6.65
68
6.64
6.66
69
6.63
6.65
70
6.63
6.66
71
6.63
6.66
72
6.64
73
6.63
74
6.63
75
6.63
76
6.63
77
6.63
78
6.63
79
6.63
80
6.63
81
6.62
82
6.63
83
6.63
84
6.63
85
6.63
86
6.63
87
6.63
滴后/mL
21.2
11.4
30.3
消耗体积/mL
9.8
9.4
9.1
平均硫代硫酸钠体积/mL
9.95
9.6
9.15
硫代硫酸钠浓度 0.0499mol/L
铜库仑计阴级质量0.0197g
硫酸铜浓度 0.05 mol/L
数据处理:
电解:n(电解)=0.0197/64=3.0781×10-4mol
阴极电解后:10 mlCuSO4n=9.15×10-3×0.0499=4.5659×10-4mol
B0.726120.04356
-------------------------------------------
截距为-2.40403
LgKc=-2.40403Kc=3.9443×10-3
Er=3.9443×10-3-6.61×10-4/6.61×10-4
=496.72﹪
凝固点下降法测定摩尔质量
36
7.16
6.78
6.68
5.1
4.92
37
7.13
6.76
6.68
5.07
38
7.09
6.73
6.68
5.04
39
7.05
6.71
6.68
5.01
40
7.02
6.69
6.68
4.99
41
6.98
6.67
6.68
4.96
42
6.95
6.65
6.68
4.93
43
6.91
6.63
6.68
4.91
44
6.88
6.55
6.66
4.97
55
6.52
6.65
4.97
56
6.5
6.66
4.96
57
6.47
6.66
4.96
58
6.55
6.66
4.95
59
6.61
6.66
4.94
60
6.63
6.66
4.94
61
6.64
6.66
62
6.63
6.66
63
6.64
6.66
64
6.64
6.66
65
6.64
6.66
66
6.63
pH =1.88 -(E1-E2)/S=-(-0.17+0.234) /0.05916=-1.0818
pH =2.23 -(E1-E2)/S=-(-0.17+0.216) /0.05916=-0.7776
pH =2.40 -(E1-E2)/S=-(-0.17+0.207) /0.05916=-0.6254
91.977
91.606
92.082
10mL溶液质量/g
10.102
10.067
10.022
项目
阳极区
中间区
阴极区
硫酸铜体积/mL
10
硫代硫酸钠体积/mL
滴前/mL
12.1
0.1
22.2
滴后/mL
22.2
9.9
31.4
消耗体积/mL
10.1
9.8
9.2
硫代硫酸钠体积/mL
滴前/mL
11.4
2.0
21.2
数据记录及处理
(1)KCl溶液的电导测定C=0.01
浓度(mol/dm3)
C
C/2
C/4
C/8
C/16
电导率κ(S/m)
0.1412
0.0734
0.0394
0.0236
0.0152
摩尔电导率
Λm(S·m2/mol)
0.01412
0.01468
0.01576
0.01888
0.02432
C1/2(mol1/2(m-3)-1/2)
3.35×10-4
4.02×10-4
4.8×10-4
5.2×10-4
4.8×10-4
Λm2C
1.12225×10-8
8.0802×10-8
5.76×10-9
3.38×10-9
1.44×10-9
Λm2C~Λm拟合结果
Y=A+Bx
A=2.46428×10-8B=-4.03734×10-5
Kc
1.61×10-5
4.99
24
7.65
7.09
6.78
5.52
4.99
4.97
25
7.6
7.06
6.74
5.48
4.98
4.99
26
7.56
7.04
6.71
5.44
4.98
5
27
7.52
7.01
6.68
5.41
4.97
4.99
28
7.48
6.98
6.68
5.37
4.96
4.99
29
7.43
6.96
6.69
5.33
4.96
n(前)= 0.53628g /160=3.3518×10-3mol
n(迁)= n(后)- n(前)+ n(电解)
=3.2080×10-3-3.3518×10-3+3.0781×10-4
=1.6401×10-4
t+= n(迁)/ n(电解)= 1.6401×10-4/3.0781×10-4=0.53
E1=-170mv=-0.17v
pH =1.00 -(E1-E2)/S=-(-0.17+0.269)/0.05916=-1.6734
pH =1.32 -(E1-E2)/S=-(-0.17+0.252) /0.05916=-1.3861
pH =1.63 -(E1-E2)/S=-(-0.17+0.246) /0.05916=-1.2847
KCl和HAc电导测定拟合结果
(1)KCl溶液
Y = A + B * X
ParameterValueError
------------------------------------------------------------
A0.024150.00279
B-0.003710.00142
(2)HAc溶液
5.9
6.44
6
8.55
7.68
7.49
6.39
5.84
6.34
7
8.5
7.64
7.45
6.33
5.77
6.25
8
8.44
7.6
7.4
6.28
5.71
6.15
9
8.39
7.57
7.36
6.22
5.64
6.06
10
8.33
7.53
7.31
6.16
5.57
5.97
11
8.28
7.5
7.27
6.11
5.51
4.98
30
7.39
6.93
6.7
5.3
4.95
4.97
31
7.36
6.9
6.7
5.26
4.94
4.96
32
7.32
6.88
6.7
5.23
4.94
4.95
33
7.28
6.85
6.7
5.2
4.93
4.94
34
7.24
6.83
6.7
5.16
4.92
4.94
35
7.2
6.8
6.69
5.13
4.92
4.93
5.88
12
8.23
7.47
