化学工艺流程专题复习
高中化学:工艺流程综合题(解析版)

专题工艺流程综合题1(2024届·天津河西·统考二模)铋(Bi)及其化合物在电子材料等领域有着广泛作用。
以某铋矿(主要成分为Bi x O y、MnSO4,主要杂质Fe2O3和SiO2)制取Bi x O y并回收锰的工艺流程如下:按要求回答下列问题。
(1)元素Bi较同主族N的周期数大4,写出基态Bi原子的价层电子排布式。
(2)回收Mn时,Mn2+被还原为Mn的过程中,电子填入原子轨道的名称是。
(3)滤渣1的主要成分的晶体类型为。
(4)“还原”步骤中Bi粉的作用为。
(5)已知BiCl3在2.0<pH<11.0的环境中,易水解成BiOCl沉淀。
写出该反应的化学方程式:。
若实验室配制BiCl3溶液,需用的试剂有BiCl3、蒸馏水、。
(6)已知:常温下,K sp Fe OH2=5×10-17;“沉Bi”步骤得到BiOCl沉淀。
此“沉Bi”步骤控制溶液的pH范围为。
(7)Bi x O y(相对分子质量为Mr)的立方晶胞结构如图所示(棱长为apm)。
Bi x O y的化学式为;晶胞密度为g/cm3(用含a、Mr、N A的代数式表示;N A为阿伏伽德罗常数的值)。
【答案】(1)6s26p3(2)4s(3)共价晶体(4)将Cu2+还原成Cu,Fe3+还原成Fe2+(5)BiCl3+H2O=BiOCl↓+2HCl浓盐酸(6)小于6.5×1030(7)Bi2O32Mra3N A【分析】含铋烧渣先水浸除锰,另加入少量稀硫酸可促进MnS溶解,同时MnSO4溶于水通过过滤分离;用浓盐酸处理浸出固体后过滤,二氧化硅不反应得到滤渣1为SiO2,铋、铁、铜元素反应进入滤液,滤液中含有Fe3+、Cu2+、Bi3+;氧化性:Fe3+>Cu2+>Bi3+,则加入Bi粉处理滤液,Cu2+被还原成Cu,Fe3+被还原成Fe2+,过滤滤渣2中含有Cu以及过量的Bi,滤液中含有Fe2+、Bi3+;加入NaOH使得铋转化为沉淀过滤分离出来,沉淀加入氢氧化钠溶液脱氯处理得到Bi2O3。
化学工艺流程专题复习

箭头:箭头进入的是投料(即反应物)、出去的是生成物(包括主产 物和副产物)。
第四页,。(酸溶解表述为“浸出”) 。 ②反应条件的控制(温度、压强、催化剂、原料配比、pH、溶剂等) ③反应原理(化学平衡、水解平衡、化学反应速率、反应热、 电化学等)。
第二十四页,共29页。
【即时巩固】 3.(2012·广东省佛山市普通高中高三教学质量检测)硫铁矿烧渣是一 种重要的化学化工产业中间产物,主要成分是Fe3O4、Fe2O3、FeO和二 氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁[Fe2(OH)n(SO4)3- n/2]m的流程图:
第二十五页,共29页。
第二十三页,共29页。
【答案】 (1)Fe3+ Al3+ (2)Al(OH)3 Ca(OH)2 (3)Al(OH)3+OH-===[Al(OH)4]- (4)①盐酸挥发,制取的二氧化碳中含有 HCl 在甲与乙之间加 一盛有饱和碳酸氢钠溶液的洗气瓶 ②CaCO3(s) Ca2+(aq)+CO23-(aq)
(4)①某同学在实验室中用下图装置制取
CO2气体并通入溶液Ⅱ中,结果没有沉淀产 生,可能的原因是__________;
为了能产生沉淀该同学对图装置进行了 改进,改进的方法为__________。
②若将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,混
合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,
用方程式表示该溶解平衡关系_______________ _。
化学工艺流程专题复习
2023/5/28
生产计划部
第一页,共29页。
工艺流程题的特点 一是试题源于生产实际,以解决化学实际问题为线索进行 设问,使问题情境真实。二是试题内容丰富,涉及化学基础知 识的方方面面,能考查考生对化学知识的掌握和应用情况,同 时考查考生解决化工生产中的相关问题的迁移推理能力。三是 试题新颖,阅读量、思维含量较大,考查考生的资料收集、处 理能力。该类试题常涉及的知识点有:
2024年中考化学复习专题:工艺流程题

2024年中考化学复习专题:工艺流程题1.合成氨人类科学技术上的一项重大突破,为化肥工业奠定了基础,以下是合成氨的工艺流程图。
(1)“液氮的沸点是−196℃,液氧的沸点是−183℃”,这属于 (填“物理性质”或“化学性质”);氮气常温下化学性质较稳定,可用做 。
(2)下列有关氮气和氢气反应的催化剂说法正确的是 。
a.化学反应前后其化学性质改变了b.其改变了生成物的质量c.只是改变了化学反应速率(3)根据上图,写出氮气和氢气反应生成氨气的文字表达式 。
(4)上述流程图中,“净化压缩”过程,从微观角度解释是气体分子的 改变。
2. 垃圾分类, 有利于变废为宝。
利用废旧白口铁(镀锌铁皮) 制备磁性Fe 3O 4胶体粒子及副产物ZnO ,其工艺流程图如下:(资料:铁不与氢氧化钠溶液反应,锌会与氢氧化钠溶液反应;不溶性碱受热分解生成金属氧化物和水。
)(1)℃中将不溶物和溶液A 分离的操作为 。
(2)℃中发生反应的化学方程式为 。
(3)溶液B 中含有的金属离子为 ,℃中加入适量H 2O 2溶液的目的是 。
3.某品牌电器的废旧电路板中还有Fe 、Cu 、Ag 、Ni (镍,银白色金属)等金属,如下图是某车间回收部分金属的工艺流程,已知22442Δ2Cu+O +2H SO 2CuSO +2H O 。
回答下列问题。
(1)滤渣℃中含有的金属是。
(2)根据以上工艺流程图,可以得出Ni、Fe的金属活动性强弱顺序是Ni Fe(填“>”或“<”)。
(3)滤液℃中加入足量铁粉的主要目的是,固体A除主要含有铜外,还含有一定量的铁,为了进一步提纯铜,可以向固体A中加入适量的稀硫酸,发生反应的化学方程式为。
(4)相比于直接焚烧废旧电路板回收金属,该工艺流程的主要优点是。
4.消毒剂在公共场所进行卫生防疫时发挥着重要作用。
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌消毒剂。
以粗盐为原料生产ClO2的工艺主要包括:℃粗盐精制;℃电解微酸性NaCl 溶液制NaClO3; ℃ClO2的制取。
高中化学工艺流程专题复习

高中化学工艺流程专题复习高中化学工艺流程专题复第一部分:常见的工艺手段、操作名称和目的知识归纳一、设备:注意设备的选择和使用。
例如:二、工艺流程一)、原料处理阶段:处理类型包括:1.粉碎固体:目的是增大表面积,使固体充分反应或加快反应速率。
注:常考提高浸出率的方法。
2.溶解原料:使用溶剂或有机溶剂等进行溶解、富集。
例如:3.灼烧、焙烧:仪器选择:酒精灯、三脚架、坩埚钳等,例如从海带中提碘。
4.煅烧原料:可以改变结构,使一些物质能溶解,并使一些杂质高温下氧化、分解。
例如碳酸钙分解,煅烧高岭土等。
5.其他:1)研磨或剪碎、榨汁等。
2)表面处理:如金属表面的氧化物用浸洗。
3)除去金属表面的油污等:用浸洗。
二)、分离提纯阶段:理清原料和产品的关系→“多的要除、少的要加”→不清楚的跳过。
I.提纯的方法包括:1.氧化除杂:如除去Cu中的Fe。
1)氧化:用氧化剂将Fe氧化成易于后期处理的形式。
2)调节pH除杂:控制溶液的酸碱性使Fe离子形成氢氧化物沉淀。
加入的物质常为纯碱,但尽量不引入杂质。
2.试剂除杂:加试剂直接反应除去杂质。
例如粗盐的提纯。
3.萃取、分液除杂:如从海水中提取溴和碘单质,利用溴和碘单质易溶于有机溶剂。
1)溴和碘单质的颜色:类型水有机溶剂溴单质3+2+碘单质2+2+2)使用到的仪器:4.过滤除杂:使用到的仪器:5.蒸馏除杂:1)使用范围:2)使用到的仪器:3)常见类型:II.常见题型或知识点考查:1.加热的目的:加快化学反应或促进反应等。
2.降温反应的目的:防止某物质在高温时会参与的反应;或为使化学平衡向着某方向,例如有H2O2参与的反应。
3.电解:注意:有新信息按新信息写,无新信息按教材知识写。
4.氧化还原反应的考查:书写氧化还原反应时,找准氧化还原状态,注意环境的酸碱性、反应的条件、符号,然后配平方程式。
三)、获得产品阶段流程:结晶→过滤→洗涤→干燥1)结晶方法:①蒸发结晶:一般适用于溶质且该物质热稳定性好(不会热分解)的结晶析出。
高三化学第一轮复习10.4工艺流程专题课件

3.0
8.1
完全沉淀pH 3.2
9.0
4.7
10.1
( __F_4e_()_O_“_H__沉)3__淀。转溶”中,V2O5·xH2O转化为钒酸盐溶解。滤渣③的主要成分是
高考零距离
【2021年全国I卷】钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存 在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿 制备NH4VO3。
控制温度在一定范围
防止温度过高物质分解或挥发、分离产品、催化剂活性、防止副反 应发生、分馏等 降低温度
促使化学平衡移动、降温液化(固化)、结晶、防止温度过高物质分 解或挥发、减缓化学反应速率、降低能源成本等
学以致用
碳酸锶(SrCO3)是一 种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱 锶矿(含80~90% SrCO3, 少量MgCO3、CaCO3、 BaCO3等)制备高纯碳酸锶的工 艺流程如下:
高考零距离
【2021年全国I卷】钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存 在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿 制备NH4VO3。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
Fe3+
Fe2+
Al3+
Mn2+
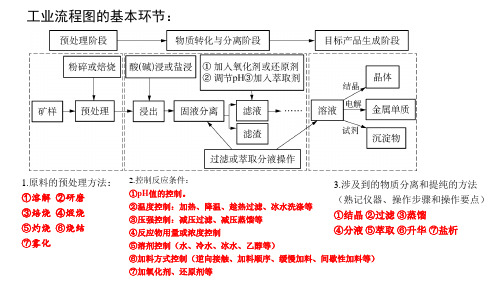
一、工业流程的表现形式 形式一:
形式二:
二、工业流程的常见考点 【小结】工业流程常见问题有哪些?
1、原料的预处理2、反应条件的控制:温度、压强、催化剂、原料配 比、pH、溶剂等。3、基本概念:氧化还原反应的判断、方程式的书写 等。4、反应原理:化学平衡、水解平衡、化学反应速率、反应焓变、 电化学等。5、实验基本操作:除杂、分离、检验、洗涤、干燥等。
高考化学 工艺流程专题复习 化学工艺流程(一)化工生产中镁、铝及其化合物的转化关系

化工生产中镁、铝及其化合物的转化关系1.从海水中提取镁的流程 (1)流程:(2)主要化学反应:①制石灰乳:CaCO 3=====高温CaO +CO 2↑、CaO +H 2O===Ca(OH)2;②沉淀Mg 2+:Mg 2++2Ca(OH)2===Mg(OH)2↓+Ca 2+;③制备MgCl 2:Mg(OH)2+2HCl===MgCl 2+2H 2O ;④电解MgCl 2:MgCl 2(熔融)=====电解Mg +Cl 2↑。
2.工业炼铝的流程铝是地壳中含量最多的金属元素,在自然界主要以化合态形式存在于氧化铝中。
铝土矿的主要成分是Al 2O 3,此外还含有少量SiO 2、Fe 2O 3等杂质,冶炼金属铝很重要的一个过程是Al 2O 3的提纯。
由于Al 2O 3是两性氧化物,而杂质SiO 2是酸性氧化物,Fe 2O 3是碱性氧化物,因而可设计出两种提纯氧化铝的方案。
方案一:碱溶法讨论回答下列问题: (1)写出①、③两步骤中可能发生反应的离子方程式。
答案 ①Al 2O 3+2OH -===2AlO -2+H 2O ,SiO 2+2OH -===SiO 2-3+H 2O③AlO -2+CO 2+2H 2O===Al(OH)3↓+HCO -3,SiO 2-3+2CO 2+2H 2O===H 2SiO 3↓+2HCO -3(2)步骤③中不用盐酸(或H 2SO 4)酸化的理由是________________________________________________________________________。
答案 因为AlO -2与酸反应生成的Al(OH)3具有两性,可溶于强酸,不易控制酸的量;CO 2廉价而且生成的副产物NaHCO 3用途广泛,经济效益好(3)步骤④中得到较纯的Al 2O 3,可能含有________杂质,在电解时它不会影响铝的纯度的原因:________________________________________________________________________。
2024高考化学工艺流程专题
②还原焙烧:指在低于炉料熔点和还原气氛条件下,使矿石中的金属氧化物转变为相应 低价金属氧化物或金属的焙烧过程。 该焙烧过程中,一般要在矿石中附加细小的炭粒作还原剂。 还原焙烧目前主要用于处理难选的铁、锰、镍、铜、锡、锑等矿物原料。
产物 ②控制反应速率 ③控制反应物转化率和产品产率 ④控制环境温度 ⑤抑制(促进)离子 的水解 ⑥降低生产成本酸浸时酸过量的目的:为了提高矿石中某金属元素的浸取率;抑制**离 子的水解等。对有多种反应物的体系,增大便宜、易得的反应物的浓度目的是:提高其他物质 的利用率,使反应充分进行;降低生产成本等。如:增大浓度可以加快反应速率,使平衡发生 移动等。(应结合具体问题进行具体分析)。(2)控制加料的方法:逆向接触、加料顺序、缓 慢加料、间歇性加料等。
(2023·全国甲卷第26题)BaTiO3是一种压电材料。以BaSO4为原料,采用下 列路线可制备粉状BaTiO3。
回答下列问题:(1)“焙烧”步骤中碳粉的主要作用是_______。(2)“焙烧”后固体产物 有BaCl2、易溶于水的BaS和微溶于水的CaS。
“浸取”时主要反应的离子方程式为_______。 (1)“焙烧”步骤中,BaSO4与过量的碳粉及过量的氯化钙在高温下焙烧得到CO、BaCl2、BaS 和CaS,BaSO4被还原为BaS,因此,碳粉的主要作用是做还原剂,将BaSO4还原。(2)S2-易发生 水解生成HS-,
4.研磨:增大固体样品与溶液的接触面积,加快反应(浸取)速率或使反应更充分。
真题思演维练模型和方法模型
2024年中考化学总复习 特色专题专训 题型三 工艺流程图题 (含解析)

题型三工艺流程图题基础作业1.铝是一种重要金属,从铝土矿(主要成分为Al2O3、Fe2O3、SiO2等)中冶炼Al的工业生产流程如图所示:(1)操作Ⅰ的名称是。
(2)溶液A中含有的阳离子为Al3+、Fe3+和 (填离子符号)。
(3)电解氧化铝时还会生成一种气体,该反应的化学方程式为。
(4)溶液C中含有Na2CO3,则该生产流程中可循环使用的物质除NaOH外,还有、。
2.某化学活动小组在实验室以MnO2固体为原料制取少量MnCO3,基本流程如下:已知:MnSO4可溶于水;MnCO3难溶于水且在100 ℃时开始分解。
(1)操作a的名称为。
(2)反应①中生成物只有MnSO4,该反应的化学方程式为。
(3)产品MnCO3(Ⅱ)比MnCO3(Ⅰ)更纯净,原因是产品MnCO3(Ⅰ)经过洗涤、烘干以后,除去了表面附着的和。
(4)烘干MnCO3时需要控制的条件是。
3.某同学以金泥(含有Au、CuS、ZnS等)为原料制备Au和Cu的流程如图所示:已知:①预处理的主要目的是将含硫化合物转化为氧化物。
②热空气流充分加热的目的是将Cu、Zn转化为氧化物,并完全分离出ZnO烟尘。
(1)“预处理”中会产生SO2,若SO2直接排放,会导致。
(2)“过程Ⅱ”产生的固体a中,除CuO外一定还有的物质是。
(3)“过程Ⅲ”分离Au的操作是 ,加入过量稀硫酸的目的是。
(4)“系列进程”中有一步是向滤液中加入过量铁粉,这一步生成气体的化学方程式为 ,该反应属于 (填写基本反应类型)。
(5)ZnO烟尘可用NaOH溶液吸收,该反应生成偏锌酸钠(Na2ZnO2)和H2O的化学方程式为。
4.硫酸锌可制备各种含锌材料,在防腐、医学上有很多应用。
菱锌矿的主要成分是ZnCO3,还含有少量的二氧化硅和氧化铁。
以菱锌矿为原料制备ZnSO4·7H2O的工艺流程如下图所示。
(二氧化硅难溶于水,也不与稀硫酸反应)ZnSO4·7H2O回答下列问题:(1)菱锌矿属于 (选填“纯净物”或“混合物”)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3)评价 ①氨碱法的优点:原料便宜易得、产品
③灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一
些杂质高温下氧化、分解。
(2)分离提纯阶段的常见考点: ①调pH除杂: a.控制溶液的酸碱性使其中某些金属离子形成氢氧化物沉淀。
例如:已知下列物质开始沉淀和沉淀完全时的pH如下表所示 物质 Fe(OH)3 Fe(OH)2 Mn(OH)2 开始沉淀 2.7 7.6 8.3 沉淀完全 3.7 9.6 9.8
二.熟悉工业流程常见的操作与名词
(1)原料处理阶段的常见考点与常见名词:
①加快反应速率。 ②溶解:通常用酸溶,如用硫酸、盐酸、浓硫酸等。 水浸:与水接触反应或溶解。 浸出:固体加水(酸)溶解得到离子。 酸浸:在酸溶液中反应使可溶性金属离子进入溶液,不溶物通 过过滤除去的溶解过程。
浸出率:固体溶解后,离子在溶液中的含量的多少(更多转化)。
③加热:加快反应速率或促进平衡向某个方向移动。如果在
制备过程中出现一些受热易分解的物质或产物,则要注意对温度
的控制。如NaHCO3、H2O2、Ca(HCO3)2、KMnO4、AgNO3、 HNO3(浓)等物质。
④降温:防止某物质在高温时会溶解(或分解)、使 化学平衡向着题目要求的方向移动。 ⑤萃取。 (3)获得产品阶段的常见考点: ①洗涤(冰水、热水):洗去晶体表面的杂质离子, 并减少晶体在洗涤过程中的溶解损耗。 ②蒸发加热时的气体氛围抑制水解:如从溶液中析 出FeCl3、AlCl3、MgCl2等溶质时,应在HCl的气氛中加 热,以防其水解。 ③蒸发浓缩、冷却结晶:如除去KNO3中的少量
如要除去Mn2+溶液中含有的Fe2+,应该先用氧化剂 把Fe2+氧化为Fe3+,再调溶液的pH到 3.7。
b.调节pH所需的物质一般应满足两点:
能与H+反应,使溶液pH增大;不引入新杂质。 例如:若要除去Cu2+溶液中混有的Fe3+,可加入CuO、 Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH。 调pH值的目的:促进或抑制水解 调pH值的方法:加酸性或碱性物质(未必是酸和碱),注意 不能引入杂质离子(产品中没有的) pH值的控制范围:一种物质完全沉淀点,与另一种物质完全 不沉淀点 ②试剂除杂。
知识点四
氯碱工业
离子交换膜法电解食盐水: 1. 设备 离子交换膜电解槽。离子交换膜只允许阳离子通过。
2. 原理 通电 2NaCl+2H2O=====2NaOH+H2↑+Cl2↑。 3. 工艺流程 沉淀剂 加适量稀盐酸 离子交换树脂 粗盐水 ――→ 过滤 ――→ 水。 在进入电解槽前需通过阳离子交换塔进一步除去 ―→精盐
催化剂 2SO2(g)+O2(g) 2SO3(g) △ (2)接触氧化:
196.6 kJ· mol-1。 (3)三氧化硫的吸收: SO3(g)+H2O(l)===H2SO4(l)
ΔH=-130.0 kJ· mol
-1
ΔH=-
。
3. 三个主要设备: 沸腾炉 、 接触室 、 吸收塔 。
4. 三个反应条件 (1)温度:根据平衡移动原理,应在低温下进行,但低温时 催化剂的活性不高,反应速率低,实际生产中采用 400~500℃ 的温度。 (2)常压:根据平衡移动原理,应在高压下进行,但增大压 强对SO2的转化率提高不大,且加压会增大成本和能量消耗, 而常压下的转化率已很高,实际生产采用常压操作。 (3)适当 过量 的空气:目的是提高SO2的转化率。
(3)反应条件的选择 ①、试剂用量控制 控制流速:控制用量,从而控制产物种类、反应产生的热量 ②反应温度选择 水浴加热的优点:受热均匀,便于控制温度。 控制一定温度的目的:a.加快反应速率 b.防止温度过高,物 质挥发、分解 易挥发物质:浓盐酸、浓硝酸、有机物。 易分解物质:H2O2、硝酸、KMnO4、NH4Cl、难溶的碱 (Mg(OH)2,Fe(OH)3,等),次氯酸 结晶的方法 : 蒸发浓缩、冷却结晶:如除去KNO3中的少量 NaCl。 蒸发结晶、趁热过滤:如除去NaCl中的少量KNO3。 ⑷ 工艺流程的优缺点评价 循环利用,节约成本 ※能循环利用的物质的判断:闭合回 路,有进有出 原料价格低廉 .原子利用率高,绿色化学 ,没有污染,没有 有毒有害物质产生
(2)原料气的净化 为防止催化剂中毒,需对原料气净化:
H2O+H2S===NH4HS+H2O 。 ①吸收H2S: NH3· 催化剂 CO+H2O CO2+H2 ②除去CO: , 加热 K2CO3+CO2+H2O===2KHCO3
。
③精制原料气:用 醋酸 、 铜 和 氨 配制成的溶液来吸
CO2、O2 、H2S等少量有害气体。 收 CO、
三。知识贮备
1.熟练掌握中学化学中重要的化工生产原理(列举如下)
知识点一 工业制备硫酸 1. 合成硫酸的三种原料: 硫黄(或黄铁矿) 、 空气 、 水 。 2. 三个反应 (1)造气: S(s)+O2(g)===SO2(g) ΔH=-297 kJ· mol-1
或 4FeS2(s)+11O2(g)===2Fe2O3(s)+8SO2(g) ΔH=-3412 kJ· mol-1。
(3)氨的合成与分离
3. 合成氨工业的发展 (1)原料及原料气的净化; (2)催化剂的改进; (3)环境保护。
废渣:用作
建材和肥料的原料
。 等有害气体。
废气:主要是 H2S 废液:主要是含
和 CO2
氰化物 和含 氨 的污水。
[特别提醒]
(1)CO2虽是无毒、无害的物质,但随着人们
对其可能产生温室效应的关注,减少CO2的排放逐渐受到重 视。 (2)使用催化剂不影响氨的产率,但能提高合成氨的效率。 催化剂对反应有选择性,容易误认为一定的催化剂对所有反应 都有催化作用。 (3)温度的选择,兼顾三个方面:反应速率、氨的产率、催 化剂活性。
Ca2+、Mg2+ 等离子,以防破坏离子交换膜。
4. 粗盐的精制 (1)目的:除去泥沙,使Ca2 、Mg2 、Fe3 、SO42 等离子
+ + + -
的含量达到要求。
2+ 2+ (2)原因: Ca 、Mg 等会在碱溶液中形成沉淀,破坏
2- 泥沙及 SO 离子交换膜, 会引起杂质。 4
(3)试剂:BaCl2、Ca(OH)2、Na2CO3、稀盐酸 。 用BaCl2除去SO42-,用Ca(OH)2除去Mg2+、Fe3+,用 Na2CO3除去Ba2+及Ca2+,所加沉淀剂需稍过量。
工艺流程专题
一.工艺流程题的特点 二.工业流程常见的操作与名词
三.知识贮备(中学化学中重要的化工生产原理)
四.化工流程题常见的解题方法和答题技巧
一.工艺流程题的特点
一是试题源于生产实际,以解决化学实际问题为线索进行设
问,使问题情境真实。二是试题内容丰富,涉及化学基础知识的 方方面面,能考查考生对化学知识的掌握和应用情况,同时考查
硫酸生产中的反应热可用于预热反应物,满足自身能量的 需要,还可以由硫酸厂向外界输出大量能量(供热发电)。
[特别提醒]
(1)注意硫酸工业生产中的五个“三”:“三
原料”、“三反应”、“三设备”、“三条件”、“三废”。 (2)SO3与水反应放出大量的热,用水吸收会形成酸雾,SO3 的吸收不充分,故用98.3%的浓H2SO4吸收SO3而不用水吸收。 (3)SO2、O2的混合气体在进入接触室之前要经过除尘、除 杂,以防止催化剂中毒。 (4)注意结合化学反应速率、化学平衡理论解决实际工业操 作。
二氧化碳
获得氮气;
与 碳 作用生成 二氧化碳 ,再除
得到氮气。
②氢气 a. 水蒸气通过赤热的煤(或焦炭)层,化学方程式为 △ C+H2O=====CO+H2 。 b. 甲烷与水蒸气在催化剂作用下反应,化学方程式为
催化剂 催化剂 CH4+H2O CO+3H2;CH4+2H2O CO2+4 (1)反应原理 催化剂 N2+3H2 2NH3 高温高压 方程式: (2)工业化生产的条件 温度: 化剂:
400~500℃
。
;压强: 10 MPa~30 MPa ;催 。
以铁为主的催化剂
2. 合成氨的基本生产过程 (1)制备合成氨的原料气 ①氮气 a. 将空气 液化 后 蒸发分离出氧气 b. 将空气中的 氧气 去
试剂的加入顺序:纯碱须加在钡试剂后,稀盐酸加在过滤 后。 (4)有关反应的离子方程式 Ba2++SO42-===BaSO4↓, Mg2 +2OH ===Mg(OH)2↓,
+ -
Fe3++3OH-===Fe(OH)3↓, Ca2++CO32-===CaCO3↓, Ba2 +CO32 ===BaCO3↓,
知识点三
纯碱的生产
1. 氨碱法生产纯碱 氨碱法也称 和 二氧化碳
索尔维制碱法
。
,其原料是: 食盐 、 氨
(1)生成碳酸氢钠和氯化铵 将二氧化碳通入含氨的饱和食盐溶液中,可得到碳酸氢钠 和氯化铵。
方程式为 NH3+CO2+H2O===NH4HCO3
;
NaCl+NH4HCO3===NaHCO3↓+NH4Cl 。
NaCl。
(4)过滤 ①、如何检验沉淀已完全? ②、判断沉淀已洗净的方法 ③、趁热过滤 两种溶质,一种在较高温度时溶解度小,易析出;一种溶解 度大,不易析出。 目标要得到溶解度大的物质:防止温度降低,析出溶质晶体,造成物质损 失,提高产率 目标要除去溶解度小的物质:除去滤渣,防止滤液中溶质析出 ④、用有机溶剂洗涤晶体:①除去晶体表面水分,减少溶解损耗②有机物易 挥发,便于干燥
+ -
CO32-+2H+===H2O+CO2↑。
5. 产品 (1)阳极室产品: 氯气 ,补充 饱和食盐水 流出
