2020-2021学年初三化学上学期沪教版(全国)第5章金属的冶炼与利用基础实验4常见金属的性质练习
九年级化学第5章知识点(沪教版)

第五章 金属的冶炼与利用第1节金属的性质和利用一、金属材料纯金属(90多种) 合金 (几千种)2、金属的物理性质: (1)常温下一般为固态(汞为液态),有金属光泽。
(2)大多数呈银白色(铜为紫红色,金为黄色) (3)有良好的导热性、导电性、延展性3、金属之最:(1)铝:地壳中含量最多的金属元素(2)钙:人体中含量最多的金属元素 (3)铁:目前世界年产量最多的金属(铁>铝>铜) (4)银:导电、导热性最好的金属(银>铜>金>铝)(5)铬:硬度最高的金属 (6)钨:熔点最高的金属 (7)汞:熔点最低的金属 (8)锇:密度最大的金属 (9)锂 :密度最小的金属4、合金:由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属特性的物质。
注:钛和钛合金:被认为是21世纪的重要金属材料,钛合金与人体有很好的“相容性”,因此可用来制造人造骨等。
(1)熔点高、密度小优点 (2)可塑性好、易于加工、机械性能好(3)抗腐蚀性能好5. 生铁和钢(1)钢和生铁都是由铁、碳等元素形成的合金 (2)生铁特点:硬而脆,无韧性,只能铸造钢特点:硬度大、韧性好,有良好的延展性和弹性。
可铸、可锻、可轧 钢和生铁的本质差异:含碳量不同 二、金属的化学性质1、金属材料2锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑锌和稀盐酸Zn + 2HCl=== ZnCl2 + H2↑铁和稀盐酸Fe + 2HCl=== FeCl2 + H2↑镁和稀盐酸Mg+ 2HCl=== MgCl2 + H2↑铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑3、金属 + 盐→另一金属 + 另一盐(条件:“前换后,盐可溶”)铁与硫酸铜反应:Fe+CuSO4==Cu+FeSO4现象:铁条表面覆盖一层红色的物质,溶液由蓝色变成浅绿色。
九年级化学上册第5章金属的冶炼与利用第2节金属矿物铁的冶炼课件沪教版

数为 56×2 ×100%=70% 56×2+16×3
Fe3O4
中铁元素的质量分数为 56×3 ×100%≈72.4% 56×3+16×4
FeO 中铁元素的质量分数为 56 ×100%≈77.8% 56+16
因此当硬质玻璃管内固体中铁元素的质量分数为74%时,固体成分是Fe3O4和FeO,D正确。
举一反三 所谓“倒吸”是指由于气压的减小,后面装置内液体被吸入前面装置 的现象。
生成物为Fe3O4。他又发现m2恰好为___4_._6_4__ g,这可成为支持上述猜想的新证据。
(3)甲、乙两组实验说明温度对CO和Fe2O3反应有影响,且均体现出CO的 _还__原__性__和__可__燃__性__(_写__出__还__原__性__即__可__)___(填化学性质)。
【解析】(1)由于反应物CO有毒,且该反应在反应前需先通一会儿CO,反应中通入的CO 也未全部发生反应,直接排放到空气中会造成空气污染,甚至造成中毒,故还应在装置末 端增加尾气处理装置,如在装置末端放一盏燃着的酒精灯或系一个气球对尾气进行收集; (2)①在甲中,黑色粉末全部能被磁铁吸引,能全部与盐酸反应产生气泡,加入足量CuSO4溶 液,有红色物质生成,甲组的固体产物是Fe,产生气泡的化学方程式为Fe+2HCl===FeCl2+ H2↑;②一氧化碳和氧化铁反应的固体产物为黑色,可能是铁粉、四氧化三铁或二者的混合 物,在乙组中,生成物能被磁铁吸引,取黑色粉末加入盐酸,乙组观察到无明显现象,加 入足量CuSO4溶液,无明显现象,说明没有铁粉的产生,则生成物是四氧化三铁,根据化学
a. 吸收二氧化碳 b. 消耗一氧化碳 c. 检验一氧化碳
(2)如图2是用适量木炭粉还原氧化铁粉末的实验装置,写出反应的化学方程式: ___3_C_+__2_F_e_2O_3_=高_=_=温_==_4_F_e_+__3_C_O_2_↑_____________,试管口部略向下倾斜的原因是 __防__止__冷__凝__水__倒__流__、__炸__裂__试__管______________。反应一段时间后,装置C中澄清石灰水 无现象的原因是____2_N_a_O_H_+__C_O_2=_=_=_N_a_2_C_O_3+__H_2_O_____________(用化学方程式表示)。
九年级化学上册 第5章 金属的冶炼与利用 第1节 金属的性质和利用教案 沪教版

第五章金属的冶炼与利用1.知识与技能(1)了解常见金属的物理性质,知道物质的性质在很大程度上决定了物质的用途,但同时还要考虑价格、是否美观、使用是否便利、资源以及废料是否易于回收等其他因素。
(2)认识在金属中加热熔合某些金属或非金属可以制得合金,知道生铁和钢等重要合金,以及合金比纯金属具有更广泛的用途。
(3)知道铁、铝、铜等常见金属与氧气的反应。
(4)初步认识常见金属与盐酸、稀硫酸的置换反应,以及金属与某些化合物溶液的置换反应;并能用置换反应解释一些与日常生活有关的化学现象。
(5)知道一些常见金属如铁、铝、铜等的矿物,了解利用铁矿石炼铁的原理;会根据化学方程式进行有关含杂质的反应物或生成物的计算。
(6)了解金属锈蚀的条件以及防止金属锈蚀的简单方法。
2.过程与方法(1)通过情景设置,使学生具有较强的问题意识,能够发现和提出有探究价值的化学问题。
通过动手实验,培养实验能力和分析问题的能力。
(2)认识科学探究的基本过程,能进行初步的探究活动;通过实验探究和讨论交流,认识金属的化学性质及其活动性顺序。
(3)初步学会运用观察、实验等方法获取等信息,并能用图表和化学语言表达有关的信息。
(4)了解化学与日常生活和生产的密切关系,提高解决实际问题的能力。
3.情感、态度与价值观(1)通过对五彩纷呈的化学现象的观察,激发好奇心和求知欲,发展学习化学的兴趣,树立珍惜资源、爱护环境、合理使用化学物质的观念。
(2)培养合作意识以及勤于思考、勇于创新、严谨求实的科学精神。
(3)在有趣的实验与老师的点拨中轻松掌握化学知识,体验到学习的快乐。
(4)通过收集材料、查阅资料、讨论交流等具体探究活动培养良好学习习惯和学习方法。
(5)增强热爱祖国的情感,树立为民族振兴、社会进步学习化学的志向,体会学习化学的价值。
本章主要介绍了常见金属的性质、合金的重要特性、铁的冶炼、钢铁的防锈及废金属的回收利用等知识。
从教学目标来讲,涉及到镁、铁、铝、铜等纯金属以及生铁与钢等合金的基础知识,金属腐蚀条件初步探究活动的过程、方法。
沪教版九年级上册第五章 金属的冶炼与利用 第一节金属的性质和利用教学课件 (共19张PPT)

= H2↑ + = H2↑ +
Fe + CuSO4 = Cu +
单质
化合物
新单质
MgCl2 FeSO4 FeSO4 新化合物
3.置换反应:
由一种化单合质反跟应一:种A化+合B物+…作→用C生成另一种单质和另 一种化合物分的解反反应应叫:置A换→反B应+。C+…
特点:
1、试判断下列物质的化学反应类型: A.化合反应 B.分解反应 C.置换反应
反应物 反应现象
反应 反应方程式 速度
镁
剧烈反应,金属逐渐 减少,产生大量气泡
Mg + 2HCl == MgCl2 + H2 ↑
很快
Mg + H2 SO4 == MgSO4 + H2 ↑
稀
盐
开始气泡较少随着反
酸 或
锌
应进行气泡逐渐增多, 反应剧烈,金属逐渐
较快
消失,产生大量气泡
稀
Zn+2HCl==ZnCl2+H2↑ Zn+H2SO4=ZnSO4+H2↑
(1)2Al+6HCl====2AlCl3+3H2↑( C )
(2)H2CO3====CO2↑+H2O (3)Fe+CuSO4====FeSO4+Cu
(B) ( C)
(4)CaO+H2O====Ca(OH)2
(A )
2.已知锌可以与稀硫酸反应,请写 出反应的化学方程式。
Zn + H2 SO4 == ZnSO4 + H2 ↑
6、“教学的艺术不在于传授本领,而在于激励、唤醒、鼓舞”。2021年11月下午8时51分21.11.920:51November 9, 2021
沪教版九年级上册化学课件:第5章 金属的冶炼与利用 (共17张PPT)

镁
锌
铁
铜
实 明显放热 缓慢放热 无明显放热 验
现 象
快速产生 大量气泡
较快产生 气泡
缓慢产生 气泡
无明显现象
三、金属与盐反应 在金属活动性顺序表中,除非常活泼的金属外,排在前面的金属
一般可以将位于其后面的、比它不活泼的金属从它们的盐溶液中置换 出来。
Fe + CuSO4 = Cu + FeSO4
湿法冶金的先驱
。
金属的物理性质
• 常温下金属大多为固体(汞 是液体),有特殊金属光泽 ,良好的延展性,机械强度 大,易导电、传热。
一、金属与氧气反应
将铝片用坩埚钳夹持置于酒精灯火焰上方加热,观察现象(注 意观察铝片的颜色)
表面变暗,失去金属光泽,悬而不滴
二、金属与酸反应
取镁片、锌片、铁片、铜片,用砂纸打磨好放于试 管,分别加入少量稀盐酸,观察现象
1.实验中,右边酒精灯的作用是什么?
2.当三氧化二铁反应完全后,应先 熄ቤተ መጻሕፍቲ ባይዱ哪个灯? (选填左边或右边)
知识网络: 物理性质
与氧气反应 生锈
铁 化学性质 与酸反应
防锈
金金
与硫酸铜反应
属 与 矿
属 合金
铝、铜
生铁 钢
冶炼 铁矿石 石灰石等
物 矿物
黄金的有关性质
• 金单质是金黄色金属,熔点为1064.43℃,
沸点为3080℃,密度为19.3×103kg/m3, 有光泽,质软,延展性大,能拉成5×104g/m的丝,碾成1×10-5mm厚的半透明箔
片。在空气中不被氧化,亦不变暗,古人 云“真金不怕火炼”。
• 以上描述属于金的物理性质的是 。化
学性质的是
沪教版初中初三九年级上册化学:第五章 金属的治炼和利用 复习课件

• (4)置换反应:一种单质与一种 ___化_合__物_____作用生成另一种__单_质____和 另一种化合物的反应。
• (5)金属活动性顺序 • K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、
(H)、Cu、Hg、Ag、Pt、Au。 • ①从前到后,金属活动性逐渐__减__弱____; • ②位于氢前面的金属_能___置换出盐酸、
• (2)与酸反应
• 条件:金属(H之前),酸(盐酸、稀硫酸等)
• Fe+___2___HCl===_F_e_C_l2_+__H_2↑______
• •
Z注n意+:H2SO4===_Z_n_S_O_4+__H_2_↑_____
• ①铁与稀盐酸或稀硫酸发生置换反应时,只 能生成亚铁离子,溶液的颜色是浅绿色。
【方法点拨】金属的性质在很大程度上决定了它们的 用途,但不是唯一的决定因素。题目往往是通过图表 和文字信息来反映某一具体物质的用途,考查对所涉 及物质性质的掌握情况。
【解析】由于铁的硬度比铝大,所以菜刀要用铁做; 导电性的指数越高,导电性也就越强,所以铜的导电 性最强;常温下越容易与氧气反应,也表现出其金属 活动性越强。
第五章 金属的冶炼和利用 复习课件
知识网络
金属的冶 炼和利用
金属的性质和利用 金属的性质
合金
金属矿物铁的冶炼
常见金属矿物 铁的冶炼
金属防护和 废金属回收
金属锈蚀条件 金属锈蚀的防护 废金属的回收利用
ቤተ መጻሕፍቲ ባይዱ
知识回顾 知识点1 金属的性质和利用
• 1.金属的物理性质 • 有光泽,常温下为固态(_汞_____除外);不同金
• 4.常见的铁的矿物:赤铁矿、黄铁矿、 _菱__铁__矿_____。
沪教版化学九年级上册第5章金属的冶炼与利用知识点汇总

第五章金属的冶炼与利用(重要方程式)1、铁丝在氧气中燃烧:化学方程式为: 3Fe+2O2点燃Fe3O42、镁带在空气中燃烧:化学方程式为:2Mg+O2点燃2MgO3、铝在空气中反应:化学方程式为:4Al+3O2==2Al2O3实验现象为:铝表面变暗,形成致密的氧化膜,“自我保护”4、铜在空气中受热:化学方程式为:2Cu+O2Δ2CuO实验现象为:铜表面变黑;金在通常情况下不与氧气反应:即“真金不怕火炼”,表明金的化学性质不活泼。
5、铁与稀硫酸反应:化学方程式为:Fe+H2SO4=FeSO4+H2↑铁与稀盐酸反应:化学方程式为:Fe+2HCl=FeCl2+H2↑实验现象为:铁不断溶解,铁表面有气泡产生,溶液由无色变成浅绿色;★注意:置换反应都生成亚铁化合物6、镁与稀硫酸反应:化学方程式为:Mg+H2SO4=MgSO4+H2↑镁与稀盐酸反应:化学方程式为:Mg+2HCl=MgCl2+H2↑实验现象为:镁不断溶解,镁表面有气泡产生;7、铝与稀硫酸反应:化学方程式为:2Al+3H2SO4=Al2(SO4)3+3H2↑铝与稀盐酸反应:化学方程式为:2Al+6HCl=2AlCl3+3H2↑注意:Al+3价8、锌与稀硫酸反应:化学方程式为:Zn+H2SO4=ZnSO4+H2↑实验室制氢气锌与稀盐酸反应:化学方程式为:Zn+2HCl=ZnCl2+H2↑常见的金属中,镁、铝、锌、铁能与稀盐酸或稀硫酸反应,铜、银、金等不与稀盐酸或稀硫酸反应。
9、(湿法冶金、曾青得铁则化为铜)化学方程式为:Fe+CuSO4=FeSO4+Cu实验现象为:铁表面有红色物质析出,溶液由蓝色变成浅绿色。
(不能用铁制容器盛放硫酸铜溶液)★单质铁在发生置换反应时,生成的都是+2价的亚铁。
10、实验室用一氧化碳和氧化铁炼铁:3CO+Fe2O3高温2Fe+3CO2实验现象为:红棕色固体逐渐变黑,澄清的石灰水变浑浊;11、尾气的点燃:2CO+O2点燃2CO212、焦炭的作用:①做燃料提供热量(方程式为C+O2点燃CO2);②产生还原剂CO(方程式为C+CO2高温2CO)。
沪教版化学-九年级上册-第5章金属的冶炼与利用第1节金属的性质和利用第2课金属的性质及合金
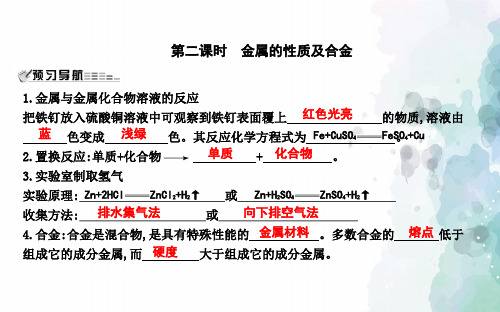
10.现有a、b两块等质量等体积的铁,分别将a浸入稀硫酸中,b浸入硫酸铜溶液中,相 同时间后同时取出晾干称量,两块铁的质量是( A ) A.a<b B.a>b C.a=b D.a≥b 11.某化学兴趣小组的同学欲验证镁、锌、银的活动性顺序,应选取下列适宜的试剂 组( B ) A.镁、锌、氯化银溶液 B.锌、氯化镁溶液、氯化银溶液 C.锌、银、氯化镁溶液 D.银、氯化镁溶液、稀盐酸
C.铁可以把锌从硫酸锌溶液中置换出来
D.铁与稀盐酸反应的化学方程式为2Fe+6HCl
2FeCl3+3H2↑
解析:根据漫画中,四种金属与酸是否产生气泡及气泡的多少可知:Mg最活泼,Zn次 之,Fe再次之,Cu最稳定不与稀盐酸反应,故A错误,B正确;由于铁的活动性小于锌,故铁 不能和硫酸锌溶液反应置换出锌,C错误;铁和盐酸反应生成氯化亚铁和氢气,正确的化 学方程式为Fe+2HCl FeCl2+H2↑,故D错误。 答案:B
12.现向A、B、C三种银白色金属中分别加入等浓度等体积的稀盐酸,观察到B表面有气 泡产生,A和C无变化。另取适量A、C分别放到硫酸铜溶液中,一段时间后观察A表面有 红色固体析出而C无明显现象。据此推断下列反应一定不可以实现的是( B ) A.金属B能与稀盐酸发生置换反应生成氢气 B.金属C能与B的盐溶液发生置换反应生成单质B C.金属A能与C的盐溶液发生置换反应生成单质C D.金属B能与硫酸铜溶液发生置换反应生成单质铜 13.把三块相同锌片分别插入一定浓度足量的FeSO4、CuCl2、AgNO3三种溶液中,假设X 表示时间,W表示溶液中固体的总质量,如图所示分析可知:
A表示插入 AgNO3 溶液,B表示插入 CuCl2 溶液,C表示插入 FeSO4 溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020-2021学年初三化学上学期沪教版(全国)第5章金属的冶炼与利用基
础实验4常见金属的性质同步练习
一、单选题
1.下列物质中,不属于合金的是( )
A.不锈钢B.氧化汞C.黄铜D.生铁
2.化学小组为探究铝、铜、银三种金属的活动性顺序,设计了如图所示实验方案。
下列说法不正确的是( )
A.由实验甲可知金属活动性:Al>Cu
B.B.由实验乙可知金属活动性:Cu>Ag
C.由实验甲、乙、丙可知金属活动性:Al>Cu>Ag
D.实验甲中的CuSO4改为CuCl2不能完成本实验探究
3.鉴别与除杂是化学实验的重要内容,下列设计的方案不能达到实验目的是()
A .A
B .B
C .C
D .D
4.a 、b 、c 三种酸分别与足量的金属Mg 充分反应,生成等质量的H 2 , 反应消耗a 、b 、c 的分子数目之比为3:6:2.下列关于a 、b 、c 的推理合理的是(HX 、H 2Y 、H 3Z 分别表示三种酸)( )
A .a 、b 、c 可能分别为HX 、H 3Z 、H 2Y
B .a 、b 、c 可能分别为H 3Z 、H 2Y 、HX
C .a 、b 、c 可能分别为HX 、H 2Y 、H 3Z
D .a 、b 、c 可能分别为H 2Y 、HX 、H 3Z
5.某同学设计了两种由CuO→Cu 的实验方案:方案一:Zn 24H SO 稀−−−−→H 2 CuO −−−
→Cu 方案二:CuO 24H SO 稀−−−−→CuSO 4Zn −−
→ Cu>大家认为方案二优于方案一,理由是:>节约能源>Cu 产率高>产品纯净>操作安全,其中,评价正确的是( )
A .>>>
B .>>>
C .>>>
D .>>>
6.小明同学对所学部分化学知识归纳如下,其中完全正确的一组是( )
A .物质的分类:>合成橡胶、合金都属于合成材料>氧化物中含有氧元素>混合物中一定含有多种元素
B .资源的利用和保护:>保护空气要减少有害气体和烟尘的排放>爱护水资源要节约用水和防止水体污染>保护金属资源只能通过防止金属腐蚀实现
C .“低碳经济”的措施:>改造或淘汰高能耗、高污染产业>研制和开发新能源替代传统能源>减少使用一次性塑料方便袋
D .用“化学”眼光分析:>铝不易生锈是因为铝不易与氧气反应>湿衣服晾干是因为分子之间有间隔>不能用铁桶盛装稀硫酸是因为二者发生化学反应
7.下列说法正确的是( )
A .为了节约成本,高炉炼铁的废气可以不经过处理直接排放到大气中
B .置换反应前后,组成各物质的所有元素的化合价一定要变化的
C .氢气在氧气中完全燃烧,反应物的化学计量数之比v (H 2):v (O 2)=1:2
D.铁和铝都可以用来制作炊具,这是利用了它们的导热性
8.下列有关图象描述正确的是()
A.加水稀释浓盐酸B.点燃一定质量的镁带C.一定质量的锌粒放入稀硫酸中D.电解水
9.物质的用途与性质密切相关.下列说法不正确的是()
A.铜用于制导线,是由于铜有良好的导电性
B.铁制品表面涂“银粉”(铝粉),是由于铝的化学性质没有铁稳定
C.用墨书写的字画可以保存很长时间,是由于常温下碳的化学性质稳定
D.制糖工业中利用活性炭来脱色,是由于活性炭的吸附性强
10.下列化学式对应的俗名正确的是()
A.Ag:水银B.CaO:消石灰C.NaCl:苛性钠D.Na2CO3:纯碱
11.下列有关金属说法正确的是()
A.金属铝有良好的抗腐蚀性是因为铝的化学性质不活泼
B.钢就是铁
C.铜的化学性质不活泼,但在潮湿的空气中能生锈
D.镀锌的“白铁皮”不易生锈,说明锌没有铁活泼
12.物质的性质决定其用途,下列关于物质的用途不正确的是()
A.铜﹣﹣做导线B.金刚石﹣﹣切割玻璃
C.氧气﹣﹣做燃料D.干冰﹣﹣用于人工降雨
13.所谓合金,就是不同种金属(或金属与非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点判断,其中不能形成合金的是()
A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na
14.下列各组物质,按混合物、单质顺序排列的是()
A.井水、干冰B.冰水、水银C.食醋、米酒D.黄铜、黄金
15.下列物质的性质和用途,对应关系错误的是()
A.A B.B C.C D.D
二、综合应用题
16.化学实验是进行科学探究的重要方式.
(1)下列实验仪器中不能用于加热的是________(填字母代号).
a.烧杯b.量筒c.试管d.蒸发皿
(2)某化学小组选用以下装置和药品进行探究实验.
①A中反应的化学方程式为__________________________
②若将A、B连接,A中产生的气体并不能使B中的溶液变浑浊,这是为什么?____________
③若要制取一瓶较为纯净、干燥的CO2,所选用装置的导管接口从左到右的正确连接顺序为:a接________、________接________、________接________.
(3)为探究工业废水的综合利用,某化学小组在实验室中完成了以下实验.
①X为________;乙与硝酸钡反应的化学方程式为________.
②操作I和操作>中都要用到一种玻璃仪器.该仪器在操作>中的作用是什么?_______
(4)某工厂变废为宝,探究用废硫酸等来制取所需产品.现有废硫酸4.9t(H2SO4的质量分数为20%),与
足量废铁屑反应来制取硫酸亚铁,同时将生成的全部氢气通入足量氧化铜中并加热(H2+CuO Δ
Cu+H2O),
请计算理论上最多可生产铜的质量._______
17.金属材料广泛应用于生产、生活中。
(1)金属铜常用作导线、是利用了铜良好的延展性和_____。
(2)以氧化铁和一氧化碳为原料炼铁的化学方程式为_____
(3)实验室的氧化铜中混有铁粉,为提炼其中的铜,取等质量两份样品,分别进行以下实验。
实验一:
>分离得到溶液D的操作名称是_____
>写出步骤Ⅱ中反应的化学方程式_____
>上述步骤_____(填步骤编号)体现了铁的活动性比铜强
实验二
>两种实验方案你认为哪个更好?并说明理由_____。
>E、F是同一种溶质形成的溶液,能否判断E、F溶液中该溶质质量的大小关系?并说明理由_____。
(4)在金属活动顺序表中,金属位置越靠前,越容易失去电子。
Ca比Mg失电子能力强,如图是两种原子的结构示意图,据此推测金属失电子能力的强弱除与最外层电子数有关外,还可能与_____有关。
18.人类文明的发展和社会的进步同金属材料关系十分密切,其中钢铁是基本的结构材料,称为“工业的骨骼”。
(1)金属锂是密度最小的金属,用于原子反应堆、制轻合金及电池等。
锂(Li)的原子结构示意图如图所示。
则Li的原子核内质子数为___,它从稀硫酸中置换出H2的化学反应方程式为____。
(2)铝是地壳中含量位于第____位的元素,它是活泼的金属元素,但因为铝制品表面,在空气中可以形成_____,所以铝制品在日常生活中可以得到广泛的使用。
(3)实验室常用如图装置模拟炼铁反应。
①实验过程中硬质玻璃管中,发生反应的化学方程式为____,石灰水的作用为_____。
②请你简要回答,如何证明NaOH溶液是否完全参加了反应。
____。
(4)取含氧化铁的铁矿石5g,利用上述装置制备铁,充分反应后称重,得到铁单质2.8g。
该铁矿石中氧化铁的含量是____?
参考答案
1.B2.D3.B4.D5.B6.C7.D8.C9.B10.D11.C12.C13.C14.D15.C
16.b CaCO3+2HCl═CaCl2+CO2↑+H2O 浓盐酸易挥发,使CO2中混有HCl,不能生成CaCO3沉淀g f e d h 锌(或Zn)ZnSO4+Ba(NO3)2=BaSO4↓+Zn(NO3)2用玻璃棒搅拌的作用是防止因局部温度过高造成液滴飞溅0.64t
17.导电性Fe2O3+3CO 高温
2Fe+3CO2过滤Fe+H2SO4=FeSO4+H2↑和Fe+CuSO4=
FeSO4+Cu II和III 实验二,因为实验一中铁置换硫酸铜中的铜,导致生成的铜附着在铁的表面,阻止了反应的进行,使得到的铜粉不纯实验一中的大,因为过程中加入的铁也转化为了硫酸亚铁电子层数
18.3 2Li+H2SO4=Li2SO4+H2↑ 3 致密的氧化物薄膜Fe2O3+3CO2Fe +3CO2检验生成的CO2取适量溶液滴加过量的BaCl2,再取沉淀后的清液,滴加酚酞试液,溶液不显红色说明NaOH完全参加了反应,溶液显红色说明NaOH没有完全参加反应80%。
