顺反异构和对映异构
合集下载
第二章 立体化学

(Z)-1,2-二氯-1-溴乙烯 反-1,2-二氯-1-溴乙烯
(E)-1,2-二氯-1-溴乙烯 顺-1,2-二氯-1-溴乙烯
(E)-3, 4-二甲基-2-戊烯 顺-3, 4-二甲基-2-戊烯
(Z)-3, 4-二甲基-2-戊烯 反-3, 4-二甲基-2-戊烯
二、顺反异构体的性质
▪ห้องสมุดไป่ตู้物理性质不同 ▪ 化学性质:基本相同,与空间构型有关的有差别。
次互换,使最不优先的基团位于顶部,剩下3个原子或基团按照从优先到不优
先的顺序,顺时针方向排列为R-构型,逆时针方向排列为S-构型。
(二)对称中心
如果有机分子中存在一个假想的点,从分子中任一原子或基团向该点作一直 线,再从该点将直线延长,在等距离处遇到相同的原子或原子团,则该点即 为该分子的对称中心。
四、判断对映体的方法
➢ 比较一个分子和它的镜像,如果两者不能重合,则为对映体。 ➢ 有对称面或对称中心的分子为非手性分子(没有对映体)。 ➢ 仅有一个手性碳原子(或手性中心)的分子为手性分子(有对映体)。
第三节
手性、手性分子和对映体
一、手性
镜像与实物不能重合的现象称为手性(chirality)。
二、手性分子和对映体
手性分子:与镜像不能重合的分子。 手性碳(不对称中心):连接4个不同原子或基团的碳。
手性碳
与镜像不能重合的分子彼此互为对映异构体(手性异构体)
三、分子中常见对称因素
(一)对称面
对称面:能将分子切分为具有实物与镜像关系的假想平面。有对称面的化合 物不是手性分子。
第二章
立体化学
立体化学:研究有机分子的立体结构、反应的立体选择性 及其相关规律和应用。
碳链异构
位置异构 构造异构
第八章 立体化学对映异构
l ??
? : 旋光度;c: 溶液浓度 (g/mL);ρ: 纯液体密度(g/mL) ;l: 管长(dm)
? ? 通常要标出测定时的温度和偏振光的波长:
?
t
?
溶剂对比旋光度也有影响,要注明所用溶剂。
例: 在20℃时,以钠光灯为光源测得葡萄糖水溶液的比旋光度为
右旋52.5°,记为:
??
?20 D
?
? 52.5?(水)
返回
26
R-S 标记法
? 根据手性碳原子所连接的四个基团在空间的排列来标记: (1)先把手性碳原子所连接的四个基团设为: a、b、c、d,并
将它们按次序规则排队。 (2)若a,b,c,d 四个基团的顺序是 a(较优基团)>b>c>d ,将该手
性碳原子在空间作如下安排:
? 把排在最后的基团 d放在离观察者 最远的位置,然后按 先后次序观察其他三个基团。 ? 即从最先的a开始看,经过b,再到c。 ? 若方向是 顺时针 的,则该手性碳原子的构型标记为 “R”;若为逆时针,则标记为“S”
-31.3°(乙酸乙酯 )
+31.3°(乙酸乙酯
外消旋体153
)
(III) (2R,3S)-(-) 167
-9.4°(水)
(IV) (2S,3R)- 167
+9.4°(水)
?非对映(+体) 可用一般的物理方法分离.
37
例:酒石酸的立体异构体
COOH
COOH
O HO C
HH *C C* OH OH
COOH
OH
乳酸(2-羟基丙酸)
H3C
C H
COOH
手性分子
乳酸的分子模型图
两个乳酸模型不能叠合
? : 旋光度;c: 溶液浓度 (g/mL);ρ: 纯液体密度(g/mL) ;l: 管长(dm)
? ? 通常要标出测定时的温度和偏振光的波长:
?
t
?
溶剂对比旋光度也有影响,要注明所用溶剂。
例: 在20℃时,以钠光灯为光源测得葡萄糖水溶液的比旋光度为
右旋52.5°,记为:
??
?20 D
?
? 52.5?(水)
返回
26
R-S 标记法
? 根据手性碳原子所连接的四个基团在空间的排列来标记: (1)先把手性碳原子所连接的四个基团设为: a、b、c、d,并
将它们按次序规则排队。 (2)若a,b,c,d 四个基团的顺序是 a(较优基团)>b>c>d ,将该手
性碳原子在空间作如下安排:
? 把排在最后的基团 d放在离观察者 最远的位置,然后按 先后次序观察其他三个基团。 ? 即从最先的a开始看,经过b,再到c。 ? 若方向是 顺时针 的,则该手性碳原子的构型标记为 “R”;若为逆时针,则标记为“S”
-31.3°(乙酸乙酯 )
+31.3°(乙酸乙酯
外消旋体153
)
(III) (2R,3S)-(-) 167
-9.4°(水)
(IV) (2S,3R)- 167
+9.4°(水)
?非对映(+体) 可用一般的物理方法分离.
37
例:酒石酸的立体异构体
COOH
COOH
O HO C
HH *C C* OH OH
COOH
OH
乳酸(2-羟基丙酸)
H3C
C H
COOH
手性分子
乳酸的分子模型图
两个乳酸模型不能叠合
对映异构-有机化学

泳衣品牌
它们不同对映体
表现出相反作用。
对于含手性碳原子的药物,即便是同一药物,
产生的生物活性,有的强弱不一,有的甚至
这是因为生物大分子(如酶、受体、抗体等)或它的 活性部位具有手性,具有一定的立体构型和构象,所以 它要求和它相互作用的的生物活性分子(如神经递质、
激素、药物、毒物等)也要具有和它相适应的立体化学
二 含一个手性碳原子化合物的对映异构
手性碳原子:
泳衣品牌与四个不同的原子或原子团相
* CH CH CO O H 3 OH
连的碳原子。 例如:乳酸分子
(一) 对映异构体
COOH C CH3 H OH H HO COOH
对
互为实物与镜
影关系,不能 相互重叠的两
C CH3
映 体
S-(+)-乳酸
R-(-)-乳酸
5、迅猛增长的市场需求,刺激了手性药物的研究与开发。
§9.1 偏振光和旋光性
一、偏振光和物质的旋光性
光是一种电磁波,光波的振动方向与其前进方向垂直。
光束先进方向
光源
尼可尔棱镜 (偏振片)
与棱镜晶轴 平行的振动 平面
晶轴 b a c d
普通光
a 平面偏振光
有无数个振动平面,振动平面与光的前进方向 相垂直
-1 2 °
0° ( m) 酒 石 酸
0°
内消旋体(分子中有对称面)
内消旋体(meso):分子内部形成对映两半的化合物。
(有平面 对称因素)。内消旋体无旋光性。 具有两个手性中心的内消旋结构一定是(R、S)构 型。 外消旋体与内消旋体异同: 外消旋体与内消旋体的共同之处是:二者均 无旋光性,但本质不同。 外消旋体:是混合物,可拆分出一对对映体。 内消旋体:是化合物,不能拆分。
顺反异构、对映异构

顺反异构、对映异构对应异构:两种物质互为镜像,就跟⼈的左右⼿间的关系⼀样,外形相似但不能重合。
我们知道,⽣命是由碳元素组成的,碳原⼦在形成有机分⼦的时候,4个原⼦或基团可以通过4根共价键形成三维的空间结构。
由于相连的原⼦或基团不同,它会形成两种分⼦结构。
这两种分⼦拥有完全⼀样的物理、化学性质。
⽐如它们的沸点⼀样,溶解度和光谱也⼀样。
但是从分⼦的组成形状来看,它们依然是两种分⼦。
这种情形像是镜⼦⾥和镜⼦外的物体那样,看上去互为对应。
由于是三维结构,它们不管怎样旋转都不会重合,就像我们的左⼿和右⼿那样,所以⼜叫⼿性分⼦。
定义⽴体异构的⼀种,由于双键不能⾃由旋转引起的,⼀般指烯烃的双键,也有C=N双键,N=N双键及环状等化合物的顺反异构。
顺式异构体:两个相同原⼦或基团在双键同⼀侧的为顺式异构体,也⽤ cis- 来表⽰。
反式异构体:两个相同原⼦或基团分别在双键两侧的为反式异构体,也⽤ trans- 来表⽰。
图中Pt(NH3)2Cl2应该没有顺反异构2产⽣条件⑴分⼦不能⾃由旋转(否则将变成另外⼀种分⼦)⑵双键上同⼀碳上不能有相同的基团;注:同分异构是分⼦式相同,结构式不同,顺反异构是空间构象不同。
但顺反异构属于同分异构。
若双键上两个碳原⼦上连有四个完全不同的原⼦或基团,按“顺序规则”分别⽐较每个碳原⼦上连接的两个原⼦或基团,若两个较优基团在π键平⾯同侧者为Z型异构体,在异侧者为E型异构体。
顺反异构体的性质顺反异构体,原⼦或原⼦团的连接顺序以及双键的位置相同,只是空间排列⽅式不同。
因此化学性质基本相同,但在⽣物体内的⽣物活性不同,物理性质有⼀定的差异:⼀般,反式有较⾼的熔点,较低的溶解度,且较为稳定。
顺反异构和对映异构

对映异构
由于分子中存在手性碳原子,使得分子中的原子或基团在空间排列上产生不同 的方式,形成具有旋光性的对映异构体。
空间结构
顺反异构
由于碳碳双键或碳碳单键的限制,顺式和反式异构体的空间结构不同,通常表现为键长、键角和偶极矩等物理性 质的差异。
对映异构
对映异构体的空间结构也不同,但由于手性碳原子的存在,使得分子呈现出旋光性,可以通过偏振光实验进行鉴 别。
化学工业
顺反异构
在化学工业中,顺反异构的应用主要涉及烯烃的合成和反应。通过控制双键两侧取代基的排列方式, 可以合成具有特定性质的烯烃,如聚烯烃塑料、橡胶等。
对映异构
对映异构在化学工业中有重要应用,尤其是在手性药物的合成中。手性药物具有旋光性,可以通过对 映异构体的拆分或合成,获得单一的对映体,提高药物的疗效和降低副作用。
材料科学
顺反异构
在材料科学中,顺反异构的应用主要涉及功 能材料的合成和性质研究。例如,通过控制 材料分子中的顺反结构,可以调节材料的物 理和化学性质,开发出具有特定功能的新型 材料。
对映异构
对映异构在材料科学中有一定应用,尤其是 在手性材料的研究中。手性材料具有旋光性 ,可以通过对映异构体的选择和合成,获得 具有特定光学性质的手性材料,如光学器件 、显示材料等。
THANKS
感谢观看
药物合成
顺反异构
在药物合成中,顺反异构的应用主要涉 及抗生素、激素等药物的合成。通过控 制药物分子中特定基团的排列方式,可 以合成具有特定药效的药物。
VS
对映异构
对映异构在药物合成中具有重要意义,因 为许多生物分子和药物分子都具有手性特 征。通过对映异构体的选择,可以开发出 更有效、副作用更小的药物。
形成条件
由于分子中存在手性碳原子,使得分子中的原子或基团在空间排列上产生不同 的方式,形成具有旋光性的对映异构体。
空间结构
顺反异构
由于碳碳双键或碳碳单键的限制,顺式和反式异构体的空间结构不同,通常表现为键长、键角和偶极矩等物理性 质的差异。
对映异构
对映异构体的空间结构也不同,但由于手性碳原子的存在,使得分子呈现出旋光性,可以通过偏振光实验进行鉴 别。
化学工业
顺反异构
在化学工业中,顺反异构的应用主要涉及烯烃的合成和反应。通过控制双键两侧取代基的排列方式, 可以合成具有特定性质的烯烃,如聚烯烃塑料、橡胶等。
对映异构
对映异构在化学工业中有重要应用,尤其是在手性药物的合成中。手性药物具有旋光性,可以通过对 映异构体的拆分或合成,获得单一的对映体,提高药物的疗效和降低副作用。
材料科学
顺反异构
在材料科学中,顺反异构的应用主要涉及功 能材料的合成和性质研究。例如,通过控制 材料分子中的顺反结构,可以调节材料的物 理和化学性质,开发出具有特定功能的新型 材料。
对映异构
对映异构在材料科学中有一定应用,尤其是 在手性材料的研究中。手性材料具有旋光性 ,可以通过对映异构体的选择和合成,获得 具有特定光学性质的手性材料,如光学器件 、显示材料等。
THANKS
感谢观看
药物合成
顺反异构
在药物合成中,顺反异构的应用主要涉 及抗生素、激素等药物的合成。通过控 制药物分子中特定基团的排列方式,可 以合成具有特定药效的药物。
VS
对映异构
对映异构在药物合成中具有重要意义,因 为许多生物分子和药物分子都具有手性特 征。通过对映异构体的选择,可以开发出 更有效、副作用更小的药物。
形成条件
第4章对映异构
Cl C H C2 C Cl C6 H
但有时,有对称轴的分子也有手性。例如: 但有时,有对称轴的分子也有手性。例如:
COOH H HO OH H COOH HO H HCOO C2 H OH COOH
有手性
练习
有机化学
对称轴不是分子有无手性的判断依据。 对称轴不是分子有无手性的判断依据。
药学院化学教研室 对映异构体的旋光性 1.3 对映异构体的旋光性 偏振光和偏振面
OH H3C C
CH3CH2
练习
COOH
I
*
*
COOH
C6H5
P
H H
C
*
OH
H
H
CH3
C * OH CH3
含一个C 的分子一定是手性分子,含一个以上C 含一个 * 的分子一定是手性分子,含一个以上 * 的分子则不一定是手性分子
有机化学
1.2 手性与分子的对称因素
对称因素 对称面、对称中心) (对称面、对称中心) 有面或者有中心 无面且无中心 手性 无 有
1.对映异构的 1.对映异构的基本概念 对映异构的基本概念 对映异构体和手性分子 手性分子; 对映异构体和手性分子 手性与分子的对称因素 对称面、 对称因素: 手性与分子的对称因素:对称面、对称中心 重点 对映异构的旋光性 对映异构的旋光性 难点 旋光异构体的表示方法 透视式;费歇尔投影式; 表示方法:透视式 旋光异构体的表示方法 透视式;费歇尔投影式; 2.旋光异构体的标记:D/L构型和R/S构型 旋光异构体的标记: 重点难点 3.具有手性中心(C*)的分子 3.具有手性中心(C*)的分子 具有手性中心 一个手性碳原子化合物的旋光异构 含一个手性碳原子化合物的旋光异构 重点 两个手性碳原子( 含两个手性碳原子(不同C ,相同C )的旋光异构 环状化合物的旋光异构 环状化合物的旋光异构 不具有C*的手性分子 不具有 的手性分子 4.立体选择性和立体专一性 4.立体选择性和立体专一性反应 立体选择性和立体专一性反应 有机化学 5.旋光异构体与生物医学的关系 旋光异构体与生物医学的关 旋光异构体与生物医学的关系 重点
但有时,有对称轴的分子也有手性。例如: 但有时,有对称轴的分子也有手性。例如:
COOH H HO OH H COOH HO H HCOO C2 H OH COOH
有手性
练习
有机化学
对称轴不是分子有无手性的判断依据。 对称轴不是分子有无手性的判断依据。
药学院化学教研室 对映异构体的旋光性 1.3 对映异构体的旋光性 偏振光和偏振面
OH H3C C
CH3CH2
练习
COOH
I
*
*
COOH
C6H5
P
H H
C
*
OH
H
H
CH3
C * OH CH3
含一个C 的分子一定是手性分子,含一个以上C 含一个 * 的分子一定是手性分子,含一个以上 * 的分子则不一定是手性分子
有机化学
1.2 手性与分子的对称因素
对称因素 对称面、对称中心) (对称面、对称中心) 有面或者有中心 无面且无中心 手性 无 有
1.对映异构的 1.对映异构的基本概念 对映异构的基本概念 对映异构体和手性分子 手性分子; 对映异构体和手性分子 手性与分子的对称因素 对称面、 对称因素: 手性与分子的对称因素:对称面、对称中心 重点 对映异构的旋光性 对映异构的旋光性 难点 旋光异构体的表示方法 透视式;费歇尔投影式; 表示方法:透视式 旋光异构体的表示方法 透视式;费歇尔投影式; 2.旋光异构体的标记:D/L构型和R/S构型 旋光异构体的标记: 重点难点 3.具有手性中心(C*)的分子 3.具有手性中心(C*)的分子 具有手性中心 一个手性碳原子化合物的旋光异构 含一个手性碳原子化合物的旋光异构 重点 两个手性碳原子( 含两个手性碳原子(不同C ,相同C )的旋光异构 环状化合物的旋光异构 环状化合物的旋光异构 不具有C*的手性分子 不具有 的手性分子 4.立体选择性和立体专一性 4.立体选择性和立体专一性反应 立体选择性和立体专一性反应 有机化学 5.旋光异构体与生物医学的关系 旋光异构体与生物医学的关 旋光异构体与生物医学的关系 重点
第七章 对映异构

第七章 对映异构
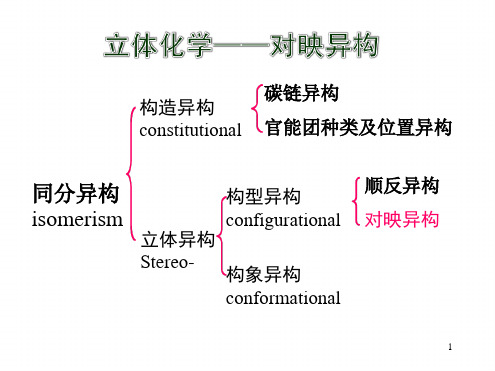
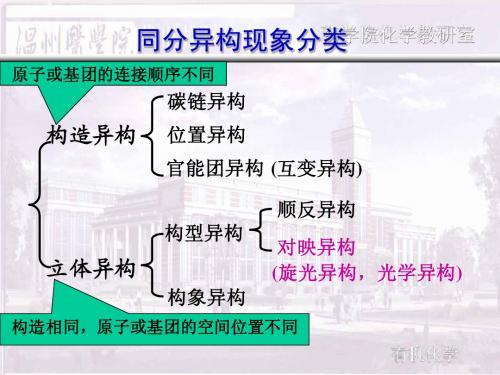
构造异构
同分异构
立体异构
顺反异构 构型异构
立体异构
构象异构
对映异构
一、物质的旋光性
• 平面偏振光:
光线通过尼科尔Nicol棱镜,变为只在一个平面振动 的光,称为平面偏振光。
Nicol棱镜
对映异构现象:
图.7.3 左右手互为镜像,不能重叠
图7.2 互为镜像的一对对映体
图 7.4 2-羟基丁烷的一对对映异构体
CH3 C H
sp杂化
CH3 C C H
CH3 C H C C
CH3 H
CH3 但若为 H C C C
CH3 CH3
则无旋光性
比如,抗菌素菌霉素:
HC C CH C CH CH CH CH2COOH
2.螺环化合物:
用环状结构代替丙二烯手性化合物中的一个或两个双键 得到的化合物也具有手性
H3C H P132 H H3C
内消旋体 非对映体
对映体
内消旋体:没有旋光性,分子内部手性碳原子旋光能 力相互抵消; 外消旋体:两种分子间旋光能力相互抵消。 有手性碳原子的化合物不一定具有手性
氯霉素分子中有两个手性碳原子,有四个对映异构体 CH2OH H OH 有抗菌作用的仅是 D-(-)-苏式氯霉素
O Cl2CHCNH H
NO2
图7.14 2-丁酮在镍的催化作用下加氢还原为等量的 (R)-2-丁醇和 (S)2-丁醇
2、 第二个手性中心的产生:
CH3 H CH3 H H CH3 Cl H Cl2 H H CH3 Q: * CH3CH2CH2CH3 Cl 外消旋体 A: No. Cl2 * * CH3CHCHCH3 Cl Cl Cl2 Cl CH3 CH3 Cl Cl (2S,3R)-2氯丁烷 (内消旋体) 有无旋光性? 71 Cl H (2S,3S)-2氯丁烷 比例 29
构造异构
同分异构
立体异构
顺反异构 构型异构
立体异构
构象异构
对映异构
一、物质的旋光性
• 平面偏振光:
光线通过尼科尔Nicol棱镜,变为只在一个平面振动 的光,称为平面偏振光。
Nicol棱镜
对映异构现象:
图.7.3 左右手互为镜像,不能重叠
图7.2 互为镜像的一对对映体
图 7.4 2-羟基丁烷的一对对映异构体
CH3 C H
sp杂化
CH3 C C H
CH3 C H C C
CH3 H
CH3 但若为 H C C C
CH3 CH3
则无旋光性
比如,抗菌素菌霉素:
HC C CH C CH CH CH CH2COOH
2.螺环化合物:
用环状结构代替丙二烯手性化合物中的一个或两个双键 得到的化合物也具有手性
H3C H P132 H H3C
内消旋体 非对映体
对映体
内消旋体:没有旋光性,分子内部手性碳原子旋光能 力相互抵消; 外消旋体:两种分子间旋光能力相互抵消。 有手性碳原子的化合物不一定具有手性
氯霉素分子中有两个手性碳原子,有四个对映异构体 CH2OH H OH 有抗菌作用的仅是 D-(-)-苏式氯霉素
O Cl2CHCNH H
NO2
图7.14 2-丁酮在镍的催化作用下加氢还原为等量的 (R)-2-丁醇和 (S)2-丁醇
2、 第二个手性中心的产生:
CH3 H CH3 H H CH3 Cl H Cl2 H H CH3 Q: * CH3CH2CH2CH3 Cl 外消旋体 A: No. Cl2 * * CH3CHCHCH3 Cl Cl Cl2 Cl CH3 CH3 Cl Cl (2S,3R)-2氯丁烷 (内消旋体) 有无旋光性? 71 Cl H (2S,3S)-2氯丁烷 比例 29
环烷烃的顺反异构对映异构.

• D型为拉丁文Dexter,右 • L型为拉丁文Laevus,左
• 这样旋光方向和构型联系起来,也即D( + ) - 甘 油 醛 , 它 的 对 应 体 L-(-)- 甘 油 醛。其他化合物的构型以甘油醛的构型 为参照标准,在保持手性碳构型不变中, 可由D型甘油醛转化来的化合物就是D型,
• 可由L型甘油醛转化来的化合物就是L型。
D-(+)-甘油醛
D-(-)-甘油酸
• 与甘油醛相关联的手性化合物都可用D/L 来标记。此种命名法主要对葡萄糖、氨 基酸类化合物。适用范围有限。
• 与甘油醛不相关联的手性化合物就不可 用D/L法来标记只能用IUPAC规定的R/S 法来标记。
• R/S构型标记法(绝对)规定:
• A、首先按次序规则确定与手性碳原子连 接的四个不同的原子或基团a,b,c,d的先后 次序(排大小)a>b>c>d ‘>’表示“优先 于”
• 分析分子中有无对称元素。若分子中没有对称 面也没有对称中心,一般为手性分子,具有旋 光性;否则为非手性分子。
•
• 1 对称面(Plane of symmetry):如果假想一 个平面将分子一分为二切开,两部分互为镜像, 这个平面就成为该分子的对称面,用σ表示。 有对称面的分子一定是非手性分子,没有旋光 性。
• ·手性化合物的特点: • 结构:镜像与实物不重合。 • 内能相同(左、右旋)
• 物理性质与化学性质在非手性环境中相 同,在手性环境中有区别。
• 旋光能力相同,但旋光方向相反。
• 3. 手性分子构型表示法
• 构型是表示分子中原子或基团在空间 的排列,手性分子构型就是表示手性碳 原子相连的四个原子或基团在空间的排 列。它的表示方法有:
• 这样旋光方向和构型联系起来,也即D( + ) - 甘 油 醛 , 它 的 对 应 体 L-(-)- 甘 油 醛。其他化合物的构型以甘油醛的构型 为参照标准,在保持手性碳构型不变中, 可由D型甘油醛转化来的化合物就是D型,
• 可由L型甘油醛转化来的化合物就是L型。
D-(+)-甘油醛
D-(-)-甘油酸
• 与甘油醛相关联的手性化合物都可用D/L 来标记。此种命名法主要对葡萄糖、氨 基酸类化合物。适用范围有限。
• 与甘油醛不相关联的手性化合物就不可 用D/L法来标记只能用IUPAC规定的R/S 法来标记。
• R/S构型标记法(绝对)规定:
• A、首先按次序规则确定与手性碳原子连 接的四个不同的原子或基团a,b,c,d的先后 次序(排大小)a>b>c>d ‘>’表示“优先 于”
• 分析分子中有无对称元素。若分子中没有对称 面也没有对称中心,一般为手性分子,具有旋 光性;否则为非手性分子。
•
• 1 对称面(Plane of symmetry):如果假想一 个平面将分子一分为二切开,两部分互为镜像, 这个平面就成为该分子的对称面,用σ表示。 有对称面的分子一定是非手性分子,没有旋光 性。
• ·手性化合物的特点: • 结构:镜像与实物不重合。 • 内能相同(左、右旋)
• 物理性质与化学性质在非手性环境中相 同,在手性环境中有区别。
• 旋光能力相同,但旋光方向相反。
• 3. 手性分子构型表示法
• 构型是表示分子中原子或基团在空间 的排列,手性分子构型就是表示手性碳 原子相连的四个原子或基团在空间的排 列。它的表示方法有:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Br
H
CH3 C=C Cl
(E)-1-氯-2-溴丙烯
Cl
CH2CH3
CH3 C=C H
(Z)-2-氯-2-戊烯
CH3
CH2CH2CH3
C=C
C2H5
CH(CH3)2
(Z)-3-甲基-4-异丙基-3-庚烯
④若化合物中含有两个以上能产生顺反异 构的双键时,每个双键的构型均须标出,并对 双键位置编号,写在构型符号前面。
旋光仪
旋光仪示意图 在盛液管中放入旋光性物质后,偏振光将发生偏 转。能使偏振光向右旋转的,称为右旋化合物,用 (+)表示; 能使偏振光向左旋转的,称为左旋化合物 ,用(-)表示。
旋光度
旋光性物质使偏振光旋转的角度称为旋光 度,用α表示.
物质旋光度α的大小与盛液管的长度、溶液 的浓度、光源的波长、测定时的温度、所用 的溶剂的有关。
CH3
H
CH3 C
优先于 CH3 C
CH3
CH3
叔丁基C(C、C、C),异丙基C(C、C、H)
CH3
CH2 CH2 CH CH3 优先于 CH2 CH2 CH2 CH3
-C(CHH),C(CHH),C(CCH)
-C(CHH),C(CHH),C(CHH)
③与—C=C—相连的取代基团为不饱和基 团时,应把双键或叁键原子看作是它以单 键和多个原子相连接。
顺反异构和对 映异构
构造异构:分子组成相同而原子(或原子团) 相互连接方式和顺序不同。 碳链异构
构造异构 位置异构
同分异构现象
立体异构
官能团异构 构型异构 构象异构
构型异构 顺反异构(几何异构) 对映异构
立体异构:分子中原子(或原子团)在空间排列 方式不同。
顺反异构
一、含C=C化合物的顺反异构 1. 产生顺反异构体的原因和条件
对映异构
彼此不能重合,并且互为镜象关系的异构体, 称为对映异构体。
对映异构体能使平面偏振光的振动面发生旋 转,故对映异构又称旋光异构或光学异构。
例如:乳酸
H3C CH COOH OH
平面偏振光
普通光在所有可能的平面上 振动。
普通光
如果使单色光通过尼可尔( Nicol) 棱镜,只有同棱镜晶轴平行的平面上 振动的光线才可以通过棱镜,因此通 过振这 动种,棱 这镜种的只光在线一就 个只 平在 面一 上个 振平 动面的上光平面偏振光 就是平面偏振光。
(1)分子内存在着阻碍自由旋转的因素: 如 C=C ,脂环 ;
2、每个双键碳原子上所连接的两个原子 或基团必须不相同,如:
a
d ab
b
C=C f
df
2.顺反异构体的命名
(1)顺/反命名法(四个原子或基团中有两个相同)
顺式(cis-)
反式(trans-)
顺-1,2-二溴乙烯
H HH
C=C
C=C
CH3 CH2
H
H
C=C
CH3
C6H5 H C=C H
(1Z,3Z)-1-苯基-1,3-戊二烯
Z-E构型命名法和顺反构型命名法是表示
构型的两种不同方法。Z-E构型命名法适用于
所有具有顺反异构的烯烃命名。目前Z-E构型
命名法和顺反构型命名法同时并用,这两种命
名法所使用的规则不同,但它们之间也没有必
然的联系。顺式构型不一定是Z构型;反式构
2、产生顺反异构的条件:环上至少有两个 碳原子所连的两个原子或原子团不相同。
3、命名:脂环化合物顺反异构体用顺/反 命名法命名(不用Z/E命名法命名)
Cl Cl
H Cl
HH
顺-1,2-二氯环丙烷
H H
CH3 Cl
顺-1-甲基-3-氯环己烷
Cl H
反-1,2-二氯环丙烷
CH3 H
H Cl
反-1-甲基-3-氯环己烷
Cl
H
C=C
H
CH3
反- 1- 氯丙烯
H
CH3
顺,顺-2,5-庚二烯
H
H
H
C=C
C=C
CH3
H
C2H5
反,顺-2,4- 庚二烯
CH3
H
C2H5
C=C
C=C
H
H
H
顺,反-2,4- 庚二烯
Br H
CC
CH3
Cl
如何命名?
(2)构型的Z/E命名法 首先确定每个双键碳上所连的两个原子或 基团的优先顺序
如果a>b, d>f ,则以下两式的构型为
CC
CH CH2 相当于 CH CH2
C CH 相当于
CC C CH CC
NC C N 相当于 C N
NC CC
C CH 相当于 C C H
CC
H2C
CH C
C CH2
CH3
CH3 CH2
CH3
Z型
H
CH2 CH3
CC
CH3
H
E型
-I>-Br>-Cl>-SO3H>-F>-OCOR>-OR >-OH>-NO2>-CCl3>-CHC12>-COCl> -CH2Cl>-COOR>-COOH>-CONH2> >-CHO>-C6H5>-CHR2>-CH2R>-CH3> -D>-H
H
CH3
C=C
CH3
COOH
反 _ 2 _ 甲基 _ 2 _ 丁烯酸
(Z)_ 2 _ 甲基 _ 2 _ 丁烯酸
H
H
H
C=C
C=C
C6H5
H
CH3
反 , 顺 _ 1_ 苯基 _1,3 _戊二烯 (1E , 3Z) _ 1_ 苯基 _1,3 _戊二烯
二. 脂环化合物的顺反异构
1、产生顺反异构的原因:环上的碳原子不 能自由旋转;
手性分子
化合物分子中的一个碳原子与四个不同的原子相 连时,这个化合物在空间有两种不同排列,即两种 构型.这两种不同构型的化合物相互不能重叠,像人的 两只手.
型也不一定是E构型。
H3C
CH3
CC
Cl
H
H3C
H
CC
Cl
CH3
顺-2-氯-2-丁烯
反-2-氯-2-丁烯
(E)-2-氯-2-丁烯
(Z)-2-氯-2-丁烯
H
COOH
C=C
CH3
CH3
顺 _ 2 _ 甲基 _ 2 _ 丁烯酸
(E)_ 2 _ 甲基 _ 2 _ 丁烯酸
H
H
C=C
CH3
C6H5
C=C
H
H
顺 , 顺 _ 1_ 苯基 _1,3 _ 戊二烯 (1Z , 3Z) _ 1_ 苯基 _1,3 _ 戊二烯
a
d
C=C
b
f
Z--型
a
f
பைடு நூலகம்
C=C
b
d
E--型
即把两个优先基团在双键同侧的定 为Z型,在不同一侧的定为E型。
①与—C=C—相连的第一个原子的原子序 数由大到小排列,大者为“优先”基团; 按此规定,在取代基团-CH3、-H、-Br、 -OH、-NH2之中,先后次序应为: -Br>-OH>-NH2>-CH3> -H ②若第1个原子相同,比较第2……个原子。 例:-CH2CH3 > -CH3 又如 -CH(CH3)2与—CH2CH3相比较,第一 原子都是碳,与第一原子相连的原子。前 者为 C、C、H,后者为C、H、H,前者多 一个碳,所以-CH(CH3)2优先于-CH2CH3。
