神经性钠离子通道Nav1.8对心脏功能和疾病的影响论文
离子通道与神经系统疾病的关系研究

离子通道与神经系统疾病的关系研究神经系统是人体最为重要的组成部分之一,它负责协调、控制和调节我们的行动、思维和感觉等各种生理活动。
然而,神经系统疾病却是现代医学中的一个严重问题,它可能导致失明、耳聋、癫痫、帕金森病、阿尔兹海默病等各种疾病。
其中,离子通道与神经系统疾病的关系备受关注。
什么是离子通道?离子通道是细胞膜上的一种蛋白质复合物,它形成了一种可以让离子(如钠、钾、钙、氯离子等)通过细胞膜的通道,从而调节细胞内的离子平衡,在神经和心肌细胞的兴奋和抑制过程中发挥着重要的作用。
离子通道与神经系统疾病的关系神经系统疾病的发生机制极为复杂,其中离子通道的异常功能被认为是很多神经系统疾病的重要原因。
在某些神经细胞中,如神经元和心肌细胞,离子通道在神经冲动传导和细胞兴奋中发挥着至关重要的作用,因此细微的离子通道异常可能导致神经系统功能紊乱。
例如,帕金森病是一种中枢神经系统疾病,它与神经元酪氨酸羟化酶(tyrosine hydroxylase, TH)的缺乏有关。
该酶在中脑黑质多巴胺神经元中起着合成多巴胺的重要作用。
然而,多巴胺的合成需要依赖于多巴氧化酶(dopamine β-hydroxylase, DBH)参与的儿茶酚胺合成途径。
DBH是一种分泌性蛋白,它能够在细胞体内转运多巴胺,并将其转化为去甲肾上腺素。
但是,DBH的活性需要依赖于离子通道的调控,因此离子通道的故障往往与帕金森病的发生有着密切的关系。
另外,多种神经系统疾病还可能与离子通道突变和基因的异质性有关。
例如,先天性无酸碱毒的遗传性疾病与离子通道中的突变有关。
目前,全球的科学家正在努力研究离子通道与神经系统疾病之间的关系,希望找到更好的治疗和预防方法,从而保障人类的神经健康。
伤害性感受神经元上的钠通道在痛觉敏化中的作用

伤害性感受神经元上的钠通道在痛觉敏化中的作用摘要:钠离子通道在神经元兴奋性产生过程中发挥重要作用,一直以来受到广大研究人员的关注。
钠通道在许多神经病变,特别是神经病理性疼痛、炎性疼痛的产生中发挥重要作用。
本文通过检索近年来的文献,从外周神经系统中钠离子通道的分型、表达、功能等方面进行综述,特别是钠通道对神经元兴奋性的调节,以及在疼痛中的表达变化和潜在作用机制。
有利于我们进一步探索疼痛发生的神经机制,促进镇痛新药的研发。
关键词:伤害性感受神经元,钠通道,钠电流,兴奋性,疼痛前言:背根神经节(DRG)神经元又称作初级感觉神经元,它是外周感觉传入的第一级神经元。
DRG细胞根据细胞直径大小可分为:大(>45um)、中(25-45um)、小(<25um)三类[1]。
生理情况下,小直径神经元发出的无髓鞘C类纤维,以及由中型神经元发出的薄髓鞘A纤维和少数来源于大直径神经元的有髓Aβ纤维,它们可以加工并传递多觉伤害性刺激,遂被定义为“伤害性感受器”。
神经纤维和神经元将外周伤害性刺激传递到脊髓背角进而传入更高级的中枢系统,这一过程主要依赖离子的电活动进行,因此各种离子通道则是产生电活动的物质基础。
由大分子膜蛋白组成含有水分子的孔道即为离子通道,它们镶嵌在脂质双分子层的细胞膜上,发挥着多种多样的生物学功能,其中电压依赖性钠离子通道则是细胞兴奋必不可少的重要元素之一。
钠离子通道通常由分子量260KD的α亚基蛋白以及β亚基蛋白组成,它们广泛的存在于可兴奋性细胞中,通过钠离子内流使细胞发生去极化,介导动作电位的传播,从而在细胞的生理活动中起重要作用[2]。
目前根据氨基酸序列和染色体定位是否具有一致性可以将电压依赖性钠离子通道分为9个亚型:Nav1.1、Nav1.2、Nav1.3、Nav1.4、Nav1.5、Nav1.6、Nav1.7、Nav1.8、Nav1.9,这9种通道被归为同一家族,即Nav1家族。
Nav1家族中存在有三种特殊的通道亚型,Nav1.5、Nav1.8和Nav1.9的第一同源区氨基酸序列发生变化,致使它们对河豚毒素(Tetrotodoxin, TTX)不敏感,所以根据这一特点又将该家族钠通道笼统的分为两类:TTX敏感的钠离子通道以及TTX不敏感的钠离子通道[3]。
钠离子通道在神经系统和心血管系统中的功能

钠离子通道在神经系统和心血管系统中的功能钠离子通道是细胞膜上的重要蛋白质,是神经元和心肌细胞中控制电信号传导的关键分子。
在神经系统和心血管系统中,钠离子通道起着非常重要的功能,它们的开放和关闭状态直接影响神经和心肌细胞的兴奋性和动作电位,从而控制复杂的生理过程。
神经系统中的钠离子通道在神经系统中,钠离子通道主要分布在神经元的轴突初始段和突触前膜上,控制信号传导的初始过程和动作电位的产生和传播。
神经元膜上的钠离子通道有多种类型,可归纳为三大类:快速型通道(Nav1.1-Nav1.7)、慢速型通道(Nav1.8、Nav1.9)和钙依赖性通道(Nav1.4、Nav1.5、Nav1.6)。
快速型钠离子通道是神经元中最常见的类型,分布在轴突初始段和突触前膜上,是控制动作电位迅速产生和传播的关键分子。
它们的开放和关闭速度非常快,可以在微秒级别内完成,从而实现了神经信号在神经元间高速传递。
慢速型钠离子通道则包括Nav1.8和Nav1.9两种类型,分布在感觉神经末梢和自主神经节等部位。
它们的开放和关闭速度比快速型钠离子通道慢得多,同时也具有更低的阈值,可以在低强度刺激下被激活。
这些特性使得慢速型钠离子通道在疼痛感知和心血管调节等领域中有重要作用。
钙依赖性钠离子通道则是一种电压敏感的通道,在细胞膜上需要有足够的高电位才能被激活。
它们主要分布在心肌细胞和横纹肌细胞中,是调控心肌兴奋和收缩的重要分子。
针对这些钙依赖性钠离子通道的药物,比如硫酸奎尼丁,可用于治疗心衰、心律失常等疾病。
心血管系统中的钠离子通道在心血管系统中,钠离子通道也起着重要的功能。
心肌细胞中的钠离子通道控制心脏的兴奋性和节律,从而维持正常的心律和心功能。
此外,血管平滑肌细胞中的钠离子通道也具有重要的调节作用,可实现血管舒张和收缩。
心肌细胞中的钠离子通道主要分布在细胞膜上,参与控制兴奋性和动作电位。
和神经元中的钠离子通道不同的是,心肌细胞中的钠离子通道开放和关闭速度较慢,需要有足够高的电位才能被激活。
A型肉毒毒素调控钠离子通道Nav1.8缓解神经病理性疼痛的作用

A型肉毒毒素调控钠离子通道Nav1.8缓解神经病理性疼痛的作用陈曦;郑淑慧;胡昔权;刘先国【期刊名称】《中山大学学报(医学科学版)》【年(卷),期】2014(035)006【摘要】[目的]研究A型肉毒毒素(BoNT/A)对腰5脊神经前根切断(L5 VRT)介导的神经病理性疼痛的影响,并进一步探讨其可能的内在作用机制.[方法]利用行为学测试方法观察BoNT/A足底注射后对L5 VRT大鼠机械刺激撤足阈值的影响,采用Western blot方法分析BoNT/A对L5 VRT术后背根神经节(DRG)神经元中钠离子通道(Nav1.8)蛋白表达的影响,并进一步应用全细胞膜片钳技术观察BoNT/A对DRG神经元中功能性Nav1.8电流密度的影响.[结果]一侧足底注射7、15 U/kg 的BoNT/A 1 d后可显著缓解L5 VRT介导的机械触诱发痛症状,且作用时间至少持续至给药后14 d;BoNT/A可显著下调L5 VRT术后DRG神经元中Nav1.8蛋白表达水平,并可明显降低功能性Nav1.8电流密度.[结论]BoNT/A可能通过下调DRG神经元中Nav1.8蛋白表达,降低功能性Nav1.8电流,发挥缓解神经病理性疼痛的作用.【总页数】6页(P801-806)【作者】陈曦;郑淑慧;胡昔权;刘先国【作者单位】中山大学附属第三医院康复医学科,广东广州510630,广东广州510080;中山大学附属第一医院转化医学研究中心,广东广州510080;中山大学附属第三医院康复医学科,广东广州510630,广东广州510080;中山大学疼痛研究中心,广东广州510080【正文语种】中文【中图分类】R338.3【相关文献】1.电压门控钠离子通道β3亚基下调缓解神经病理性疼痛 [J], 赵璇;谭弘;李昌林;张璐;王英伟;俞卫锋2.钠离子通道在神经病理性疼痛中的作用研究进展 [J], 寿雯婷;张世红;陈忠3.A型肉毒毒素通过调控大鼠背根神经节神经元中钠离子通道缓解神经病理性疼痛的研究 [J], 陈曦;胡昔权;张丽颖;阚宏俊4.A型肉毒毒素在神经病理性疼痛中的治疗作用及机制的研究进展 [J], 史小娟;初晓;王琳;李铁山5.米贝拉地尔缓解糖尿病周围神经病理性疼痛的作用机制:阻断外周的CaV3.2 T型钙离子通道 [J], 周兆霖因版权原因,仅展示原文概要,查看原文内容请购买。
神经科学热门产品:电压门控钠离子通道抗体
Nav1.9
R
天竺鼠
IHC,WB
(说明:H- Human, M- Mouse, R- Rat)
Anti-NaV1.5 (SCN5A) (493-511) Antibody
Nav1.5
H, M, R
兔
ICC, IHC, IP, WB
ASC-008
Anti-NaV1.7 (SCN9A) Antibody
Nav1.7
H, M, R
兔
ICC, IHC, WB
ASC-016
Anti-NaV1.8 (SCN10A) Antibody
神经科学热门产品:电压门控钠离子通道抗体
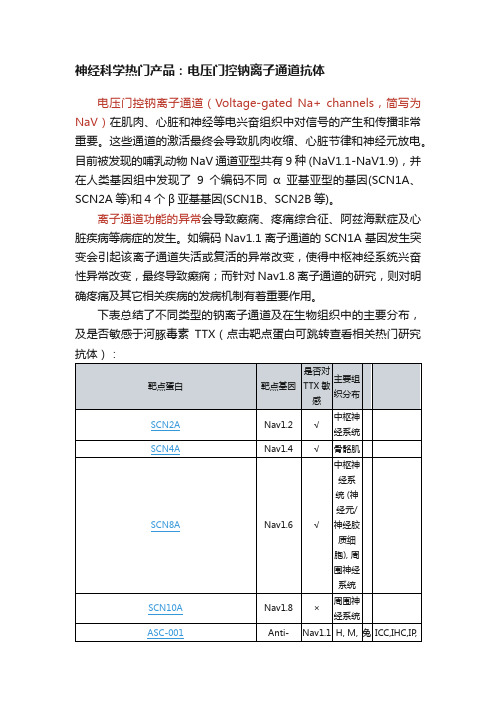
电压门控钠离子通道(Voltage-gated Na+ channels,简写为NaV)在肌肉、心脏和神经等电兴奋组织中对信号的产生和传播非常重要。这些通道的激活最终会导致肌肉收缩、心脏节律和神经元放电。目前被发现的哺乳动物NaV通道亚型共有9种 (NaV1.1-NaV1.9),并在人类基因组中发现了9个编码不同α亚基亚型的基因(SCN1A、SCN2A等)和4个β亚基基因(SCN1B、SCN2B等)。
靶点蛋白
靶点基因
是否对TTX敏感
主要组织分布
SCN2A
Nav1.2
√
中枢神经系统
SCN4A
Nav1.4
√
骨骼肌
SCN8A
Nav1.6
√
中枢神经系统 (神经元/神经胶质细胞), 周围神经系统
SCN10A
Nav1.8
×
周围神经系统
ASC-001
Anti-SCN1A (NaV1.1) Antibody
《2024年Ank-G对缺氧心房肌细胞HL-1的Nav1.5通道调控的研究》范文

《Ank-G对缺氧心房肌细胞HL-1的Nav1.5通道调控的研究》篇一摘要:本文以心房肌细胞中Nav1.5钠离子通道为主要研究对象,探究了Ank-G在缺氧环境下的调控作用。
通过对缺氧HL-1心房肌细胞模型中Ank-G表达水平的检测以及其与Nav1.5通道的相互作用,本研究发现Ank-G可有效调节缺氧时钠离子通道的功能,为进一步理解心房肌细胞在缺氧条件下的电生理反应及治疗心脏疾病提供了理论依据。
一、引言心脏疾病是全球范围内威胁人类健康的主要疾病之一,其中与缺氧相关的疾病如心肌缺血、心律失常等更是心脏疾病中的常见类型。
在心房肌细胞中,Nav1.5钠离子通道起着决定动作电位上升速度和传导速度的关键作用。
然而,在缺氧环境下,Nav1.5通道的功能往往发生异常,这直接影响了心脏的电生理活动。
因此,寻找并研究能够有效调控这一通道的分子机制显得尤为重要。
Ank-G作为一种新近发现的与心脏功能相关的分子,其在缺氧环境下的作用逐渐受到关注。
二、材料与方法本研究采用HL-1心房肌细胞作为实验模型,通过模拟缺氧环境来研究Ank-G对Nav1.5通道的调控作用。
首先构建了缺氧的HL-1细胞模型,并通过基因检测技术分析Ank-G的表达水平。
接着,利用电生理技术记录细胞膜电位变化,以及Western blot 等分子生物学技术手段分析Ank-G与Nav1.5通道的相互作用。
三、实验结果1. Ank-G在缺氧HL-1心房肌细胞中的表达变化通过基因检测技术发现,在缺氧环境下,Ank-G的表达水平显著上升。
这表明Ank-G可能参与了缺氧应激反应的调节过程。
2. Ank-G对Nav1.5通道的影响实验数据显示,Ank-G表达水平升高时,HL-1细胞的膜电位变化受到明显影响,尤其是Nav1.5通道的功能受到影响,表现出明显的钠离子流活动减弱。
这表明Ank-G可能直接或间接地调控了Nav1.5通道的活动。
3. Ank-G与Nav1.5通道的相互作用机制通过分子生物学技术手段分析发现,Ank-G与Nav1.5通道之间存在相互作用关系。
《2024年Ank-G对缺氧心房肌细胞HL-1的Nav1.5通道调控的研究》范文
《Ank-G对缺氧心房肌细胞HL-1的Nav1.5通道调控的研究》篇一一、引言心脏的正常功能依赖于其电信号的精确传导,这一过程主要由离子通道调控。
其中,Nav1.5通道作为心房肌细胞中主要的钠离子通道,在维持心肌细胞的电生理特性中起着至关重要的作用。
然而,在缺氧等病理条件下,心房肌细胞的Nav1.5通道表达和功能会发生变化,这可能导致心律失常等心脏疾病的发生。
因此,研究Nav1.5通道的调控机制,特别是与缺氧条件下心房肌细胞HL-1的相互作用,对于理解心脏疾病的发病机制和寻找治疗方法具有重要意义。
近年来,Ank-G(Ankyrin-G)作为一种与离子通道密切相关的蛋白质,被认为在调节Nav1.5通道的功能中发挥了重要作用。
本文旨在探讨Ank-G对缺氧心房肌细胞HL-1的Nav1.5通道的调控作用及其可能的机制。
二、研究内容(一)实验材料和方法本实验主要采用心房肌细胞HL-1为研究对象,通过缺氧模型模拟病理条件下的心肌细胞环境。
使用分子生物学和电生理学技术手段,探究Ank-G对Nav1.5通道的调控作用。
具体方法包括:细胞培养、RNA和蛋白质表达分析、电生理记录等。
(二)Ank-G与Nav1.5通道的相互作用实验结果显示,Ank-G与Nav1.5通道之间存在相互作用。
在缺氧条件下,Ank-G的表达水平增加,与Nav1.5通道的结合增强。
这表明Ank-G可能通过与Nav1.5通道的相互作用来调节其功能。
(三)Ank-G对Nav1.5通道功能的影响通过电生理学记录分析发现,在缺氧条件下,Ank-G的表达增加导致Nav1.5通道的电流密度增大。
这表明Ank-G能够增强Nav1.5通道的活性,从而影响心房肌细胞的电生理特性。
进一步研究发现,这种增强作用可能与Ank-G对Nav1.5通道的磷酸化水平的影响有关。
(四)Ank-G调控Nav1.5通道的分子机制通过分子生物学技术手段,我们发现Ank-G通过与Nav1.5通道的特定区域结合,影响其磷酸化水平。
钠离子通道研究及其相关疾病治疗
钠离子通道研究及其相关疾病治疗近年来,钠离子通道的研究备受关注,因为它涉及到多种疾病的治疗,如心律失常、癫痫、神经疼痛、多发性硬化等。
本文将从钠离子通道的基础研究、疾病的发生机制以及目前的治疗措施三个方面进行论述。
一、钠离子通道的基础研究钠离子通道是一种跨膜蛋白,它能够在神经元膜上形成电压门控通道,使钠离子通过细胞膜进入细胞内部,产生神经信号。
目前已经发现了数十种钠离子通道,如Nav1.1、Nav1.2、Nav1.3等。
其中,Nav1.7是最为研究的一种钠离子通道,因为它在疼痛感知上起到了关键作用。
研究表明,在慢性疼痛患者中,Nav1.7的基因会发生突变,从而影响了人体自然止痛的能力。
因此,Nav1.7的研究成为了一种新的抗疼痛治疗方向。
二、相关疾病的发生机制1、心律失常心律失常是由于心脏肌肉细胞中的离子通道发生异常而导致的一类疾病。
其中,钠离子通道的异常是导致心律失常的重要原因。
目前,钠离子通道拮抗剂已经成为了心律失常治疗的主要药物。
这些药物通过减慢心肌细胞的兴奋性来调节心率和心律。
2、癫痫癫痫是一种由于脑电活动异常而引起的疾病。
研究表明,Nav1.1、Nav1.2、Nav1.6和Nav1.7在癫痫的病理生理机制中起到了关键作用。
因此,针对这些钠离子通道的药物也成为了治疗癫痫的有效手段。
3、神经疼痛神经疼痛是由于神经系统异常导致的一种疾病,如坐骨神经痛、带状疱疹等。
近年来,Nav1.7的研究表明,它是疼痛感知过程中的一个重要调节因子。
因此,针对Nav1.7的药物已经成为了一种新的抗疼痛治疗方向。
三、目前的治疗措施1、抗心律失常药物目前,抗心律失常药物主要有利多卡因、普罗卡因胺、胺碘酮等。
这些药物能够通过减慢心肌组织的兴奋传导来稳定心律。
然而,由于这些药物存在一定的毒副作用,因此应该在医生的指导下使用。
2、抗癫痫药物抗癫痫药物主要有苯巴比妥、卡马西平、加巴喷丁等。
这些药物能够通过抑制脑电活动来治疗癫痫。
Nav1.8通道抑制毒素与镇痛药物研究进展
Nav1.8通道亚型是一种主要表达于伤害感觉神经元上的海豚毒素 不敏感型钠通道,该通道电流占所在细胞动作电位去极化相电流的绝 大部分。Nav1.8的表达水平与生物物理特性可以通过伤害性感受信号 输入进行调节。如在皮下注射完全氟氏佐剂或角叉采后,大鼠的指状 神经与背根神经节上Nav1.8的表达会增加。局部注射前列腺素,5-羟色胺
Fig. 4. Inflammatory pain behavior in littermate controls (white boxes/bars) and DTA mice (black boxes/bars). (A) FCA; thermal hyperalgesia was measured using the 足底测痛仪Hargreaves A strong difference was observed. (B) FCA; mechanical sensitivity was measured using von Frey filaments. A strong difference was observed.
J Neurobiol. 2004, 61:55–71.
Voltage-Gated Sodium Channels and Pain Pathways.
John N. Wood, James P. Boorman, Kenji Okuse, Mark D. Baker Molecular Nociception Group, Department of Biology, University College, Gower Street, London WC1E 6BT, UK
nav18通道亚型是一种主要表达于伤害感觉神经元上的海豚毒素不敏感型钠通道该通道电流占所在细胞动作电位去极化相电流的绝大部分
离子通道在神经元和心肌细胞中的调制作用及其生理和病理意义
离子通道在神经元和心肌细胞中的调制作用及其生理和病理意义离子通道是控制离子进出细胞膜的蛋白质,是神经元和心肌细胞活动的重要调节因素。
本文将从离子通道在神经元和心肌细胞中的调制作用出发,探讨其在生理和病理情况下的意义。
一、离子通道在神经元中的调制作用神经元中的离子通道种类繁多,包括钙、钾、钠、氯离子通道等。
其中,钠离子通道和钾离子通道对于神经元动作电位(AP)的产生和传导起着决定性作用。
当神经元处于静息状态时,膜电位为-70mV。
当膜电位被刺激,超过阈值电势-55mV时,钠离子通道就开始开放,钠离子从胞外进入神经元内部,使得膜电位快速升高,达到+30mV。
而此时,钾离子通道也开始开放,钾离子从神经元内部流出,使得膜电位逐渐恢复到静息状态。
此时,钾离子通道的关闭会导致短暂的“反射率下降期”(refractory period,RP),使得神经元无法再次产生AP。
而在RP结束后,钾离子通道关闭后又可以重新兴奋。
这一过程称为神经元兴奋-抑制平衡,涉及到神经元内部离子的快速交换和离子通道的快速调节。
此外,在神经元中,还存在其他的离子通道调节机制。
例如某些离子通道可以通过二级信号分子、胞外因子、靶向药物等调节机制来改变通道的灵敏度和状态,从而影响神经元的兴奋和抑制。
二、离子通道在心肌细胞中的调制作用心肌细胞在收缩和舒张过程中需要改变其膜电位和离子通道状态,以便产生有效的心肌收缩力。
其中,钠离子通道对于心肌细胞的兴奋和缩短起着重要作用,而钙离子通道则对心肌细胞的去极化和舒张起着重要调节作用。
当心肌细胞进入兴奋状态时,钠离子通道开始开放,钠离子从胞外进入细胞内部,引起快速膜电位上升,以产生有效的心肌收缩力。
而在收缩过程中,钙离子则通过特定的离子通道进入细胞内部,引起心肌蛋白丝滑动,使得肌肉产生有效的收缩。
此外,钙离子通道在心肌细胞的舒张中也起着重要作用。
在心肌舒张时,钙离子通过电流或钙离子释放通道进入到细胞内部,促进心肌细胞去极化和放松。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
自从1992年编码的“心脏”钠通道Ot一亚基(Na。1.5)的 SCN5A基因被克隆以来,传统的心脏电生理学一直认为,它 掌控着心肌细胞动作电位的0相除极和心肌组织的快速传 导性能…。SCN5A突变所致的通道动力学和蛋白合成转运 等方面的改变可导致峰钠电流(,№,)降低和(或)晚钠电流
(,….)增大,从而诱发心脏钠离子通道病。与SCN5A突变
节。Boogaard等在SCN5A—SCNl0A位点确定了2个增强子,
它们是通过TBX3及其家庭成员和激活物,TBX5调控。研 究还表明,SCNl0A增强子的一个单核苷酸多态性(SNP)可 改变人体心脏传导的模式,破坏与TBX3/TBX5的结合,降低 增强子在体内的心脏活性,并且可能增加心律失常的易感 性¨…。进一步研究确认SCNl0A的一个常见SNP (rs6801957)可与SCN5A的启动子相互作用,在人体心脏中 与SCN5A的表达水平有关。从而认定SCNl0A的常见变异 可以影响心脏电生理,增加心律失常易感性’2“。目前在 Na。1.5和Na。1.8之间所观察到的功能相互作用,可能是在 2个通道间直接存在的,亦或是在一个较大的蛋白质复合物 间间接产生的。 三、SCNl0A常见与少见变异在心脏疾病中的影响 近期大量的GWAS研究支持Na。1.8通过影响人群的 PR问期、QRs时程、心率以及致心律失常的风险,在调节人 体心脏电生理上扮演着非常关键的角色。有几个影响心脏 传导和心率的独立SCNIOA位点已经确定,包括rs6795970 (A1073V)[4-9]、rs6798015(IVS8.186 G>A)㈨…、rs6800541
study,GWAS)意外提示编码Na。1.8(曾命名为
PN3,SNS)钠电流的SCNIOA基因,是心电图上心脏传导参 数(如PR间期,QRS间期等)的重要决定因素之一,其关联 性甚至强于SCN5A。4。1“。后续的研究进一步确认,这个以前 认为主要在神经系统(背根神经节)中分布的钠电流,也存 在于人类心脏,并可能与多种心律失常的发生有关¨“。在 过去的5年,尽管医学界对SCNl0A与心脏的关系进行了大 量的研究,对于它的认识也取得了不小的进步,但是目前对 于SCNl0A和(或)其相关产物是如何影响心肌传导和心律 失常的发生出现了空前的争论,并且迄今为止尚无任何针对 性的药物或治疗措施可以有效纠正SCNl0A异常所致的心 脏事件。本文就目前SCNIOA与心脏的关系予以总结,并对 其中热点问题进行总结讨论。 一、Na。1.8在心脏中的表达分布 哺乳动物的钠通道现已发现9种,分别是Na。1.1一 Navl.9,其中Navl.5、Navl.8和Navl.9同为Tetrodotoxin (1frx)一耐受性电压门控钠通道,其他亚型均为TYX一敏感性。 SCNl0A位于人类染色体3P21-22区域,与SCNSA和 SCNllA毗邻¨3。“j。人类SCNl0A和SCN5A的氨基酸序列 相似度高达70.4%。一直以来,Na。1.8作为经典的外周神
99l・
16.7%,但其中1/4的患者合并其他BrS的基因突变。相较 没有SCNl0A突变的BrS患者而言,阳性突变的携带者的症 状更加明显,心电图检查呈现显著延长的PR和QRS间期。 SCNl0A基因R14L突变或R1268Q突变与SCN5A的野生型 共表达时,Na。1.8与Na。1.5出现了共沉淀现象,并且分别 使钠离子通道电流下降79.4%和84.4%,以及激活、失活和 恢复曲线出现显著偏移。这种改变可以降低心肌的兴奋性, 可导致致心律失常基质的出现。结果说明SCNIOA是BrS 的主要易感基因,其作用可能是通过影响SCN5A而达到。 该研究是自1998年发现第一个BrS易感基因(SCNSA)以 来,第2个具有重大临床和基础研究意义的易感基因,也是 首个针对遗传性心律失常综合征患者,采用GWAS提示的 候选基因进行筛查而发现致病型突变的例子13…。随后的多 个研究组均证实,虽然SCNl0A变异在BrS患者中的阳性率 各不一样,但不可否认的是,其在BrS发病过程中具有重要 作用‘3卜33]。 除此之外,SCNl0A与AF的发生也成为研究热点。有 研究对大样本人群进行调查发现rs6795970与AF及其他心 律失常的发生关系密切‘5。。后续研究表明rs6795970除了 与PR间期有关之外,还可能和AF时心室率的反应性相 关口“。他们的另一项观察在274例早发孤立性AF的患者 中发现了18个突变(17个错义突变和1个移码突变, 6.6%)。将突变转染到ND7/23细胞中后,417delK几乎完 全失能,而A1886V和Y158D—R814H突变的/Na.V和IN.,L都有 显著的增加"5。。丹麦的一个研究组在225例孤立性AF患 者中发现9个罕见错义突变和一个剪接位点突变(4.4%), 相关性研究认定rs6795970的A1073可增加AF易感性。而 功能学研究发现错义突变(V94G和R1588Q)可导致通道失 能,两个常见的SNP(rs6795970的A1073和rsl2632942的 P1092)相反导致通道获能。3“。虽然相关结果与其他报道不 一致,功能学分析也令人费解,但这两个结果至少首次确认 SCNIOA的外显子的突变可以导致AF。丹麦的另一项相关 研究发现,与BrS显著相关的rsl0428132却可能是AF的一 个保护因素¨“。 正常心肌细胞中Na。1.8的表达较少,人们推测在病理 情况下其表达量可能会增加。相关的基因型和临床表型的 分析表明,SCNIOA突变患者出现胸痛症状的比例要明显高 于非SCNl0A突变患者或正常对照,这一点也与假设不谋而 合旧“。结合Na。1.8的表达可能与神经相关因子有关,提示 心脏重构过程中神经纤维的再生和Na。1.8的表达和分别存 在着一定的联系。对犬模型的研究表明A一803467可抑制迷 走神经刺激(VNS)对心脏传导和诱发AF的影响,最有可能 是通过抑制心脏神经节丛(GP)的神经活动的影响旧…。由 此设想,在其他与可以导致心脏电重构和离子通道异常的疾 病,如心力衰竭、心肌梗死和各种类型心肌病等,Na。1.8均 可能参与其中。 总之,SCNl0A对心脏的调节作用是毋庸置疑的,其疾 病谱也与Na。1.5的类似。SCNIOA异常在BrS、AF、传导障
状态下具有较小的,№¨且对A一803467不敏感。与抑制
,….一致的是,A一803467也可抑制小鼠和家兔心室肌细胞中
由ATX一1I诱发的早后除极化(EAD)。其结果表明SCNIOA 表达有助于心肌细胞的,№。形成,并且直接调节心脏电生
DOI:10.3760/cma.j.issn.0253-3758.2016.1 1.020
理。另一方面,Veldkamp及其同事报道称,A一803467能部分 地阻滞心内的神经元,№,,但是对心室肌细胞没有作用。该 药物了通过减少内向钠电流而减缓神经元去极化的发放频 率,但对分离的心肌细胞的动作电位的参数和钠电流密度没 有影响017 3。Liu等的体内电生理研究表明,将A-803467注 人心内脂肪垫处神经节后,以右颈迷走神经刺激,与对照组
相关的疾病主要有进行性心脏传导疾病(cardiac
conduction
disease,CCD)、Brugada综合征(Bmgada syndrome,BrS)、早期 复极综合征(early
repolarization
syndrome,ERS)、窦性心动过
缓、窦房结功能障碍、心房颤动(atrial fibrillation,AF)、长QT 综合征、特发性心室颤动(idiopathic
・990・
虫堡!坚鱼暨痘苤查!!!i生Байду номын сангаас!旦笠竺鲞箜!!塑g!垫』垦!型i!!:盟!!!翌!竺垫!!:!尘:竺盟!:!!
.综述.
神经性钠离子通道Nav 1.8对心脏功能和疾病的影响
胡丹
陈晓梦Hector Barajas Martinez杨韬
经钠通道主要分布于脊髓背根神经节以及c类感觉神经纤 维,参与伤害性感受器反射弧过程,与外周神经炎症及慢性 疼痛有关,其表达水平增加见于神经瘤、鼻炎和牙髓炎等情 况¨。”J。目前人们对Na。1.8(SCNIOA)在心脏的具体分布 还不甚了解¨…。RT—PCR和免疫染色方法检测到,SCNIOA 在小鼠和人类心脏组织中低水平表达,在浦肯野等传导系统 中表达水平略高m’9’“’”o。另有学者在人类心房和心室组织 中发现,Na。1.8主要分布于心脏内神经节和神经元中;而在 心肌纤维中呈现出与连接蛋白或Na。1.5相似的分布,主要 出现在闰盘和缝隙连接处‘1 6’…。对于组织切片进行血管标 志物(内皮型一氧化氮合酶和血管性血友病因子)和Na。1.8 的免疫染色,结果提示感觉神经支配和小的心肌毛细血管之 间有着密切关系Ⅲo。与此同时,也有少数研究表明Na。L
(IVSl5-4440 G>A)[7.11]、rs7430477(IVSl8-446G>A)[7 2和
rsl2632942(L1092P)‘61等。其中rs6795970和rsl2632942无 疑是影响最显著和最令人瞩目的。在对肥厚性心肌病研究 中发现,rs6795970与传导异常的关系,发现携带有A等位基 因的肥厚性心肌病患者发生传导异常比例显著增高Ⅲ。。对 唐氏综合征老鼠模型的分析表明,SCNl0A水平在心房和心 室的显著降低可能是此类患者出现心脏传导障碍的原因之 一"“。Na。1.8的一个亚效等位基因突变的小鼠 (Na。1.8“…)的心电图表现与正常小鼠类似,但是在抓颈 时则出现了与血压无关的心动过缓和显著的心率变异。抗 胆碱能药物阿托品可预防这种现象的发生,提示SCNIOA突 变可能引起迷走神经张力过高而导致心动过缓‘2…。 一个GWAS研究对312例BrS患者和l 115名健康对照 者进行了分析,发现在SCNIOA基因的rsl0428132和
ventricular fibrillation,
IVF)、扩张性心肌病以及急性心肌梗死后的电风暴等,而这 些疾病具有极高心脏性猝死的风险旧…。 自2010年起,多个全基因组关联研究(genome—wide
association
不存在或极少量表达于心肌细胞本身Ⅲo。最近的一项研究 利用30 d左右的人胚胎干细胞分化的心肌细胞,发现确有 Na。1.8蛋白的表达,且SCNIOA转录水平为SCN5A的一半 左右[21]。 二、Na。1.8对心脏电生理的调节功能及相关机制 体外研究Na。1.8电流的特性显示,其激活较Na。1.5 慢,且其失活特性也较Na。1.5慢,窗口钠电流较Na。1.5更 大。因此该特性可能导致了不同细胞之间去极化速度的差 异,由此影响了心肌电信号的传导。目前,在小鼠的体内和 体外电生理研究中也存在相互冲突的结论。A一803467 (c。。H,。CLNO。)是Na。1.8的高度选择性抑制剂,为呋喃类 似物,其在缓解炎性、神经性和机械性疼痛方面具有明显的 功效’22|。有报道显示使用A.803467可显著延长小鼠心脏 的PR、QRS和HV间期旧o;而涉及SCNl0A敲除 (SCNIOA。一)的小鼠研究报道,基因敲除组的PR间期反而 比正常的wT组要短一1。Yang等¨副报道称,在小鼠和家兔 的心肌细胞中低浓度的A一803467可选择性阻断ll、a并缩短 动作电位;而 A0lNCSL,出示显中胞细肌心的鼠小一。 在基础
