铁和铝典型例题答案
高一化学钠铁铝经典题目(含答案)
1:在50mL b mol·L-1的AlCl 3溶液中加入50mL a mol·L -1的NaOH 溶液。
〔1〕当a≤3b 时,生成Al(OH)3沉淀的物质的量为____。
〔2〕当a 、b 满足_____条件时,无沉淀生成。
〔3〕当a 、b 满足_____条件时,现有沉淀生成,后又有部分沉淀溶解,此时Al(OH)3沉淀的质量为_______g 。
2 将amol 明矾溶于水中,逐滴滴入Ba(OH)2溶液 〔1〕写出明矾溶于水的电离方程式。
〔2〕当Al 3+完全沉淀时沉淀的物质的量是 mol ,质量是 g ,消耗Ba(OH)2的物质的量是 mol 。
〔3〕当SO 42-完全沉淀时沉淀的物质的量是 mol ,质量是 g ,消耗Ba(OH)2的物质的量 是 mol 。
(4)通过比较分析何时生成沉淀的物质的量最大?何时生成沉淀的质量最大?3向明矾溶液中逐渐加氢氧化钡溶液至过量,横坐标为所加氢氧化钡物质的量,纵坐标为沉淀量画图。
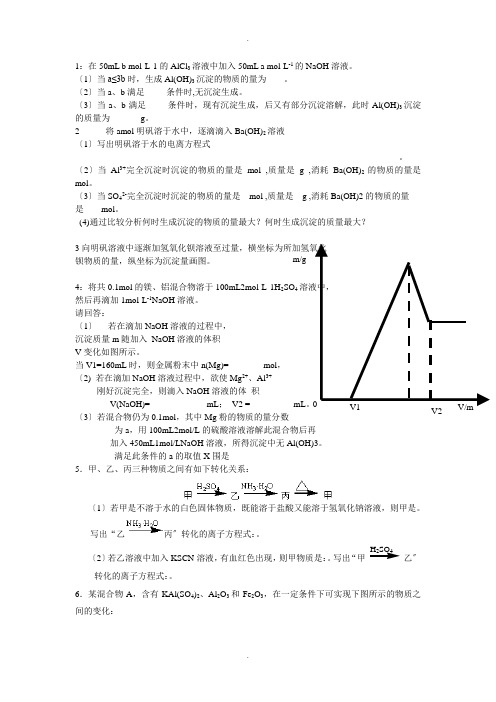
4:将共0.1mol 的镁、铝混合物溶于100mL2mol·L-1H 2SO 4溶液中, 然后再滴加1mol·L -1NaOH 溶液。
请回答:〔1〕 若在滴加NaOH 溶液的过程中, 沉淀质量m 随加入 NaOH 溶液的体积 V 变化如图所示。
当V1=160mL 时,则金属粉末中n(Mg)= mol , 〔2) 若在滴加NaOH 溶液过程中,欲使Mg 2+、Al 3+ 刚好沉淀完全,则滴入NaOH 溶液的体 积V(NaOH)= mL ; V2 = mL 〔3〕若混合物仍为0.1mol ,其中Mg 粉的物质的量分数为a ,用100mL2mol/L 的硫酸溶液溶解此混合物后再 加入450mL1mol/LNaOH 溶液,所得沉淀中无Al(OH)3。
满足此条件的a 的取值X 围是 ____________ 5.甲、乙、丙三种物质之间有如下转化关系:〔1〕若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是。
2024年钢轨铝热焊技术知识考试题库及答案(含各题型)

2024年钢轨铝热焊技术知识考试题库及答案(含各题型)一、单选题1.所有焊接材料均应存放在有屋顶的库房内,库房应保持通风良好,环境干燥。
离四周墙面的距离不小于()cm。
A、5B、10C、15D、20标准答案:B2.()是机件在受到变动载荷作用下经过较长时间工作发生的断裂现象。
A、脆性断裂B、疲劳断裂C、热裂纹D、冷裂纹标准答案:B3.作为铝热焊剂的主要成分之一的铝粉易受潮氧化,变质后呈()色并无光泽。
A、白B、黄D、黑标准答案:D4.铝热焊预热结束时,钢轨端部各部位温度约为(),端面为亮黄色。
A、800-900°B、950-1000C、950-1000°D、1050-1300°标准答案:B5.增加焊缝中碳的含量,以下说法不正确的是()。
A、提高焊缝的抗张强度B、提高焊缝的硬度C、提高钢的韧性指标D、钢的可焊性降低标准答案:C6.()的设计,直接影响到焊缝的质量和缺陷的形成。
A、化学热效应B、预热方式C、浇注系统D、金属相变标准答案:C7.马氏体是高温奥氏体快速冷却,在抑制其()条件下形成的。
B、相变C、凝固分解D、扩散性分解标准答案:B8.精磨机的磨削部分所采用的材料是()。
A、碳钢B、合金C、高强砂轮D、普通砂轮标准答案:C9.点燃后高温火柴插入焊剂()mm。
A、15B、20C、25D、30标准答案:C10.焊接后的钢轨接头组织不允许出现()组织。
A、铁素体B、渗碳体C、珠光体D、马氏体标准答案:D11.铝热焊中,在焊缝内的疏松,则容易在()产生A、轨腰B、轨头C、轨底中央部分D、轨角标准答案:C12.热处理工艺一般包括加热,()和保温三个过程。
A、冷却B、退火C、正火D、淬火标准答案:A13.焊接焊缝的化学成分决定于()A、浇注系统B、焊剂成分配比C、预热方式D、受力方向标准答案:B14.一般情况下氧气瓶是一种钢制圆柱形()容器。
A、低压B、中压C、高压D、超高压标准答案:C15.铝热焊中点燃并调节火焰时,火焰的颜色是()。
苏教版必修一铝铁铜练习及答案

页眉内容练习卷一(铝铁铜)学校:姓名:班级:第I 卷(选择题)、单选题:共15题每题3分共45分1.向H2SO4、CuCl2 混合溶液中投入足量的铁粉,经充分反应后,过滤、洗涤、干燥、称重,知所得固体的质量与加入的铁粉的质量相等,则原溶液中c()与c(Cl ﹣)之比()2.下列各组物质反应后,滴入A.过量的铁与稀盐酸反应KSCN溶液,显红色的是( )B.过量的铁粉与氯化铜溶液反应C.过量氯水与氯化亚铁溶液反应D.过量铁粉与三氯化铁溶液反应3.下列常见金属的冶炼原理中不合理的是( )金属冶炼原理A Fe Fe2O3 +3CO 2Fe+3CO2B Hg 2HgO 2Hg+O2↑C Mg 2MgO熔( 融) 2Mg+O2↑D Na 2NaCl(熔融) 2Na+Cl2↑A.1:2B.1:7C.7:1D.1:144.(2013·山东师大附中期中考试)下列图象中, 纵坐标为产生沉淀物的物质的量, 横坐标为向某溶液中加入反应物的物质的量, 则相应的图象序号与(1)~(4) 对应的顺序正确的为( )页眉内容5.如图所示为AlCl 3 溶液与NaOH溶液相互滴加的过程中某些物质的物质的量的变化, 则下列说法中错误的是( )A.①线表示Al 3+的物质的量的变化B.x 表示AlCl 3的物质的量C.②③线表示Al(OH) 3的物质的量的变化D.④线表示Al 的物质的量的变6.将一定量的金属钠投入下列溶液中,充分反应后,最终不可能有沉淀的是( )A.硫酸铜溶液B.盐酸C.氯化铁溶液D.氯化铝溶液7.将表面已完全氧化的铝条,插入下列溶液中,不会发生反应的是( )A. 稀硝酸B. 稀盐酸C. 硝酸铜D. 氢氧化钠8.有两种金属组成的混合物粉末13 g 与足量的稀盐酸反应,生成11.2 L( 标准状况下)H2,则该混合物的组成不可能是( )A.Fe、ZnB.Al 、CuC.Al 、FeD.Cu、Mg9.工业上用铝土矿(主要成分为Al2O3 ? xH2O、Fe2O3、SiO2 等)提取纯Al 2O3作冶炼铝的原料,提取时操作过程如图,指出图中操作错误的是( )A. ④⑤B.③④C.②⑤D.①②10.小明家收藏了一张清末的铝制佛像,至今保存完好。
江苏省常州高级中学高中化学必修一第三章《铁金属材料》经典题(含答案解析)

一、选择题1.铝具有较强的抗腐蚀性能,主要是因为A .与氧气在加热时才反应B .铝性质不活泼,不与任何物质反应C .铝表面能形成一层氧化膜,氧化膜对其起保护作用D .铝和酸不反应2.在给定条件下,下列选项所示的物质间转化均能实现的是A .MnO 2−−−−−→稀盐酸ΔCl 2−−−−−→2H 点燃HCl B .Fe 2Cl 点燃−−−→FeCl 2()NaOH aq →Fe(OH)2C .Na 2O点燃−−−→Na 2O 2H O −−−→NaOH D .饱和NaCl(aq)−−−−−−−−−→先通氨气再通二氧化碳NaHCO 3(s)Δ−−→Na 2CO 33.能正确表示下列反应的离子方程式为A .碳酸氢钠溶液中滴入氢氧化钙溶液:HCO 3-+OH ﹣=CO 23-+H 2OB .用醋酸除去水垢:2H ++CaCO 3=Ca 2++CO 2↑+H 2OC .硫化钡加入稀硫酸:BaS+2H +=H 2S↑+Ba 2+D .新制的氧化铝可溶于氢氧化钠溶液:Al 2O 3+2OH ﹣=2AlO 2-+H 2O4.下列实验现象描述错误的是A .AB .BC .CD .D 5.只用下列试剂中的一种,就能将FeCl 3、AlCl 3和NaCl 三种溶液区别开的是 A .KSCN 溶液B .BaCl 2溶液C .NaOH 溶液D .AgNO 3溶液 6.下列溶液中,能使铁粉溶解,但不会产生沉淀和气体的是A .稀H 2SO 4B .CuSO 4溶液C .Fe 2(SO 4)3D .FeCl 27.将0.01molNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。
下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是A.B.C.D.8.等物质的量的铁和铜的混合物24 g与600 mL稀硝酸恰好完全反应,生成NO6.72 L(标准状况)。
向反应后的溶液中加入1 mol/LNaOH溶液使金属离子怡好沉淀。
人教版高中化学必修第一册-3.2.1 铁合金、铝和铝合金练习【含解析】

人教版高中化学必修第一册-3.2.1 铁合金、铝和铝合金练习(原卷版)1.对于铝和烧碱溶液的反应,下列说法不正确的是()A.铝是还原剂B.该反应是氧化还原反应C.该反应说明所有金属都能与碱反应D.H2为还原产物2.下列反应的离子方程式书写正确的是()A.钠和冷水反应:Na+2H2O===Na++2OH-+H2↑B.金属铝溶于氢氧化钠溶液:Al+2OH-===AlO-2+H2↑C.金属铝溶于盐酸中:2Al+6H+===2Al3++3H2↑D.铁跟稀硫酸反应:Fe+2H+===Fe3++H2↑3.在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体6.72 L,生成物NaAlO2的物质的量浓度为(假定反应前后,溶液体积不变)()A.1 mol·L-1B.0.4 mol·L-1C.1.5 mol·L-1D.2 mol·L-14.将某铁铝合金样品等分成两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积之比为3∶2 ,则样品中铁、铝的物质的量之比为()A.3∶2 B.2∶1C.3∶4 D.4∶35.Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48 L。
下列推断中不正确的是() A.参加反应的Mg、Al共0.2 molB.参加反应的HCl为0.4 molC.Mg、Al在反应中共失去0.4 mol电子D.若与足量的稀硫酸反应能产生0.2 mol H26.下列说法正确的是()A.Al2O3难溶于水不跟水反应,所以Al2O3不是Al(OH)3对应的氧化物B.因为Al2O3是金属氧化物,所以它是碱性氧化物C.Al2O3属于两性氧化物D.Al2O3能与所有的酸、碱溶液反应7.下列物质不属于合金的是()A.不锈钢B.高碳钢C.金刚石D.白铜8.某合金与铁物理性质的比较如下表所示:还知该合金耐腐蚀、强度大。
从以上性能看,该合金不适合用作()A.导线B.门窗框C.炉具D.飞机外壳9.工业生产中常将两种或多种金属(或金属与非金属)在同一容器中加热使其熔合,冷凝后得到具有金属特性的熔合物——合金。
高中二年级[铁、铝]练习卷和答案解析
![高中二年级[铁、铝]练习卷和答案解析](https://img.taocdn.com/s3/m/b201e23b79563c1ec5da71ee.png)
高二化学测验卷(铁、铝)班级姓名得分相对原子质量:O-16,Fe-56,Ca-40,C-12,Al-27,Mg-24一、选择题1.下列叙述与金属的物理性质无关的是()A.良好的导电性B.反应中易失电子C.延展性D.导热性2.利用铝合金代替铝制钥匙是利用铝合金的()A.熔点低 B.不易锈蚀C.硬度大 D.密度小3.下列关于Al(OH)3的性质叙述中错误的是()A. Al(OH)3与过量的浓氨水反应生成NH4AlO2B. Al(OH)3是难溶于水的白色胶状物质C. Al(OH)3能凝聚水中的悬浮物,还能吸附色素D. Al(OH)3受热能分解4.常温下,下列物质中能用铁罐储存的是()①稀HNO3②浓H2SO4③浓盐酸④浓HNO3A.②③④B.①④ C.②③D.②④5.下列叙述中,正确的是()A.带有氧化膜的铝片不能跟热水反应,也不跟酸反应B.硬铝的强度比纯铝的大C.合金是两种金属的熔合物,具有原成分金属的性质D.铝粉和金属氧化物的混合物叫铝热剂6.地壳中含量最多的金属元素和非金属元素形成的化合物是()A.Fe2O3 B.SiO2 C.CuO D.Al2O37.下列物质不能通过化合反应制得的是()A.FeCl2B.Fe(OH)3 C.FeS D.CuS8.鉴别Fe2+和Fe3+可用下列试剂中的()①NaOH溶液②稀H2SO4③KSCN溶液④H2S溶液⑤NH3·H2OA.①②③B.①③④⑤C.③④⑤D.②③④9.称取两份铝粉,第一份加入足量的NaOH溶液,第二份加入足量的盐酸,若放出的氢气的体积相等(同温同压)。
则两份铝粉的质量比为: ( )A. 1:2 B.1:3 C.3:2 D.1:110.两种金属混合粉末15g,与足量的盐酸反应时,生成11.2L H2(标况),符合上述情况的金属混合物 ( )A.Fe和Cu B. Mg和Al C.Al和Zn D.Fe和Zn11.某500mL溶液中含0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol 铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)A.0.4 mol·L-1 B.0.6 mol·L-1C.0.8 mol·L-1 D.1.0 mol·L-11、12.苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。
铁和铝典型例题答案
【典型例题】类型一:铝与NaOH溶液的反应例题1 甲、乙两烧杯中各盛有100 mL 3 mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为1∶2,则加入铝粉的质量为()A.5.4 g B.3.6 g C.2.7 g D.1.8 g【答案】A【解析】2Al+6HCl=2AlCl3+3H2↑2Al+2NaOH+2H2O=2NaAlO2+3H2↑由反应方程式可知,若在等物质的量浓度的盐酸和NaOH溶液中分别加入足量铝,反应时产生H2的体积之比1∶3,现在产生H2的体积之比为1∶2,说明铝粉的量相对于盐酸来说是过量的,对于NaOH来说是不足量的,所以与盐酸反应的铝粉质量为2.7 g,与NaOH反应的铝粉质量为5.4 g。
【总结升华】因为铝与NaOH溶液反应是一个较为特殊的反应,所以当铝与NaOH溶液在同一题目中出现时,往往要用到2Al+2NaOH+2H2O=2NaAlO2+3H2↑这一关系来解。
举一反三:【变式1】取两份等质量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同情况下产生的气体体积之比是()A.1∶1 B.1∶2 C.1∶3 D.3∶2【答案】A【变式2】下列关于金属元素特征的叙述正确的是()(1)金属元素的原子只有还原性,离子只有氧化性;(2)金属元素在化合物中只显正价;(3)金属性越强的元素相应的离子氧化性越弱;(4)价电子越多的金属原子金属性越强;(5)离子化合物一定含金属元素A、(1)(2)(3)B、(2)(3)C、(1)(4)(5)D、全部【答案】B【解析】(1)对于变价金属中,较低价态的金属离子既有氧化性,又有还原性,如Fe2+。
(2)金属元素的原子只具有还原性,故在化合物中只显正价。
(4)金属性的强弱要看失电子的难易。
(5)离子化合物不一定含金属元素,如NH4Cl。
类型二:Al2O3、Al(OH)3的性质与制法例题2 既能与盐酸反应又能与氢氧化钠溶液反应的化合物是()①Al ②NaHCO3③Al2O3④Mg(OH)2⑤Al(OH)3A.①②③⑤ B.①④⑤ C.②③⑤ D.①③④【答案】C【解析】注意审题,题目要求是“化合物”,防止错选A。
高考化学复习《一轮复习备考:第五单元铝、铁及其化合物答案
高中化学学习材料(灿若寒星**整理制作)第五单元铝、铁及其化合物可能用到的相对原子质量:H1C12N14O16Na23Mg24Cl35.5Ca40Fe56第Ⅰ卷(选择题共45分)一、选择题(本题包括15小题,每小题3分,共45分。
每小题只有一个选项符合题意)1.解析:铝易进入食品、饭、水等,并被人体吸收,所以要加以控制。
答案:A2.解析:钢是对含碳量(质量百分比)介于0.02%至2.04%之间的铁合金的统称。
答案:A3.解析:食盐中添加碘酸钾,是因为碘酸钾能溶于水且其中含有人体所需的碘元素。
答案:C4.解析:N在酸性条件下有强氧化性,能将Fe2+转化为Fe3+。
答案:C5.解析:Al2O3、Fe、Fe(OH)2分别与NaOH溶液、O2、O2和H2O反应生成NaAlO2、Fe3O4、Fe(OH)3,故A项符合题意。
答案:A6.解析:镁的金属性强于铝,铝与水反应很困难,镁能与沸水反应。
答案:B7.解析:金属性是指元素的原子失电子的能力,非金属性是指元素的原子得电子的能力。
铝不论是与酸反应还是与碱反应,都是失去3e-,化合价升高为+3价,均是作为还原剂,因而铝具有较强的金属性,D项错误。
答案:D8.解析:铝能溶于稀HNO3,在浓HNO3中会钝化,A项错误;浓氨水会挥发出NH3,NH3与AlCl3溶液反应生成Al(OH)3白色沉淀,B项正确;Al2O3+2OH-2Al+H2O,Al+CO2+2H2O Al(OH)3↓+HC,C项正确;根据Al3++3OH-Al(OH)3↓、Al3++4OH-Al+2H2O。
①<3时,铝的存在形式为Al(OH)3、Al3+;②3<<4时,铝的存在形式为Al(OH)3、Al;③>4时,铝的存在形式为Al,D项正确。
答案:A9.解析:磁性氧化铁中Fe元素的化合价为+2、+3价,溶于盐酸后生成Fe2+和Fe3+,B项错误;C项中电荷不守恒,C项错误;铁与稀硫酸反应生成二价亚铁离子,D项错误。
金属材料练习题及答案
金属材料练习题及答案【典型例题】类型一:合金的概念及其性质例1 制取合金常用的方法是将两种或两种以上的金属(或金属与非金属)加热到某一温度。
使其全部熔化,再冷却成为合金。
根据表中数据判断(其他条件均满足),下列合金不宜采用这种方法制取的是()。
A.Fe—Al合金B.Na—Al合金C.Mg—Fe合金D.Mg—Al合金【答案】C【解析】由题意知,C项的合金不宜采用题给方法制取,原因是镁的沸点(1090℃)比铁的熔点(1535℃)低,当温度升高到大于1090℃而小于1535℃时,镁已经变成气体逸散,而铁还没有熔化。
【总结升华】涉及合金的知识还可以有合金的概念、常见合金的种类、熔点比较、硬度比较。
举一反三:【变式1】合金有许多特点,如Na—K合金为液体,而Na和K的单质均为固体。
据此试推测生铁、纯铁、碳三种物质中,熔点最低的是()。
A.纯铁B.生铁C.碳D.无法确定【答案】B【变式2】有关合金的性质叙述不正确的是A、合金的熔点比它的各成分的熔点低B、合金一定是金属熔合而成C、合金的硬度和强度一般比纯金属高D、硬铝、黄铜、钢均为合金【答案】B类型二:关于铁合金例2 取3.00 g某钢样粉末放在O2气流中充分灼烧后,将得到的气体通到足量含140Ba(OH)2的溶液中,得到了0.50 g沉淀。
(1)写出下列反应的化学方程式。
①Fe和O2点燃:________________;②产生的气体通入140Ba(OH)2溶液:________________。
(2)钢样中碳的质量分数是________。
【答案】(1)①3Fe+2O2Fe3O4②CO2+140Ba(OH)2==140BaCO3↓+H2O (2)1.0%【解析】钢是除去S、P等杂质后的Fe—C合金,所以将钢样粉末放在O2气流中灼烧时,Fe、C分别与O2反应生成Fe3O4和CO2。
CO2通入140Ba(OH)2溶液中得到140BaCO3沉淀,根据40BaCO3的质量求出n (CO2),利用原子守恒,钢样中n (C)=n (CO2),从而求出碳的质量分数。
安徽池州市高中化学必修一第三章《铁金属材料》经典题(含答案解析)
一、选择题1.向相同体积、相同浓度的盐酸和氢氧化钠溶液中分别放入足量铝粉,放出的氢气在同温同压下的体积比为 A .1:3 B .1:6C .1:1D .3:2答案:A 【详解】由2Al+6HCl=2AlCl 3+3H 2↑、2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑可知,参加反应的铝、酸碱与生成的氢气的物质的量关系为:2Al ~6HCl ~3H 2,2Al ~2NaOH ~3H 2,根据n=cV 可知,盐酸和氢氧化钠溶液物质的量之比为1:1,则体积和物质的量浓度都相等的盐酸和氢氧化钠溶液中投入足量的铝粉,放出的氢气物质的量之比是=1:3,A 项正确; 答案选A 。
2.在给定条件下,下列选项所示的物质间转化均能实现的是A .MnO 2−−−−−→稀盐酸ΔCl 2−−−−−→2H点燃HCl B .Fe 2Cl点燃−−−→FeCl 2()NaOH aq →Fe(OH)2C .Na 2O点燃−−−→Na 2O 2H O −−−→NaOH D .饱和NaCl(aq)−−−−−−−−−→先通氨气再通二氧化碳NaHCO 3(s)Δ−−→Na 2CO 3答案:D 【详解】A .二氧化锰与稀盐酸不反应,不能实现转化,故A 错误;B .氯气具有强氧化性,铁与氯气反应生成三氯化铁,而不是氯化亚铁, 故B 错误;C .钠在空气中燃烧生成22Na O ,钠与氧气在常温下生成氧化钠,故C 错误;D .氯化钠溶液中通入氨气、二氧化碳气体生成碳酸氢钠沉淀和氯化铵,碳酸氢钠加热分解为碳酸钠,故D 正确; 选D 。
3.某反应过程中存在2Fe +、3NO -、3Fe +、4NH +、H +和2H O 六种粒子,测得3Fe +、3NO -的质量分数(w)随时间变化的曲线如图所示,下列判断错误的是A .3NO -被还原,发生还原反应 B .还原性:2++4Fe >NHC .2Fe +被氧化为3Fe +D .还原剂与氧化剂的物质的量之比为1:8答案:D 【详解】A .根据图像得出NO 3-、H +、Fe 2+反应,反应中NO 3-所含氮元素化合价降低,被还原,发生还原反应,故A 正确;B .根据题意说明NO 3-、H +、Fe 2+反应生成Fe 3+、NH 4+和H 2O ,根据还原剂的还原性大于还原产物的还原性,得到还原性:Fe 2+>NH 4+,故B 正确;C .该反应中Fe 2+化合价升高,失去电子, Fe 2+被氧化为Fe 3+,故C 正确;D .NO 3-、H +、Fe 2+反应生成Fe 3+、NH 4+和H 2O ,还原剂是Fe 2+,化合价升高1,氧化剂是NO 3-,氮元素化合价降低8,根据化合价升降守恒,因此在反应中参加反应的还原剂与氧化剂的物质的量之比为8:1,故D 错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【典型例题】类型一:铝与NaOH溶液的反应例题1 甲、乙两烧杯中各盛有100 mL 3 mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为1∶2,则加入铝粉的质量为()A.5.4 g B.3.6 g C.2.7 g D.1.8 g【答案】A【解析】2Al+6HCl=2AlCl3+3H2↑2Al+2NaOH+2H2O=2NaAlO2+3H2↑由反应方程式可知,若在等物质的量浓度的盐酸和NaOH溶液中分别加入足量铝,反应时产生H2的体积之比1∶3,现在产生H2的体积之比为1∶2,说明铝粉的量相对于盐酸来说是过量的,对于NaOH来说是不足量的,所以与盐酸反应的铝粉质量为2.7 g,与NaOH反应的铝粉质量为5.4 g。
【总结升华】因为铝与NaOH溶液反应是一个较为特殊的反应,所以当铝与NaOH溶液在同一题目中出现时,往往要用到2Al+2NaOH+2H2O=2NaAlO2+3H2↑这一关系来解。
举一反三:【变式1】取两份等质量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同情况下产生的气体体积之比是()A.1∶1 B.1∶2 C.1∶3 D.3∶2【答案】A【变式2】下列关于金属元素特征的叙述正确的是()(1)金属元素的原子只有还原性,离子只有氧化性;(2)金属元素在化合物中只显正价;(3)金属性越强的元素相应的离子氧化性越弱;(4)价电子越多的金属原子金属性越强;(5)离子化合物一定含金属元素A、(1)(2)(3)B、(2)(3)C、(1)(4)(5)D、全部【答案】B【解析】(1)对于变价金属中,较低价态的金属离子既有氧化性,又有还原性,如Fe2+。
(2)金属元素的原子只具有还原性,故在化合物中只显正价。
(4)金属性的强弱要看失电子的难易。
(5)离子化合物不一定含金属元素,如NH4Cl。
类型二:Al2O3、Al(OH)3的性质与制法例题2 既能与盐酸反应又能与氢氧化钠溶液反应的化合物是()①Al ②NaHCO3③Al2O3④Mg(OH)2⑤Al(OH)3A.①②③⑤B.①④⑤C.②③⑤D.①③④【答案】C【解析】注意审题,题目要求是“化合物”,防止错选A。
特别提示:两性物质是指既能与酸反应又能与碱反应生成盐和水的化合物。
两性氧化物有Al2O3、ZnO等,两性氢氧化物有Al(OH)3、Zn(OH)2等。
定义中的酸指非氧化性强酸溶液,碱指强碱溶液,其实质是与H+和OH―反应。
弱酸的铵盐[如(NH4)2CO3、(NH4)2S等]、弱酸的酸式盐(如NaHCO3)均既能与强酸(H+)反应又能与强碱(OH―)反应,但它们不属于两性物质。
举一反三:【变式1】氧化铝熔点很高,常用于制造耐火材料,例如制作坩埚,下列操作不能在氧化铝坩埚中进行的是()A.加热使CuSO4·5H2O失水B.加热使KMnO4分解C.加热熔化烧碱D.加热分解碱式碳酸铜【答案】C类型三:“铝三角”及其转化例题3 向50 mL 1 mol·L ―1的Al 2(SO 4)3溶液中加入100 mL KOH 溶液,充分反应后得到3.9 g 沉淀,则KOH 溶液的物质的量浓度可能是( )A .1 mol·L ―1B .3 mol·L ―1C .1.5 mol·L ―1D .3.5 mol·L ―1【答案】C 、D【解析】方法一:根据Al 3+的物质的量与沉淀Al(OH)3的物质的量比较可推测KOH 溶液的两种情况:(1)当加入KOH 不足量时, 313.9g (KOH)3[Al(OH)]30.15mol 78g mol n n -==⨯=⋅, 故10.15mol (KOH) 1.5mol L 0.1Lc -==⋅。
(2)当加入KOH 过量时,n (KOH)=4n (Al 3+)―n [Al(OH)3]=0.4 mol―0.05 mol=0.35 mol 。
故10.35mol (KOH) 3.5mol L 0.1Lc -==⋅。
方法二:用图像法求解,如图所示,用纵坐标表示生成的Al(OH)3的物质的量,横坐标表示KOH 的物质的量。
当生成沉淀0.05 mol 时,需KOH 的物质的量为0.15 mol 或0.35 mol 。
【总结升华】本题易漏选答案D ,原因是未考虑到3.9 g 沉淀可以是Al(OH)3被过量的KOH 溶液溶解了一部分而剩余部分沉淀的情况。
举一反三:【变式1】等体积的AlCl 3和NaOH 溶液混合后,沉淀物中含铝的质量与溶液中含铝的质量相等,则AlCl 3和NaOH 两种溶液的物质的量浓度之比为( )A 、1∶3B 、2∶3C 、1∶4D 、2∶7【答案】B 、D【解析】AlCl 3和NaOH 溶液混和有沉淀物生成,可能有两种情况:①NaOH 不足量,②NaOH 部分过量。
假设溶液中含有2mol 的AlCl 3,如果为第一种情况生成Al(OH)3沉淀的物质的量与未反应的AlCl 3物质的量相等,所以耗NaOH 3mol 。
则答案为B 。
如果为第二种情况,则生成1mol 的Al(OH)3,1mol 的AlO 2-,共消耗NaOH 为7mol 。
所以答案为D 。
【变式2】向50mL1mol/L 的AlCl 3溶液中加入0.2mol/L 的NaOH 溶液,生成沉淀1.56g ,需NaOH 溶液多少mL?【解析】⑴当NaOH 不足时:3NaOH ——Al(OH)33 78x 1.56解得 x=0.06mol∴V(NaOH)= =0.3L=300mL⑵当NaOH 过量时:Al 3+——3NaOH ——Al(OH)31mol 3mol 78g0.05mol y x解得 x=3.9g y=0.15mol Al(OH)3——NaOH78g 1mol(3.9-1.56)g z解得z=0.03mol∴n(NaOH)=0.15+0.03 =0.18(mol)V(NaOH)= =0.9L=900mL另解:∵ n[Al(OH)3]=4n(Al3+) – n(OH-)n[Al(OH)3]=1.56/78 = 0.02(mol)∴ 0.02 = 4×0.05 - n(OH-)n(OH-) = 0.18molV(NaOH)=0.18/0.2 =0.9L=900mL类型四:与Al(OH)3、Al3+、AlO2―有关的图像例题4 把x溶液(或气体)慢慢加入(或通入)到一定量的y溶液中,产生的沉淀量与加入x物质的量的关系如图所示,符合图中曲线的是()A、x为CO2,y为Ca(OH)2B、x为NH3·H2O,y为AlCl3C、x为NaOH,y为AlCl3D、x为HCl,y为NaAlO2【答案】D【解析】CO2通入Ca(OH)2溶液中可产生碳酸钙沉淀,继续通CO2沉淀溶解而生成Ca(HCO3)2溶液。
氨水加入AlCl3溶液产生沉淀,但过量不溶,方程式为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+NaOH溶液滴加到AlCl3溶液中生成Al(OH)3沉淀,继续加入沉淀溶解生成偏铝酸盐。
AlCl3+3NaOH=Al(OH)3↓+3NaCl Al(OH)3+NaOH=NaAlO2+2H2O盐酸加入到NaAlO2溶液中,先生成Al(OH)3沉淀,继续加入沉淀溶解生成三价铝盐。
HCl+NaAlO2+H2O=Al(OH)3↓+NaCl Al(OH)3+3HCl=AlCl3+3H2O从观察方程式的系数,定量角度分析。
举一反三:【变式1】有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种。
现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。
加入Na2O2的量与生成白色沉淀的量之间的关系用下图来表示。
试推断:(1)原溶液中一定含有________。
(2)一定不含有________。
(3)可能含有________。
(4)为了进一步确定可能含有的离子,应增加的实验操作为________。
【答案】(1)Al3+和Mg2+(2)Fe3+、NH4+、Cu2+(3)K+(4)焰色反应【解析】向溶液里加入过氧化钠粉末,会发生Na2O2和H2O的反应,生成NaOH和O2。
因题目中没有刺激性气味气体产生,说明原溶液中不含有Fe3+和NH4+。
又因生成的沉淀是白色的,所以原溶液中不含有Fe3+和Cu2+。
根据图中曲线的变化,表明随Na2O2的加入(即NaOH的形成),白色沉淀逐渐增多,后来又逐渐减少,最后保持不变,说明原溶液中一定含有Al3+和Mg2+。
K+可能存在,可通过焰色反应来检验。
规律总结:解答图像计算题,必须抓住有关化学原理和有关物质的性质,结合图像的特点,综合分析逐步计算求解,其关键是抓住图像四点(原点、交点、转折点、终点),数形结合,分析计算。
【变式2】向20 mL某物质的量浓度AlCl3溶液中滴入2 mol·L―1 NaOH溶液时,得到Al(OH)3沉淀质量与所滴加NaOH溶液的体积(mL)关系如右图所示,试回答下列问题:(1)图中A点表示的意义是________。
(2)图中B点所示的意义是________。
(3)上述两反应用总的离子方程式可表示为________。
(4)假若溶液中有Al(OH)3沉淀0.39 g,则此时用去NaOH溶液的体积为________。
【答案】(1)加入NaOH溶液15 mL时,沉淀达到最多,质量为0.78 g(2)当NaOH溶液达到20 mL时,生成的沉淀恰好全部溶液(3)Al3++4OH―=AlO2―+2H2O(4)7.5 mL或17.5 mL【典型例题】类型一:金属与水(水蒸气)反应的实验探究例1 如下图所示,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的气体,并靠近火焰点火。
(1)所观察到的现象是________,有关反应的化学方程式是________。
(2)干燥管内可装入的试剂是________,其作用是________。
干燥管还可用________(填装置名称)代替。
(3)玻璃管中石棉绒的作用是________。
实验开始时应先点燃________,实验结束时,应先熄灭______。
【答案】(1)红热的铁与水蒸气反应,放出气体,这种气体靠近火焰点火时,能燃烧或发出爆鸣声3Fe+4H2O (g)△Fe3O4+4H2(2)碱石灰(或无水CaCl2、硅胶等)吸收水蒸气,干燥氢气U形管(3)铁粉的载体,增大铁粉与水蒸气的接触面积酒精灯酒精喷灯【解析】常温下Fe不与H2O发生反应,但在高温下,Fe与H2O (g)反应生成Fe3O4和H2。
因铁粉和Fe3O4均为黑色,因此实验过程中固体颜色无明显变化,但产物H2可用点燃的方法验证。
