附表中国体外诊断网
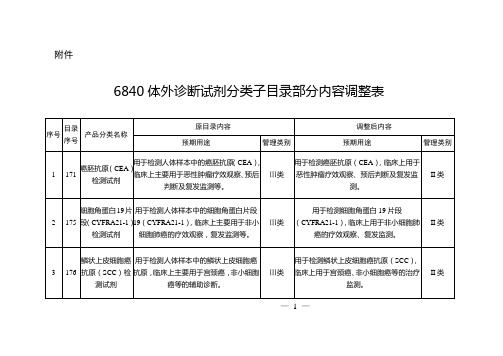
6840体外诊断试剂分类子目录部分内容调整表
用于检测泌乳素,临床上用于泌乳素瘤的治疗监测。
II类
27
206
降钙素检测试剂
用于检测人体样本中的降钙素(CT),临床上主要用于甲状腺髓样癌、小细胞肺癌的辅助诊断。
Ⅲ类
用于检测降钙素,临床上用于甲状腺髓样癌、小细胞肺癌的治疗监测。
II类
28
207
芳香基硫酸酯酶检测试剂
用于检测人体样本中的芳香基硫酸酯酶,临床上主要用于乳腺癌、结直肠癌的辅助诊断。
附件
6840体外诊断试剂分类子目录部分内容调整表
序号
目录序号
产品分类名称
原目录内容
调整后内容
预期用途
管理类别
预期用途
管理类别
1
171
癌胚抗原(CEA)检测试剂
用于检测人体样本中的癌胚抗原(CEA),临床上主要用于恶性肿瘤疗效观察、预后判断及复发监测等。
Ⅲ类
用于检测癌胚抗原(CEA),临床上用于恶性肿瘤疗效观察、预后判断及复发监测。
Ⅲ类
用于检测癌抗原15-3(CA15-3),临床上用于乳腺癌治疗疗效及预后观察。
II类
8
181
糖类抗原19-9(CA19-9)检测试剂
用于检测人体样本中的糖类抗原19-9(CA19-9),临床上主要用于胰腺等消化道恶性肿瘤的辅助诊断,疗效监测等。
Ⅲ类
用于检测糖类抗原19-9(CA19-9),临床上用于胰腺等消化道恶性肿瘤的疗效监测。
II类
21
196
胃蛋白酶原(PG)Ⅱ检测试剂
用于检测人体样本中的胃蛋白酶原(PG)Ⅱ。PGⅡ的浓度水平及PGI/Ⅱ的比值可用于胃癌的辅助诊断。
Ⅲ类
用于检测胃蛋白酶原(PG)Ⅱ,临床上用于监测PGII的浓度水平及PGI/Ⅱ的比值可用于胃癌的治疗监测。
医院体外诊断试剂临床试验立项资料目录(器械和试剂)

JG-form-011B-1.0
资料目录
1
备案登记证明
2
体外诊断试剂临床试验立项审核表
3
我国人类遗传资源管理审批/备案材料
4
组长单位伦理审查批件(如有)
5
研究者手册(包括产品说明书等关研究参考资料)
6
临床试验方案(已签字盖章)
7
知情同意书样本
8
病历报告表样表
9
产品检测报告(包括试验试剂和对照试剂)
18
项目经理/监查员的授权委托书原件、个人简历、GCP培训证书、身份证或/和工作证复印件等(需加盖单位公章)
19
主要研究者及项目组成员分工、简历及资质材料
20
试验用相关记录表格及其他资料(请自行添加)
10
试验试剂标签文本
11
临床前研究相关资料
12
对照产品的合法来源证明及说明书等文件
13
申办方资质证明文件
14
体外诊断试剂的研制符合适用的体外诊断试剂质量管理体系相关要求的声明
15
体外诊断试剂临床试验委托书原件
16
CRO/SMO公司资质证明文件(如适用)
17
申办方对CRO/SMO的委托函原件(如适用)
国内体外诊断IVD行业主要企业总结
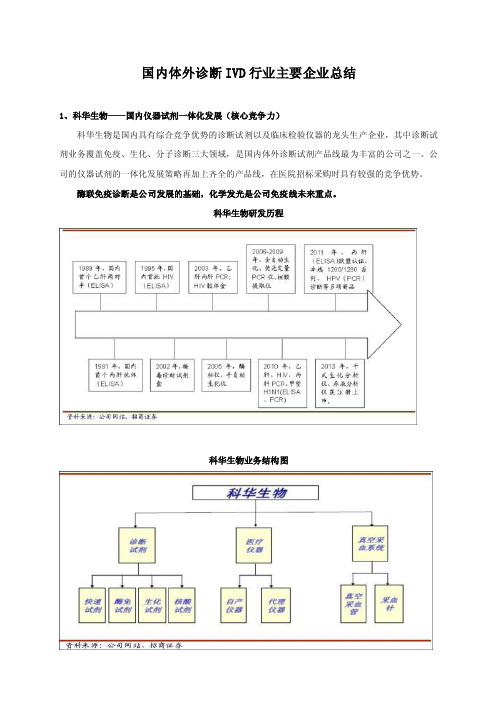
国内体外诊断IVD行业主要企业总结1、科华生物——国内仪器试剂一体化发展(核心竞争力)科华生物是国内具有综合竞争优势的诊断试剂以及临床检验仪器的龙头生产企业,其中诊断试剂业务覆盖免疫、生化、分子诊断三大领域,是国内体外诊断试剂产品线最为丰富的公司之一。
公司的仪器试剂的一体化发展策略再加上齐全的产品线,在医院招标采购时具有较强的竞争优势。
酶联免疫诊断是公司发展的基础,化学发光是公司免疫线未来重点。
科华生物研发历程科华生物业务结构图科华生物产品线总的来看,仪器+试剂一体化发展,外延并购,扩张有望提速。
科华拥有诊断试剂、诊断仪器、真空采血管三大产品线,诊断试剂涵盖生化、免疫、分子和POCT,是国内产品线最为齐备的诊断试剂公司。
仪器业务主要为代理的希森美康(Sysmex)尿液分析仪、五分类血液分析仪、血液流水线分析系统,自主研发的卓越系列生化分析仪、Fluocycle 实时荧光定量PCR仪,以及全自动核酸提取仪等产品,代表着国内同类产品的领先水平,2013年干式生化分析仪、尿液分析仪上市。
生化线(70多种)保持稳定增长,干式生化分析、尿液分析领域是新的增长点;免疫线经历近几年下滑后企稳,化学发光业务是未来看点;分子诊断保持快速增长,血筛业务还需要政策落地;代理仪器业务由于基数较高,预计每年平稳增长。
2、利德曼—立足生化、进军免疫、核心竞争力突出利德曼是是我国体外生化诊断试剂品种最齐全的生产厂商之一,能够满足医疗机构、体检中心等各种生化检测需求。
(1)生化产品线齐全。
目前公司已获得超100项生化诊断试剂产品注册证书,涵盖肝功、肾功、血脂与脂蛋白、血糖、心肌酶、离子、胰腺、特殊蛋白等九大系列,是国内生化诊断试剂品种最齐全的生产厂商之一。
产品线齐全给临床检验科室的营销工作带来极大的助力。
(2)研发实力雄厚。
预计公司每年将推出10 款以上的新产品。
(3)成熟的营销网络、优秀的市场管理能力。
截止2012 年底,公司共有骨干经销商62个,二级经销商300 至350 家,终端客户已经超过2400家,其中三级医院630 家,占全国三级医院总量的59%,已建成覆盖全国的营销网络。
体外诊断试剂研制情况核查报告表

体外诊断试剂研制情况核查报告表报告编号:XXXX-YYYY-ZZZZ日期:XXXX年XX月XX日一、背景随着医疗技术的不断进步,体外诊断试剂在医疗领域的应用越来越广泛。
体外诊断试剂是指用于检测人体体液或组织样本中生物化学或免疫学反应的试剂,可以帮助医生准确诊断和监测疾病。
为了满足市场需求,不断有新的体外诊断试剂研制出现。
二、目的本报告旨在对体外诊断试剂研制情况进行核查,包括研发团队、研发内容、现有成果等方面的情况,并针对存在的问题提出改进建议,以促进体外诊断试剂的研发和应用水平的提高。
三、核查内容1.研发团队:核查研发团队的组成与人员分工情况,以及团队成员的背景和专业技能。
2.研发内容:核查研发项目的具体内容,包括但不限于试剂的种类、功能、原理等。
3.研发进展:核查研发项目的进展情况,包括已经完成的研究阶段、正在进行的研发工作以及下一步计划。
4.研发成果:核查研发项目取得的成果,包括专利申请、论文发表、研发报告等。
5.问题与建议:对研发过程中出现的问题进行整理,并提出改进建议,以促进研发水平的提高。
四、核查结果1.研发团队:核查结果显示,研发团队由X位具有丰富研发经验的科研人员组成,其中包括X位博士生导师和X位博士后研究人员。
团队成员背景各异,涵盖了生物化学、医学、免疫学等多个领域。
2.研发内容:核查结果显示,研发项目主要集中在感染性疾病的体外诊断试剂研制上,包括新型冠状病毒、流感病毒等常见病原体的检测。
其中,试剂种类涵盖了免疫检测试剂、核酸检测试剂等多种类型。
3.研发进展:核查结果显示,研发项目已经完成了前期的理论研究和前期实验室验证,并且正在进行中期的临床研究。
下一步的计划是进一步完善试剂的灵敏度和特异性,争取尽快推向市场使用。
4.研发成果:核查结果显示,研发项目已经获得X项国内外专利,并在国内外重要学术期刊上发表了X篇论文。
此外,还编写了X份研发报告,以提高研发成果的传播和利用效果。
5.问题与建议:通过核查,发现研发项目面临的主要问题是研发周期较长、资金短缺等。
体外诊断试剂表格模板
省博济光明医药员工健康档案编号:建档时间:年月员工培训档案职务或职称:员工培训考核记录2011年度首营企业审批表编号: 填表日期:年月日仁济医药股份首营品种审批表编号:填表日期:年月日适用围质量标准有效期试剂质量信息汇总表省博济光明医药质重上制度丸行情况自查表*省博济光明医药质量制度执行情况自查表省博济光明医药质量制度执行情况考核表省博济光明医药质量制度执行情况考核表培训签到表时间:供货方档案表企业名称地址客户资质审核表仓库温湿度记录适宜温度围:〜℃适宜相对湿度围:45%〜75%养护设备使用记录年度:_____ 生设备名称:规格/型号:设备编号:养护设备检修维护记录填表口期:养护(维修)人:设备档案编号:建档日期:建档人:名称生产企业试剂养护档案报损试剂销毁记录不合格试剂报损审批表时间:试剂运输记录表试剂运输工具:⑴冷藏车⑵试剂运输车⑶其它填写说明:本表供购进/销售试剂运输时填写;运输超过6小时需记录途中温度,每天记录2次, 间隔不少于6小时:使用无自动温度显示的冰排保冷设备时,只在启运和到达时填写冰排状态(冻结、冰水混合物、完全融化)。
产品追回记录年月口试剂质量、质量管理征询意见表调查口期: 编号:客户名称地址调查人:文件签收单收文部门:文件借(查)阅登记表文件销毁单文件修订审批单申请修订文件名称编码修订理由和容:质量领导组意见:编号:申请部门: 日期:质量负责人签名: 日期:拒收报告单产品名称供货企业拒收原因质量复检通知单编号:质量复检报告单编号:试剂停售通知单各有关部门:以下试剂因质量问题决定停售,请按规定采取有效措施停止出售,等待处理。
试剂名称:规格型号:产品批号:有效期:生产日期:生产企业:质管部年月日解除停售通知单年第号各有关部门:以下试剂经质量复查结果合格,撤销年第号“试剂停售通知单”,请恢复正常出库发货及销售,特此告知。
试剂名称:规格型号:产品批号:有效期:生产日期:生产企业:质管部年月日不合格试剂通知单年第号各有关部门:以下试剂经质量复查结果为不合格,请按《不合格试剂控制程序》处理,停止出售,特此告知。
体外诊断试剂研发及市场发展概况

体外诊断试剂研发及市场发展概况袁银池;赵晓勤;陈大明;张春芳【摘要】基因组学、分子生物学等基础学科的发展,促进了体外诊断试剂的开发应用和更新换代,使其在疾病诊治中发挥越来越重要的作用.2016年全球体外诊断试剂市场容量约680亿美元,未来全球增速预计达7%~8%,其中中国是全球增速最快的市场.主要就体外诊断试剂的研发及市场发展情况进行阐释.【期刊名称】《生物产业技术》【年(卷),期】2017(000)004【总页数】9页(P16-24)【关键词】体外诊断试剂;技术研发;市场发展【作者】袁银池;赵晓勤;陈大明;张春芳【作者单位】中国科学院上海生命科学信息中心,上海 200031;上海图书馆(上海科学技术情报研究所),上海 200031;中国科学院上海生命科学信息中心,上海 200031;中银消费金融有限公司,上海 200002【正文语种】中文目前,全球医疗决策中约有三分之二是依据诊断做出,其中体外诊断(in vitro diagnostics,IVD)已是预防诊断和治疗疾病过程中的重要环节。
体外诊断从人体样本中获取临床检测信息,达到诊断的目的。
体外诊断市场可以细分为体外诊断试剂和体外诊断仪器两个部分。
就国内体外诊断市场而言,体外诊断试剂占据大部分的体外诊断市场。
国家食品药品监督管理总局(CFDA)2014公布的《体外诊断试剂注册管理办法》中指出,体外诊断试剂是指按医疗器械管理的体外诊断试剂,包括可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂(盒)、校准品、质控品等产品。
CFDA 2017年通过的《体外诊断试剂注册管理办法修正案》,表明体外诊断试剂全链条动态质量管理是提升产业格局、优化产品结构的监管方向。
1.1 发展历程体外诊断试剂行业在我国开展较晚,20世纪70年代才刚刚拉开帷幕[1]。
1970年初,我国小规模引进西方国家的技术设备,诊断试剂产业的雏形初现;1980年,开始大量引入海外先进技术,出现一批体外诊断试剂的生产企业,诸如生化类诊断试剂的北京中生、深圳迈瑞等生产企业,免疫类诊断试剂的上海科华、郑州安图等生产企业;20世纪90年代初期,生化类诊断试剂已有100多家的生产企业,免疫类诊断试剂的生产企业约300家,但大多数缺少合法资质,此时诊断试剂行业竞争白热化;90年代后期,CFDA着手对血源筛查类、免疫类诊断试剂开展市场清查,取缔违规不合格生产厂家;2010年之前,我国体外诊断试剂生产企业集中于较低端的生化与免疫诊断市场,缺乏创新性;2010年之后,体外诊断技术得到快速发展,尤其是分子生物学技术在临床检验领域应用带来的新一轮医疗革命。
体外诊断试剂原料产业分析

一、体外诊断的定义及细分1.1.体外诊断定义体外诊断(In Vitro Diagnostics,IVD)是指在人体之外,通过对人体样本(血液、体液、组织等)进行检测获取临床诊断信息,进而判断机体功能和机体疾病的诊断方法。
除了某些特殊情形需要体内诊断以外,目前临床诊断信息的80%来自体外诊断。
体外诊断包括产品和服务,其中体外诊断试剂作为国家药监系统监管产品,由《体外诊断试剂注册管理办法》做出解释:按医疗器械管理的体外诊断试剂,包括可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,用于对⼈体样本(各种体液、细胞、组织样本等)进⾏体外检测的试剂、试剂盒、校准品(物)、质控品(物)等。
1.2.体外诊断分类按照不同的检测原理或方法,体外诊断可分为生化诊断、免疫诊断、分子诊断、微生物诊断、尿液诊断、凝血类诊断、血液学和流式细胞诊断等,我国目前体外诊断的主要方法是生化诊断、免疫诊断和分子诊断。
下图为各分类体外诊断原料组成。
图表1:体外诊断分类简介数据来源:solarzoom、智银资本1.3.体外诊断试剂原料定义与分类体外诊断试剂原料指用于生化、免疫或分子诊断等试剂的反应体系原料,主要指核心反应体系。
上游诊断试剂原材料质量的好坏直接决定了体外诊断产品的质量,其中核心反应体系原材料如抗原、抗体、诊断酶是体外诊断质量控制最为重要的战略节点。
按照性质不同,体外诊断试剂原料可分为抗原、抗体、酶与辅酶、底物及标准品等类别。
图表2:体外诊断试剂原料的分类数据来源:IVD资讯网、头豹研究院、智银资本抗原与抗体、酶及辅酶是体外诊断试剂发挥诊断功能的重要组成成分,影响体外诊断试剂各项性能水平(如灵敏度、稳定性),是体外诊断试剂成本构成主要的部分,合计占据体外诊断原料市场75%以上的市场份额。
其他原料是除上述发生核心反应的活性物质外的原料,包括微球、磁珠、膜、引物、探针及其他化学及生物制品等。
体外诊断试剂分析报告

体外诊断试剂(IVD)分析报告及建议体外诊断试剂是指按医疗器械管理的体外诊断试剂,包括可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,用于对人体样本(各种体液、细胞、组织样本等)进行体外检测的试剂、试剂盒、校准品(物)、质控品(物)等。
国家法定用于血源筛查的体外诊断试剂、采用放射性核素标记的体外诊断试剂不属于《体外诊断试剂注册管理办法(试行)》的管理范围。
一、体外诊断试剂(IVD)市场分析中国体外诊断(IVD)产业兴起于20世纪80年代初期,经历近30年的发展,从无到有,从弱到强,现在整个产业已经具备了规模化发展条件。
中国诊断产品用户主要包括19800 多家医院、39000多个乡镇卫生院和300多家血站,以及日新月异的体检中心和正在兴起的临床检验独立实验室。
总体来看,中国诊断行业仍处在成长初期目前,我国诊断试剂市场基本可以分成7个部分,其中免疫学诊断试剂市场规模最大,市场份额29.61%,其次是:生化诊断试剂,血糖自我监测试剂血液诊断试剂,尿液诊断试剂,生物学诊断试剂3.97%,分子及其他诊断试剂12.01%。
分子诊断试剂是20世纪80年代后期发展起来的,无论技术还是市场,都是目前所有诊断试剂产品中发展最快的。
免疫诊断试剂的市场规模已逐渐超过临床化学试剂,但由于二者的检验对象有所区别,生化诊断试剂还将保持较大份额。
据《2013-2017年中国诊断试剂行业产销需求与投资预测分析报告》[4]分析,2007-2009年中国诊断试剂行业的市场规模年复合增长率达17.93%,呈现高速增长趋势。
2009年中国诊断试剂市场规模达到96.72亿元,人均年费用为7.3元,而日本2008年人均年使用量为227.5元,差距悬殊。
总体来看,中国诊断行业仍处在成长期初期。
诊断试剂行业是生物制药行业的重要组成部分,就国内的现状来说,中国的诊断试剂仍处于弱小成长期,才处于产品研发与生产的投入初期,成长期还没有真正到来。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
52.
YY/T 1170-2009
碱性蛋白胨水培养基
53.
YY/T 1171-2009
改良罗氏基础培养基
54.
YY/T 1172-2010
医学实验室质量管理术语
55.
YY/T 1173-2010
聚合酶链反应分析仪
56.
YY/T 1174-2010
半自动化学发光免疫分析仪
57.
YY/T 1175-2010
61.
YY/T 1179-2010
糖类抗原CA50定量试剂(盒)(化学发光免疫分析法)
62.
YY/T 1180-2010
人类白细胞抗原(HLA)基因分型试剂盒(SSP法)
63.
YY/T 1181-2010
免疫组织化学试剂盒
64.
YY/T 1182-2010
核酸扩增检测用试剂(盒)
65.
YY/T 1183-2010
116.
YY/T 1234-2014
碱性磷酸酶测定试剂(盒)(NPP底物-AMP缓冲液法)
117.
YY/T 1235-2014
风疹病毒IgG/IgM抗体检测试剂(盒)
118.
YY/T 1236-2014
巨细胞病毒IgG/IgM抗体检测试剂(盒)
119.
YY/T 1237-2014
弓形虫IgG抗体检测试剂(盒)(酶联免疫法)
143.
YY/T 1260-2015
戊型肝炎病毒IgM抗体检测试剂盒(酶联免疫吸附法)
144.
YY/T 1261-2015
HER2基因检测试剂盒(荧光原位杂交法)
145.
YY/T 1262-2015
神经元特异性烯醇化酶定量标记免疫分析试剂盒
146.
YY/T 1303-2015
核酸扩增反向点杂交试剂(盒)
103.
YY/T 1221-2013
心肌肌钙蛋白1诊断试剂(盒)(胶体金法)
104.
YY/T 1222-2014
总三碘甲状腺原氨酸定量标记免疫分析试剂盒
105.
YY/T 1223-2014
总甲状腺素定量标记免疫分析试剂盒
106.
YY/T 1224-2014
膀胱癌细胞相关染色体及基因异常检测试剂盒(荧光原位杂交法)
生物芯片用醛基基片
40.
YY/T 1153-2009
体外诊断用DNA微阵列芯片
41.
YY/T 1154-2009
激光共聚焦扫描仪
42.
YY/T 0575-2005
硫乙醇酸盐流体培养基
43.
YY/T 0576-2005
哥伦比亚5
营养琼脂培养基
45.
YY/T 0578-2005
112.
YY/T 1230-2014
胱抑素C测定试剂(盒)
113.
YY/T 1231-2014
肌酐测定试剂(盒)(肌氨酸氧化酶法)
114.
YY/T 1232-2014
γ-谷氨酰基转移酶测定试剂(盒)(GPNA底物法)
115.
YY/T 1233-2014
心肌肌钙蛋白-Ⅰ测定试剂(盒)(化学发光免疫分析法)
84.
YY/T 1202-2013
钾(K)测定试剂盒(酶法)
85.
YY/T 1203-2013
钠(Na)测定试剂盒(酶法)
86.
YY/T 1204-2013
总胆汁酸(TBA)测定试剂盒(酶循环法)
87.
YY/T 1205-2013
总胆红素试剂盒(钒酸盐氧化法)
88.
YY/T 1206-2013
总胆固醇试剂盒(氧化酶法)
酶联免疫吸附法检测试剂(盒)
66.
YY/T 1184-2010
流式细胞仪用单克隆抗体试剂
67.
YY/T 1185-2010
脑心浸液培养基
68.
YY/T 1186-2010
MH肉汤培养基
69.
YY/T 1187-2010
营养肉汤培养基
70.
YY/T 1188-2010
曙红亚甲蓝琼脂培养基
71.
YY/T 1189-2010
YY/T0456.4-2014
血液分析仪用试剂第4部分有核红细胞检测试剂
5.
YY/T0456.5-2014
血液分析仪用试剂第5部分网织红细胞检测试剂
6.
YY/T0032-2004
血红蛋白计
7.
YY/T0087-2004
电泳装置
8.
YY/T0475-2011
尿液化学分析仪通用技术条件
9.
YY/T0478-2011
130.
YY/T 1248-2014
乙型肝炎病毒表面抗体测定试剂(盒)(化学发光免疫分析法)
131.
YY/T 1249-2014
游离前列腺特异性抗原定量标记免疫分析试剂盒
132.
YY/T 1250-2014
胰岛素定量标记免疫分析试剂盒
133.
YY/T 1251-2014
红细胞沉降率测定仪
134.
YY/T 0996-2015
中国蓝琼脂培养基
72.
YY/T 1190-2010
乳糖胆盐发酵培养基
73.
YY/T 1191-2011
《抗菌剂药敏纸片》
74.
YY/T 1192-2011
《人绒毛膜促性腺激素(HCG)定量测定试剂盒(化学发光免疫分析法)》
75.
YY/T 1193-2011
《促卵泡生成激素(FSH)定量测定试剂盒(化学发光免疫分析法)》
尿液有形成分分析仪(数字成像自动识别)
135.
Y/T 1252-2015
总IgE定量标记免疫分析试剂盒
136.
YY/T 1253-2015
低密度脂蛋白胆固醇测定试剂(盒)
137.
YY/T 1254-2015
高密度脂蛋白胆固醇测定试剂(盒)
138.
YY/T 1255-2015
免疫比浊法检测试剂(盒)(透射法)
125.
YY/T 1243-2014
肌酸激酶测定试剂(盒)
126.
YY/T 1244-2014
体外诊断试剂用纯化水
127.
YY/T 1245-2014
自动血型分析仪
128.
YY/T 1246-2014
糖化血红蛋白分析仪
129.
YY/T 1247-2014
乙型肝炎病毒表面抗原测定试剂(盒)(化学发光免疫分析法)
天门冬氨酸氨基转移酶(AST)测定试剂盒(连续监测法)
81.
YY/T 1199-2013
甘油三酯(TG)测定试剂盒(甘油磷酸氧化酶-过氧化物酶法)
82.
YY/T 1200-2013
葡萄糖(GLU)测定试剂盒(葡萄糖氧化酶法)
83.
YY/T 1201-2013
尿素氮(BUN)测定试剂盒(酶偶联监测法)
YY/T1157-2009
活化部分凝血活酶时间检测试剂(盒)
31.
YY/T1158-2009
凝血酶原时间检测试剂(盒)
32.
YY/T1159-2009
纤维蛋白原检测试剂(盒)
33.
YY/T1160-2009
癌胚抗原定量测定试剂(盒)
34.
YY/T 1161-2009
肿瘤相关抗原CA125定量测定试剂(盒)
体外诊断医疗器械制造商为生物学染色用体外诊断试剂提供的信息
15.
YY 0648-2008
《测量、控制和试验室用电气设备的安全要求第2-101部分:体外诊断(IVD)医用设备的专用要求》
16.
YY/T 0653-2008
血液分析仪
17.
YY/T 0654-2008
全自动生化分析仪
18.
YY/T 0655-2008
120.
YY/T 1238-2014
RhD(IgM)血型定型试剂(单克隆抗体)
121.
YY/T 1239-2014
琼脂平板培养基
122.
YY/T 1240-2014
D-二聚体定量检测试剂(盒)
123.
YY/T 1241-2014
乳酸脱氢酶测定试剂(盒)
124.
YY/T 1242-2014
α-羟丁酸脱氢酶测定试剂(盒)
94.
YY/T 1212-2013
庆大霉素琼脂基础培养基
95.
YY/T 1213-2013
促卵泡生成素定量标记免疫分析试剂盒
96.
YY/T 1214-2013
人绒毛膜促性腺激素定量标记免疫分析试剂盒
97.
YY/T 1215-2013
丙型肝炎病毒(HCV)抗体检测试剂盒(胶体金法)
98.
YY/T 1216-2013
甲胎蛋白定量标记免疫分析试剂盒
99.
YY/T 1217-2013
促黄体生成素定量标记免疫分析试剂盒
100.
YY/T 1218-2013
促甲状腺素定量标记免疫分析试剂盒
101.
YY/T 1219-2013
胰酪胨大豆肉汤培养基
102.
YY/T 1220-2013
肌酸激酶同工酶(CK-MB)诊断试剂(盒)(胶体金法)
附表2 SAC/TC136归口行业标准列表(2016年12月)
序号
标准编号
标准项目名称
1.
YY/T0456.1-2014
血细胞分析仪应用试剂第1部分:清洗液
2.
YY/T0456.2-2014
血细胞分析仪应用试剂第2部分:溶血剂
