有机催化 α, β-不饱和羰基化合物的
2011中南大学有机化学大纲

中南大学研究生入学考试<<有机化学>>课程考试大纲【考试大纲的目的要求】一、掌握各类有机化合物的命名方法、同分异构、化合物结构及性质、化合物重要合成方法以及他们之间的相互转化关系。
二、应用价键理论的基本概念,理解有机化合物的结构;应用分子轨道理论的基本概念解释乙烯、丁二烯、苯的结构。
三、掌握诱导效应和共轭效应,并运用其解释有机物结构和性质的关系。
四、了解过渡态理论,初步掌握碳正离子、碳负离子、碳游离基等活性中间体及其在有机反应中的应用。
五、了解亲核取代、亲电取代、亲核加成、亲电加成、消去反应、游离基反应、氧化、还原、缺电子重排反应的历程。
并能初步运用来解释相应的化学反应和合成上的应用。
六、掌握常见有机金属化合物(锂、镁)的重要反应。
七、掌握立体化学的基本知识、基本理论。
八、应用红外光谱、核磁共振谱的方法测定有机化合物的结构,并能解析简单的谱图。
九、掌握各类重要有机化合物的来源、工业制法及其主要用途。
了解碳水化合物、蛋白质、油脂、主要生物碱等天然产物的结构、性质和用途。
十、掌握有机化学实验的基本技能和原理。
【考试大纲的内容】一、基本知识1. 命名与结构式(1) 系统命名烷、烯、炔、二烯、脂环(环烷、环烯、螺环和桥环)、芳烃(取代芳烃及多核芳烃)、卤代烃(卤代烷、卤代烯、卤代炔)、醇(卤代醇、芳醇)、酚(各种取代酚)、醚、醛(脂肪不饱和醛、芳醛)、酮(芳酮、环内酮)、醌、酸(取代一元酸、二元酸、芳酸、不饱和酸)、羧酸衍生物、取代酸(羟基酸、卤代酸、羰基酸)、硝基化合物、胺(芳胺)、腈、杂环化合物(母体、音译法)、碳水化合物、氨基酸的系统命名。
(2) 了解以上各类化合物的习惯命名、简单有机化合物的衍生物命名和常见化合物的俗名。
(3) 基团的命名:伯、仲、叔、季碳原子,伯、仲、叔胺、季铵,基(烷基、烯基、炔基等)的普通命名和系统命名。
(4) 写结构式:根据命名写结构式。
(5) 同系列:根据分子式、通式找出所属系列;同系物关系(同系差)。
有机合成经典反应 Heck 反应

经典化学合成反应标准操作1。
前言 (1)2. 分子内的Heck反应 (2)2.1 生成烯基取代的反应 (2)2。
1。
1 分子内Heck反应化生成环外双键示例 (3)2。
2 形成季碳中心的反应 (4)2.2。
1 分子内不对称Heck反应示例 (5)2。
3 多烯大环的合成 (5)2.2。
1 Heck反应用于合成大环多烯示例 (6)3。
分子间的Heck 反应 (7)3。
1 常规分子间Heck反应 (7)3。
1.1 Pd(OAc)2—P(o-tol)3体系用于不饱和羧酸酯的Heck反应标准操作三 (8)3.1.2 不饱和酮的Heck反应标准操作 (9)3.1。
3 杂环芳香卤代物和不饱和羧酸酯的Heck反应标准操作一 (9)3。
1。
4 杂环芳香卤代物和不饱和羧酸酯的Heck反应标准操作二 (9)3.1。
5 芳香卤代物和不饱和羧酸的Heck反应合成反式3-芳基不饱和酸示例103。
1.6 非共轭双键Heck反应示例 (10)3.2 不对称分子间Heck反应 (11)3。
3 非常用离去基团的Heck反应(Irina P。
Beletskaya Chem。
Rev. 2000,100,3009—3066) (11)3。
3。
1 重氮盐参与的Heck反应示例 (12)3.3.2 酰氯参与的Heck反应示例 (14)1。
前言通常把在碱性条件下钯催化的芳基或乙烯基卤代物和活性烯烃之间的偶联反应称为Heck反应。
自从20世纪60年代末Heck 和Morizoki独立发现该反应以来,通过对催化剂和反应条件的不断改进使其的应用范围越来越广泛,使该反应已经成为构成C-C 键的重要反应之一。
另外,Heck反应具有很好的Trans选择性R XPd(0)Z RZX = I, Br, OTf, etcZ = H, R, Ar, CN, CO2R, OR, OAc, NHAc, etc研究表明,Heck反应的机理有一定的规律,通常认为反应共分四步:(a)氧化加成(Oxidative addition): RX (R为烯基或芳基,X=I > TfO 〉Br >〉Cl)与Pd0L2的加成,形成PdⅡ配合物中间体;(b)配位插入(Cordination—insertion):烯键插入Pd—R键的过程;(c)β—H的消除;(d)催化剂的再生:加碱催化使重新得到Pd0L2。
α, β不饱和醛酮
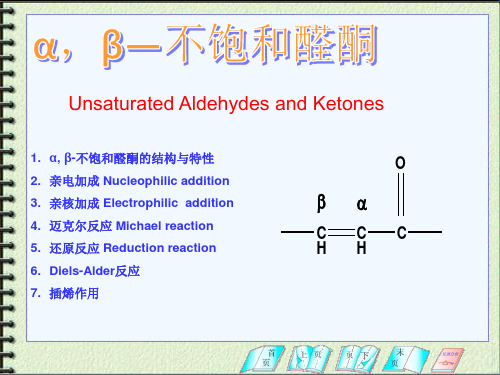
SO3Na
O R CH CH C H(R,)
N H
O
RCH
N
CH2 C
H(R,)
O
+
HCN
(C2H5)3Al
O CN
85%
(2)和金属有机化合物反应
1.R2CuLi, RMgX,RLi
2.1,4-加成和1,2-加成均有,取决于羰基旁边的基团大 小,也与试剂的空间位阻有关
3.醛羰基旁边的空间位阻很小,因此与烃基锂,格 氏试剂时主要以1,2-加成为主 4.与格氏试剂反应要做具体分析
特性: 2.特性:体系稳定 体系
如 CH2=CHCH2CH=O 3-丁烯醛
C=C与 C=O 组成共轭
OHH+ CH3CH=CHCH=O CH3CH=CHCH=O 2-丁烯醛
3.制备: 3.制备:主要由羟醛缩合反应制备 制备
C6H5CHO + CH3COC6H5
HCHO + CH3COCH3
OH-
OHOH-
HCl(g)
CH3CH(Cl)CH2COCH3 CH3CH(Br)CH(Br)COCH3
Br2 CCl4
3.亲核加成 Nucleophilic addition 亲核加成
HCN NH
1,4-加成产物为主 1,4-加成产物为主
C=C-C=O
1) R 2 CuLi 2)H 2 O
1,4-加成产物为主
1) RMgX,CuCl 1,4-加成产物为主 2)H 3 O + 1) RLi 2) H 2O
查耳酮类
rt 30min
饱和酮
6.Diels-Alder反应 Diels-Alder反应
+
CHO
16秋浙大《有机化学(A)》在线作业

B. CH3CHO
C. PhCOCH3
D. CH3COCH3
正确答案:
3. 下列各组物质一定是同系物的是
A. 符合通式(CH2)nO2 的酯
B. 甲酸和醋酸
C. 正丁烷和异戊烯
D. 硬脂酸和油酸
正确答案:
4. 已知甲、乙两种烃的含碳的质量分数相同,下列判断正确的是
D. 甲烷与氯气均在黑暗中混合
正确答案:
22. 下列化合物的沸点最高的是()。
A. 正已醇
B. 正已烷
C. 1-己炔
D. 1-氯己烷
正确答案:
23. 下列四个试剂,不跟CH3CH2COCH2CH3反应的是:
A. RMgX
B. NaHSO3饱和水溶液
C. PCl5
D. LiAlH4
A. 环丙烷
B. 环丁烷
C. 环戊烷
D. 环己烷
正确答案:
31. (R)-2-氯丁烷 与(S)-2-氯丁烷的哪种性质不同?
A. (A) 熔点
B. 沸点
C. 折射率
D. 比旋光度
正确答案:
32. (CH3)3CBr与乙醇钠在乙醇溶液中反应主要产物是:
A. (CH3)3COCH2CH3
A. 错误
B. 正确
正确答案:
3. 芳杂环化合物是平面形的,π电子数符合4n+2规则。
A. 错误
B. 正确
正确答案:
4. 卤素取代位置对反应的影响:卤素离羧基越近,诱导效应越强,酸性越弱。
A. 错误
B. 正确
正确答案:
5. 在农业上常用稀释的福尔马林来浸种,给种子消毒,因为该溶液中含有甲酸。
αβ不饱和醛酮
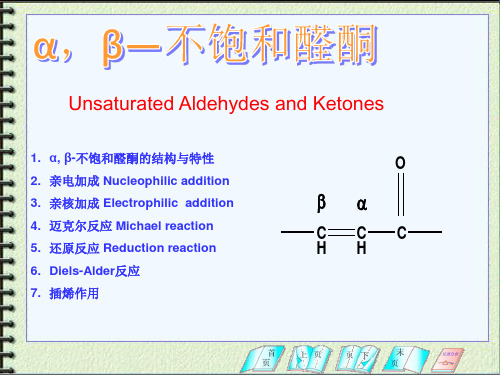
+ CH2=CHCOCH3
O
O CH2CH2COCH3 O
O
KOH
CH2CH2COCH3 O
NH C6H6
O
分子内缩合
O
OH-
+ H2O
or
O
+
O
OH-
O
O
O
O
5.还原反应
Reduction reaction
(97%)
(1)只 还原C=O 用LiAlH4 或 NaBH4 H OH O H2O LiAlH4
HCN NH
1,4-加成产物为主 1,4-加成产物为主
C=C-C=O
1) R2CuLi 2)H2O
1,4-加成产物为主
1) RMgX,CuCl 1,4-加成产物为主 2)H3O+ 1) RLi 2) H2O
1,2-加成产物为主 不饱和醛(1,2-加成产物为主) 不饱和酮 甲基酮(1,2-加成为主) 其他酮(1,4-加成为主)
CH3C CH2 C CH CH CH C R 4.碱性催化剂:三乙胺,六氢吡啶,氢氧化钾,乙醇钠,氨基钠 5.该反应可逆,升温对你反应有利
O CH3 O
+CH2
O CH C CH3
KOH
O CH3
O
O
CH2 CH2
O
C CH3
KOH
O
6.反应机理: 碱夺取碳上的活泼氢,生成一个碳负离子,然后碳负离子与受体发 生1,4-共轭加成,形成加成物从溶剂中夺取一个质子形成烯醇,在互 变异构形成最终产物。 7.用途:用于合成环状化合物,通常用迈克尔反应和羟醛缩合一起合成环 状化合物
+
OH
O
第四章 缩合反应(简单版)

Cannizzaro 反应
CH2OH
有机金属化合物的α−羟烷基化反应
(1) Reformatsky reaction: 醛、酮与α−卤代酸酯在锌粉的 存在下缩合而得β−羟基酸酯或脱水得α,β−不饱和酸酯。
O R1 R2 + X H C CO2R H R
1 2
1) Zn 2) H3O+ R
1 2
OH H C C CO2R H -H2O
+
C6H5 C6H5COCH2CHCH2CO2H
O CO2Et + CH CCOCH3
K2CO3/Acetone
O CO2Et COCH3
KOH/EtOH CHCN Et + CH2 CHCN
CN C CH2CH2CN Et
O CO2Et + Yb(OTf)3 CH2 CHCOCH3
O CO2Et COCH3 (95%)
O O HO NH2 CN HO O NH CN Cl OCH3 HO O N
O OCH3 CN
化合物Ⅰ
化合物Ⅱ
O O Ni/H2 HO N OCH3 NH2 NaOH/ref HO O N O NH
化合物Ⅲ(VAM水溶液)
化合物Ⅳ(Wing-B)
2.有机金属化合物的β−羰烷基化反应
有机金属化合物对α,β−不饱和羰基化合物的1,4− 加成−β−位引入烷基。
O R C CH3 + 3NH3 + 3HCHO
O R C C(CH2NH2)3
NH3
+
HCHO
CH2
NH2
Imine (亚胺)
2.Streck反应- a-氨基酸的制备
醛、酮类化合物与ΗCΝ和氨(胺类化合物)反应生成 α−氨基腈,再经酸或碱水解得到α−氨基酸的反应。
考研有机化学机理题题库

1 螺戊烷在光照条件下与氯气反应是制备氯代螺戊烷的最好方法。
Cl解释在该反应条件下,为什么氯化是制备这一化合物的如此有用的方法并写出反应历程。
解:H.该反应条件下螺戊烷氯化是自由基反应, 形成图示的平面型或近似于平面型的自由基中间体,中心碳原子为sp 2杂化, 未参与杂化的p 轨道只有一个未配对电子,垂直于三个sp 2杂化轨道,并被另一个环丙烷的弯曲键所稳定,活化能低,反应速度快,是制备该化合物有效的方法。
链引发:Cl 2链传递:Cl链终止:ClCl 2..2 解释:甲醇和2-甲基丙烯在硫酸催化下反应生成甲基叔丁基醚CH 3OC(CH 3)3(该过程与烯烃的水合过程相似)。
解:3O CH 3+- H+3下面两个反应的位置选择性不同CF3CH=CH 2CF 3CH 2CH 2ClCH3OCH=CH 2CH 3OCHClCH 3解:三氟甲基是强吸电子基,存在强的– I 效应。
生成稳定中间体碳正离子CF 3CH 2CH 2+。
连在烯键上的甲氧基存在强的+C 、弱的–I 效应,即CH 3OCH δ+=CH 2δ–,氢离子进攻 CH 2δ– ,得到中间体碳正离子CH 3OCH + CH 3也较稳定。
4解 两次亲电加成, 第一次是氢离子加到烯键上,第二次是分子内加成(碳正离子加到烯键上), 每次都生成较稳定的碳正离子。
- H +5CO 2CH 3解 +HgOAc 对烯键亲电加成后,接着经过一系列亲电加成, 再失去氢离子,得最终产物.COOCH 3OAcCOOCH 3OAcHgHg ++6Cl解 碳正离子1发生重排。
不重排的产物是1-异丙基-1-氯环己烷。
本题碳正离子重排由氢迁移造成。
ClCl++7Cl解发生碳正离子重排。
第一步得到的碳正离子已是叔碳正离子,但分子中有五元环。
重排时,碳正离子α-位环戊基的一条键带一对电子移到碳正离子上,生成六员环(1,2-迁移,碳正离子是1-位,2-位基团迁到1-位上)。
合成化学复习题

在小环体系的桥头碳原子上形成,即双键总是远离桥头。
D、季铵碱加热分解时,遵循Hofmann规则。
12、片呐醇重排反应是立体专属反应,下列反应不正确的是(
)
OH2 CH3 OH CH3 _H _H O
2
CH3 CH3
CH3 OH2 OH CH3 _H O _H
2
CH3O C CH3
O
CH3 CH3O OH2 OH H _H O _H
2
OH2
CH3 _H _H O
2
C H
OH
பைடு நூலகம்
CH3 CH3
CH3
O
13、下列关于绿色合成的论述,不正确的是(
)
A、绿色合成即设计环境友好的化学反应路线,物质和能量
构成封闭循环的化学工艺流程以及生产绿色产品。
B、绿色合成要考虑化学反应的原子经济性。即将原料分子 中的每一个原子最大限度的归宿于目标分子中,达到零排放。
O
7、合成:
CH2CO2C2H5 ,下列合成路线中,最为理想的是(
)
A、苯并-1-环戊酮与溴乙酸乙酯在强碱体系中直接化合。
B、先将苯并-1-环戊酮转变为亚胺,再与溴乙酸乙酯在强碱
体系中直接化合,最后水解。
C、先将苯并-1-环戊酮转变为烯胺,再与溴乙酸乙酯直接化 合,最后水解。
D、先将苯并-1-环戊酮转变为烯胺,再与溴乙酸乙酯在催化 剂存在下化合,最后水解。
Ph O
Ph
EtONa
CO2C2H5 Ph Ph
O Ph Ph
_H O
2
4、合成:维生素D2 .
C9H17
+
C9H17
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
