钛的原子核外电子排步式
1-36号元素基态原子核外电子排布式

1-36号元素基态原子核外电子排布式元素的基态电子排布是指元素原子核外电子在基态时的分布。
基态是指电子在最低能级时的排布方式。
原子核外电子的排布方式决定了元素的性质和化学反应。
在排布原子核外电子时,需要遵循一些规则:1.泡利不相容原理:每个电子的量子态要不同,即不可能有两个电子具有完全相同的四个量子数。
2.需要按能级填充:电子会先填充能级较低的量子态。
3.每个能级最多填充一定数量的电子:对于s能级,最多填充2个电子;对于p能级,最多填充6个电子;对于d能级,最多填充10个电子;对于f能级,最多填充14个电子。
根据这些规则,我们来看一下1-36号元素基态原子核外电子的排布。
1.氢(H):1s^12.氦(He):1s^23.锂(Li):1s^22s^14.铍(Be):1s^22s^25.硼(B):1s^22s^22p^16.碳(C):1s^22s^22p^27.氮(N):1s^22s^22p^38.氧(O):1s^22s^22p^49.氟(F):1s^22s^22p^510.氖(Ne):1s^22s^22p^611.钠(Na):1s^22s^22p^63s^112.镁(Mg):1s^22s^22p^63s^213.铝(Al):1s^22s^22p^63s^23p^114.硅(Si):1s^22s^22p^63s^23p^215.磷(P):1s^22s^22p^63s^23p^316.硫(S):1s^22s^22p^63s^23p^417.氯(Cl):1s^22s^22p^63s^23p^518.钾(K):1s^22s^22p^63s^23p^64s^119.钙(Ca):1s^22s^22p^63s^23p^64s^220.钪(Sc):1s^22s^22p^63s^23p^64s^23d^121.钛(Ti):1s^22s^22p^63s^23p^64s^23d^222.钒(V):1s^22s^22p^63s^23p^64s^23d^323.铬(Cr):1s^22s^22p^63s^23p^64s^13d^524.锰(Mn):1s^22s^22p^63s^23p^64s^23d^525.铁(Fe):1s^22s^22p^63s^23p^64s^23d^626.钴(Co):1s^22s^22p^63s^23p^64s^23d^727.镍(Ni):1s^22s^22p^63s^23p^64s^23d^828.铜(Cu):1s^22s^22p^63s^23p^64s^13d^1029.锌(Zn):1s^22s^22p^63s^23p^64s^23d^1030.镓(Ga):1s^22s^22p^63s^23p^64s^23d^104p^131.锗(Ge):1s^22s^22p^63s^23p^64s^23d^104p^232.砷(As):1s^22s^22p^63s^23p^64s^23d^104p^333.锑(Sb):1s^22s^22p^63s^23p^64s^23d^104p^434.钸(Te):1s^22s^22p^63s^23p^64s^23d^104p^535.碘(I):1s^22s^22p^63s^23p^64s^23d^104p^65s^24d^105p^536.高锝(Xe):1s^22s^22p^63s^23p^64s^23d^104p^65s^24d^105p^66s^24f^145d^5以上是1-36号元素基态原子核外电子的排布方式。
1-36核外电子排布式

[1]H氢1s1[2]He氦1s2[3]Li锂1s2 2s1 [4]Be铍1s2 2s2 [5]B硼1s2 2s2 2p1 [6]C碳1s2 2s2 2p2 [7]N氮1s2 2s2 2p3[8]O氧1s2 2s2 2p4[9]F氟1s2 2s2 2p5 [10]Ne氖1s2 2s2 2p6 [11]Na钠1s2 2s2 2p6 3s1 [12]Mg镁1s2 2s2 2p6 3s2 [13]Al铝1s2 2s2 2p6 3s2 3p1 [14]Si硅1s2 2s2 2p6 3s2 3p2[15]P磷1s2 2s2 2p6 3s2 3p3 [16]S硫1s2 2s2 2p6 3s2 3p4 [17]Cl氯1s2 2s2 2p6 3s2 3p5 [18]Ar氩1s2 2s2 2p6 3s2 3p6 [19]K钾1s2 2s2 2p6 3s2 3p6 4s1 [20]Ca钙1s2 2s2 2p6 3s2 3p6 4s2 [21]Sc钪1s2 2s2 2p6 3s2 3p6 3d1 4s21s2 2s2 2p6 3s2 3p6 3d2 4s2 [23]V 钒1s2 2s2 2p6 3s2 3p6 3d3 4s2 *[24]Cr铬1s2 2s2 2p6 3s2 3p6 3d5 4s1 [25]Mn锰1s2 2s2 2p6 3s2 3p6 3d5 4s2 [26]Fe铁1s2 2s2 2p6 3s2 3p6 3d6 4s2 [27]Co钴1s2 2s2 2p6 3s2 3p6 3d7 4s2 [28]Ni镍1s2 2s2 2p6 3s2 3p6 3d8 4s21s2 2s2 2p6 3s2 3p6 3d10 4s1 [30]Zn锌1s2 2s2 2p6 3s2 3p6 3d10 4s2 [31]Ga镓1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1 [32]Ge锗1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2 [33]As砷1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 [34]Se硒1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 [35]Br溴1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5[36]Kr氪1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6例3.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。
钛元素的化合价

钛元素的化合价
常见化合价:正2,正3,正4价;核内质子数:22;核外电子数:22;核电荷数:22;外围电子层排布:3d2 4s2;所属周期:4;所属族数:ⅣB;摩尔质量:48;外围电子排布:2、8、8、4;核外电子排布:2、8、10、2;晶体结构:晶胞为六方晶胞。
钛是一种银白色的过渡金属,其特征为重量轻、强度高、具金属光泽,耐湿氯气腐蚀。
但钛不能应用于干氯气中,即使是温度0度以下的干氯气,也会发生剧烈的化学反应,生成四氯化钛,再分解生成二氯化钛,甚至燃烧。
只有当氯气中的含水量高于百分之零点五的时候,钛在其中才能保持可靠的稳定性。
钛被认为是一种稀有金属,这是由于在自然界中其存在分散并难于提取。
但其相对丰富,在所有元素中居第十位。
钛的矿石主要有钛铁矿及金红石,广布于地壳及岩石圈之中。
钛亦同时存在于几乎所有生物、岩石、水体及土壤中。
钛最常见的化合物是二氧化钛,可用于制造白色颜料。
2020版《新高考 二轮专题突破+考前集训 化学》 题库 14专题十四 物质结构与性质(选修)

限时:40分钟1.(2019四川绵阳第三次诊断,35)氮、磷是植物生长所需的重要元素。
回答下列问题:(1)下列N原子电子排布图表示的状态中,能量由低到高的顺序是________(填标号)。
(2)羟氨(NH2OH)可看成是氨分子内的一个氢原子被羟基取代的衍生物,分子中N的杂化类型是________。
羟氨易溶于水,其主要原因是__________________________________。
(3)第一电离能I1(N)______I1(P)(填“>”“<”“=”),原因是________________________________________________________________________。
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,如图所示。
则由n个磷氧四面体形成的这类磷酸根离子的通式为____________。
(5)氮化锗具有耐腐蚀、硬度高等优点,晶体中锗原子与氮原子之间存在明显的sp杂化现象,氮化锗晶体属于________晶体。
一种氮化锗晶胞的球棍模型如图,其化学式为__________,若晶胞长方体的高为b pm,设阿伏加德罗常数值为N A,晶体的密度为ρg·cm-3,则晶胞底面正方形的边长为____________ pm(列出计算式)。
1.(1)A<C<B<D(2)sp 3杂化 羟氨分子与水分子均为极性分子,分子间都能形成氢键(3)> N 的原子半径比P 的原子半径小,原子核对最外层电子的吸引力较大(4)[P n O 3n +1](n +2)-(5)原子 Ge 3N 4 550b ρN A ×1015或550b ×10-10ρN A×1010 【解析】(1)基态N 原子具有的能量最低,激发态N 原子具有的能量较高,且较高能级轨道排布的电子越多,原子具有的能量越高,故N 原子能量由低到高的顺序是A <C <B <D 。
前三十六号元素价层电子排布式

前三十六号元素价层电子排布式1.氢(H)的电子配置为1s^1,其中的1表示电子所在的能级(层),s表示轨道类型,上标1表示轨道中只有一个电子。
2.氦(He)属于2族元素,它的电子配置为1s^23.锂(Li)属于3族元素,它的电子配置为1s^22s^14.铍(Be)属于4族元素,它的电子配置为1s^22s^25.硼(B)属于5族元素,它的电子配置为1s^22s^22p^16.碳(C)属于6族元素,它的电子配置为1s^22s^22p^27.氮(N)属于7族元素,它的电子配置为1s^22s^22p^38.氧(O)属于8族元素,它的电子配置为1s^22s^22p^49.氟(F)属于9族元素,它的电子配置为1s^22s^22p^510.氖(Ne)属于10族元素,它的电子配置为1s^22s^22p^6从11到18号元素,它们的电子配置均符合2s层和2p层的填充顺序:11.钠(Na)属于11族元素,它的电子配置为1s^22s^22p^63s^112.镁(Mg)属于12族元素,它的电子配置为1s^22s^22p^63s^213.铝(Al)属于13族元素,它的电子配置为1s^22s^22p^63s^23p^114.硅(Si)属于14族元素,它的电子配置为1s^22s^22p^63s^23p^215.磷(P)属于15族元素,它的电子配置为1s^22s^22p^63s^23p^316.硫(S)属于16族元素,它的电子配置为1s^22s^22p^63s^23p^417.氯(Cl)属于17族元素,它的电子配置为1s^22s^22p^63s^23p^518.氩(Ar)属于18族元素,它的电子配置为1s^22s^22p^63s^23p^6从19到36号元素,它们的电子配置符合3s层、3p层和3d层的填充顺序:19.钾(K)属于19族元素,它的电子配置为1s^22s^22p^63s^23p^64s^120.钙(Ca)属于20族元素,它的电子配置为1s^22s^22p^63s^23p^64s^221.钪(Sc)属于21族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^122.钛(Ti)属于22族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^223.钒(V)属于23族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^324.铬(Cr)属于24族元素,它的电子配置为1s^22s^22p^63s^23p^64s^13d^51s^22s^22p^63s^23p^64s^23d^526.铁(Fe)属于26族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^627.钴(Co)属于27族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^728.镍(Ni)属于28族元素,它的电子配置为1s^22s^22p^63s^23p^64s^23d^829.铜(Cu)属于29族元素,它的电子配置为1s^22s^22p^63s^23p^64s^13d^10。
1-36号元素电子排布式

1-36号元素电子排布式化学元素是组成物质的基本单位。
元素的属性不仅受到原子核中质子和中子的影响,电子的排布方式也在很大程度上决定了元素的性质。
为了更好的理解元素的性质以及化学反应过程,学习元素的电子排布式是非常必要的。
本篇文章将介绍1-36号元素的电子排布式。
1. 氢元素(H,原子序数1)氢元素只含有一个电子,因此其电子排布式为1。
2. 氦元素(He,原子序数2)氦元素包含2个电子,因此其电子排布式为1s2。
3. 锂元素(Li,原子序数3)锂元素包含3个电子,其电子排布式为1s2 2s1。
4. 铍元素(Be,原子序数4)铍元素包含4个电子,其电子排布式为1s2 2s2。
5. 碳元素(C,原子序数6)碳元素包含6个电子,其电子排布式为1s2 2s2 2p2。
6. 氮元素(N,原子序数7)氮元素包含7个电子,其电子排布式为1s2 2s2 2p3。
7. 氧元素(O,原子序数8)氧元素包含8个电子,其电子排布式为1s2 2s2 2p4。
8. 氟元素(F,原子序数9)氟元素包含9个电子,其电子排布式为1s2 2s2 2p5。
9. 氖元素(Ne,原子序数10)氖元素包含10个电子,其电子排布式为1s2 2s2 2p6。
10. 钠元素(Na,原子序数11)钠元素包含11个电子,其电子排布式为1s2 2s2 2p6 3s1。
11. 镁元素(Mg,原子序数12)镁元素包含12个电子,其电子排布式为1s2 2s2 2p6 3s2。
12. 铝元素(Al,原子序数13)铝元素包含13个电子,其电子排布式为1s2 2s2 2p6 3s2 3p1。
13. 硅元素(Si,原子序数14)硅元素包含14个电子,其电子排布式为1s2 2s2 2p6 3s2 3p2。
14. 磷元素(P,原子序数15)磷元素包含15个电子,其电子排布式为1s2 2s2 2p6 3s2 3p3。
15. 硫元素(S,原子序数16)硫元素包含16个电子,其电子排布式为1s2 2s2 2p6 3s2 3p4。
原子核外电子排布

钠 Na 2 2 6 1
镁 Mg 2 2 6 2
铝 Al 2 2 6 2 1
硅 Si 2 2 6 2 2
磷 P 22623
硫 S 22624
氯 Cl 2 2 6 2 5
氩 Ar 2 2 6 2 6
(备注:斜体元素为锕系、镧系,初高中理科教师群 100035163,Chol-2NBD 整理)
周原元元
镤 Pa 2 2 6 2 6 10 2 6 10 14 2 6 10 2 2 6 1 2
铀 U 2 2 6 2 6 10 2 6 10 14 2 6 10 3 2 6 1 2
镎 Np 2 2 6 2 6 10 2 6 10 14 2 6 10 4 2 6 1 2
钚 Pu 2 2 6 2 6 10 2 6 10 14 2 6 10 6 2 6
261
2
58 铈 Ce 2 2 6 2 6 10 2 6 10 1 2 6 1
2
59 镨 Pr 2 2 6 2 6 10 2 6 10 3 2 6
2
6(32) 60 钕 Nd 2 2 6 2 6 10 2 6 10 4 2 6
2
61 钷 Pm 2 2 6 2 6 10 2 6 10 5 2 6
2
62 釤 Sm 2 2 6 2 6 10 2 6 10 6 2 6
2
40 锆 Zr 2 2 6 2 6 10 2 6 2
2
41 铌 Nb 2 2 6 2 6 10 2 6 4
1
42 鉬 Mo 2 2 6 2 6 10 2 6 5
1
43 锝 Tc 2 2 6 2 6 10 2 6 5
2
44 钌 Ru 2 2 6 2 6 10 2 6 7
1
化学元素核外电子排布表
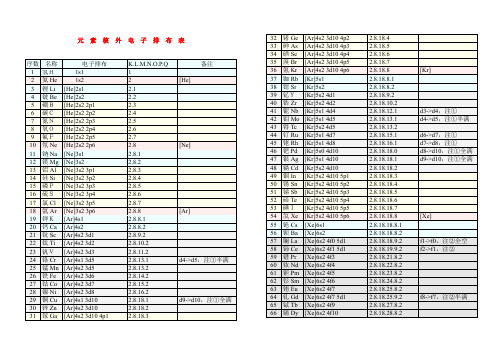
41
铌Nb
[Kr]5s1 4d4
2.8.18.12.1
d3->d4,注①
42
钼Mo
[Kr]5s1 4d5
2.8.18.13.1
d4->d5,注①半满
43
锝Tc
[Kr]5s2 4d5
2.8.18.13.2
44
钌Ru
[Kr]5s1 4d7
2.8.18.15.1
d6->d7,注①
45
2.8.18.32.11.2
74
钨W
[Xe]6s2 4f14 5d4
2.8.18.32.12.2
75
铼Re
[Xe]6s2 4f14 5d5
2.8.18.32.13.2
76
锇Os
[Xe]6s2 4f14 5d6
2.8.18.32.14.2
77
铱Ir
[Xe]6s2 4f14 5d7
2.8.18.32.15.2
69
铥Tm
[Xe]6s2 4f13
2.8.18.31.8.2
70
镱Yb
[Xe]6s2 4f14
2.8.18.32.8.2
71
镥Lu
[Xe]6s2 4f14 5d1
2.8.18.32.9.2
72
铪Hf
[Xe]6s2 4f14 5d2
2.8.18.32.10.2
73
钽Ta
[Xe]6s2 4f14 5d3
2.8.18.32.32.18.7
灰色为未发现元素
118
[Rn]7s2 5f14 6d10 7p6
2.8.18.32.32.18.8
注:①d亚层在s亚层外,常多填d亚层(使之趋于全满/半满),少填s亚层
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
钛的原子核外电子排步式
钛(Ti)元素原子的价电子排布式为:3d24s2,配离子[TiCl(H2O)5]2+的中心离子的符号为Ti3+。
钛(Titanium)是一种金属化学元素,化学符号Ti,原子序数22,在化学元素周期表中位于第4周期、第IVB族。
是一种银白色的过渡金属,其特征为重量轻、强度高、具金属光泽,耐湿氯气腐蚀。
但钛不能应用于干氯气中,即使是温度0℃以下的干氯气,也会发生剧烈的化学反应,生成四氯化钛,再分解生成二氯化钛,甚至燃烧。
只有当氯气中的含水量高于0.5%的时候,钛在其中才能保持可靠的稳定性。
钛在较高的温度下,可与许多元素和化合物发生反应。
各种元素,按其与钛发生不同反应可分为四类:
第一类:卤素和氧族元素与钛生成共价键与离子键化合物。
第二类:过渡元素、氢、铍、硼族、碳族和氮族元素与钛生成金属间化物和有限固溶体。
第三类:锆、铪、钒族、铬族、钪元素与钛生成无限固溶体。
第四类:惰性气体、碱金属、碱土金属、稀土元素(除钪外),锕、钍等不与钛发生反应或基本上不发生反应。
