第二章_大气环境化..(1)
大气环境化学

2、R和RO2等自由基的来源 R来源是乙醛和丙酮的光解: CH3- CHO + hγ→CH3 + HCO CH3- COCH3 + hγ→CH3 + CH3CO O和HO与烃类发生H摘除: R-H + O →R + HO R-H + HO →R + H2O RO2由烷基与空气中的O2结合而形成的: R + O2 → RO2
例如:大气中氯化氢的光化学反应过程: HCl + hγ → H + Cl ① H + HCl → H2 + Cl ② Cl + Cl → Cl2 (M) ③ ① 为初级过程 ②、③为次级过程
2、大气中重要光物质的光离解
大气中的光物质主要包括: O2、N2、O3、NO2、HNO2、HNO3、SO2、H2CO 和氯代烃。 (1)氧分子和氮分子的光离解:
⑤大气在以太阳为能源的庞大的蒸馏室中起冷凝器的作用, 形成降雨,从而把水从海洋输送到陆地,为陆地生物提 供了必要的生活条件。 ⑥大气还吸收来自外层空间的宇宙射线和来自太阳的大部 分电磁辐射,滤掉了被长小于290纳米的紫外辐射,使 地球上的生物兔受其伤害。
酸雨、温室效应、臭氧空洞是人们关注的主要环境问题。 一、大气层的结构 围绕地球的大气总质量约为5.5x105吨; 地球的总表面积约为5.1x1014平方米; 地球表面的压力,大致为1千克每平方厘米。 1、大气质量在铅直方向的分布: 大气质量在铅直方向的分布是极不均匀的。
环境化学把光化学反应分为: 初级过程和次级过程。 初级过程 : (相当于引发过程) 步骤为: A + hγ → A* 式中:A*—物种A的激发态; hγ—光量子。 次级过程:(传播和终止过程)
环境化学第二章

气在上升时温度降低值与上升高度的比。
Γd=0.98℃/100m≈1 ℃/100m
空气移动,高压区→低压,膨胀降温,压缩升温。 当气团在水平方向运动,非绝热过程。 当气团作垂直升降运动时,近似为绝热过程
第一节 大气中污染物的迁移
四、大气稳定度:指大气中某一高度上的气块在垂直方
第一节 大气中污染物的迁移
平流层(stratosphere) (12-48km) ①气温随高度增加而升高,Γ<0 ,层顶接近0℃, 20km-25km臭氧浓度最高; ②气体状态稳定,垂直对流很小,污染物成一薄层 ③空气稀薄,大气透明度高
民航:最高飞行10km左右 人造卫星:30-50km以上
第一节 大气中污染物的迁移 中间层(mesosphere )(48-78km) ①气温随高度增加而降低,气温可达-92℃; ②垂直运动剧烈; ③发生光化学反应。 热层(thermosphere)/电离层(80-800km) ①气温随高度增加而迅速升高,顶部可达1200℃ ②空气密度很小,气体电离。
第一节 大气中污染物的迁移
地理地势的影响
➢ 海风:白天陆地上空的气温增加得比海面上空快,在 海陆之间形成指向大陆的气压梯度,较冷的空气从海 洋流向大陆而形成海风。
➢ 陆风:夜间海水温度降低得较慢,海面的温度较陆地 高,在海陆之间形成指向海洋的气压梯度,于是陆地 上空的空气流向海洋,形成陆风。
冷
气
光物理过程
辐射跃迁: A* A h
通过辐射磷光或荧光失活
碰撞失活:A* M A M
为无辐射跃迁,即碰撞失活
光化学过程
光离解: A* B1 B2 生成新物质
与其它分子反应生成新物种:
《环境化学》第二章.ppt

平流层 -56 -2 17 55 O3
中层
-2 -92 55 85 O2+、NO+
热层
-92 1200 85 500 O2+、NO+、NO+
大气稳定度
大气中污染物的迁移
• 污染物在大气的迁移是指由污染源排放 出来的污染物由于空气的运动使其传输 和分散的过程。
• 影响大气污染物迁移的因素: (1)风和大气湍流的影响 (2)天气形势和地理形势的影响
(随时间累积) 5~10a
(随时间累积) 107a
(随时间累积) (随时间累积)
4~7a 0.2~0.5a
4~8a 2.5~4a 0.3~2a 0.5~4d 2~4d 5~6d 8~11d
性质
永 久 性 气不 体可
变 成 半分 永 久 气 体
可 变 成 分
大气各成分的作用
大气组成
主要作用
干
主要 N2 生物体的基本成分
(2)污染物体积与气样总体积的比值(体 积—体积浓度),常用单位为ppm或 ppb。适用于气态或蒸气态物质。
ppm系指在100万体积空气中含有害气体或蒸 气的体积数,表示百万分之一;ppb是ppm的 1/1000。
大气中污 染物的转
化
第三节 大气中重要的光 化学反应
自由基化学基础
• 自由基也称游离基,是指由于共价键均裂 而生成的带有未成对电子的碎片。
• 人为源是指人类的生产活动和生活活动 产生的污染物。
(1)工业污染源 (2)交通污染源 (3)农业污染源 (4)居民生活污染源
大气污染物组成分类
• 使大气产生污染的物质称为大气污染物。 物理状态
形成过程 化学组成
大气污染物浓度表示方法
环境化学答案

《大气环境化学》第二章重点习题及参考答案1.大气的主要层次是如何划分的每个层次具有哪些特点(1)主要层次划分:根据温度随海拔高度的变化情况将大气分为四层。
(2)各层次特点:①对流层:0~18km;气温随高度升高而降低;有强烈的空气垂直对流;空气密度大(占大气总质量的3/4和几乎全部的水汽和固体杂质);天气现象复杂多变。
②平流层:18~50km;平流层下部30~35km以下气温变化不大(同温层),30~35km以上随高度升高温度增大(逆温层);有一20km厚的臭氧层,可吸收太阳的紫外辐射,并且臭氧分解是放热过程,可导致平流层的温度升高;空气稀薄,水气、尘埃的含量极少、透明度好,很少出现天气现象,飞机在平流层低部飞行既平稳又安全;空气的垂直对流运动很小,只随地球自转产生平流运动,污染物进入平流层可遍布全球。
③中间层:50~80km;空气较稀薄;臭氧层消失;温度随海拔高度的增加而迅速降低;大气的垂直对流强烈。
④热层:80~500km;在太阳紫外线照射下空气处于高度电离状态(电离层),能反射无线电波,人类可利用它进行远距离无线电通讯;大气温度随高度增加而升高;空气更加稀薄,大气质量仅占大气总质量的0.5%。
热层以上的大气层称为逃逸层。
这层空气在太阳紫外线和宇宙射线的作用与大气温度不同,大气的压力总是随着海拔高度的增加而减小。
2.逆温现象对大气中污染物的迁移有什么影响?一般情况下,大气温度随着高度增加而下降,每上升100m,温度降低0.6℃左右。
即是说在数千米以下,总是低层大气温度高、密度小,高层大气温度低、密度大,显得“头重脚轻”。
这种大气层结容易发生上下翻滚即“对流运动”,可将近地面层的污染物向高空乃至远方疏散,从而使城市上空污染程度减轻。
因而在通常情况下,城市上空为轻度污染,对人体健康影响不大。
可是在某些天气条件下,一地上空的大气结构会出现气温随高度增加而升高的反常现象,从而导致大气层结“脚重头轻”,气象学家称之为“逆温”。
环境化学 第二章 大气环境化学

大气中重要吸光物质的光离解
4 3
(1) O2和N2的光离解
2
1 O2键能493.8KJ/mol。相 应波长为243nm。在紫外区 lgε 0 120-240nm有吸收。
O2 + hν
λ < 240 nm
-1 -2
O· + O·
N2键能:939.4KJ/mol。 对应的波长为127nm。
-3
-4
HNO
3
h ν HO NO
2
2
HO CO CO
H
2
H O 2 M HO 2HO
2
M
(有CO存在时)
H 2O 2 O 2
产生过氧自由基和过氧化氢
(5) SO2对光的吸收
SO2的键能为545.1kJ/mol, 吸收光谱 中呈现三条吸收带,键能大,240 - 400 nm 的光不能使其离解,只能生成激发态:
思考题:
太阳的发射光谱 和地面测得的太阳光 谱是否相同?为什么?
3.3大气中重要自由基来源
自由基 由于在其电子壳层的外层有
一个不成对的电子,因而有很高的活 性,具有强氧化作用。如:
CH 3 C(O)H hv H 3 C HCO
由于高层大气十分稀薄,自由基的半 衰期可以是几分钟或更长时间。自由基参 加反应,每次反应的产物之一是自由基, 最后通过另一个自由基反应使链终止,如:
SO 2 h SO 2
*
240 400 nm
SO2*在污染大气中可参与许多光化学反应。
( P73,图2-32)
(6) 甲醛的光离解
HCHO中H-CHO的键能为 356.5 kJ/mol, 它对 240 – 360 nm 范围内的光有吸收, 吸光后的光解反应为:
环境化学期末复习资料
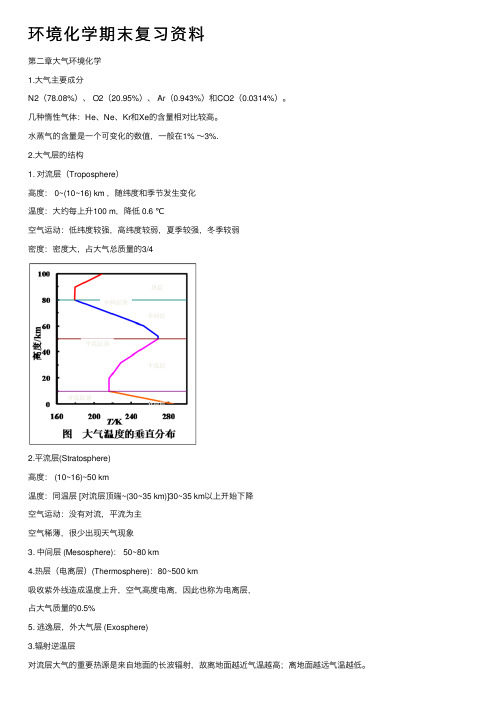
环境化学期末复习资料第⼆章⼤⽓环境化学1.⼤⽓主要成分N2(78.08%)、 O2(20.95%)、 Ar(0.943%)和CO2(0.0314%)。
⼏种惰性⽓体:He、Ne、Kr和Xe的含量相对⽐较⾼。
⽔蒸⽓的含量是⼀个可变化的数值,⼀般在1% ~3%.2.⼤⽓层的结构1. 对流层(Troposphere)⾼度: 0~(10~16) km ,随纬度和季节发⽣变化温度:⼤约每上升100 m,降低 0.6 ℃空⽓运动:低纬度较强,⾼纬度较弱,夏季较强,冬季较弱密度:密度⼤,占⼤⽓总质量的3/42.平流层(Stratosphere)⾼度: (10~16)~50 km温度:同温层 [对流层顶端~(30~35 km)]30~35 km以上开始下降空⽓运动:没有对流,平流为主空⽓稀薄,很少出现天⽓现象3. 中间层 (Mesosphere): 50~80 km4.热层(电离层)(Thermosphere):80~500 km吸收紫外线造成温度上升,空⽓⾼度电离,因此也称为电离层,占⼤⽓质量的0.5%5. 逃逸层,外⼤⽓层 (Exosphere)3.辐射逆温层对流层⼤⽓的重要热源是来⾃地⾯的长波辐射,故离地⾯越近⽓温越⾼;离地⾯越远⽓温越低。
随⾼度升⾼⽓温的降低率称为⼤⽓垂直递减率:Γ=-dT/dz式中:T——热⼒学温度,K;z——⾼度。
在对流层中,dT/dz<0,Γ = 0.6 K · (100m)-1,即每升⾼100 m ⽓温降低0.6 ℃。
⼀定条件下出现反常现象当Γ=0 时,称为等温层;当Γ<0 时,称为逆温层。
这时⽓层稳定性强,对⼤⽓的垂直运动的发展起着阻碍作⽤。
辐射逆温产⽣特点●是地⾯因强烈辐射⽽冷却降温所形成的。
●这种逆温层多发⽣在距地⾯ 100~150 m ⾼度内。
●最有利于辐射逆温发展的条件是平静⽽晴朗的夜晚。
●有云和有风都能减弱逆温。
●风速超过 2~3 m · s-1,逆温就不易形成4.主要⾃由基及其来源HO ?和HO2 ?来源1) HO ?来源清洁⼤⽓:O3 的光解是清洁⼤⽓中HO ?的重要来源O3 + h→ O ? + O2O ? + H2O → 2HO ?污染⼤⽓,如存在HNO2,H2O2 (HNO2 的光解是⼤⽓中HO ?的重要来源)HNO2 + h→ HO ? + NOH2O2 + h→ 2HO ?2)HO2 ?来源①主要来⾃醛类的光解,尤其是甲醛的光解H2CO + h→ H ? + HCO ?H ? + O2 + M → HO2 ? + MHCO ? + O2 → HO2 ? + CO②只要有 H ?和 HCO ?存在,均可与 O2 反应⽣成 HO2 ?③亚硝酸酯和 H2O2 光解CH3ONO + hv → CH3O ? + NOCH3O ? +O2 → HO2 ? + H2COH2O2 + hv → 2HO ?HO ? + H2O2 → H2O + HO2 ?④若有CO存在,则:HO ? + CO → CO2 + H ?H ? + O2 → HO2 ?R ?,RO ?,RO2 ?来源1) R ?烷基⾃由基来源:⼤⽓中存在最多的烷基是甲基,它的主要来源是⼄醛和丙酮的光解。
大气环境化学

合。在进行针对数据科学家的调查中,调查者要求数据专业人员指出他们 在25项不同数据科学技能上的熟练程度。
这项研究数据基于620名被访的数据专业人士,具备某种技能的百分比 反映了指出他在该技能上至少中等熟练程度的被访问者比例职位角色,即: 商业经理 = 250;开发人员 = 222;创意人员 = 221;研究人员 = 353。
大气的升温过程
太
阳
辐
射
地
大气吸收
大 气
面
辐
吸
射
收
地面增温 “太阳暖大地”
射向地面 地面
射向宇宙空 间 大气上界
大 气 吸 收
“大地暖大气”
• 气温垂直递减率对大气污染的影响
气温垂直递减率的大小直接影响大气的稳定性, 并进而影响到污染物的扩散:
当Г>0时,大气不稳定,有利于污染物的扩散, 减轻大气污染对地面层的影响;
数据科学
(3)创意人员: 统计 – 沟通(87%) 技术 – 处理结构化数据(79%) 商业 – 项目管理(77%) 统计 – 数据挖掘和可视化工具(77%) 数学&建模 – 数学(75%) 商业 – 产品设计和开发(68%) 统计 – 科学/科学方法(68%) 统计 – 数据管理(67%) 统计 – 统计学和统计建模(63%) 商业 – 商业开发(58%)
地理因素 地形和地貌的影响 山谷风 海陆风 城市热岛效应
其他因素 污染物的性质和成分
白天的海风
夜晚的陆风
第二节 大气污染及其 影响和危害
• 一、大气污染和大气污染物
•
大气污染的定义
起源于对有害影响的观察,即是指由于人类活动或自然过 程,改变了大气层中某些原有成分或增加了某些有毒有害物质, 致使大气质量恶化,影响原来有利的生态平衡体系,严重威胁 着人体健康和正常工农业生产,对建筑物和设备财产等造成损 坏,这种现象称为大气污染,也称空气污染。
环境化学_戴树桂版_第二版_课件_2第二章1节

800km的地方
(1) 温度随高度增加迅速增高;
(2) 大气更为稀薄;
(3) 大部分空气分子被电离成为离子和自由电子,又称电
离层,可以反射无线电波
9
10
5、逸散层(Stratopause )
(1) 800km以上高空 (2) 空气稀薄,密度几乎与太空相同 (3) 空气分子受地球引力极小,所以 气体及其微粒可以不断从该层逃逸出去
19km,两极8-9km,云雨主要发生层,夏季厚, 冬季薄。
特点:(1)气温随高度升高而降低。
(2)空气密度大。 (3)天气复杂多变。 (4)对流层下部湍流。
5
6
2、平流层(Stratosphere ):对流层顶到约50km的地
方
特点:
(1) 空气基本无对流,平流运动占显著优势。 (2) 空气比下层稀薄,水汽、尘埃含量很少,很少 有天气现象,透明度极高。 (3) 在15-35km的范围内(平流层上层),厚度约 20km的臭氧层。
d
故rd= C g p = 99 .5 .9 8 J m 6 k 1 2 K s 1 g 9.5 9 9 N .8 m 6 2 m 1 K s 1 = k 09 .9g .85 9 k K9 /.8 16 g m 02 m 0 2 m ms 1 K k s 1g (1N=1kg m s-2,1J=1N m)
一、大气垂直分层 二、基本气象要素 三、气块的绝热过程和干绝热递减率 四、大气稳定度 五、逆温 六、局地环流对污染物扩散的影响 七、大气化学组分介绍
4
一、大气垂直分层:
1962,WMO, 对流层、平流层、中间层、热成层、逸散 层。
) 1 、 对 流 层 (Troposphere : 平 均 厚 度 12km, 赤 道
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3、光化学烟雾的控对策
控制污染源,减少氮氧化物和碳氢化合物污染源的排放 预防光化学烟雾主要是控制污染源,减少氮氧化物和碳氢化合物的排
放。NO的主要来源是燃煤,近70%来自于煤炭的直接燃烧,可见固定源是 NO排放的重要来源。因此控制固定源的排放尤为重要。为此应采取以下措 施:
(1 )改善能源结构。推广使用天然气和二次能源,如煤气、液化石 油气、电等,加强对太阳能、风能、地热等清洁能2 ]
又因为:
d[SO2 dt
]
k 4 [O][SO2
]
可以解得:
ln
[SO2 ]t [SO2 ]0
k 4 [O]t
所以 [SO2 ]t [SO2 ]0 exp( k4[O]t)
现在把SO2被O ·氧化而消耗到起始浓度的1/e所需要的时间用τ表示,并称
20世纪40年代之后,随着全球工业和汽车业的迅猛发展,光化学烟雾污染在世界各地不断出现,如美国洛杉矶 、日本东京、大阪、英国伦敦、澳大利亚、德国等大城市均发生过光化学烟雾现象。鉴于光化学烟雾的频繁发生及 其造成危害巨大,如何控制其形成已成为令人注目的研究课题。
(2)特征: 烟雾蓝色 刺激物浓度峰值出现在中午和午后 污染区域出现在污染源下风向几十到几百公里的范围内 具有强氧化性,能使橡胶开裂 对眼睛、呼吸道等有强烈刺激,并引起头痛、呼吸道疾 病恶化,严重造成死亡 对植物叶子有害,能使大气能见度降低
但单重态的激发态SO2分子很不稳定,立即可以通过放出磷光转变 为三重态或基态。
1SO2+M→3SO2+M
1SO2+M→SO2+M
1SO2→SO2+hv
三重态的SO2分子在大气中比较稳定,寿命比较长,所以三重态的 SO2对于氧化和酸雨的形成有重要贡献。
因为基态的SO2分子没有三重态3SO2分子化学性质活波,所以三重 态SO2对于酸雨的贡献更大。
SO2 + HO · HOSO2 ·(25摄氏度,1atm,k=9×10-13cm3mol-1s-1) 自由基HOSO2 ·不稳定,立即进一步与大气中的氧分子作用:
HOSO2 ·+ O2+M HO2 ·+SO3+M SO3+H2O→H2SO4 HO2 ·+NO→HO ·+NO2 (污染大气中有NO,所以HO重生)
SO2的天然来源是火山喷发,喷发中大部分硫化物是以SO2形式存在的, 少部分以H2S形式存在。H2S在大气中又很快氧化成为SO2。
大气中的硫化合物包括H2S、二氧化硫、三氧化硫等,其中三氧化硫很 容易溶解于水形成硫酸,再与颗粒物作用生成硫酸盐气溶胶。
一般情况下SO2不容易直接被O2所氧化,需要将SO2先行激活(光化学的 激发态)或者需要氧化性更强的氧化剂来对之进行氧化。 实际测定研究结果说明:光强、湿度和氧化剂浓度都对SO2的氧化过程有 影响。 SO2在大气中转化的最终结果是形成硫酸-酸雨。
可见,在R·及RCO·寿命期内可以使多个NO转化成NO2。所以说,在 一个自由基形成之后到他灭亡之前可以参加多个自由基传递反应,
正是这种自由基传递过程提供了NO转化为NO2的最终条件。NO2既是 链反应的引发物质,又是链反应的终止物质。
2、光化学反应简化机制的总结
可概括为以下12个反应方程式
引发反应:
1、SO2的气相氧化
(1)直接光氧化(是否能直接光解?):
低层大气中SO2的吸光过程是变成激发态SO2分子,而不是造成 SO2的直接离解。激发态的SO2分子有两种:单重态和三重态。
SO2+hv(340-400nm)→3SO2 (三重态,电子自旋,平行,能态低)
SO2+hv(290-340nm)→1SO2 (单重态,电子自旋,反向,能态高)
(3)日变化曲线
总体上,白天生成,夜晚消失,污染物浓度峰值出现在中 午和午后。
烃类和NO发生在早上交通高峰时节,此时NO2浓度很低。 随太阳辐射增强,O3和NO2浓度逐渐增加,到中午已经较高, 一般O3和NO2浓度峰值比NO浓度峰值晚出现4-5小时。 推断:O3、NO2、PAN是主要二次污染物。 傍晚虽然交通繁忙,但是日光较弱,因此不足以引起光化 学反应。
NO2+hv→NO+O ·
O ·+O2+M→O3 +M
O3+NO→NO2+O2
自由基传递: RH+HO ·+O2→RO2 ·+H2O RCHO+HO ·+O2→RC(O)O2 ·+ H2O RCHO+hv+2O2→RO2 ·+HO2+CO HO2 ·+NO→NO2+HO · RO2 ·+NO+O2→NO2+ R`CHO+HO2 · RC(O)OO ·+NO+O2→NO2+RO2 ·+CO2 终止: NO2 +HO ·→HNO3 NO2+RC(O)OO ·→RC(O)OONO2 RC(O)OONO2→RC(O)OO ·+ NO2
大气中三重态3SO2分子比基态SO2分子容易被直接氧化:
3SO2+O2→SO4(3SO2和O2的结合体,不稳定,分解很快)→SO3+O·
或 SO4+SO2→2SO3
SO3+H2O→H2SO4
(2)被自由基氧化-间接光氧化:
污染大气中含有各类有机污染物的光解以及反应生成的各种自由基, 这些自由基大多具有强氧化性,因此SO2分子很容易被他们氧化 与HO ·自由基的反应是大气中SO2分子氧化的重要反应:
实验证明,树木在一定浓度范围内,吸收各种有毒气体,使污染的 空气得以净化。因此应大力提倡植树造林,绿化环境。
七、大气中硫氧化合物的转化
由污染源直接排放到大气中的主要硫氧化合物是SO2,人为污染源是含
硫矿物的燃烧过程,将矿物中的有机硫或元素硫氧化为SO2。一般煤中含硫 0.5-6%,石油0.5-3%。就全球范围,人为排放的SO2中有60%来自燃煤,30%来 自燃油。
(4)烟雾箱模拟揭示的机理
研究条件:封闭的容器+反应气体(丙烯(HC)、NOx、空气)+ 模拟太阳光照射 观察结果: 随时间增加,NO向NO2转化(NO消耗) 由于氧化而大量消耗丙烯(碳氢化合物消耗) 臭氧、PAN、HCHO、NO2等二次污染物生成 关键反应: NO2光解导致O3的生成(光化学反应_诱因) 丙烯氧化得到活性自由基,HO·,HO2·(自由基链反应_强化) 活性自由基促使NO向NO2转化,同时使PAN、O3等生成(结果)
第二章 大气环境化学 第三节 大气中污染物的转化
迁移过程只是使污染物在大气 中的空间分布发生了变化,是一
一、自由基化学基础 二、光化学反应基础
个物理过程。
三、大气中重要自由基的来源
而转化则使污染物的形态、组 四、大气中氮氧化物的转化
分、甚至种类发生了改变,要么 五、大气中碳氢化合物的转化
转化为无毒化合物,消除了污染, 六、光化学烟雾
(3)被原子氧、臭氧氧化:
污染大气中的原子氧主要来自NO2的光解。 NO2+hv→NO+O · k1 O ·+SO2→SO3 k4 另有反应:O ·+O2+M→O3 +M k2
由上述反应可得到:
d[O] dt
k1[NO2 ] k2[O][O2 ] k4[O][SO2 ]
稳态时,并且已知k4<<k1或k2,得到: [O]
(2)区域集中供热发展区域集中供暖供热,设立规模较大的热电厂和 供热站,取缔市区矮小烟囱。
(3)推广燃煤电厂烟气脱N技术。如选择性催化还原法(SCR)、非选 择性催化还原法(SNCR)和吸收法。选择性催化还原法是以金属铂的氧化 物作为催化剂,以氨、硫化氢和一氧化碳等作为还原剂,选择最佳脱硝反 应温度,将烟气中的氮氧化物还原为N2。非选择性催化还原法与选择性催 化还原法不同的是非选择性控制一定的反应温度,在将烟气中的氮氧化物 还原为N2的同时,一定量的还原剂还与烟气中的过剩氧发生反应。吸收法 是利用特定的吸收剂吸收烟气中的NO 。根据所使用的吸收剂,可分为碱吸 收法,溶融盐吸收法和稀硝酸吸收法。
使用化学抑制剂目的是消除自由基,以抑制链式反应的进行,从而 控制光化学烟雾的形成。人们发现二乙基羟胺,苯胺,二苯胺,酚等对 氢氧自由基有不同的抑制作用,尤其是二乙基羟胺(DEHA)对光化学烟 雾有较好的抑制作用。在大气中喷洒0.05ppm的二乙基羟胺,能有效抑 制光化学烟雾,利于环保。但在使用的过程中,要注意抑制剂对人体和 动植物的毒害作用,并注意防止抑制剂产生二次污染。 植树造林
就会由光化学反应引发一系列的化学过程,产生一些氧化性很强的物质, 如臭氧、PAN,HNO3,H2O2等二次污染物,该过程实际就是光化学烟雾的形 成过程。
(1)概念:主要含有氮氧化物和碳氢化合物等一次性污染物的大气,在阳 光照射下发生化学反应而产生的二次污染物,这种由一次污染物和二次污 染物的混合物所形成的烟雾污染现象,称为光化学烟雾,因最早在1943年 的美国洛杉矶首先发现,因此又称为洛杉矶烟雾。
为O ·氧化的特征时间,则有: k2[O2 ]
k4k1[NO2 ]
作用:对比不同物质的特征氧化时间,比较其氧化特性
可以定义SO2在单位时间的转化百分数。 X+SO2→SO3 k
则
d[SO2 dt
]
k[ X
][SO2
与其他自由基的反应:
二元活性自由基 CH3CHOO ·+SO2→CH3CHO+SO3 (白天主要与HO·反应,夜间发生该反应,二元自由基来源于前述的臭氧 和烯烃的反应)
