欧洲药典对乙酰氨基酚原料质量标准——有关物质检测(译文)
对乙酰氨基酚
不得过0.1%
不得过0.1%
不得过0.1%
不得过0.10%
不得过0.1%
重金属
不得过百万分之十
不得过0.001%
不得过20ppm
不得过10ppm
不得过20ppm
砷盐
不得过2ppm
易炭化物
应符合规定
有机挥发性杂质
应符合规定(气相色谱法)
含量测定
按干燥品计,含对乙酰氨基酚应为98.0%~102.0%(紫外分光光度法)
(5)焰色反应:乙酰基红外 Nhomakorabea谱:应与对照的图谱一致
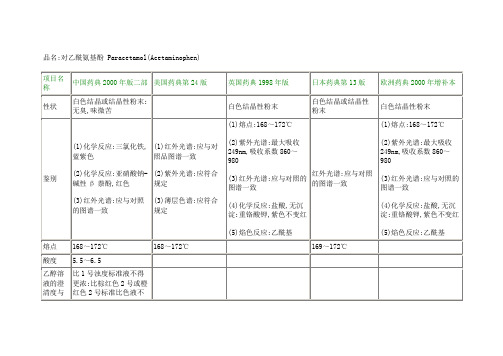
(1)熔点:168~172℃
(2)紫外光谱:最大吸收249nm,吸收系数860~980
(3)红外光谱:应与对照的图谱一致
(4)化学反应:盐酸,无沉淀;重铬酸钾,紫色不变红
(5)焰色反应:乙酰基
熔点
168~172℃
168~172℃
169~172℃
酸度
5.5~6.5
乙醇溶液的澄清度与颜色
比1号浊度标准液不得更浓;比棕红色2号或橙红色2号标准比色液不得更深
氯化物
不得过0.01%
不得过0.014%
不得过0.014%
硫酸盐
不得过0.02%
不得过0.02%
不得过0.019%
有关物质
应符合规定(薄层色谱法)
应符合规定(薄层色谱法)
应符合规定(高效液相色谱法)
应符合规定(薄层色谱法)
按无水物计,含对乙酰氨基酚应为98.0%~101.0%(紫外分光光度法)
按干燥品计,含对乙酰氨基酚应为99.0%~101.0%(铵-硫酸铯液,菲绕啉离子试剂)
按干燥品计,含对乙酰氨基酚不得少于98.0%(紫外分光光度法)
对乙酰氨基酚含量测定公式_概述及解释说明

对乙酰氨基酚含量测定公式概述及解释说明1. 引言1.1 概述在医药领域中,乙酰氨基酚是一种常见的非处方药物,被广泛应用于缓解头痛、发热和肌肉酸痛等不适症状。
针对乙酰氨基酚含量的准确测定十分重要,因为它直接关系到药物的安全性和有效性。
本文旨在综述并详细解释乙酰氨基酚含量测定公式以及其应用。
1.2 文章结构本文主要分为五个部分。
首先,在引言部分提出了问题,并介绍了本文的目标与意义。
其次,第二部分将简要介绍乙酰氨基酚的概述、含量测定的重要性以及公式在实际应用中的作用和场景。
接下来,第三部分将深入解析乙酰氨基酚含量测定公式的组成原理和常见误差影响因素。
第四部分将通过实例分析与案例讨论来演示公式的具体使用过程、数据处理和结果分析,并讨论实验中可能遇到的挑战以及相应解决方案。
最后,在第五部分中,我们将总结研究内容与发现结果,并展望乙酰氨基酚含量测定公式未来的发展方向并提出建议。
1.3 目的本文的目的是全面梳理乙酰氨基酚含量测定公式,并通过实例和案例讨论解释其使用方法和注意事项。
同时,对于公式的组成原理进行详细阐述,并探讨常见误差和其影响因素,以帮助读者更好地理解该公式的有效使用。
通过本文的阐述和分析,旨在为相关领域从业人员提供参考,并促进乙酰氨基酚含量测定公式在未来的改进与发展。
2. 乙酰氨基酚含量测定公式简介:2.1 乙酰氨基酚的概述:乙酰氨基酚,化学名为N-乙酰对氨基酚,是一种常用的解热镇痛药物。
它具有退热、镇痛和抗炎等药理作用,并且被广泛应用于医药领域。
乙酰氨基酚可以通过口服片剂、栓剂、注射液等多种形式进行使用。
2.2 含量测定的重要性:在制药过程中,准确测定乙酰氨基酚的含量是非常重要的。
合理控制其含量可以保证药品质量稳定,确保疗效的有效发挥。
因此,开发一种准确可靠的含量测定公式对于质量控制至关重要。
2.3 公式的作用和应用场景:乙酰氨基酚含量测定公式是一种数学模型或算法,根据已知实验数据和物质特性,通过计算来确定乙酰氨基酚的含量。
欧洲药典附录中文版.

第二部分、附录附录1 溶液的澄清度 (2)附录2 溶液颜色检查 (3)附录3 旋光度 (7)附录4 铵盐检查法 (9)附录5 氯化物检查法 (11)附录6 硫酸盐灰分 (13)附录7 铁 (14)附录8 重金属 (16)附录9 干燥失重 (21)附录10 硫酸盐检查法 (23)附录11 红外吸收分光光度法 (25)附录12 pH测定 (29)附录13 滴定 (34)附录14 氯化物鉴别反应 (37)附录15 指示剂颜色与溶液pH 的关系 (38)附录1 溶液的澄清度在内径15~25mm,平底,无色、透明、中性玻璃管中,加入等量的供试溶液与浊度标准液,使液位的深度都为40mm,按如下所述方法进行比较。
浊度标准液制备5分钟后,以色散自然光照射浊度标准溶液和供试溶液,在黑色背景下从垂直方向观察、比较澄清度或浑浊程度。
色散自然光必须较容易区分浊度标准溶液Ⅰ与水,浊度标准溶液Ⅱ与浊度标准溶液Ⅰ。
如果供试溶液的澄清、透明程度与水相同,或者与所用溶剂相同,或者其澄清度不超过Ⅰ号浊度标准溶液,那么可判定该溶液为澄清。
试剂:硫酸肼溶液:取1.0g硫酸肼溶于水,加水稀释至100.0ml,静置4~6小时。
乌洛托品(六亚甲基四胺)溶液:在100ml容量平中,以25.0ml水溶解2.5g乌洛托品。
浊度标准贮备液:在存放乌洛托品溶液的100ml容量瓶中,加25.0ml的硫酸肼溶液。
混合,静置24小时,贮存在无表面要求的玻璃容器中,可在2个月内使用。
该浊度液不得黏附玻璃,用前必须充分摇匀。
浊度标准原液:取浊度标准贮备液15ml,加水稀释、定容至1000ml。
该液临用前制备,至多保存24小时。
浊度标准液:由浊度标准原液与水按表1-1配制,即得。
本液应临用前配制。
表1-1附录2 溶液颜色检查按本药典规定,用下面两种方法之一可以检出溶液在棕色-黄色-红色范围内的颜色。
如果溶液A的外观与水或所用溶剂相同,或者颜色浅于标准比色液B9,则可判定溶液A为无色。
实训六--对乙酰氨基酚片的质量检验教学总结

实训六--对乙酰氨基酚片的质量检验教学总结实训六对乙酰氨基酚片的质量检验一、实训目标通过本实训,要求掌握对乙酰氨基酚片的质量检验的程序、方法与操作技能,掌握检验结果的处理与判断,能够规范书写检验原始记录及检验报告书。
二、质量标准对乙酰氨基酚片Duiyixian’anjifen PianParacetamol Tablets本品含对乙酰氨基酚(C8H9NO2)应为标示量的95.0%~105.0%。
【性状】本品为白色片、薄膜衣或明胶包衣体,除去包衣后显白色。
【鉴别】取本品的细粉适量(约相当于对乙酰氨基酚0.5g),用乙醇20ml分次研磨使对乙酰氨基酚溶解,滤过,合并滤液,蒸干,残渣照对乙酰氨基酚项下鉴别(1)(2)项试验,显相同反应。
【检查】溶出度取本品,照溶出度测定法(附录1[1]ⅩC第一法),以稀盐酸24ml 加水至1000ml为溶出介质,转速为每分钟100 转,依法操作,经30分钟时,取溶液5ml 滤过,精密量取续滤液1ml,加0.04%氢氧化钠溶液稀释至50ml,摇匀,照紫外-可见分光光度法(附录ⅣA),在257nm 的波长处测定吸光度,按C8H9NO2的吸收系数(E cm%11)为715计算出每片的溶出量,限度为标示量的80%,应符合规定。
其他应符合片剂项下有关的各项规定(附录ⅠA)。
【含量测定】取本品10片,精密称定,研细,精密称取适量(约相当于对乙酰氨基酚40mg),置250ml量瓶中,加0.4%氢氧化钠溶液50ml及水50ml,振摇15分钟,加水至刻度,摇匀,用干燥滤纸滤过,精密量取续滤液5ml,照对乙酰氨基酚含量测定项下方法,自“置100ml量瓶中”起,依法测定,即得。
【类别】同对乙酰氨基酚。
【规格】 (1) 0.1g (2) 0.3g (3) 0.5g【贮藏】密封保存。
四、实训过程(一)仪器、试药准备及实训用液的制备1、实训用仪器与试药的准备仪器:溶出仪、紫外分光光度仪、电子或分析天平(感量0.1mg)、托盘天平、称量瓶、试管、小烧杯(50ml、10ml)、量筒(1000ml、100ml)、胶头滴管、移液管(5ml、1ml)、量瓶(250ml、100ml、50ml)、注射器(10ml)、漏斗、干燥器、玻棒及乳钵。
[答案][西安交通大学]《药物分析》作业
![[答案][西安交通大学]《药物分析》作业](https://img.taocdn.com/s3/m/f05c53cf6edb6f1afe001f4e.png)
1.砷盐检查法中,醋酸铅棉花的作用是()[答案:D]A.消除锑对检查的干扰B.消除铅对检查的干扰C.消除铁对检查的干扰D.消除硫化物对检查的干扰E.消除氯化氢气体对检查的干扰2.《中国药典》(2010年版)将生物制品列入()[答案:C]A.第二部附录B.第二部C.第三部D.第一部附录E.第一部3.用酸度计测定溶液的pH值,测定前应用pH值与供试液较接近的一种标准缓冲液调节仪器旋钮,使仪器pH示值与标准缓冲液的pH值一致,此操作步骤为()[答案:E]A.调节零点B.调节斜率C.校正温度D.平衡E.定位4.按《中国药典》(2010年版)的规定,红外光谱仪校正的项目有()[答案:B]A.波数的准确性和杂散光B.波数的准确性和分辨率C.检测灵敏度和杂散光D.检测灵敏度和分辨率E.杂散光和分辨率5.检查药物中的残留溶剂,各国药典均采用()[答案:E]A.高效液相色谱法B.薄层色谱法C.紫外-可见分光光度法D.滴定分析法E.气相色谱法6.《中国药典》(2010年版)薄层色谱法在检查中主要应用于()[答案:A]A.溶液颜色的检查B.水分的测定C.有机溶剂残留量的测定D.有关物质的检查E.一般杂质检查7.《中国药典》(2010年版)检查对乙酰氨基酚中的对氨基酚及有关物质采用的方法是()[答案:A]A.高效液相色谱法B.薄层色谱法C.紫外分光光度法D.气相色谱法E.比色法8.测定某药物的比旋度,若供试品溶液的浓度为10.0mg/ml,样品管长度为2dm,测得的旋光度值为2.02,则比旋度为()[答案:E]A.202B.20.0C.2.02D.101E.10.19.适用于贵重药物和空气中易氧化药物干燥失重测定的方法是()[答案:C]A.电泳法B.热重分析法C.差示热分析法D.差示扫描量热法E.X-射线粉末衍射法10.盐酸氯丙嗪需检查溶液的颜色,此项目检查的杂质是()[答案:B]A.铁盐B.重金属C.因被还原而产生的杂质D.因被氧化而产生的杂质E.因聚合而产生的杂质11.取供试品,加氢氧化钠试液溶解后,加铁氰化钾试液和正丁醇,振摇,放置分层后醇层显强烈的蓝色荧光,加酸使成酸性,荧光消失,再加碱使成碱性,荧光又出现。
对乙酰氨基酚中国药典标准

对乙酰氨基酚中国药典标准对乙酰氨基酚(Acetaminophen)是一种非处方药,常用于退烧、解热和缓解轻至中度疼痛。
它也是中国药典标准中规定的药物之一。
下面将对乙酰氨基酚的中国药典标准进行详细介绍。
【名称与含量】乙酰氨基酚 Acetaminophen含量:不低于99.0%(干燥物)【性状】乙酰氨基酚为白色或类白色结晶或结晶性粉末。
无臭或微有香气。
味微苦。
【标识】初步有色试验:取少许样品于试管中,加乙醚5ml,振摇均匀,用杯之反光观察。
酸碱指示剂试验:取少许样品于试管中,加水2ml,试管缓缓倾斜,将水平面观察,比较强酸指示剂用于酸性试液,比较弱碱指示剂液用于碱性试液。
【溶解度】准备不同溶剂,分别加入适量的乙酰氨基酚,观察其溶解情况:水:在18℃下,1g乙酰氨基酚可溶于80ml水。
醇:在25℃下,1g乙酰氨基酚可溶于3ml 乙醇或1ml丙酮。
【透明度和颜色】取适量乙酰氨基酚,在日光或自然阳光下观察其颜色。
【酸度或碱度】将乙酰氨基酚溶解于水,用酸度试纸测定其酸度,应无碱性反应。
【重金属】取适量乙酰氨基酚,采用火焰原子吸收光谱法,进行重金属检测。
【残留量】取适量乙酰氨基酚,进行残留有机溶剂的测定,应符合药典中的要求。
【纯度】乙酰氨基酚的纯度可通过高效液相色谱法(HPLC方法)进行测定。
其中的样品供试品溶液,试液采用正己烷-乙酸乙酯-甲酸-异丙醇(10:2:2:2)的溶液,流动相为甲酮-水-甲醇(250:300:450)。
在特定的检测条件下测定其纯度,并计算出纯度百分数。
【杂质】通过气相色谱法进行杂质的测定,如异丙酮、水和无机物等。
【微生物限度】对乙酰氨基酚的微生物限度应符合药典的规定,可使用菌落总数、大肠杆菌、沙门氏菌和金黄色葡萄球菌等指标进行检测。
【贮藏】将乙酰氨基酚贮存在密闭容器中。
贮存期限应符合药典规定,一般不得超过两年。
应避光,防潮,干燥处保存。
【附则】本品为白色结晶性粉末。
总结起来,乙酰氨基酚的中国药典标准主要涵盖了名称与含量、性状、标识、溶解度、透明度和颜色、酸度或碱度、重金属、残留量、纯度、杂质、微生物限度、贮藏等方面的要求。
对乙酰氨基酚中国药典标准

对乙酰氨基酚中国药典标准# 乙酰氨基酚中国药典标准## 引言乙酰氨基酚(Acetaminophen),通常被称为对乙酰氨基酚,是一种广泛应用于医药领域的药物,具有镇痛和退热的功效。
其在医学实践中的广泛使用,使其成为世界卫生组织基本药物之一。
为了确保对乙酰氨基酚的质量、安全和有效性,中国药典对其进行了详细的标准规范,以指导药品生产、检验和使用。
本文将对对乙酰氨基酚中国药典标准进行全面而系统的介绍,以确保对该药物的合理应用和科学研究。
## 1. 药品名称和标识对乙酰氨基酚的药品名称应按照国家相关规定确定,包括通用名称、商品名称等。
在药品包装上应有清晰的标识,包括药品名称、规格、批号、生产日期、有效期等信息。
这些信息的准确标注有助于对乙酰氨基酚药品的溯源和监管。
## 2. 质量要求### 2.1 外观和性状药典规定了对乙酰氨基酚的外观和性状标准。
这包括颜色、形状、气味等方面的描述,以确保药品的外观符合质量标准,且易于辨识。
### 2.2 质量标准对乙酰氨基酚的质量标准主要包括物理和化学性质、纯度、含量等方面。
这些标准是确保对乙酰氨基酚在生产和使用过程中具有一致的质量特性的关键因素。
### 2.3 杂质和掺杂物药典详细列举了对乙酰氨基酚中可能存在的杂质和掺杂物,并规定了其合理的限量范围。
这有助于防止因不纯物质引起的药品不良反应,确保患者的用药安全。
## 3. 检验方法为了确保对乙酰氨基酚的质量控制,药典明确了一系列检验方法,包括但不限于物理检验、化学检验、显微镜检验等。
这些方法既考虑了对乙酰氨基酚的主要成分,又对可能的杂质和掺杂物进行了检测。
## 4. 贮存对乙酰氨基酚在贮存过程中容易受到湿度、温度等因素的影响,因此药典规定了合适的贮存条件,包括避光、防潮、通风等要求。
这有助于保持药品的稳定性和有效性。
## 5. 包装药典规定了对乙酰氨基酚的包装要求,确保药品在运输和使用过程中不受到外界环境的影响。
包装材料的选择、标签的标注等方面都有详细的规定。
欧洲药典-凡例(中英文对照)

欧洲药典-凡例1.1. GENERAL STATEMENTSThe General Notices apply to all monographs and other texts of the European Pharmacopoeia.总论的内容适用于各论和欧洲药典中的其它章节。
The official texts of the European Pharmacopoeia are published in English and French. Translations in other languages may be prepared by the signatory States of the European Pharmacopoeia Convention. In case of doubt or dispute, the English and French versions are alone authoritative.欧洲药典以英语和法语形式发行,欧洲药典委员会的签署国可将药典内容译成其它语言,但若发生争议,应以英语和法语版为权威。
In the texts of the European Pharmacopoeia, the word "Pharmacopoeia" without qualification means the European Pharmacopoeia. The official abbreviation Ph. Eur. may be used to indicate the European Pharmacopoeia.在欧洲药典中,如无特殊规定,“药典”是指欧洲药典,缩写Ph. Eur.也指欧洲药典。
The use of the title or the subtitle of a monograph implies that the article complies with the requirements of the relevant monograph. Such references to monographs in the texts of the Pharmacopoeia are shown using the monograph title and reference number in italics.文章中如果引用了各论中的标题和副标题意味着文章内容符合相关各论的要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
EP检测方法:Related substances. Liquid chromatography (2.2.29). Prepare the solutions immediately before use.Test solution. Dissolve 0.200 g of the substance to be examined in 2.5 mL of methanol R containing 4.6 g/L of a 400 g/L solution of tetrabutylammonium hydroxide R and dilute to 10.0 mL with a mixture of equal volumes of a 17.9 g/L solution of disodium hydrogen phosphate R and of a 7.8 g/L solution of sodium dihydrogen phosphate R.Reference solution (a). Dilute 1.0 mL of the test solution to 50.0 mL with the mobile phase. Dilute 5.0 mL of this solution to 100.0 mL with the mobile phase.Reference solution (b). Dilute 1.0 mL of reference solution (a) to 10.0 mL with the mobile phase.Reference solution (c). Dissolve 5.0 mg of 4-aminophenol R,5 mg of paracetamol CRS and 5.0 mg of chloroacetanilide R in methanol R and dilute to 20.0 mL with the same solvent. Dilute 1.0 mL to 250.0 mL with the mobile phase.Reference solution (d). Dissolve 20.0 mg of 4-nitrophenol R in methanol R and dilute to 50.0 mL with the same solvent.Dilute 1.0 mL to 20.0 mL with the mobile phase.有关物质。
液相色谱(2.2.29)。
溶液临用现配。
供试品溶液:取0.200g的物质溶解在2.5ml甲醇溶液(含有400g/L的氢氧化四丁铵溶液4.6g/L)中,再用17.9 g/L 的磷酸氢二钠溶液和7.8 g/L磷酸二氢钠溶液的等体积混合液稀释至10ml。
对照溶液A:取供试品溶液1.0ml用流动相稀释至50ml,再取该溶液5.0ml稀释至100.0ml。
对照溶液B:取对照溶液A 1.0ml用流动相稀释至10ml。
对照溶液C:取5.0mg4-aminophenol对照品,5mgparacetamol CRS对照品和5.0mg chloroacetanilide对照品用甲醇溶解并稀释到20.0ml。
取1.0ml用流动相稀释至250.0ml。
对照溶液D:取20.0mg 4-nitrophenol对照品用甲醇溶解和稀释到50.0ml。
取1ml用流动相稀释至20ml。
Column:—size: l = 0.25 m, Ø = 4.6 mm,— stationary phase: octylsilyl silica gel for chromatography R(5 μm),— temperature: 35 °C.Mobile phase: mix 375 volumes of a 17.9 g/L solution ofdisodium hydrogen phosphate R, 375 volumes of a 7.8 g/Lsolution of sodium dihydrogen phosphate R and 250 volumesof methanol R containing 4.6 g/L of a 400 g/L solution oftetrabutylammonium hydroxide R.Flow rate: 1.5 mL/min.Detection: spectrophotometer at 245 nm.Injection: 20 μL.Run time: 12 times the retention time of paracetamol.Relative retentions with reference to paracetamol (retentiontime = about 4min) : impurity K = about 0.8 ; impurity F = about 3;impurity J = about 7.色谱柱:C-8色谱柱250mm*4.6mm*5μm柱温:35°C。
流动相:17.9g/L磷酸氢二钠:7.8g/L的磷酸二氢钠溶液:甲醇溶液(含400g/L的四丁基氢氧化铵4.6g/L)=375:375:250。
流量:1.5毫升/分钟。
检测波长245nm。
进样量:20μL。
运行时间:12倍扑热息痛的保留时间。
相对保留(参照对乙酰氨基酚,保留时间约4分钟):杂质K = 0.8;杂质F = 3;杂质J=7。
System suitability :reference solution (c) :— resolution: minimum 4.0 between the peaks due toimpurity K and to paracetamol,— signal-to-noise ratio : minimum 50 for the peak due toimpurity J.Limits :— impurity J : not more than 0.2 times the area of thecorresponding peak in the chromatogram obtained withreference solution (c) (10 ppm),— impurity K: not more than the area of the correspondingpeak in the chromatogram obtained with referencesolution (c) (50 ppm),— impurity F: not more than half the area of the correspondingpeak in the chromatogram obtained with referencesolution (d) (0.05 per cent),— any other impurity : not more than half the area of theprincipal peak in the chromatogram obtained with referencesolution (a) (0.05 per cent),— total of other impurities : not more than the area of theprincipal peak in the chromatogram obtained with referencesolution (a) (0.1 per cent),—disregard limit for the calculation of the total of other impurities : the area of the principal peak in thechromatogram obtained with reference solution (b) (0.01 percent).系统适用性:对照溶液(c):对乙酰氨基酚峰与杂质K之间分离度不得小于4.0,信噪比: 杂质J不得小于50.限度:——杂质J:不超过对照(c)相应峰的0.2倍(10 ppm),——杂质K: 不超过对照(c)相应峰(50ppm),——杂质F:不大于对照溶液(d)中相应峰面积的0.5倍(0.05%),——任何其他杂质:不大于对照溶液A中主峰面积的0.5倍(0.05%),——总其他杂质:不得大于对照溶液A中主峰面积(0.1%),——可忽略计算的杂质:峰面积小于杂质B中主峰面积的杂质(0.01%)A. R1 = R3 = R4 = H, R2 = OH: N-(2-hydroxyphenyl)acetamide,B. R1 = CH3, R2 = R3 = H, R4 = OH: N-(4-hydroxyphenyl)propanamide,C. R1 = R2 = H, R3 = Cl, R4 = OH: N-(3-chloro-4-hydroxyphenyl)acetamide,D. R1 = R2 = R3 = R4 = H: N-phenylacetamide,H. R1 = R2 = R3 = H, R4 = O-CO-CH3 : 4-(acetylamino)phenyl acetate,J. R1 = R2 = R3 = H, R4 = Cl: N-(4-chlorophenyl)acetamide (chloroacetanilide),E. X = O, R2 = H, R4 = OH: 1-(4-hydroxyphenyl)ethanone,G. X = N-OH, R2 = H, R4 = OH: 1-(4-hydroxyphenyl)ethanoneoxime,I. X = O, R2 = OH, R4 = H: 1-(2-hydroxyphenyl)ethanone,F. R = NO2: 4-nitrophenol,K. R = NH2: 4-aminophenol.。
