第4章 炔烃 二烯烃 红外光谱
第四章 炔烃 二烯烃 红外光谱

H
C
③
C①0.134nm C② 122.4°
H
H
C④ H
特点:①π电子云,非“定域” 而是发生了“离域”。
② p轨道平行且相邻时,才发生离域。 离域能 热值体现。
从氢化
现在你正浏览到当前第三十页,共五十四页。
共轭效应(离域效应):
分类:
①π,π共轭效应(单双键交替) ②σ,π超共轭效应( σ键与相邻π键的共轭)
R’
C=C
H
H
例如:
CH2=CH—CH2—C≡CH + H2
林德拉催化剂
CH2=CH—CH2—CH=CH2 顺式加成产物
现在你正浏览到当前第十四页,共五十四页。
⒉ 亲电加成: ① 和卤素加成
HC≡CH Cl2
X2 HC≡CH +I2
HClC=CClH Cl2 X2
I
H
C=C
H
I
HCl2C—CCl2H
(选择性加成)
解释:碳原子采用sp杂化吸电子能力强,形成碳正离子需要更高 的活化能。
现在你正浏览到当前第十六页,共五十四页。
② 和氢卤酸加成
Ⅰ:符合马尔科夫尼科夫规则加成,比烯烃困难些。
R—C≡CH
HX R—C=CH2 HX X
X R—C—CH3
X
可控制在一分子加成上
若要加速反应可采用亚铜盐或汞盐作为催化剂。
乙炔亚铜(红色)
+ 2NH4Cl +2NH3
现在你正浏览到当前第十一页,共五十四页。
金属炔化物干燥状态下受热或受撞击时,易发生爆炸。所以实 验室中不拟再利用的重金属炔化物,应即加酸予以处理。
AgC≡CAg △ 2Ag + 2C + 364KJ/mol
第四章 炔烃 二烯烃 红外光谱
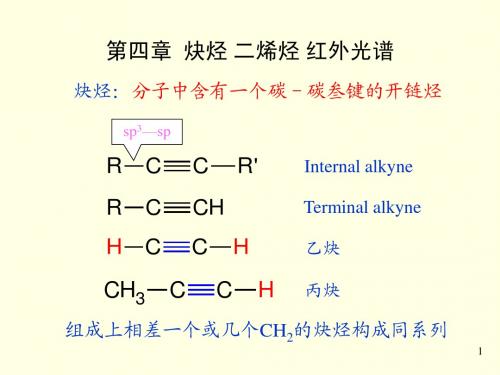
炔烃:分子中含有一个碳-碳叁键的开链烃
sp3—sp
R R H
CH3
C C C
C
C CH C
C
R'
Internal alkyne Terminal alkyne
H
H
乙炔 丙炔
组成上相差一个或几个CH2的炔烃构成同系列
1
炔烃的结构-sp杂化轨道
杂化
2
乙炔的结构-轨道重叠成键图
1,3-丁二烯的分子轨道图
反键轨道
成键轨道
29
共轭效应的解释-氢化热与键长
π键
大π键
30
共轭效应的解释-1,4-加成
Allylic: next to a double bond
31
烯丙基型碳正离子的轨道结构
32
烯丙基型碳正离子的共振结构表达式
The true structure is the combination of the two resonance hybrid A mule is the hybrid of a horse and a donkey
有机化学的四大光谱
质谱 红外光谱 核磁共振 紫外光谱
54
分子中化学键的振动形式-伸缩振动
(伸缩振动)
1 % ν= f ( m1 + m2 ) 2π c m1m2
1 % ν (cm ) = λ (cm) (波数)
−1
55
分子中化学键的振动形式-弯曲振动
(面内) (弯曲振动)
剪式(Scissoring)
7
酸性的比较-负离子的稳定性
8
负离子稳定性对酸性强弱的影响
9
炔烃的反应-催化加氢
有机化学课件 炔烃、二烯烃及红外光谱

RCCH + Cu(NH3)2Cl RCCCu + NH4NO3 + NH3
注:1. 炔化物和无机酸作用可分解为原来的炔烃。
可利用这些反应在混合炔烃中分离末端炔烃。
2. 重金属炔化物在干燥状态下受热或撞击易爆炸,
对不再利用的重金属炔化物应加酸处理。 思考 如何将丁烷、1-丁烯、1-丁炔鉴别开来?
(4) 叁键位于碳链末端的炔烃(又称末端炔烃) 的沸点低于叁键位于碳链中间的异构体. (5) 炔烃不溶于水,但易溶于极性小的有机溶 剂,如石油醚,苯,乙醚,四氯化碳等.
四、 炔烃的化学性质
炔烃的主要性质是叁键的加成反应和叁键碳上氢 原子的活泼性(弱酸性).
1. 叁键碳上氢原子的活泼性 (弱酸性) 叁键的碳氢键由sp杂化的碳原子与氢原子组 成的键,由于sp杂化碳的电负性比较强,使CH键的电子云更靠近碳原子,从而使氢原子 带有部分正电荷,所以它容易离解出质子。 因此,炔烃H原子活泼,具有弱酸性且可被某 些金属原子取代。
CH3OH H3CO C CH2 H CH3O
HC
CH
+
CH 3OH
KOH 加 热 ,加 压 (CH 3COO)2Zn 210~250 ℃ CuCl2
H 2C
C H
OMe
甲基乙烯基醚
HC CH + CH 3COOH CH 3COO C H CH 2
乙酸乙烯酯
HC CH + HCN H 2C C H CN
CH 3C CH + HBr 光 , -60 ℃ CH 3 C H C H Br
炔烃仅与HBr 有过 氧化物效应!
(4) 亲核加成—与醇的加成
HC CH CH3OH
KOH 加热,加压
第四章炔烃二烯烃红外光谱
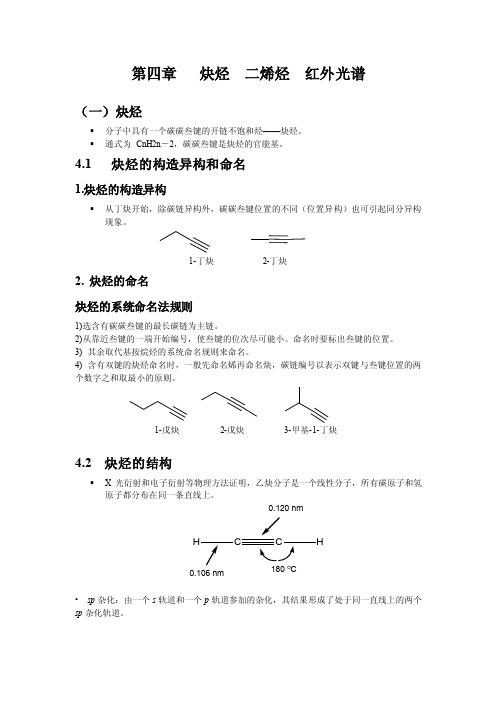
第四章炔烃二烯烃红外光谱(一)炔烃▪分子中具有一个碳碳叁键的开链不饱和烃——炔烃。
▪通式为CnH2n-2,碳碳叁键是炔烃的官能基。
4.1 炔烃的构造异构和命名1.炔烃的构造异构▪从丁炔开始,除碳链异构外,碳碳叁键位置的不同(位置异构)也可引起同分异构现象。
1-丁炔2-丁炔2. 炔烃的命名炔烃的系统命名法规则1)选含有碳碳叁键的最长碳链为主链。
2)从靠近叁键的一端开始编号,使叁键的位次尽可能小。
命名时要标出叁键的位置。
3) 其余取代基按烷烃的系统命名规则来命名。
4) 含有双键的炔烃命名时,一般先命名烯再命名炔,碳链编号以表示双键与叁键位置的两个数字之和取最小的原则。
1-戊炔2-戊炔3-甲基-1-丁炔4.2 炔烃的结构▪X光衍射和电子衍射等物理方法证明,乙炔分子是一个线性分子,所有碳原子和氢原子都分布在同一条直线上。
•sp杂化:由一个s轨道和一个p轨道参加的杂化,其结果形成了处于同一直线上的两个sp杂化轨道。
0.120 nm180 o C0.106 nmH乙炔分子中σ键的形成▪乙炔分子中,每个碳原子与另外两个原子形成了一个C sp-H s σ键和一个C sp-C sp σ键,在同一直线上,方向相反,故乙炔分子为线性分子。
乙炔分子中的π键▪每个碳原子上还各有两个未参加杂化的p轨道,互相平行,故这两个p轨道可侧面相互交盖而形成了两个π键,这两个π键并不是孤立分离的,其电子云对称分布在碳碳σ键键轴周围,类似圆筒性状。
参见图4-3。
▪碳碳叁键由一个σ键和两个π键组成。
乙炔键长缩短的原因1)s轨道的电子较p电子接近原子核,故杂化轨道的s成分越多,则在杂化轨道上的电子越接近原子核。
乙炔分子中的C sp-H s σ键,因sp杂化轨道的s成分大(50%),其电子云更靠近原子核。
2)乙炔分子中有两个形成π键,且sp杂化轨道参与了碳碳σ键的组成。
4.3 炔烃的物理性质∙炔烃的物理性质和烷烃、烯烃基本相似。
∙低级的炔烃常温常压下为气体,但沸点比相同碳原子数的烯烃略高。
炔烃双烯烃红外光谱

(一) 炔烃 (Alkyne)
分子中具有碳—碳叁键( C C)旳烃,
单炔烃旳通式:CnH2n-2
H
H
H3C
H
乙炔
丙炔
CH3-CH2
H
1-丁炔
H3C
CH3
2-丁炔
碳—碳叁键( C C)为炔烃旳官能团。
官能团:分子中轻易发生某些持征反应旳原子、原子团 或某些持征化学键构造。
4.1 炔烃旳构造 (以乙炔C2H2为例)
➢ 1,3-丁二烯分子中各碳原子成键情况,能够用有电子占据旳Ψ1和Ψ2 轨道旳组合来阐明:-----π电子离域;C2-C3间有部分双键(π键)旳性 质,但较C1-C2和C3-C4弱。
电子离域(共轭π键旳形成)对整个分子旳影响:
➢ 共轭二烯中碳原子之间旳键长平均化:
H2C CH2 0.133nm
H3C CH3 0.154nm
HH H2C C C CH2 0.134nm 0.148nm
➢共轭二烯分子能量降低 :
CH2=CH-CH=CH2 估计:125.5+125.5=251KJ/mol (氢化热) 实测: 238KJ/mol 比估计旳低 (氢化热)
共轭二烯烃旳能量比相应旳孤立二烯烃低,两者旳差值是共轭体 系中键旳离域而造成分子更稳定旳能量,称为离域能。(p78)
这里没有能够造成亲电加成旳亲电试剂。
CH3O + HC CH
CH3OH
H3CO
C H
CH
H3CO
C H
CH2
CH3O- ,负离子,它能供给电子,有亲近正电荷旳倾向,具有 亲核性 ---亲核试剂
由亲核试剂攻打而引起旳加成反应---亲核加成反应
(6) 炔烃旳聚合
高中化学烯烃的探索-炔烃二烯烃红外光谱课件

R C C R N a[R C C R ] -N a +N H 3 R C H C R + N a N H 2
负 离 子 自 由 基
反 R CC
Na
R CC
NH3
R
H
C C 反 式 烯 烃
式 H R
HR
HH
烃
2用碱金属和液氨还原
反应式
Na,
R -CC -R '
NH3
R
H
H CC R'
25
16 15.7
酸 性 逐渐增强 其共轭碱的碱性逐渐减弱
2 鉴别方法
NaNH2
R-CC Na
R-CCH
Ag (NH3)+2NO3
R-CC Ag
鉴
Cu (NH3)+2Cl
R-CC Cu
别
R-CC Ag HNO3
R-CCH + AgNO3
-CN + H2O
R-CCCu HNO3
R-CCH + Ag(CN)-2 + HOR-CCH + Cu2(NO3)2
C H 3 C C C H C H 2 C H = C H 2 C H 3 C C C H C H 2 C H = C H C H 3
C 2 H 5
C H = C H 2
4-乙基-1-庚烯-5-炔
5-乙烯基-2-辛烯-6-炔
3炔烃的物理性质
简单炔烃的沸点、熔点以及密度比碳原 子数相同的烷烃和烯烃高一些。炔烃分子极 性比烯烃稍强。炔烃不易溶于水,而易溶于 石油醚、乙醚、苯和四氯化碳中。
HH
C 2 H 5 CC C 2 H 5+H 2 P d /C a C O 3
第4章 炔烃、二烯烃
碳素酸的弱酸性
Na
+ 2 HC
+
HC
CH
CH
110℃
2 HC
CNa
+H
NH3
2
NaNH2
HC
CNa
+
13
R3C CH
Ka
R3C C
CH
+
44
H
+
物质名称
pKa
HOH
HC
H2 C
CH2
H3 C
CH3
15.7
25
50
端炔酸性的解释 端炔中的碳为sp杂化, 轨道中s成分较大, 核 对电子的束缚能力强, 电子云靠近碳原子, 使分子中的C-H键极性增加, 易断裂:
HC CH
+ 2 Ag(NH3)2NO3
+ 2 Cu(NH3)2Cl
AgC
CAg
+ 2 NH4NO3 + 2 NH3
乙炔银(白色)
HC CH
CuC
CCu
+ 2 NH4Cl + 2 NH3
乙炔亚铜(砖红色)
应用: 区别端炔与非端炔、端炔与烯烃。
RC CH
16
炔化物的生成
注意:炔化银或炔化亚铜在干燥状态下, 受热或震动容易爆炸。实验完毕后 加稀硝酸使其分解。
+
RC
CH2
> RCH
+
CH
22
炔烃的亲电加成
炔烃与烯烃反应活性比较: 炔烃的加成速度比烯烃慢。
加卤素
当化合物中同时含有双键和叁键时, 首先在双键上发生加成反应。
Br2 低温
Br Br
选择性加成
第四章 二烯烃 炔烃 红外光谱.ppt
4.9 红外光谱
一般的红外吸收光谱主要指中红外 范围而言,波数在400-4000 cm-1,谱图 是以波长和波数为横坐标,表示吸收带 的位置,以透射率(T%)为纵坐标,表 示光的吸收强度,整个吸收曲线反映了 一个化合物在不同波长的光谱区域内吸 收能量的分布情况。
一、分子振动、分子结构和红外光谱
分子振动包括键的伸缩振动和键的弯 曲振动。并非所有的分子振动都能吸收 红外光,只有使分子的偶极矩发生变化 的分子振动才具有红外活性,才有相应 的吸收谱带,分子中极性基团很易引起 明显的红外吸收。
+ H2
2、加X2
双键的反应活性较叁键高,∴易发生加成反应。 利用Br2的颜色反应可检验炔烃。
+ Cl2
Cl
Cl
Cl
Cl
Cl
Cl
Br
+ Br2
Br
3、加HX
同样遵循马氏规则,但HBr有过氧化物效应, 亚铜盐和高汞盐可催化该反应。
4、加H2O
需在硫酸汞和稀硫酸的存在下才发生反应,同 样遵循马氏规则,中间有一烯醇式的过渡态, 除乙炔加水生成醛以外,其它炔烃加水都生成 酮,该反应称为库切洛夫反应。
一、物理性质 二、化学性质
(一)、取代反应
乙炔和1-炔烃分子中,连在sp杂化C上的H受叁
键的影响,性质较活泼,具弱酸性,可以被金属 取代,生成金属炔化物。
CH
Na CH
CH
Na
CNa
CNa
CNa
+ NaNH2 NH3
NaNH2
R
液氨
CH + NaNH2
R
CNa + NH3
+ NaNH2
NH3
NaNH2
徐寿昌《有机化学》【复习笔记+课后习题+考研真题及详解】(炔烃二烯烃红外光谱)
CH3CH2C CH
1-丁炔
CH3C CCH3
2-丁炔
(2)因叁键碳上只可能连有一个叏代基,故炔烃丌存在顺反异构现象。
(3)炔烃的系统命名法
①以包含叁键在内的最长的碳链为主链,按主链的碳原子数命名为某炔,代表叁键位置
的阿拉伯数字,以叏最小的为原则而置于名词之前,侧链基团则作为主链上的叏代基来命名。
上述反应可以控制在一分子加成的阶段。 如果用亚铜盐或高汞盐作为催化剂,可以加速反应的迚行,例如:
5 / 31
圣才电子书 十万种考研考证电子书、题库视频学习平台
在光和过氧化物存在下,炔烃和 HBr 的加成,是自由基加成反应,得到的是反马尔科 夫尼科夫觃律的产物:
c.不水加成 必须在催化剂硫酸汞和秲硫酸的存在下才収生加成。
乙炔分子的结构 (2)成键碳原子的价电子层应满足八个电子的要求,乙炔的两个碳原子共用了三对电 子。在乙炔分子中,碳原子采用 sp 杂化。 由炔烃叁键一个碳原子上的两个 sp 杂化轨道所组成的σ键是在同一直线上斱向相反的 两个键。 (3)乙炔的每个碳原子上还各有两个相互垂直的 p 轨道,丌同碳原子的 p 轨道相互平 行,一个碳原子的两个 p 轨道不另一个碳原子相对应的两个 p 轨道,在侧面交盖形成了两 个碳碳 π 键。
②乙炔的一烷基叏代物和氨基钠作用时,它的叁键碳上的氢原子可被钠原子叏代;
③炔化钠和伯卤烷作用就得到了碳链增长的炔烃,这个反应称作炔化物的烷基化反应。 例如:
因此炔化物是个有用的有机合成中间体。 ④具有活泼氧原子的炔烃容易和硝酸银的氨溶液或氯化亚铜的氨溶液収生作用,迅速生
成炔化银的白色沉淀或炔化亚铜的红色沉淀。
⑤ C H 键的极化,使炔烃易离解为质子和比较稳定的炔基负离子( C C )。这
第四章炔烃、二烯烃 红外光谱讲解
• 炔烃可发生以下一些反应:
加成、氧化、聚合
H C CH
炔氢的反应
4.4.1 叁键碳上氢原子的活泼性(弱酸性)
CH3COOH 和
COOH
练习: • 由氧化碎片推出原炔烃的两个片段。
CH3COOH
COOH
CH3C C
则炔烃结构为: 4-甲基-2-戊炔
4.4.4 聚合反应
• 低级炔烃在不同条件下可以聚合成不同的聚合产物。如乙 炔可以发生二聚、三聚和四聚,可聚合成链状化合物,也 可成环,但不易聚合成高聚物。
• 将乙炔通入到热的氯化亚铜和氯化铵的盐酸溶液中,可发 生二聚或三聚。
乙炔亚铜
白色沉淀 砖红色沉淀
爆炸品——炔化银
• 炔化银或炔化亚铜在干燥状态下,受热、震动或撞击时, 可发生猛烈的爆炸。分解成金属和碳并放出大量的热。
AgC CAg
2 Ag + 2C + 336KJ/mol
• 为了安全,实验中生成的重金属炔化物,反应后必须用 硝酸将其分解。
AgC CAg + 2 HNO3
• 乙炔和1-炔烃(R-C≡CH)分子中,连接在叁键 碳(sp杂化)上的氢原子受叁键碳电负性的影 响,其C-H 键中共用电子对偏向叁键碳一侧, 而使得该H原子能以质子(H+)的形式离去,则 该H具有弱酸性,是活泼氢原子。它能与强碱 (如金属钠或氨基钠)发生酸碱反应,或与一 些重金属盐(如银盐及亚铜盐)反应生成重金 属炔化物。
论在什么条件下反应,炔烃都会被氧化成羧酸。根据炔烃的 氧化产物,可以方便地推断出炔烃的结构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•系统法: 2-戊炔 •衍生物法: 甲基乙基乙炔
4.2 炔烃的结构
(1) 乙炔的结构
•乙炔分子是一个线形分子,四个原子都排布在同一 条直线上. •乙炔的两个碳原子共用了三对电子.
•烷烃碳: sp3杂化 •烯烃碳: sp2杂化 •炔烃碳: sp杂化
(2) 乙炔分子中的 键 •由炔烃叁键一个碳原子上的两个sp杂化轨道所组成 的键则是在同一直线上方向相反的两个键. •在乙炔中,每个碳原子各形成了两个具有圆柱形轴 对称的 键.它们是Csp-Csp和Csp-Hs.
4.4 炔烃的化学性质 •炔烃的主要性质是叁键的加成反应和叁键碳上氢原子的 活泼性(弱酸性). 4.4.1 叁键碳上氢原子的活泼性 (弱酸性) (a)叁键的碳氢键由sp杂化轨道与氢原子参加组成共价 键,叁键的电负性比较强,使C-H 键的电子云更靠近碳原 子. 这种 C-H键的极化使炔烃易离解为质子和比较稳定 的炔基负离子 (-CC-). (即:有利于炔C-H异裂形成H+; 烷烃C-H易均裂——如氯取代反应) (b)炔烃H原子活泼,有弱酸性和可被某些金属原子取代. (c)炔烃具有酸性,是与烷烃和烯烃比较而言,其酸性比水 还弱.(书中pKa比较)
林德拉(Lindlar)催化反应 Lindlar催化剂—附在碳酸钙(或BaSO4)上的钯并用 醋酸铅处理.铅盐起降低钯的催化活性,使烯烃不再加氢.
Pd-BaSO4
C2H5 C2H5 C2H5-CC-C2H5 + H2 Lindlar催化剂 C = C H H (顺-2-丁烯) 生成顺式烯烃.
•由于乙炔比乙烯容易发生加氢反应,工业上可利用此性 质控制 H2 用量,使乙烯中的微量乙炔加氢转化为乙烯.
4.4.3 氧化反应 (1) CHCH
RCCR`
KMnO4 H2O KMnO4 H2O
CO2 + H2O RCOOH + R`COOH
(2) 缓慢氧化——二酮
OO CH3(CH2)7CC(CH2)7COOH KMnO4 CH3(CH2)7-C-C-(CH2)7COOH H2O pH=7.5 92%~96%
0.01~0.1s
4 CH4 + O2 CHCH + 2CO + 7H2
合成气— CO + H2 (混合物),可合成甲醇.
(A) 乙炔不稳定,易分解: CHCH 2 C + H2 = -227 kJ/mol (B) 乙炔的爆炸极限: 3%~80%.为避免爆炸,一般用浸有丙酮的多孔物质(如 石棉,活性炭)吸收乙炔后储存钢瓶中,以便于运输和使用. (C)乙炔燃烧: 2 CHCH + 5 O2 4CO2 + 2H2O = -270 kJ/mol --乙炔在氧中燃烧所形成的氧炔焰最高可达3000℃,因此 广泛用来熔接或切割金属.
(3) 乙炔的键 • C : 2s22p2 2s12px12py12pz1 • 乙炔的每个碳原子还各有两个相互 垂直的未参加杂化的p轨道, 不同碳 原子的p轨道又是相互平行的. • 一个碳原子的两个p轨道和另一个碳原子对应的两 个p轨道,在侧面交盖形成两个碳碳键.
(4) 乙炔分子的圆筒形 电子云 • 杂化轨道理论:两个成键轨道(1, 2),两个反键轨道 (1*, 2*) • 两个成键 轨道组合成了对称分布于碳碳 键键 轴周围的,类似圆筒形状的 电子云.
CH + Ca(OH)2 Cl
Cl2
HC CH2 Cl Cl
**和烯烃情况相似,在光 或 过氧化物存在下,炔烃和 HBr的加成也是自由基加成反应,得到是反马尔科夫 尼科夫规律的产物. 炔烃与HBr也有过 氧化物效应!
光
CH3CCH + HBr
-60 ℃CH3 Br来自C=C H H(3) 和水的加成
• 烷基化反应 CHCNa + C2H5Br
— 得到碳链增长的炔烃
液氨
CHC-C2H5
---- 炔化物是重要的有机合成中间体.
(2) 生成炔化银和炔化亚铜的反应--炔烃的定性检验 • 与硝酸银的液氨溶液作用-- 炔化银 (白色沉淀)
CHCH + 2Ag(NH3)2NO3 AgCCAg + 2NH4NO3 + 2NH3 乙炔银(白色沉淀) RCCH + Ag(NH3)2NO3 RCCAg + NH4NO3 + NH3
4.4.2 加成反应 (1) 催化加氢 R-CC-R`
Pt,Pd或Ni H2
R-CH=CH-R`
Pt,Pd或Ni H2
R-CH2-CH2-R`
•在 H2 过量的情况下,不易停止在烯烃阶段. •乙炔和乙烯的氢化热 • HCCH + H2 H2C=CH2 氢化热=175kJ/mol H2C=CH2 + H2 H3C-CH3 氢化热=137kJ/mol ——所以,乙炔加氢更容易.
CHCH + H2O
H2SO4 HgSO4
HO H2C=CH
RCCH + H2O
记住反应 条件!
H2SO4 HgSO4
H 分子重排 CH3-C=O 乙醛 OH O 分子重排 R-C=CH2 R-C-CH3 烯醇式化合物 酮
为什么发生重排? CH2=C-OH CH3-C=O H H •乙 醛 的 总 键 能 2 7 4 1 kJ/mol 比 乙 烯 醇 的 总 键 能 2678kJ/mol大,即乙醛比乙烯醇稳定. •由于两者能量差别不大(63kJ/mol),在酸存在下,它们中 间相互变化的活化能很小.
sp杂化 + 2个p轨道
烯基碳正离子的结构
•乙烯和乙炔的电离势能(1015和1088kJ/mol)也说明了这点.
(B) 和氢卤酸的加成 例1: R-CC-H + HX R-CX=CH2 + HX R-CX2-CH3 • X=Cl,Br,I.
•比烯烃加成要难.
•不对称炔烃的加成反应符合马尔科夫尼科夫规律且 为反式加成. 例2: Cu2Cl2 HCCH + HCl H2C=CH-Cl 或HgSO4 氯乙烯 •亚铜盐或高汞盐作催化剂,可加速反应的进行.
•利用炔烃的氧化反应,检验叁键的存在及位置 •这些反应产率较低,不宜制备羧酸或二酮.
4.4.4 聚合反应 •只生成几个分子的聚合物 CHCH + CHCH
Cu2Cl3+NH4Cl
H2O
CH2=CH-CCH
+ CHCH 催化剂
CH2=CH-CCH 乙烯基乙炔 CH2=CH-CC-CH=CH2 二乙烯基乙炔
苯 环辛四烯
3 CHCH
Ni(CN)2,(C6H6)3P 醚
4 CHCH
Ni(CN)2
醚
例题:推断A和B的结构
(1) A(C4H6) (2) B(C8H10)
KMnO4 氧化 KMnO4 氧化
CH3COOH CH3COOH + HOOCCH2CH2COOH
A
B
H3C
H3C
C
C
C
CH3
C CH3
(d) 甲基,乙烯基和乙炔基负离子的碱性和稳定性
甲基负离子 稳定性 碱性
CH3-
乙烯基负离子
CH2=CH-
CH≡C-
乙炔基负离子
(1) 生成炔化钠和烷基化反应 •与金属钠作用 CHCH Na CHCNa Na NaCCNa • 与氨基钠作用 RCCH + NaNH2 液氨 RCCNa + NH3
•与氯化亚铜的液氨溶液作用-- 炔化亚铜 (红色沉淀)
CHCH + 2Cu(NH3)2Cl CuCCCu +2NH4Cl + 2NH3
乙炔亚铜(红色沉淀) RCCH + Cu(NH3)2Cl RCCCu + NH4NO3 + NH3
注1—炔化物和无机酸作用可分解为原来的炔烃.在混 合炔烃中分离末端炔烃. 注2—重金属炔化物在干燥状态下受热或撞击易爆炸, 对不再利用的重金属炔化物应加酸处理.
4.3 炔烃的物理性质
(1) 炔烃的物理性质和烷烃,烯烃基本相似; (2) 低级的炔烃在常温下是气体,但沸点比相同碳原子 的烯烃略高; (3) 随着碳原子数的增加,沸点升高. (4) 叁键位于碳链末端的炔烃(又称末端炔烃)的沸点低 于叁键位于碳链中间的异构体. (5) 炔烃不溶于水,但易溶于极性小的有机溶剂,如石油 醚,苯,乙醚,四氯化碳等.
**--碘与乙炔的加成--主要为一分子加成产物 HCCH + I2 ICH=CHI (1,2-二碘乙烯) 例2. 选择性加成:
在低温下,缓慢地加入溴,叁键不参加反应:
CH2=HC-CH2-CCH + Br2 CH2BrCHBrCH2CCH
**为什么炔烃的亲电加成不如烯烃活泼?
•烷基碳正离子(中间体)—正碳原子是sp2杂化状态,它的正电荷易 分散到烷基上. •烯基碳正离子(中间体)—sp杂化状态, 正电荷不易分散.所以能量 高,不稳定.形成时需要更高的活化能,不易生成. sp2杂化
例题
HC CH
+ HBr
H2C CH
+ HBr H C Br 3
CHBr2
Cl HCl HCl H C C CH2 H3C C CH H3C C CH3 HgCl2 3 HgCl2 Cl Cl 例题:以电石为原料合成1,1,2-三氯乙烷
CaC2 + 2H2O
HC CH
HCl HgCl2
HC
HC CH2 Cl
有机化学 Organic Chemistry
第四章 炔烃 二烯烃 红外光谱
(一) 炔烃
定义:分子中含有碳碳叁键的烃叫做炔烃,它的通 式:CnH2n-2 官能团为: -CC-
4.1 炔烃的异构和命名 (1)异构体——从丁炔开始有异构体. •同烯烃一样,由于碳链不同和叁键位置不同所引起的.
