下呼吸道感染细菌培养操作规范
如何提高下呼吸道标本质量及操作规范

分析前: 明确下呼吸道标本适合诊断的病原和检验项目 规范下呼吸道标本的采集、运送,标本初筛、合格判断
分析中: 痰/气管吸出物定性和气管镜采集标本定量细菌 培养程序,病原菌筛查和判断 质量控制
分析后: 染色、培养结果报告格式及临床意义
人类口咽部位定植着大量需氧 菌、兼性厌氧菌和厌氧菌,总 数可达1010CFU/mL~1012CFU/mL
可发现培养不能 生长的细菌
注:除引起社区非典型肺炎的病原不能常规培养外,其他常见肺部感染的病原菌均可用常规培养方法 分离,但培养方法的敏感性低,且无法判断分离菌的来源。
纤维支气管镜标本定量培养的临床意义
半定量
♣ 经纤维支气管镜获取的支气管肺泡灌洗液和保护毛刷 标本适合做细菌定量培养
♣ 当可能致病菌的菌落数大于阈值时,其诊断下呼吸道 感染的特异性可达82%~91%,诊断价值远高于痰标本
于10个即达到阈值103 CFU/mL 稀释平板计数:菌落数等于相同形态菌落数乘以稀释倍数103 CFU/mL
定量培养标本的处理
标本
自然咳痰 诱导痰
气管内吸取物 支气管肺泡灌洗液
保护性毛刷 支气管灌洗液
有意义的浓度(CFU/ml)
107 不确定
106 104 103 不做培养
气管镜标本处理
♣ 接种其他培养基并培养 BAL标本或PSB标本接种麦康凯或中国蓝培养基做分区划线。 肺组织标本研磨后接种血平板和巧克力平板延长培养至4d
106
感染可能大,建议重复培养(重复培 养2~3+感染菌)
>10
<5
<5
107
多为感染病原菌
注:任何数量均应报告 注:患儿标本任何数量均
最新下呼吸道感染细菌学检验操作规范
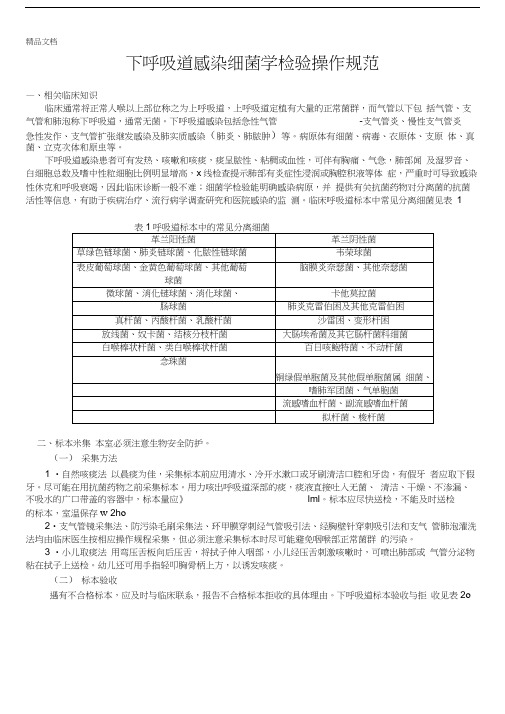
下呼吸道感染细菌学检验操作规范—、相关临床知识临床通常将正常人喉以上部位称之为上呼吸道,上呼吸道定植有大量的正常菌群,而气管以下包括气管、支气管和肺泡称下呼吸道,通常无菌。
下呼吸道感染包括急性气管-支气管炎、慢性支气管炎急性发作、支气管扩张继发感染及肺实质感染(肺炎、肺脓肿)等。
病原体有细菌、病毒、衣原体、支原体、真菌、立克次体和原虫等。
下呼吸道感染患者可有发热、咳嗽和咳痰,痰呈脓性、粘稠或血性,可伴有胸痛、气急,肺部闻及湿罗音、白细胞总数及嗜中性粒细胞比例明显增高,x线检查提示肺部有炎症性浸润或胸腔积液等体症,严重时可导致感染性休克和呼吸衰竭,因此临床诊断一般不难;细菌学检验能明确感染病原,并提供有关抗菌药物对分离菌的抗菌活性等信息,有助于疾病治疗、流行病学调查研究和医院感染的监测。
临床呼吸道标本中常见分离细菌见表1表1呼吸道标本中的常见分离细菌二、标本米集本室必须注意生物安全防护。
(一)采集方法1 •自然咳痰法以晨痰为佳,采集标本前应用清水、冷开水漱口或牙刷清洁口腔和牙齿,有假牙者应取下假牙。
尽可能在用抗菌药物之前采集标本。
用力咳出呼吸道深部的痰,痰液直接吐入无菌、清洁、干燥、不渗漏、不吸水的广口带盖的容器中,标本量应》lml。
标本应尽快送检,不能及时送检的标本,室温保存w 2h o2•支气管镜采集法、防污染毛刷采集法、环甲膜穿刺经气管吸引法、经胸壁针穿刺吸引法和支气管肺泡灌洗法均由临床医生按相应操作规程采集,但必须注意采集标本时尽可能避免咽喉部正常菌群的污染。
3 •小儿取痰法用弯压舌板向后压舌,将拭子伸入咽部,小儿经压舌刺激咳嗽时,可喷出肺部或气管分泌物粘在拭子上送检。
幼儿还可用手指轻叩胸骨柄上方,以诱发咳痰。
(二)标本验收遇有不合格标本,应及时与临床联系,报告不合格标本拒收的具体理由。
下呼吸道标本验收与拒收见表2o三、实验室检查(一)肉眼观察 观察痰液的颜色、粘度、有无血丝和是否呈脓性,如见有颗粒存在,则应注意可能 与放线菌属及奴卡菌属感染有关。
细菌标本采集规范

临床微生物学标本采取和处理的规范化要求正确的采取、处理与运送用于细菌培养的标本是临床细菌检验成功的关键.标本采取与处理的规范化是准确、及时地向临床提供重要的临床感染信息的基础;而标本采取与处理不当将严重影响检验结果,给临床以误导,延误对患者的正确治疗。
为此,我们提出初步的参考意见,并希望在实践中不断完善。
一、血液细菌培养标本的采集和处理临床上疑为败血症、脓毒血症或其他血液感染的患者,需做血液细菌培养以明确病原。
1.采集方法:静脉采血,以无菌操作方法抽取血液后,直接注入血培养瓶中,轻轻颠倒混匀,以防血液凝固.如果同时作需氧和厌氧培养,应先将标本接种到厌氧瓶中,再注入需氧瓶,严格防止将空气注入厌氧瓶中。
2。
采血时间以及血培养份数:在患者发热期间越早越好,最好在抗菌治疗前,用药前24小时内采集2~3次血液标本,可使细菌检出率高达99%.对间歇性寒战或发热的患者,应在寒战或体温高峰到来之前0。
5~1小时采血,亦可在寒战或发热后1小时采集血液标本。
特殊感染患者采血培养时应遵循以下原则:(1)可疑急性发热性菌血症、败血症患者:应在使用抗菌药物之前,在24小时内从不同部位采集2~3份血液标本培养.(2)可疑细菌性心内膜炎患者、感染性心内膜炎患者:在1~2小时内采集3份血标本培养,如果24小时后阴性,再采集两份血标本培养。
(3)不明原因发热患者:先采集2~3份血标本,抽血间隔60 min,24~36小时后体温升高之前,再采集2份血标本进行培养。
因为1次血培养不足以说明问题,可能会遗漏阳性结果。
(4)可疑菌血症但血培养持续阴性时;应改变血培养方法,以获得罕见或苛养的微生物。
(5)在急性发热性疾病如脑膜炎、细菌性肺炎,需马上做抗菌治疗;或急性骨髓炎、化脓性关节炎等要紧急手术的患者,应立即从两臂分别取2份标本.3。
采血部位:采血部位通常为肘静脉。
疑为亚急性心内膜炎的患者,以肘动脉或股动脉采血为宜。
疑为细菌性骨髓炎或伤寒患者,在病灶或髂前(后)上棘处严格消毒后抽取骨髓。
呼吸道标本细菌学检验

呼吸道标本细菌学检验标准操作程序1.检验目的规范呼吸道标本细菌学检验操作规程,确保检验结果准确可靠。
2.适用范围呼吸道标本培养和涂片检查。
3.标本采集与运送3.1 采集时间以晨痰为好。
3.2 采集方法3.2.1 自然咳痰法用清水反复漱口后从气管深部咳出痰,吐入无菌容器内。
3.2.2 气管镜下采集法在病灶附近用导管吸或用支气管刷直接取得标本。
3.2.3 气管穿刺法在环甲膜下穿刺抽取痰液,收集标本,适用于厌氧菌培养。
3.2.4 呼吸机采集法使用呼吸机的病人,可利用呼吸机吸取深部痰入专用采集器内送检。
3.2.5 为了明确扁桃体炎、会厌炎、鼻咽部化脓性感染的病原体,可以采集拭子送检。
首先拭子用无菌生理盐水沾湿,然后用力在感染部位擦拭,采集标本与无菌管送检。
3.3 标本运送3.3.1 采集标本后立即送到实验室,放置时间不应超过2h。
3.3.2 延迟送检或待处理标本应置于4℃冰箱保存(疑为肺炎双球菌、流感嗜血杆菌等苛氧菌感染除外),以免杂菌生长,但必须在24h内处理。
3.3.3 对可疑烈性呼吸道传染病的患者检验标本,在采集、运送及保存过程中必须注意生物安全防护。
4.检验步骤4.1接种:用无菌拭子蘸取脓性部分,接种于血平板和巧克力平板第一区,再用一次性接种环分区划线接种。
4.2 涂片在接种的同时进行涂片。
用铅笔在磨砂部位编号,每片只涂一份标本。
4.3 培养:血平板、巧克力平板置35℃二氧化碳培养箱培养18-48h。
4.4 涂片染色镜检:涂片革兰染色,自然干燥后镜检。
先用低倍镜浏览整片,计数平均每个低倍视野WBC、上皮细胞的数量。
标本合格与否参考表1,合格标本再用油镜观察,主要观察片中主要细菌类型、WBC内吞噬什么细菌等,以作为看板时决定什么细菌要做的依据。
表1 痰液标本分级4.5 培养结果观察4.5.1 口咽部正常寄生的需氧菌主要是腐生的奈瑟菌、草绿色链球菌,4.5.2 有明确意义的病原菌: A群溶血性链球菌(咽炎)、流感嗜血杆菌(b型5y以下儿童急性会厌炎、急性支气管炎)、肺炎链球菌(急性支气管炎常继发于病毒感染、大叶性肺炎)、百日咳鲍特菌(咳嗽、支气管扩张)、金黄色葡萄球菌(肺炎)、军团菌(肺炎)、白喉棒状杆菌。
下呼吸道感染细菌培养操作规范

Standard for Bacterial Culture Procedures 标本European Manual Microbiology.1罗斯菌属(Rothia spp.) `脑膜炎奈瑟菌草绿色链球菌草绿色链球菌、奈瑟菌属嗜血杆菌属、莫拉菌属常见引起细菌性社区感染典型肺炎病原菌:•肺炎链球菌•流感嗜血杆菌上呼吸道正常菌群•金黄色葡萄球•卡他莫拉菌细胞内病原引起非典型肺炎:•肺炎支原体•肺炎/鹦鹉热衣原体•嗜肺军团菌•柯克斯体(Q 热)痰的来源?是否被上呼吸道污染?hospitalization.Clin.Infec.Dis.31:869-874.9Gleckman,R.,J.DeVita,D.Hibert,C.Pelletier,and R.Martin.1988.Sputum gram stain assessment in community-acquired bacteremic pneumonia.J.Clin.Microbiol.26:846-849.内容特异性82%~91%,诊断价值远高于痰标本;附录B:“适合诊断的病原及检验项目”5.下呼吸道感染细菌培养的局限性培养结果假阴性、假阳性的原因球菌、流感嗜血杆菌(具侵袭性)定植数量会增加;`基础条件变化:使用免疫抑制剂、慢性肺病、广谱抗菌药物治疗或住院患者等人群中,革兰阴性杆菌的优势明显增加。
1)肺部感染的最常见机制:肺泡内吸入了口咽部定植菌;¾吸入性肺炎患者咽部菌群种类:多侵袭性细菌或耐药细菌,如肺炎链球菌或革兰阴性杆菌。
¾清除机制:健康宿主吸入口腔定植菌后常无临床症状,细菌通常被粘液柱状纤维清除。
¾吸入能否引起肺部感染取决于:吸入菌的致病性及数量;患者免疫系统;呼吸道功能等诸方面的因素。
2)吸入气溶胶肺部感染占第二位:主因:使用了不清洁的呼吸机。
3)血液播散性肺炎占第三位:感染通常造成双肺下叶肺炎。
呼吸道感染细菌学检验操作规范

细菌培养
01
02
03
04
培养基选择
根据不同病原体选择适宜的培 养基,如血琼脂、巧克力琼脂 等。
标本采集
采集呼吸道分泌物、痰液、肺 泡灌洗液等作为培养样本。
培养条件
菌落鉴别
在恒温(35-37℃)条件下进行 培养,观察菌落生长情况。
根据菌落的形态、染色特性、 生化反应等指标鉴别细菌种类 。
药敏试验
分子生物学检测
细菌学快速检测
采用自动化仪器和试剂盒进行细菌学 快速检测,如免疫分析仪、干式生化 分析仪等。
利用PCR等分子生物学技术检测病原 体核酸,具有快速、敏感的优点。
05
结果报告与解读
结果报告的格式与内容
检验结果
包括细菌培养、药敏试验等结果, 应详细记录。
检验报告单
应包括患者基本信息、送检标本类 型、检验项目、检验结果及结论等。
事故应急处理
制定实验室事故应急处理预案 ,并定期进行演练,确保在发 生事故时能够迅速、有效地应
对。
THANK YOU
感谢聆听
检验报告时间
应在规定时间内出具检验报告,并 注明报告时间。
结果解读与临床意义
解读依据
根据细菌培养和药敏试验结果, 结合患者临床表现和实验室检查 指标进行综合分析。
临床意义
为医生提供细菌种类、耐药性及 感染部位等信息,指导临床用药 和治疗方案制定。
结果报告的注意事项
准确性
确保检验结果的准确性,避免误差和误报。
样本稀释
将采集的样本进行稀释, 以便后续的细菌分离和培 养。
样本预处理
对稀释后的样本进行预处 理,如添加抗菌药物,以 抑制其他微生物的生长。
呼吸道标本细菌学检验操作规程SOP

呼吸道标本细菌学检验操作规程(一)目的:规范呼吸道标本细菌学检验,确保检验结果准确可靠。
(二)适用范围及操作人员:呼吸道标本培养和涂片检检查;检验科工作人员。
(三)支持性文件:《WST805-2022临床微生物检验基本技术标准》、《下呼吸道感染细菌培养操作指南》、《全国临床检验操作规程》。
(四)标本类型:痰、咽拭、支气管肺泡灌洗吸出液、支气管冲洗液或刷子、肺穿刺液等。
(五)标本采集时间:尽量在抗生素使用前采集。
(六)标本采集方法:1、咳痰:适用于肺部感染患者,特别是重病监护室(ICU)及住院的社区获得性肺炎(CAP)、慢性阻塞性肺疾病急性加重(AECOPD)、肺脓肿(咳痰非最适标本)、可疑细菌性病原体引起的肺部感染患者。
咳痰前,患者用无菌生理盐水漱口;指导患者咳出深部痰,勿留取唾液和鼻咽腔分泌物。
2、气管吸出物:仅当气管插管的患者出现肺炎症状时(如发热或浸润),可采集气管吸出物标本。
从气管中吸痰,用无菌容器留取送检。
3、支气管肺泡灌洗液:利用纤维支气管镜向小支气管和肺泡中注入无菌生理盐水灌洗,在40mL~80mL回收的灌洗液中包含约1mL支气管末梢和肺泡中的分泌物;弃去前段可能污染的部分,收集其余部分后立即送检。
4、保护毛刷标本:将纤维支气管镜插入亚段支气管可疑感染部位,经支气管镜刷检孔推出双层套管中的毛刷(远端填塞聚乙二醇),刷取脓性分泌物,采样后将毛刷回收入双层套管并退出纤维支气管镜,用无菌剪刀剪断毛刷,置于含lmL生理盐水的无菌容器中(仅供需氧培养),快速送检。
5、气管穿刺法在环甲膜下穿刺抽取痰液,收集标本,适用于厌氧菌培养。
6、棉拭采集法用无菌棉拭子轻轻擦拭病人鼻咽部黏膜,留取标本,置无菌试管内送检。
(七)标本拒收标准:1、申请单姓名、科别、床号与标本的标签不符。
2、痰标本呈水样或唾液样。
3、痰涂片白细胞<10/低倍视野,上皮细胞>25/低倍视野。
4、标本容器溢漏,无瓶盖。
5、痰标本留取放置时间太长,超过2小时。
20呼吸系统标本细菌学检验标准操作规程

规范呼吸道标本细菌学检验标准操作规程,确保检验结果准确可靠。
2
呼吸道标本培养和涂片检查。
3
3.1
3.2
3.2.1
3.2.2
3.2.3
3.2.4
3.2.5
3.3
3.3.1
3.3.2
3.3.3
3.3.4
3.3.5
3.3.6
3.4
采集标本后立即送到实验室,放置时间不应超过2小时。
4
4.1
4.2
4.3
5
参见《质量管理程序》。
6.3
6.3.1
6.3.2
6.3.3
6.3.4
6.3.5
7
8
8.1
8.2
9
9.1
9.2
9.3
10
上呼吸道标本培养生长的细菌是否与疾病有关,需各方面综合分析,排除常居菌后,才可作出正确的判断。下呼吸道的痰液应是无细菌的,而经口腔咳出的痰带有多种上呼吸道的正常寄生菌(如草绿色链球菌).若从病人痰标本中查见致病菌或条件致病菌,提示可能有呼吸道细菌感染。肺炎链球菌是肺炎最常见的致病菌.儿童细菌性肺炎多为流感嗜血杆菌所致.医院获得性肺炎的常见病原菌是革兰阴性杆菌,主要有肺炎克雷伯菌、铜绿假单胞菌、沙雷菌属和肠杆菌属细菌等。肺结核由结核分枝杆菌引起的。嗜肺军团菌引起军团菌病,肺部厌氧感染大多是脆弱类杆菌及梭杆菌属的细菌等。疑典型形态细菌所致肺部感染时,常先做痰液和支气管分泌物涂片、染色镜检(如肺部结核痰液徐片、抗酸染色,镜检找抗酸染色阳性结核分枝杆菌),有助于细菌培养检查。
11
如查出抗酸杆菌阳性,则应及时向临床报告并作出传染病报告。
编写:审核:批准:
日期:年月日
6
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.5质量控制 4.5.1革兰染色 4.5.2抗酸染色 4.5.3培养基 4.5.4试剂 4.5.4.1每批号、每周需做质控的试剂 4.5.4.2每批号、每次试验需做质控的试剂
3
5.1革兰染色报告 5.1.1痰标本报告原则(见表1) “痰/气管吸出物标本涂片革兰染色结果解释” 5.1.2 BAL细胞离心涂片报告
1
内容
1.口咽部定植菌群变化对肺部感染的重要影响
肺部感染的影响因素 (定植菌变化:健康人G+
免疫、基础病/住院、用抗菌药物 G-b )
2.肺部感染的常见机制
主要机制:吸入定植菌;吸入气溶胶;血播性; 附录A:“下呼吸道感染的主要类型及主要病原菌”
3.痰涂片对下呼吸道感染病原菌诊断的重要作用
痰培养:敏感性低 / 培养+ 涂片:提高特异性和敏感性
4.支气管纤维镜标本定量培养的临床意义
特异性82%~91%,诊断价值远高于痰标本; 附录B :“适合诊断的病原及检验项目”
5.下呼吸道感染细菌培养的局限性
培养结果假阴性、假阳性的原因
汇总表 汇总表
2014/5/9
针对医疗机构微生物实验室 针对痰 (细菌) 培养项目:
常规细菌培养方法检测下呼吸道感染病原菌的检验流程 本规范的特色: (1)明确下呼吸道标本适合诊断的病原和检验项目; (2)要求细菌培养项目需同时做革兰染色涂片; (3)规范痰培养/气管吸出物的定性培养程序、气管镜采集标本的定
3.1 标本采集 3.1.1 咳痰 3.1.2 气管吸出物
注:仅当出现肺炎的临床表现(如发热或浸润)时采集气管吸出物标本, 否则勿培养气管吸出物,因气管在插管24h后即有定植菌,培养结果 可能与疾病不符。
3.1.3 血培养 注:当下呼吸道感染患者伴有高热症状时,送检血培养(具体参考血培养
标本采集和送检要求) 3.1.4 诱导痰(通常不用于细菌培养) 3.1.5 气管镜标本
4.2 气管镜标本处理
4.2.1 支气管肺泡灌洗液定量培养 4.2.2 保护毛刷定量培养 4.2.3 接种其他培养基并培养 4.2.4 革兰染色标本处理 4.2.5 剩余BAL标本可用于其他病原检测(标本珍贵)
对剩余BAL标本离心后,可根据需要进行病毒、分枝杆菌、军团菌和真 菌培养;或做病毒、卡氏肺孢子菌、抗酸染色和真菌涂片染色(见参考文献 4的第六篇相关章节)(修改解释)。
3.1.5.1 采集气管镜标本注意事项 3.5.1.2 支气管肺泡灌洗液标本(BAL) 3.5.1.3 保护毛刷(PSB)
2
2014/5/9
3.2 标本运送
注1:若送检标本超过2h,将导致有临床意义的致病菌数量减少,非苛养的口咽部定植 菌过度生长。为防止口咽部正常菌群的过度生长,可将标本放置2℃~8℃环境,但 培养分离到肺炎链球菌等苛养菌的机会和数量会减少。
5.2报告有临床意义的微生物 5.2.1应报告的病原菌 5.2.2培养和涂片相符合时报告的病原菌 5.2.3有临床意义的数量 5.2.4报告有临床意义数量的非优势菌 5.2.5报告有临床意义数量的优势菌
5.3对非致病菌的报告 5.3.1报告“肠杆菌科细菌” 5.3.2报告“非发酵细菌” 5.3.3只生长肠球菌和凝固酶阴性葡萄球菌 5.3.4报告“分离到口咽部正常菌群”
革兰染色。 4.1.2 接种标本 4.1.3 培养 4.1.4 标本涂片及革兰染色 注1:革兰染色脱色时间因选用不同的脱色剂而异。1)95%乙醇脱色时间为30s;2)丙酮-
乙醇(体积比为3:7,棕色瓶室温保存,有效期1年)脱色时间1s~5s,脱色效果一致性 好;3)丙酮(试剂纯)脱色时间最短,当标本中含大量宿主细胞时脱色效果好。 注2:使用革兰染色仪染色的实验室按照厂家操作说明书进行,注意条件优化,使涂片染色结果达到满意效果。 4.1.5显微镜观察革兰染色结果 注:低倍镜下细胞计数、油镜下细菌计数半定量指标;
4.3 连续培养并观察慢生长菌
4.4 分离并鉴定下呼吸道重要致病菌(参见附录C) “常见可疑菌落形态及经典快速鉴定方法(16种)”(修改解释)
4.4.1链球菌属 4.4.2苛养革兰阴性杆菌(在麦康凯平板上难生长) 4.4.3革兰阴性双球菌 4.4.4革兰阴性杆菌(在麦康凯平板上生长良好) 4.4.5葡萄球菌属 4.4.6肠球菌属 4.4.7革兰阳性杆菌 4.4.8鉴定丝状真菌 4.4.9涂片时可见但培养不生长的细菌
2 Murray P.R., Baron, E.J., Pfaller, M., Tenover, F., and Yolken, R. 2006. Manual of Clinical Microbiology, 9th ed. ASM Press, Washington, DC.
3 James V., Karen C.C., James H, J., Guido F., Marie L.L., David W.W.2011. Manual of Clinical Microbiology, 10th ed. ASM Press, Washington, DC.
2 美国微生物学会:《临床微生物学手册》(第9版).2006 3美国微生物学会:《临床微生物学手册》(第10版).2011 4 叶应妩, 等.全国临床检验操作规程(第3版). 2006
5 Nagendra, S., P.Bourbeau, S.Brecher, M.Dunne, Rocco, and G.Doern.2001.Sampling variability in the microbiological evaluation of expectorated sputa and endotracheal aspirates. J. Clin. Microbiol.39:2344-2347. 6 Roson,B.,J.Carratala,R.verdaguer,J.Dorca,F.Manresa,and F.Gudiol.2000.Prospective study of sputum Gram stain in the initial approach to community-acquired pneumonia requiring hospitalization.Clin.Infec.Dis.31:869-874. 7 Gleckman,R.,J.DeVita,D.Hibert,C.Pelletier,and R.Martin.1988.Sputum gram stain assessment in community-acquired bacteremic pneumonia.J.Clin.Microbiol.26:846-849.
2014/5/9
Standard for Bacterial Culture Procedures of Lower Respiratory Tract Infections
主要起草人:卫生部临床检验中心 胡继红
大多数微生物室每日近一半标本量:痰培养+药敏; 培养结果前后两天经常不一致; 培养生长的不同种类、数量细菌如何报告标准不统一; 定植菌、致病菌如何判断—标本是否合格如何判断? 培养结果与临床诊断不符合;
卫生部临床检验中心 陕西省人民医院 安徽省立医院
胡继红 任健康 马筱玲
卫生部北京医院
胡云建
北京大学人民医院
王辉
中国医学科学院北京协和医院 徐英春
首都医科大学附属北京友谊医院 苏建荣
解放军总医院
罗燕萍
浙江省温州医科大学附属第二医院李向阳
1 美国微生物学会:《下呼吸道感染》临床微生物学检验技术技术及操作系列丛书.2004
养均不合格。 诱导痰 注:诱导痰标本只适用于检测卡氏肺孢子菌和结核分枝杆菌,对其他病原菌检出效果差。
4.1 痰及气管吸出物标本处理 4.1.1 标本处理要求
接种标本及涂片操作必须在Ⅱ级生物安全柜中进行; 应尽快处理所有标本,特别是来自急诊、新入院患者和有创方法采集的标本(如:BAL和肺
活检标本),以保证致病菌的活性,避免造成重复采集标本; 使用全自动接种前处理系统的实验室按厂家说明书处理标本,洗痰、液化后自动接种和涂片
量培养程序; (4)明确了报告的临床意义和格式内容。
分析前
标本的采集、运送
标本初筛、合格判断
分析中 定性、定量培养、涂片流程
病原菌筛查和鉴定、质量控制
分析后
染色、培养结果报告(致病菌、非致病菌)、结果解释
支气管肺泡灌洗 BAL 保护毛刷标本 PSB 库什曼螺旋纤维Curschmann’s spiral fibers 夏科雷登结晶 Charcot-Leyden Crystal 弹性纤维 elastic fibers 纤毛柱状上皮细胞 ciliated columnar epithelium cell 肺泡巨噬细胞 alveolar macrophages
5.4平板上无细菌生长 5.5结果解释
1 Susan E.Sharp, Ann Robinson and Michael Saubolle, ect. 2004. Cumulative Techniques and Procedures in Clinical Microbiology 7B, Lower Respiratory Tract Infections.ASM Press, Washington, D.C.
4 叶应妩,等. 全国临床检验操作规程(第3版). 2006. 5 Nagendra, S., P.Bourbeau, S.Brecher, M.Dunne, Rocco, and G.Doern.2001.Sampling
variability in the microbiological evaluation of expectorated sputa and endotracheal aspirates. J. Clin. Microbiol.39:2344-2347. 6 Roson,B.,J.Carratala,R.verdaguer,J.Dorca,F.Manresa,and F.Gudiol.2000.Prospective study of sputum Gram stain in the initial approach to community-acquired pneumonia requiring hospitalization. Clin. Infec. Dis.31:869-874. 7 Gleckman,R.,J.DeVita,D.Hibert,C.Pelletier,and R.Martin.1988.Sputum gram stain assessment in community-acquired bacteremic pneumonia.J.Clin.Microbiol.26:846849.
