有机反应条件总结
有机化学反应的总结

有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH CH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3CH +CH 3CH 3X +CH 3CH 3+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】2CH33H323H32CH CH2CH32CH CH=CH(CH3CH2CH2)3-H3CH2CH2C22CH3CH2OCH2CH2CH33CH2CH2C2CH2CH3+O H-OHB-OCH2CH2CH3CH2CH2CH3H3CH2CH2B OCH2CH2CH3CH2CH2CH32CH2CH3HOO-B(OCH2CH2CH3)3B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO32【例】CH31)BH32)H2O2/OH-CH3HHOH3、X2加成C CBr/CClC CBrBr【机理】CCC CBrBrCBr+C CBrOH2+-H+C CBrOH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
【特点】反式加成 4、烯烃的氧化1)稀冷高锰酸钾氧化成邻二醇。
有机物发生氧化反应的条件

有机物发生氧化反应的条件
有机物氧化反应是指有机物在酸性、碱性、高温、光照以及特定催化剂的作用下所产生的化学反应,它与其他化学反应相比有自己独特的特点。
有机物发生氧化反应的条件有:
1、酸性条件下:当有机物的原子在碱性环境中,某些原子的氧化态增加,一部分反应物也会正氧化,才能发生有机物的氧化反应。
2、碱性条件下:有机物的氧化反应一般在碱性条件下发生,可碱性环境中,某些原子的氧化态减少,一部分反应物也会反氧化,形成碱氧化反应。
3、高温条件下:在高温环境中,原子的活化能可以很大程度地增加,这样反应物可以更轻易地识别到彼此的键,从而可以促进氧化反应的发生。
4、光照条件下:光产生的电子的移动可以影响到有机物的氧化性能,从而引起有机物的氧化反应。
5、特定催化剂下:催化剂可以降低反应物发生反应所需要消耗的能量,使反应更有效率地发生,当然,有机物的氧化反应也同样需要特定的催化试剂。
有机物发生氧化反应,可以影响到许多核心领域,例如农业、药物制造以及能源,因此,在实际应用中,有机物氧化反应需要合理的条件来促进反应的发生。
第十讲有机化学反应类型及条件
二、相关知识链接
常见的Lewis酸如H+、R+、Cl+、Br+、 BF3、AlCl3等。
它们是缺少电子不满足八隅体(氢是 二隅体)电子构型的正离子,或者含 具有空轨道可接受电子对的原子。
在反应中总是进攻反应中电子云密度 较大的部位,所以是一种亲电试剂。
+ transition stat
协同反应
三、小结:有机反应类型分类
各类反应的特点: 自由基反应常在气态下反应,常需光照、
高温或引发剂,一般无需酸或碱催化。 离子型反应很少在气态下发生,常需酸
或碱催化,溶剂化作用对反应速率的影 响较大。 协同反应的速率无论液相或气相都很少 受其它因素的影响而发生变化。
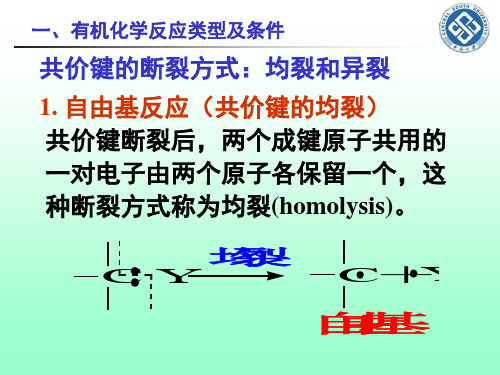
一、有机化学反应类型及条件
碳与其它原子间的σ键断裂时,可得到 碳正离子(carbonium ion或carbocation) 或碳负离子(carbanion)
异 裂
CY
C+Y
正 碳 离 子
异 裂
C Y
C + Y
负 碳 离 子
二、相关知识链接
有机酸碱概念
A 布朗斯特酸碱理论(酸碱质子理论)
凡能给出质子的物质都是酸以,能接受
一、有机化学反应类型及条件
2. 离子型反应(共价键的异裂) 共价键断裂后,其共用电子对只归属
于原共价键的某一原子,产生了正、负 离子。这种键的断裂方式叫做异裂 (heterolysis)。相应的反应称为离子型 反应(ionic reaction)
它往往被酸、碱或极性溶剂所催化, 一般在极性溶剂中进行。
E+
大学有机化学反应总结完整版

大学有机化学反应总结 HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】有机化学一、烯烃1、卤化氢加成 (1)【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)【特点】反马氏规则【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】2、硼氢化—氧化【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】 【例】 3、X 2加成 【机理】【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
【特点】反式加成 4、烯烃的氧化1)稀冷高锰酸钾氧化成邻二醇。
3H 33H3稀冷KMnO433M n OOH 2O 3H 33H 32)热浓酸性高锰酸钾氧化3)臭氧氧化 4)过氧酸氧化5、烯烃的复分解反应 【例】6、共轭二烯烃 1)卤化氢加成2)狄尔斯-阿德尔(Diels-Alder )反应【描述】共轭二烯烃和烯烃在加热的条件下很容易生成环状的1,4加成产物。
【例】二、脂环烃1、环丙烷的化学反应【描述】三元环由于张力而不稳定,易发生加成反应开环,类似碳碳双键。
【特点】环烷烃都有抗氧化性,可用于区分不饱和化合物。
【注】遵循马氏规则【例】2、环烷烃制备1)武兹(Wurtz)反应【描述】通过碱金属脱去卤素,制备环烷烃。
【例】2)卡宾①卡宾的生成A、多卤代物的α消除B、由某些双键化合物的分解②卡宾与烯烃的加成反应【特点】顺式加成,构型保持【例】③类卡宾【描述】类卡宾是一类在反应中能起到卡宾作用的非卡宾类化合物,最常用的类卡宾是ICH2ZnI。
【特点】顺式加成,构型保持【例】三、炔烃1、还原成烯烃1)、顺式加成2)、反式加成2、亲电加成1)、加X2【机理】中间体Br+R2 R1【特点】反式加成2)、加HXRRHBr R Br(一摩尔的卤化氢主要为反式加成)3)、加H2O【机理】【特点】炔烃水合符合马式规则。
有机化学合成与反应条件

有机化学合成与反应条件有机化学合成是指通过有机合成反应,从简单的有机分子合成出复杂的有机分子的过程。
在合成过程中,反应条件的选择是至关重要的,它直接影响到反应的效率和产物的选择性。
本文将介绍一些常见的有机化学合成反应及其反应条件。
一、酯化反应酯化反应是一种重要的有机合成反应,常用于制备酯类化合物。
酯化反应的反应条件通常包括反应物的摩尔比、反应温度和反应时间等。
例如,乙酸与乙醇反应制备乙酸乙酯的反应条件为乙酸和乙醇的摩尔比为1:1,反应温度为酒精沸点以下,并在酸性条件下进行反应,反应时间一般为数小时至数天。
二、脱水反应脱水反应是一种常用的有机合成反应,常用于制备醚类化合物。
脱水反应的反应条件包括反应物的摩尔比、反应温度和催化剂的选择等。
例如,乙醇与丙醇反应制备乙基丙醚的反应条件为乙醇和丙醇的摩尔比为1:1,反应温度为100-150摄氏度,并在酸性条件下进行反应,硫酸可以作为催化剂。
三、氢化反应氢化反应是一种重要的有机合成反应,常用于还原酮、醛等含氧官能团。
氢化反应的反应条件包括反应物的摩尔比、反应温度和催化剂的选择等。
例如,丙酮与氢气氢化制备丙醇的反应条件为丙酮和氢气的摩尔比为1:1,反应温度为室温下至反应物沸点,常使用铂或钯等贵金属作为催化剂。
四、取代反应取代反应是一种常见的有机合成反应,常用于合成卤代烃等化合物。
取代反应的反应条件包括反应物的摩尔比、反应温度和催化剂的选择等。
例如,氯乙烷与氨水反应制备乙胺的反应条件为氯乙烷与氨水的摩尔比为1:3,反应温度为室温下,无需催化剂。
总结:有机化学合成的反应条件多种多样,根据具体反应类型和反应物的性质选择合适的条件非常重要。
本文介绍了酯化反应、脱水反应、氢化反应和取代反应的一些常见反应条件。
熟练掌握这些基础的反应条件对于有机化学合成的研究和应用具有重要意义。
参考文献:1. March, J. Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. John Wiley & Sons, 2007.2. Li, J. H.; Zhang, Y. Z. Modern Organic Synthesis: An Introduction. Chemical Industry Press, 2006.。
常见的有机反应条件归类

常见的有机反应条件归类一.与卤素相关的反应条件1.“−−−−−→−光照或溴蒸气/)(2g Cl ”为烷烃或烷烃基(如苯环侧链)上氢原子的取代反应,并发生连锁反应,可生成一氯代物或多氯代物。
2.“−−−−→−作催化剂e l Br F /)(2”为苯环上氢原子的取代反应。
如:3.“−−−−−−→−溶液或水溶液的或422CCl Cl Br 溶液褪色”为碳碳双键或碳碳三键发生加成反应;醛基发生氧化反应。
4.“−−→−浓溴水溴水褪色或变浅,且产生白色沉淀”为含酚羟基的物质发生苯环上氢原子的取代反应。
取代的位置是酚羟基的两个邻位和一个对位,若这些位置有其它基团占据,则相应位置不能发生取代反应。
如右图所示的1 mol 白藜芦醇只能与6 mol 的Br 2发生反应。
5.“−→−2I遇碘水变蓝色”为淀粉溶液遇I 2变蓝色。
6.“−−→−溶液3FeCl 溶液变紫色”为含酚羟基的物质遇FeCl 3(实为Fe 3+)溶液变紫色。
二.与酸(如H2SO4)相关的反应条件1.“−−−−−→−或加热浓C 170/o 42SO H ”为含醇羟基的物质发生消去反应(分子内脱水),消去的是羟基和β碳原子上的氢原子,生成碳碳双键或碳碳三键和水分子。
没有β碳原子或β碳原子上没有氢原子,则不能发生该反应,如CH 3OH 和(CH 3)3CH 2OH 都不发生消去反应。
若醇不对称,可生成两种或三种烯烃,如3-甲基-3-己醇可生成如下三种烯烃。
二元醇还可以生成二烯烃或炔烃。
2.“−−−−−→−或加热浓C 140/o42SO H ”为含醇羟基的物质发生分子间脱水(取代反应),生成“—O —”(醚)。
3.“−−−→−加热浓/42SO H ”为苯环上的磺化反应和含醇羟基的物质跟含羧基的物质发生的酯化[可用(CH 3CO)2O (乙酸酐)代替浓硫酸]反应以及纤维素(用90%浓硫酸)的水解反应。
其中酯化反应的过程一般是羧基中的羟基与醇羟基上的氢原子结合成水,余下部分结合成酯。
有机还原反应知识点总结

有机还原反应知识点总结一、有机还原反应的概念有机还原反应是指通过还原剂将有机化合物中的含氧、含氮等含氧元素还原为含碳的反应。
反应中,还原剂失去电子,有机化合物得到电子,被还原。
有机还原反应广泛应用于有机合成、医药、农药、染料化工和日化等领域。
二、有机还原反应的条件1. 适宜的溶剂有机还原反应大多数是在无水无氧条件下进行的,因此通常使用惰性溶剂,如乙醚、四氢呋喃或二甲基亚砜等。
2. 适宜的温度有机还原反应往往在室温至加热条件下进行。
3. 适宜的催化剂有机还原反应通常需要催化剂的存在,如钯或镍等。
三、有机还原反应的类型1. 金属还原金属还原法是利用金属(如锂、铝、镓等)将含氧化合物还原成对应的含氢化合物。
例如,用锂将醛还原为醇,如下所示:RCHO + 2LiAlH4 → RCH2OH + 2LiAlO2 + H22. 氢化物还原氢化物还原法是利用氢化物(如氢化铝锂、氢化钠)将含氧化合物还原为对应的含氢化合物。
例如,用氢气/铁粉将醇还原为烃,如下所示:RCH2OH + 2H2/Fe → RCH3 + H2O3. 单质还原单质还原法是利用单质(如氢气)将含氧化合物还原为对应的含氢化合物。
例如,用氢气/催化剂将醛还原为醇,如下所示:RCHO + H2/Pt → RCH2OH四、有机还原反应的机理1. 金属还原反应机理金属还原反应的机理是金属先发生氧化反应,生成金属离子,然后金属离子与含氧化合物发生反应,将含氧化合物还原为对应的含氢化合物。
2. 氢化物还原反应机理氢化物还原反应的机理是氢化物先发生离子化反应,生成氢离子和阴离子,然后氢离子与含氧化合物发生反应,将含氧化合物还原为对应的含氢化合物。
3. 单质还原反应机理单质还原反应的机理是单质与含氧化合物发生氢化反应,将含氧化合物还原为对应的含氢化合物。
五、有机还原反应的应用1. 有机合成有机还原反应广泛应用于有机合成领域。
例如,将醛酮还原为对应的醇,将羧酸还原为对应的醛醇等。
有机合成反应条件归纳

2008~2019年江苏高考有机合成
必备反应条件归纳
一、催化氧化
1.醇的催化氧化
注意:①仲醇催化氧化产物为酮;②尽可能不要使用酸性高锰酸钾溶液。
2.醛催化氧化到羧酸
注意:一般不用菲林反应,更不用银镜反应。
二、氢气还原
1.烯烃与氢气
2.苯环与氢气
3.醛与氢气
注:苯环、醛基共存时,可以通过条件“催化剂,△”让醛基单独还原为醇,而苯环保持不变。
三、烯烃的加成反应(炔烃类似)
1.烯烃与卤素单质
2.烯烃与卤化氢
注意:马氏规则(氢加在氢多的碳原子上)(一般也是合成需要的)
四、卤代烃、醇的消去反应
1.卤代烃到烯烃
注意:扎伊采芙规则(尽可能生成“取代基”多的)(一般也是合成需要的)2.醇到烯烃
注意:扎伊采芙规则
五、取代反应系列
1.卤代烃水解
2.醇到卤代烃
3.苯环发生硝化反应
注:①硝基也可能在对位,甚至是邻、对位同时,根据题目灵活处理。
②苯环上烃基直接被酸性高锰酸钾溶液氧化到羧基,题目没有信息时尽可能不要用。
4.醇脱水成醚
5.羧酸与醇发生酯化反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机反应条件总结
有机反应是有机化学领域中的关键内容之一,它涉及到分子之间的结构变化和化学键的形成与断裂。
在有机反应中,不同的反应条件可以对反应的速率、产率和选择性产生重要影响。
以下是一些常见的有机反应条件的总结:
1. 酸碱条件:
酸碱条件是许多有机反应中常见的条件之一。
酸性条件通常使用强酸,如浓硫酸(H2SO4)或硫酸三甲酯(Me3SO3H)来促进酸催化反应。
碱性条件通常使用碱性试剂,如氢氧化钠(NaOH)或氢氧化钾(KOH),来促进碱催化反应。
2. 温度条件:
温度是控制有机反应速率和产物选择性的重要因素。
低温条件常常用于控制反应的立体选择性和避免副反应的发生。
高温条件通常用于加速反应速率和增加反应的产率。
反应温度可以通过冷却剂或加热设备来控制。
3. 溶剂条件:
溶剂在有机反应中起着溶解反应物、促进反应和调节反应速率的作用。
常用的有机溶剂包括乙醇、二甲基甲酰胺(DMF)、二氯甲烷(DCM)和乙醚等。
选择适当的溶剂可以提高反应的效率和选择性。
4. 氧化还原条件:
氧化还原反应在有机合成中非常重要。
常用的氧化剂包括过氧化氢(H2O2)、高锰酸钾(KMnO4)和氯氧化钠(NaClO)等。
还原剂包括氢气(H2)、氢化铝锂(LiAlH4)和二硼烷(NaBH4)等。
氧化还原条件可以用于改变分子的氧化状态、功能化和构建碳碳或碳氧化学键。
5. 光照条件:
光照条件常用于光化学反应,其中光能被吸收并转化为化学能以驱动反应。
光照条件可以用紫外线(UV)光源、可见光或甚至红外线光源来实现。
光化学反应在有机合成中广泛应用,例如光催化反应和光合成反应。
6. 催化剂条件:
催化剂在有机反应中起着关键的作用,它可以显著加速反应速率并降低活化能。
常见的催化剂包括金属催化剂(如钯、铂、铑、铜等)、酶、有机小分子催化剂(如路易斯酸和路易斯碱)等。
催化剂条件可以用于催化反应,例如加氢、加氧、加成和重排反应。
7. 时间条件:
反应时间是有机反应中另一个重要的因素。
某些反应可能需要较短的反应时间,而其他反应可能需要较长的反应时间以达到高产率。
反应时间可以通过控制反应物的加入速率、反应温度和反应容器的设计来调节。
8. 气体条件:
某些有机反应涉及气体的参与或产生,例如气相反应或气体的溶解和排放。
气体条件可以通过控制气体的流量、压力和溶解度来调节。
9. 过滤和提纯条件:
在有机反应完成后,通常需要进行过滤和提纯来获得纯净的产物。
过滤条件涉及使用适当的滤纸或滤膜将固体产物与反应溶液分离。
提纯条件包括晶体化、蒸馏、凝固、萃取等技术,以获得高纯度的产物。
10. 压力条件:
某些有机反应在高压条件下进行,例如合成高压聚合物或气相催化反应。
调节反应压力可以影响反应速率和产物的选择性。
11. 其他条件:
此外,还有一些特殊的有机反应条件,如微波辐射、超声波辐射、等离子体条件等。
这些条件可以提供非常特殊的反应环境,加速反应速率或改变反应的选择性。
以上总结了一些常见的有机反应条件。
需要注意的是,不同的反应具有不同的最佳条件,因此在设计和优化有机反应时,需要根据具体的反应类型和目标产物选择适当的条件。
此外,安全性和环境影响也是选择反应条件时需要考虑的因素之一。
