高中有机化学反应规律总结(非常齐全)
有机化学反应的总结
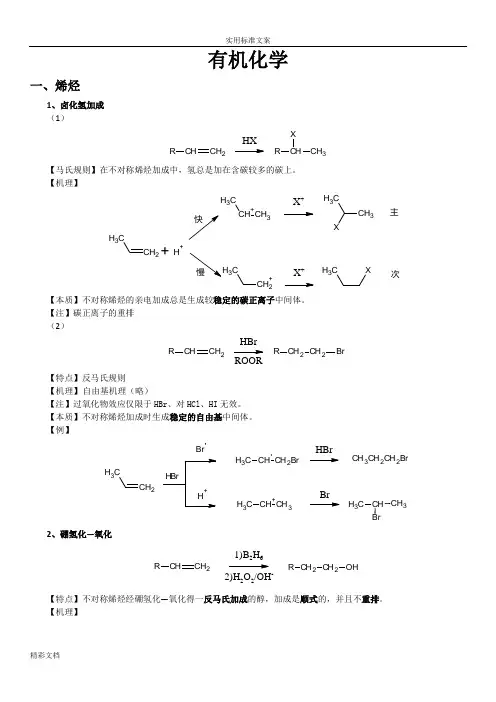
有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH CH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3CH +CH 3CH 3X +CH 3CH 3+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】2CH33H323H32CH CH2CH32CH CH=CH(CH3CH2CH2)3-H3CH2CH2C22CH3CH2OCH2CH2CH33CH2CH2C2CH2CH3+O H-OHB-OCH2CH2CH3CH2CH2CH3H3CH2CH2B OCH2CH2CH3CH2CH2CH32CH2CH3HOO-B(OCH2CH2CH3)3B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO32【例】CH31)BH32)H2O2/OH-CH3HHOH3、X2加成C CBr/CClC CBrBr【机理】CCC CBrBrCBr+C CBrOH2+-H+C CBrOH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
【特点】反式加成 4、烯烃的氧化1)稀冷高锰酸钾氧化成邻二醇。
高中化学有机反应总结

高中化学有机(yǒujī)反响(fǎnxiǎng)总结(zǒngjié)高中化学有机(yǒujī)反响(fǎnxiǎng)总结1、取代反响:有机物分子里的某些原子或原子团被其他原子或原子团所取代的反响。
⑴硝化反响:苯分子里的氢原子被NO2所取代的反响。
⑵磺化反响:苯分子里的氢原子被硫酸分子里的磺酸基〔SO3H〕所取代的反响。
⑶酯化反响:酸和醇起作用生成酯和水的反响。
⑷水解反响:一般指有机化合物在一定条件下跟水作用生成两种或多种物质的化学反响。
〔其中皂化反响也属于水解反响。
皂化反响:油脂在有碱存在的条件下水解,生成高级脂肪酸钠和甘油的反响。
〕水解反响包括卤代烃水解、酯水解、糖水解、|白质水解。
另:缩聚反响也属于取代反响。
2、加成反响:有机物分子中双键〔叁键〕两端的碳原子与其他原子或原子团所直接结合生成新的化合物的反响。
⑴油脂的氢化反响属于加成反响。
油脂的氢化:液态油在催化剂〔如Ni〕存在并加热、加压的条件下,跟氢气起加成反响,提高油脂的饱和度的反响,也叫油脂的硬化。
⑵水化反响:在有机化学中指分子中不饱和键〔双键或叁键〕或羰基在催化剂存在或不存在下和水分子化合的反响。
3、消去反响:有机化合物在一定条件下,从一个分子中脱去一个小分子〔如H2O、HBr等〕,而生成不饱和〔含双键和叁键〕化合物的反响。
4、聚合反响:由相对分子质量小的化合物分子结合成相对分子质量较大的高分子化合物的反响。
⑴加聚反响:由不饱和的相对分子质量小的化合物分子结合成相对分子质量较大的高分子化合物的反响。
这样的聚合反响同时也是加成反响,所以叫加聚反响。
⑵缩聚反响:由相对分子质量小的化合物分子结合成相对分子质量较大的高分子化合物,同时生成小分子〔如H2O、NH3、H某等分子〕的反响。
5、氧化反响:在有机反响中,通常把有机物分子中参加氧原子或失去氢原子的反响叫氧化反响。
6、复原反响:在有机反响中,通常把有机物分子中参加氢原子或失去氧原子的反响叫氧化反响。
2025年有机化学反应规律知识点总结

2025年有机化学反应规律知识点总结有机化学作为化学领域的重要分支,其反应规律复杂多样且充满魅力。
随着科学技术的不断进步和研究的深入,到 2025 年,我们对有机化学反应规律的认识也更加全面和深入。
以下将对一些重要的有机化学反应规律进行总结。
一、加成反应加成反应是有机化学中常见的反应类型之一,它是指两个或多个分子结合生成一个较大分子的反应。
1、烯烃的加成烯烃是含有碳碳双键的烃类化合物。
在加成反应中,烯烃的双键容易被打开,与其他分子发生加成。
例如,与氢气的加成可以生成烷烃;与卤素单质的加成可以生成卤代烃。
以乙烯与氢气的加成反应为例:CH₂=CH₂+ H₂ → CH₃CH₃,这个反应需要在催化剂的作用下进行,如镍。
2、炔烃的加成炔烃含有碳碳三键,其加成反应与烯烃类似,但相对较为复杂。
例如,与氢气加成可以分步进行,最终生成烷烃。
3、醛和酮的加成醛和酮中的羰基(C=O)可以与氢气、氢氰酸等发生加成反应。
例如,醛与氢气加成生成醇:CH₃CHO + H₂ → CH₃CH₂OH 。
二、取代反应取代反应是指有机物分子中的某些原子或原子团被其他原子或原子团所替代的反应。
1、烷烃的卤代反应烷烃在光照条件下可以与卤素单质发生取代反应,生成卤代烃。
例如,甲烷与氯气的反应:CH₄+ Cl₂ → CH₃Cl + HCl ,反应逐步进行,可以生成一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳等多种产物。
2、苯环上的取代反应苯环具有特殊的稳定性,但在一定条件下也能发生取代反应。
例如,苯与溴在催化剂作用下发生溴代反应生成溴苯。
3、醇的取代反应醇分子中的羟基可以被卤素原子取代,如醇与氢卤酸的反应。
三、消去反应消去反应是指在一定条件下,有机物分子脱去小分子(如 H₂O、HX 等)生成不饱和化合物的反应。
1、醇的消去反应醇在浓硫酸、加热的条件下可以发生消去反应生成烯烃。
例如,乙醇消去生成乙烯:CH₃CH₂OH → CH₂=CH₂+ H₂O 。
高中化学有机化学反应类型全总结

有机化学反应类型全总结一、取代反应定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应.取代反应的类型很多, 中学化学中主要有下面几类:1.卤代反应烷烃、芳香烃、苯酚等均能发生卤代反应如:2.硝化反应苯及其同系物、苯酚、烷烃等均能发生硝化反应如:3.磺化反应苯、苯的衍生物, 几乎均可磺化.如:邻、对位产物为主4. 酯化反应1羧酸和醇的反应.如:2无机含氧酸和醇的反应.如:5.水解反应:卤代烃、酯、多糖、二糖、蛋白质都能在一定条件下发生水解反应.如:6. 与活泼金属的反应:醇、酚、羧酸等均能与活泼金属如钠反应生成氢气.如:7.醇与卤化氢HX的反应.如:8.羧酸或醇的分子间脱水.如:二、加成反应定义有机物分子里不饱和的碳原子跟其它原子或原子团直接结合, 生成别的物质的反应, 叫加成反应分子结构中含有双键或叁键的化合物, 一般能与H2、X2X为Cl、Br、I、HX、H2O、HCN等小分子物质起加成反应.如烯烃、二烯烃、炔烃、苯及其同系物、醛、酮、不饱和高级脂肪酸及其甘油脂、单糖等.说明:1.羧基和酯基中的碳氧双键不能发生加成反应;2.醛、酮的羰基只能与H2发生加成反应; 3.共轭二烯有两种不同的加成形式;1.和氢气加成.2.和卤素加成3.和卤化氢加成4.和水加成三、消去反应定义:有机化合物在适当条件下, 从一个分子相邻两个碳原子上脱去一个小分子如H2O、HX等而生成不饱和双键或叁键化合物的反应称为消去反应, 又称消除反应发生消去反应的化合物需具备以下两个条件:1是连有一OH或一X的碳原子有相邻的碳原子;2是该相邻的碳原子上还必须连有H原子.1.醇的消去反应.如:2.卤代烃的消去反应.如:四、聚合反应定义:由许多单个分子互相结合生成高分子化合物的反应叫聚合反应.聚合反应有两个基本类型:加聚反应和缩聚反应.1.加聚反应.由许多单个分子互相加成, 又不缩掉其它小分子的聚合反应称为加成聚合反应简称加聚反应.烯烃、二烯烃及含的物质均能发生加聚反应.如:2.缩聚反应单体间相互结合生成高分子化合物的同时, 还生成小分子物质的聚合反应, 称为缩合聚合反应, 简称缩聚反应.酚和醛、氨基酸形成多肽、葡萄糖形成多糖、二元醇与二元酸、羟基羧酸等均能发生缩聚反应.如:五、有机氧化反应1.燃烧绝大多数有机物容易燃烧如:3.催化氧化或去氢(1)乙烯催化氧化制乙醛催化剂PdCl2和CuCl2(2)乙醇催化氧化制乙醛催化剂:Cu或Ag(3)乙醛催化氧化制乙酸催化剂:醋酸锰(4)丁烷氧化法制乙酸催化剂:羧酸的钴盐等4.与强氧化剂:KMnO4H+的反应:(1)烯烃、二烯烃、炔烃,含有的油脂都能使KMnO4H+的紫色褪色.如:2苯的同系物也能使KMnO4H+的紫色褪色.如:(2)醛、甲酸及其酯、甲酸盐、葡萄糖等含有醛基的物质也能使KMnO4H+的紫色褪色.如:5.醛基-CHO与弱氧化剂:银氨溶液、新制CuOH2的氧化反应. -CHO均被氧化成-COOH,醛类、甲酸及其酯、甲酸盐、葡萄糖等均能发生上述反应.如:六、有机还原反应1.催化加氢或去氢的还原反应含有或的不饱和化合物及含有的醛、酮、单糖、羧酸等物质与H2的加成反应,都属于还原反应其它反应见前面加成反应1.如:3.硝基苯制苯胺七、分解反应1.热分解反应.如:2.裂化、裂解反应.如:八、酸碱反应九、显色反应1.苯酚溶液跟FeCl3溶液作用能显紫色.因苯酚和FeCl3在水溶液里反应,生成络离子而显紫色.2.可溶性淀粉溶液遇碘变蓝色因直链淀粉的结构能容纳碘钻入并吸附成包含物质而显蓝色.4.蛋白质分子结构中含有苯环, 跟浓硝酸作用呈黄色因氨基酸中的苯环发生硝化反应, 生成黄色的硝基化合物.十、与Na反应。
高考化学有机反应知识点总结

高考化学有机反应知识点总结化学反应是化学学科中的重要内容之一,有机反应是其中的一个重要分支。
在高考化学考试中,有机反应占有相当大的比例,掌握有机反应的知识点对于取得好成绩至关重要。
本文将对高考化学有机反应的知识点进行总结和梳理,帮助考生更好地复习备考。
一、醇的氧化反应醇的氧化反应是有机化学中的基础知识点之一。
醇可以被强氧化剂氧气或者酸性高锰酸钾氧化为相应的醛或酮。
其中,一元醇氧化生成醛,二元醇氧化生成酮。
反应过程中,氧化剂被还原,醇被氧化。
二、卤代烷的消去反应卤代烷的消去反应是有机化学中的重要知识点。
卤代烷可以与碱反应,生成烯烃。
该反应常采用碱性条件下进行,生成的烯烃具有较高的不稳定性,容易发生加成反应。
三、酯的加水分解反应酯的加水分解反应也是高考化学中的重要知识点之一。
酯可以在酸性或碱性条件下与水反应,生成相应的醇和酸(或盐)。
该反应可用于制备醇和酸,也是酯的水解方法之一。
四、醛和酮的氧化还原反应醛和酮的氧化还原反应是高考化学中的重要内容。
醛和酮可以在适当条件下发生氧化还原反应,被氧化成相应的酸或被还原成相应的醇。
该反应可用于鉴别醛和酮以及制备醛酮化合物。
五、酚的溴代反应酚的溴代反应也是高考化学中的知识点之一。
酚可以在酸性条件下与溴反应,生成溴代酚。
该反应是酚的重要官能团转化方法之一。
六、醛和酮的加成反应醛和酮的加成反应是高考化学中的重要知识点。
醛和酮可以与多种试剂进行加成反应,形成相应的加成产物。
常见的加成试剂包括氢氰酸、氨水、水合肼等。
七、酸酐的加水反应酸酐的加水反应是高考化学中的知识点之一。
酸酐可以与水发生加成反应,生成相应的羧酸。
该反应也可用于制备羧酸。
八、醛和酮的缩合反应醛和酮的缩合反应也是高考化学中的重要内容。
醛和酮可以与醛酮反应生成β-羟醛或β-羟酮。
该反应是有机合成中常用的方法之一。
以上是高考化学有机反应的主要知识点总结。
通过对这些知识点的学习和理解,考生可以更好地应对化学考试,取得优异成绩。
高中化学的归纳有机化学与配位化学的重要规律总结

高中化学的归纳有机化学与配位化学的重要规律总结化学作为一门科学,涉及到了众多的分支和领域。
在高中化学的学习中,有机化学和配位化学是两个重要的方向。
通过归纳,我们可以总结出许多在这两个领域中的重要规律。
本文将针对高中化学的有机化学和配位化学,分别进行总结归纳。
一、有机化学的重要规律总结高中有机化学主要涉及有机化合物的结构、命名、性质和反应等方面的内容。
在学习中,我们归纳出了以下几个有机化学的重要规律:1. 碳原子的四价性:有机化合物中的碳原子通常是四个键的饱和原子。
它可以形成单键、双键或三键,从而构建出不同的有机分子结构。
2. 基团的作用:有机化合物中的基团对于化合物的性质和反应至关重要。
例如,羟基(-OH)使化合物具有醇的性质,氨基(-NH2)使化合物具有胺的性质等。
3. 稳定性的影响因素:有机化合物的稳定性受到分子结构的影响,如烷烃比烯烃稳定,芳香烃稳定性较高等。
此外,分子中的其他作用力,如范德华力、静电作用力等也会影响分子的稳定性。
4. 反应类型和机理:有机化学的反应类型多种多样,例如取代反应、加成反应、消除反应等。
每种反应都有其特定的反应机理,要求学生熟悉并掌握。
以上只是有机化学中的一些重要规律,还有很多其他的规律和知识需要我们深入学习和探索。
二、配位化学的重要规律总结在高中化学中,配位化学是有机化学之外的一个重要的方向,主要研究配位键的形成、配合物的性质和反应等。
以下是配位化学中的重要规律总结:1. 配位键的形成:配位键是由一个中心金属离子通过共价键与配体结合而形成的。
中心金属离子可以有不同的价态,配体也有不同的配位方式,例如双电子对给体、单电子对给体等。
2. 配合物的性质:配合物的性质受到中心金属离子和配体的影响,例如配合物的颜色、稳定性等取决于配体的电子结构和配位方式。
3. 配位反应:配位反应是指配合物中的配体发生取代反应或背景反应。
不同的配体可以通过这些反应来改变配位物的性质和结构。
中学化学反应基本类型的归纳及规律
中学化学反应基本类型的归纳及规律一、化合反应1、金属单质或非金属单质与氧的化合。
活泼性强的金属易与氧化合,反之难化合。
如:K、Na、Ca常温与O2化合迅速,Ag、Pt、Al加热也不与O2反应。
氧化性显著的非金属一般难或不与O2化合,还原性强些的非金属容易与O2化合。
如:Cl2、Br2、I2不与O2化合,N2与O2难反应,P、C与O2可燃烧,变价元素与O2在不同条件下常形成不同价态的化合物,Fe与O2加热形成Fe2O3,燃烧形成Fe3O4。
2、酸性化合物与碱性化合物的化合。
两者相对的酸、碱性相差越大,则越易化合。
如:CaO与SO3易化合,Ca与SiO2需高温才能化合,CO2与CuO、Al2O3不反应,NH3与H2SiO3难或不反应、与HCl易反应。
3、氧化物的水化。
少数碱性氧化物,如K—Mg的氧化物反应生成碱,两性氧化物与水均无反应,酸性氧化物大部分与水反应,SiO2例外。
二、分解反应1、氧化物分解。
活泼金属氧化物一般加热不分解,不活泼金属氧化物一般加热分解,如Ag2O、CaO;活泼非金属氧化物一般不稳定,不活泼非金属氧化物常难以热分解,如P2O5、SiO2。
2、气态氢化物的热分解。
一般强非金属气态氢化物难分解,弱非金属气态氢化物较易分解。
3、含氧酸的分解。
多数含氧酸能分解成酸性氧化物和水,但H3PO4可视为加热不分解。
4、盐的分解。
铵盐一般热分解成氨和酸。
强氧化性不稳定酸的铵盐热分解复杂,发生氧化还原反应。
非氧化性含氧酸盐对应酸酐挥发难分解,碳酸盐多数热分解,但K2CO3、Na2CO3例外,而硝酸盐全分解。
活泼金属硝酸盐热分解为亚硝酸盐和O2,中等活泼的分解为NO2、O2与金属氧化物,很不活泼金属硝酸盐热分解出NO2、O2和金属单质。
其它盐如KClO3、KMnO4、AgBr等受热也分解。
三、复分解反应1、酸性氧化物跟碱的反应。
但不溶性氧化物与碱一般需加热,如NaOH与SiO2。
碱与过量酸性氧化物作用生成酸式盐。
(完美版)高中有机化学反应机理总结
(完美版)高中有机化学反应机理总结
简介
有机化学是化学的一个重要分支,涉及到有机物的结构、性质和反应等方面。
了解有机化学反应机理对深入理解有机化学的本质非常关键。
本文将总结高中有机化学反应的机理,帮助读者更好地理解这一领域。
反应机理的基本概念
- 反应中的化学键的形成和断裂
- 反应中的电子转移过程
- 亲核试剂和电子试剂的作用机制
常见的高中有机化学反应机理
1. 取代反应机理
- 亲电取代反应机理(电子亲和力大的亲电试剂与亲核试剂反应)
- 亲核取代反应机理(互相排斥的亲核试剂之间的竞争)
- 反应中的亲电和亲核中心的变化
2. 加成反应机理
- 亲电加成反应机理(亲电试剂与π电子体系结合)
- 亲核加成反应机理(亲核试剂与亲电试剂结合)
3. 酯化和醇化反应机理
- 酯化反应机理(酸与醇反应)
- 醇化反应机理(醛酮与醇反应)
4. 缩合反应机理
- 醛酮缩合反应机理(醛酮官能团之间的缩合反应)
- 酯缩合反应机理(醇和羧酸之间的缩合反应)
5. 脱水反应机理
- 脱水(即水的去除)
结论
通过理解高中有机化学反应的基本机理,我们可以更好地把握有机化学的核心思想和规律。
掌握这些机理有助于我们在实验中的实际操作和解释反应结果。
希望本文对读者理解有机化学反应机理有所帮助。
有机化学反应规则总结
有机反应规则总结1 Arbuzov亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚磷酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷R'X 的烷基和亚磷酸三烷基酯(RO)3P 的烷基相同(即R' = R),则Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按 S N2 进行的分子内重排反应:反应实例2 Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例3 Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
高考化学有机化学反应基础知识全面总结
高考化学有机化学反应基础知识全面总结在高考化学中,有机化学反应是一个重要的考点。
掌握好有机化学反应的基础知识,对于理解和解决相关问题至关重要。
下面就让我们一起来全面总结一下高考化学中常见的有机化学反应。
一、取代反应取代反应是指有机物分子中的某些原子或原子团被其他原子或原子团所替代的反应。
常见的取代反应有以下几种:1、卤代反应烷烃在光照条件下与卤素单质(如氯气、溴气)发生取代反应,生成卤代烃和卤化氢。
例如,甲烷与氯气在光照下发生反应:CH₄+Cl₂ → CH₃Cl + HCl 。
2、硝化反应苯与浓硝酸、浓硫酸在加热条件下发生硝化反应,生成硝基苯和水。
3、酯化反应羧酸与醇在浓硫酸催化下发生酯化反应,生成酯和水。
例如,乙酸与乙醇反应:CH₃COOH + C₂H₅OH ⇌ CH₃COOC₂H₅+ H₂O 。
4、水解反应酯、卤代烃等在一定条件下发生水解反应,酯水解生成羧酸和醇,卤代烃水解生成醇和卤化氢。
二、加成反应加成反应是指有机物分子中不饱和键(双键或三键)两端的原子与其他原子或原子团直接结合生成新化合物的反应。
1、与氢气的加成烯烃、炔烃、苯及其同系物等在一定条件下与氢气发生加成反应,使不饱和键变为饱和键。
例如,乙烯与氢气反应:CH₂=CH₂+ H₂→ CH₃CH₃。
2、与卤素单质的加成烯烃、炔烃等与卤素单质发生加成反应。
3、与卤化氢的加成烯烃、炔烃等与卤化氢发生加成反应。
三、消去反应消去反应是指在一定条件下,有机物分子脱去小分子(如 H₂O 、HX 等)生成不饱和化合物的反应。
醇在浓硫酸、加热条件下发生消去反应生成烯烃。
例如,乙醇在浓硫酸作用下加热到 170℃发生消去反应:C₂H₅OH → CH₂=CH₂↑ +H₂O 。
卤代烃在氢氧化钠的醇溶液、加热条件下发生消去反应生成烯烃。
四、氧化反应1、燃烧有机物在氧气中燃烧,生成二氧化碳和水。
2、催化氧化醇在铜或银作催化剂、加热条件下被氧化为醛或酮。
例如,乙醇被氧化为乙醛:2CH₃CH₂OH + O₂ → 2CH₃CHO + 2H₂O 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学反应条件总结
(分子间脱水)
苯硝化(水
二糖及多糖
(取代)
酯水解(彻
化,生成醛脱去与羟基相连接碳原子上的氢和羟基中的氢
反应,烷烃
苯环侧链卤
反应,苯环被取代
不饱和烃加
举例
苯酚的取代
醛的氧化反
烯烃炔烃与
苯酚与浓溴、;醇
有机化学官能团的引入总结
卤代烃水解
烷烃芳香烃
烯烃炔烃与
烯烃炔烃与
取
—OH +NaOH +H 2O
—ONa
有机化学规律性知识性总结
举例
2CH 3CH 2OH+2Na→2CH 3CH2ONa+H 2↑
、甲
甲酸盐、
HCHO + 4Ag(NH 3)2OH 4Ag↓+ (NH 4)2CO 3 + 6NH 3 +
2H 2O
注:甲醛(相当于两个醛基) (葡萄糖、
麦芽糖等)
CH 2OH-(CHOH)4- CHO+2Ag(NH 3)2OH
CH 2OH-(CHOH)4-COONH 4+2Ag↓+3NH 3↑+H 2O
OH
官能团转化示意图
有机合成
我们说有机合成就是通过有机反应构建目标分子的骨架,并引入或转化所需的官能团。
所以说有机合成的重点就是如何重新构建骨架和引入及转变官能团,在这个过程中逆合成分析法是一个非常实用和有效的方法,即从产物的特征(包括碳链结构,官能团类型,空间结构等)出发,去分析得到该产物的上一步物质的特征,然后依次类推,并和最初给出的反应物相结合,推出合成过程中的中间产物,最终解决有机合成题。
(1)官能团的引入: 1)引入羟基(-OH )
①醇羟基的引入:a.烯烃与水加成;b.醛(酮)与氢气加成;c.卤代烃碱性水解;d.酯的水解等。
②酚羟基的引入:酚钠盐过渡中通入CO2,
的碱性水解等。
③羧羟基的引入:醛氧化为酸(被新制Cu(OH)2悬浊液或银氨溶液氧化)、酯的水解等。
2)引入卤原子:a.烃与X 2取代;b.不饱和烃与HX 或X 2加成;c.醇与HX 取代等。
3)引入双键:a.某些醇或卤代烃的消去引入C=C ;b.醇的氧化引入C=0等。
(2)官能团的消除
1)通过加成消除不饱和键。
2)通过消去、氧化或酯化等消除羟基(-OH ) 3)通过加成或氧化等消除醛基(-CHO ) 4)通过取代或消去和消除卤素原子。
(3)官能团间的衍变
卤代烃
R —X
醇 R —OH 醛 R —CHO
羧酸 RCOOH
酯RCOOR ’
水解 水解 酯化
氧化 还原
氧化
酯化 水解
不饱和烃
加
成 消
去
消去
加成
根据合成需要(有时题目信息中会明示某些衍变途径),可进行有机物的官能团衍变,以使中间物向产物递进。
常见的有三种方式:
①利用官能团的衍生关系进行衍变,如伯醇[]
−→−O 醛[]
−→−O 羧酸;
②通过某种化学途径使一个官能团变为两个, 如
CH 3CH 2OH
O
H 2-−−→−消去CH 2=CH 22
Cl +−−→−加成Cl —CH 2—CH 2—Cl −−→
−水解HO —CH 2—CH 2—OH; (4)有机高分子的合成
从有机高分子的结构特点也可以找到解题线索,如根据题中给出的高分子化合物的结构特点,可以判断出合成该高分子化合物的单体特征,然后采用逆推法,从单体出发进一步向上推演,查找单体中相应官能团和碳链结构的来源途径,并和题中的其他已知因素结合理解和推演,最终可以顺利解题。
以丙烯为例,看官能团之间的转化:
上述转化中,包含了双键、卤代烃、醇、醛、羧酸、酯高分子化合物等形式的关系,领会这些关系,基本可以把常见的有机合成问题解决。
