2007年福建省高中学生化学竞赛预赛试题剖析
高考化学复习福建省化学竞赛初赛试题及答案(5月18日).docx

高中化学学习材料鼎尚图文收集整理2008年福建省高中学生化学竞赛预赛试题(2008年5月18日8:30—11:30共计3小时)题号一二三四五六七八九十总分得分一.(10分)填空1.教科书中将铝酸盐表面描述为强Br nsted酸,而硅胶则是非常弱的酸。
SiO2晶格中有了Al3+后酸性加强的原因。
2.已知有两种形式的氮化硼,常见的一种是滑的灰色的物质,第二种是在高压下合成的,是已知最硬的物质之一。
在300℃以下,两者皆保持固体状态,这两种构型的氮化硼分别类似于和。
3.已知某黄色固体是一种主族元素的简单化合物,它不溶于热水而溶于热的稀盐酸,生成一种橙红色溶液。
当这一溶液冷却时,有一种白色晶态沉淀物析出。
加热溶液时,白色沉淀物又溶解,这个化合物是。
4.酸化某溶液得S和H2SO3,则原溶液中可能含哪些含硫化合物。
二.(10分)绿色化学法制备天青石有效地克服了传统生产方法中转化率较低、三废污染严重、能耗高、生产复杂等种种弊端。
制备的碳酸锶产品化学纯度平均达到99. 5%,并且可制备质量较高的工业副产品硫酸铵,从而大大降低了生产成本。
我国鄂东某地的天青石,其中有效成分的平均质量分数为80% ,同时含有少量的Ba, Ca, Mg, SiO2 , Fe2O3 , FeO等杂质。
天青石可以同NH4HCO3 溶液在一定的条件下发生化学反应,而生成含有某些杂质的SrCO3 粗级产品。
在上述反应过程中,添加适量的NH4Cl作为催化剂,可以使反应速度明显加快。
将分离出(NH4)2SO4溶液后的沉淀物用HCl溶解,以制取含有可溶性SrCl2及某些杂质的锶盐溶经净化除去其中的Ba2 + , Ca2 +等杂质后,即可制成纯度较高的SrCl2溶液。
此时向其中加入经过净化的碳酸氢铵溶液,经反应生成纯净的碳酸锶沉淀,沉淀物碳酸锶经脱水、洗涤、干燥、粉碎,得到高纯碳酸锶产品。
(已知K sp(SrSO4)= 3. 2 ×10- 7, K sp(SrCO3)= 1. 1 ×10- 10。
省高中学生化学竞赛(预赛)试题答案

年福建省高中学生化学竞赛(预赛)试题答案 题号 一 二 三 四 五 六 七 八 九 十 十一 总分 得分一、 分 ()于酸性溶液中混合等物质的量的和,生成哪些氧化还原产物,它们的物质量的比是多少?()用漂白粉漂白物料时,常采用以下步骤:将物料浸入漂白粉溶液,然后暴露在空气中;将物料浸在稀盐酸中;将物料浸在大苏打溶液中,最后取出放在空气中干燥;试说明每一步处理的作用,并写出有关的反应方程式。
答:() 残骛楼諍锩瀨濟溆塹籟婭骒。
所余 将和() 作用生成() (分)生成、、,其物质的量比为 : : 。
(分) ()吸收释放出而进行漂白:(分)酽锕极額閉镇桧猪訣锥顧荭。
除掉()和钙盐: () (分)彈贸摄尔霁毙攬砖卤庑诒尔。
除漂白过程中放出的:(分)謀荞抟箧飆鐸怼类蒋薔點鉍。
二、(分)设计以银币(约含%)为原料制备硝酸银和胆矾的简单步骤并写出有关的化学反应方程式。
答:第一步,将银币溶于并蒸发结晶,得和()混合晶体:↑() ↑ (共分,叙述分,方程式各分)厦礴恳蹒骈時盡继價骚卺癩。
第二步,将混合晶体在 ℃加热分解,不分解,而()分解成,再用水浸取分解产物,过滤。
前者进入溶液,后者作为沉淀滤出,将它溶于后蒸发结晶得胆矾:茕桢广鳓鯡选块网羈泪镀齐。
() ↑ ↑ ·(胆矾) (共分,叙述分,方程式各分)鹅娅尽損鹌惨歷茏鴛賴縈诘。
第三步,将上步滤液蒸发结晶,得产品。
(分) 三、(分)氮、磷、铋都是族元素,它们都可以形成氯化物,例如:、、和。
试问:籟丛妈羥为贍偾蛏练淨槠挞。
() 为什么不存在及而有? () 请写出、、水解反应反应方程式。
()热电材料() 的性质在由正值变负值时会发生急剧的变化,欲使由 变到 ,应在 () 中加碲多少克?頌圣鉉儐歲龈讶骅籴買闥。
(相对原子质量: , ) 答:()氮为第二周期元素,只有、轨道,最大配位数为。
故只能形成不可能有。
(分)渗釤呛俨匀谔鱉调硯錦鋇絨。
磷为第三周期元素,有、、轨道,既可以杂化轨道成键,也可以以杂化轨道成键,最大配位数为。
高中学生化学竞赛预赛试题答案及评分标准
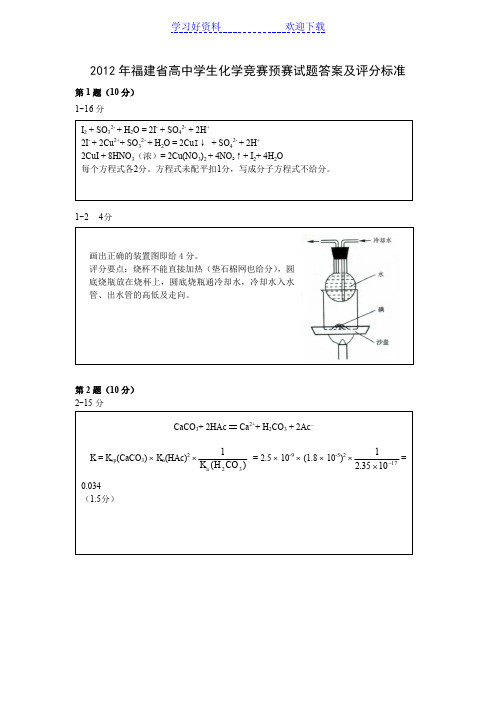
+ 2Ac -
⨯ (1.8 ⨯ 10-5)2 ⨯12351017
.⨯-2012年福建省高中学生化学竞赛预赛试题答案及评分标准
第1
题(10分) 1-16分 1-2 4分
第2题(10分) 2-15分
2-23分
第3题(11分)
3-14分,每个图2分。
(不要求标出键角、键长,但基本形状要相同)
3-24分
3-33分
第4题(9分)4-1 3分
4-23分
4-33分
第5题(10分)
5-17分
5-2 3分
第6题(10分)
6-1 4分,每个原子核外电子排布2分。
6-2 6分,每个分子2分。
第7题(10分)
评分总则:在计算式中,未带入单位不扣分。
但计算结果表示应考虑有效数字和单位。
本
题所有求算结果均为四位有效数字,第一次有效数字错误扣0.5分;求算物理量均需正确标注单位,第一次单位错误扣0.5分,但有效数字和单位错误累计扣分不超过1分。
7-14分
7-22分
第8题(15分)
8-22分
8-4 0.5分
第9题(6分)
9-1 2分,每个0.5分
9-22分,B,E,H每少写一个扣0.5分,多写的每2个扣0.5分,但扣分最高不超过2分。
9-32分
第10题(9分)
10-16分,每个1分。
历届-福建省高中化学竞赛(初赛)答案

H
+
+
2—
HSO4 (完全电离)
—
解法二:[H ]=CH2SO4
—
+
HSO4 H + SO4 X—Y X+Y Y —4 所以解出 X=5.24x10 mol/L —4 所以此时雨水中硫酸的浓度为 5.24x10 mol/L 2— — — 2— — +[ SO4 ]+[OH ] =[ HSO4 ]+2[ SO4 ]+[OH ]
S
N
S
推理一:由置换反应所给数值可列式:
×(A+96.07+18.02n)=2.137 ①
设氧化物为 AOm/2(m 为自然数),可列式:
=0.3349 ②
由①②得 =9.295,根据 m=1,2„„讨论,只有 m=1 时才有合理金属;再求出 A、n。(共 5 分) 推理二:先列式①,根据 n=1,2„„讨论,只有 n=3 时才有合理金属,确定 X;再根据 X 的相对分子质量和 Y 的含量可确定 Y。 八 D.对甲氧基甲苯 E ɑ-羟基乙苯 F 对甲基苯酚
(4)
(3 分) (其它合理的结构也可给分)
N 五 1) (2)分子晶体;因为它靠(SN)n 分子彼此间的分子作用力维系成晶体 (3)线型;因为是由线型分子整齐有序排列形成的晶体,在线伸长方向及其垂直方向上导电率相差巨大,如为立体结构,不会如此;而从 S2N2 结构推知,它也不可能是平面形,只能是线型 七 X:CuSO4·3H2O;Y:Cu2O(各 2 分)
2001 福建省高中化学竞赛初赛试题 一. (1)石灰(2 分) 3Ca(OH)2+2H3AsO3=6H2O+Ca3(AsO3)2(2 分) (2)6Zn+6H2SO4+As2O3=6ZnSO4+3H2O+2AsH3(2 分) 2AsH3=2As+3H2(l 分) (3)FeSO4+MgO+H2O=Fe(OH)2+MgSO4(2 分) 4Fe(OH)2+O2+2H2O=4Fe(OH)3(1 分) + + + + 二、1. CrO3 + 3Fe2 + 6H = Cr3 + 3Fe3 + 3H2O WFeSO47H2O/WCrO3 = 3MFeSO47H2O/MCrO3 = 3× 278/100=8.34(2 分) + + + + 按铁氧体组成需 2mol M3 (Cr3 + Fe3 )1 mol Fe2 + + + 由上式得 1 mol CrO3 产生 1 mol Cr3 、3 mol Fe3 , 因此需 2mol Fe2 WFeSO47H2O/WCrO3 = 2MFeSO47H2O/MCrO3 = 2× 278/100=5.56 所以至少需加(8.34+5.56)=13.9 倍质量的 FeSO47H2O(2 分) 2+ 2.要使还原反应发生,首先保证 Fe 不沉淀 [OH ]≦
高考化学复习福建省高中学生化学竞赛(预赛)试题答案.docx
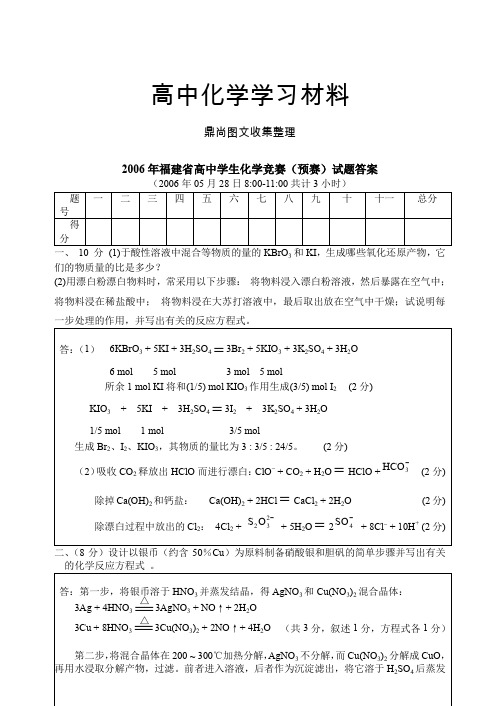
高中化学学习材料鼎尚图文收集整理2006年福建省高中学生化学竞赛(预赛)试题答案(2006年05月28日8:00-11:00共计3小时)题号一 二 三 四 五 六 七 八 九 十十一 总分 得分一、 10 分 (1)于酸性溶液中混合等物质的量的KBrO 3和KI ,生成哪些氧化还原产物,它们的物质量的比是多少?(2)用漂白粉漂白物料时,常采用以下步骤: 将物料浸入漂白粉溶液,然后暴露在空气中;将物料浸在稀盐酸中; 将物料浸在大苏打溶液中,最后取出放在空气中干燥;试说明每一步处理的作用,并写出有关的反应方程式。
答:(1) 6KBrO 3 + 5KI + 3H 2SO 4 =3Br 2 + 5KIO 3 + 3K 2SO 4 + 3H 2O6 mol 5 mol 3 mol 5 mol所余1 mol KI 将和(1/5) mol KIO 3作用生成(3/5) mol I 2 (2分) KIO 3 + 5KI + 3H 2SO 4 =3I 2 + 3K 2SO 4 + 3H 2O 1/5 mol 1 mol 3/5 mol生成Br 2、I 2、KIO 3,其物质的量比为3 : 3/5 : 24/5。
(2分)(2)吸收CO 2释放出HClO 而进行漂白:ClO -+ CO 2 + H 2O=HClO +HCO 3-(2分)除掉Ca(OH)2和钙盐: Ca(OH)2 + 2HCl= CaCl 2 + 2H 2O (2分)除漂白过程中放出的Cl 2: 4Cl 2 +S O 232-+ 5H 2O = 2SO 4- + 8Cl -+ 10H +(2分)二、(8分)设计以银币(约含50%Cu )为原料制备硝酸银和胆矾的简单步骤并写出有关的化学反应方程式 。
答:第一步,将银币溶于HNO 3并蒸发结晶,得AgNO 3和Cu(NO 3)2混合晶体:3Ag + 4HNO 3 ==3AgNO 3 + NO ↑+ 2H 2O3Cu + 8HNO 3 ==3Cu(NO 3)2 + 2NO ↑+ 4H 2O (共3分,叙述1分,方程式各1分)第二步,将混合晶体在200 ~ 300℃加热分解,AgNO 3不分解,而Cu(NO 3)2分解成CuO ,再用水浸取分解产物,过滤。
2007年福建高中学生化学竞赛预赛试题

2007 年福建省高中学生化学竞赛(预赛)试题答案及评分标准
八.(10 分)
(第4页,共 5 页)
1.(5 分,每个 1 分)
A: Br2(或 NBS), hv (或高温, 或)
B: CH2 CHCH2MgBr
C: CH2 D: Br2
Br
CHCH2CH2OH
E:
O 2.(1 分) 3,4-二溴-1-丁醇 3.(2 分) 反应式:
3Ag + 4HNO3(稀) ==== 3AgNO3+ NO↑+ 2H2O (1分) Au 不溶于稀 HNO3,过滤即得到金属 Au。 (1 分) d. 滤液浓缩、冷却结晶,可得到 AgNO3 晶体。 (1 分) e. 将 AgNO3 加热分解即得到金属 Ag:
2AgNO3 ==== 2Ag + 2NO2↑+ O2↑
2007 年福建省高中学生化学竞赛(预赛)试题答案及评分标准
(第1页,共 5 页)
2007 年福建省高中学生化学竞赛(预赛)试题
答案及评分标准
一.(10分)
1. sp2 杂化,V 型结构.
(2 分)
2. 由于分子中存在∏35
(2 分)
3. 2 NaClO3+ SO2= 2ClO2↑+ Na2SO4
NaClO3+ 2HCl=ClO2↑+ NaCl + 1/2 Cl2↑ + H2O
2.不溶于水、醇及有机溶剂, 溶于稀盐酸并伴有轻微气泡放出 (各 1 分,共 4 分)
3. MgO + Al 2O3 +H2O + CO2
4. 缓冲
3~ 5
(各0.5分,共2分) (各1分,共2分)
四.(10 分)
(1)
福建省高中学生化学竞赛(预赛)试题及答案

2007年福建省高中学生化学竞赛(预赛)试题(2007年5月20日8:30—11:30共计3小时)一.(10分)二氧化氯作为消毒剂正以其独特的优良性能在饮水消毒、工业给水处理、二次给水消毒、游泳池水处理、含酚含氰废水和医院废水处理、食品消毒以及纸浆纤维的漂白等方面越来越得到广泛的应用。
美国环保局已列为取代液氯消毒的首选药剂。
ClO2是一种黄色并有刺激性气味的气体,ClO2沸点110C,凝固点–590C,易溶于水,溶解度是氯气的5倍。
1.说明ClO2的杂化方式和分子构型。
2.在ClO2分子中的Cl-O键长为149pm,比双键长,比单键短,为什么?3.写出以亚氯酸钠或氯酸钠为原料的发生ClO2的各一种化学反应的方程式。
4.二氧化氯可以氧化处理含锰地下水,写出ClO2除二价锰反应的方程式。
二.(10分)安全火柴中的成分分别是:火柴头主要由氧化剂(KClO3)、易燃物(如硫等)和粘合剂等组成。
火柴盒侧面主要由红磷、三硫化二锑、粘合剂组成。
1. 简述安全火柴的燃烧的原理,并写出主要方程式。
2. 安全火柴与早期火柴比优点在哪里?3. 写出锑的外层价电子排布,它位于第几周期第几族,写出它常见的化合价。
三.(10分)铝碳酸镁是一种天然矿物, 其结构式为Al2Mg6 (OH) 16CO 3·4H2O ,它最早是由Feitknecht 等人在1942 年发现的。
它最广泛、最主要的用途是作为新型抗酸药, 用于治疗胃溃疡、十二脂肠溃疡、胃酸过多症及胃炎等。
1. 试用氢氧化铝和氢氧化镁等试剂写出制备铝碳酸镁的反应方程式;2. 简要推测其溶解度和酸反应的性质;3. 在铝碳酸镁热分解过程中,第一次是失去镁铝水滑石晶体中间层中的结晶水, 吸热分解失重约为产物。
4. 铝碳酸镁与传统的抗酸药如氢氧化铝或碳酸镁相比, 具有紧密的品格结构, 晶体中羟基堆积形成密置双层, 镁、铝离子以随机方式分布在八面体空隙中, 形成带正电的基本层〔M g6A l2 (OH ) 16〕2+ , 两个基本层之间夹以由碳酸根离子和水分子形成的带负电的中间层〔CO 32- + 4H2O 〕2- , 它们自身在胃内能形成体系。
高中学生化学竞赛 预赛试题

2007年福建省高中学生化学竞赛(预赛)试题一、(10分)二氧化氯作为消毒剂正以其独特的优良性能在饮水消毒、工业给水处理、二次给水消毒、游泳池水处理、含酚含氰废水和医院废水处理、食品消毒以及纸浆纤维的漂白等方面越来越得到广泛的应用。
美国环保局已列为取代液氯消毒的首选药剂。
ClO2是一种黄色并有刺激性气味的气体,ClO2沸点110C,凝固点–590C,易溶于水,溶解度是氯气的5倍。
1.说明ClO2的杂化方式和分子构型。
2.在ClO2分子中的Cl-O键长为149pm,比双键长,比单键短,为什么?3.写出以亚氯酸钠或氯酸钠为原料的发生ClO2的各一种化学反应的方程式。
4.二氧化氯可以氧化处理含锰地下水,写出ClO2除二价锰反应的方程式。
二、(10分)安全火柴中的成分分别是:火柴头主要由氧化剂(KClO3)、易燃物(如硫等)和粘合剂等组成。
火柴盒侧面主要由红磷、三硫化二锑、粘合剂组成。
1.简述安全火柴的燃烧的原理,并写出主要方程式。
2.安全火柴与早期火柴比优点在哪里?3.写出锑的外层价电子排布,它位于第几周期第几族,写出它常见的化合价。
三、(10分)铝碳酸镁是一种天然矿物, 其结构式为Al2Mg6 (OH) 16CO 3·4H2O ,它最早是由Feitknecht 等人在1942 年发现的。
它最广泛、最主要的用途是作为新型抗酸药, 用于治疗胃溃疡、十二脂肠溃疡、胃酸过多症及胃炎等。
1.试用氢氧化铝和氢氧化镁等试剂写出制备铝碳酸镁的反应方程式;2.简要推测其溶解度和酸反应的性质;3.在铝碳酸镁热分解过程中,第一次是失去镁铝水滑石晶体中间层中的结晶水, 吸热分解失重约为12. 0 %, 第二次热分解阶段是失去结构水、碳酸根分解, 吸热分解失重约为31. 8 %, 写出分解的产物。
4.铝碳酸镁与传统的抗酸药如氢氧化铝或碳酸镁相比, 具有紧密的品格结构, 晶体中羟基堆积形成密置双层, 镁、铝离子以随机方式分布在八面体空隙中, 形成带正电的基本层〔M g6A l2 (OH ) 16〕2+ , 两个基本层之间夹以由碳酸根离子和水分子形成的带负电的中间层〔CO32- + 4H2O 〕2- , 它们自身在胃内能形成体系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2007年福建省高中学生化学竞赛(预赛)试题
(2007年5月20日8:30—11:30共计3小时)
一.(10分)二氧化氯作为消毒剂正以其独特的优良性能在饮水消毒、工业给水处理、二次给水消毒、游泳池水处理、含酚含氰废水和医院废水处理、食品消毒以及纸浆纤维的漂白等方面越来越得到广泛的应用。
美国环保局已列为取代液氯消毒的首选药剂。
ClO2是一种黄色并有刺激性气味的气体,ClO2沸点110C,凝固点–590C,易溶于水,溶解度是氯气的5倍。
1.说明ClO2的杂化方式和分子构型。
2.在ClO2分子中的Cl-O键长为149pm,比双键长,比单键短,为什么?
3.写出以亚氯酸钠或氯酸钠为原料的发生ClO2的各一种化学反应的方程式。
4.二氧化氯可以氧化处理含锰地下水,写出ClO2除二价锰反应的方程式。
二.(10分)安全火柴中的成分分别是:火柴头主要由氧化剂(KClO3)、易燃物(如硫等)和粘合剂等组成。
火柴盒侧面主要由红磷、三硫化二锑、粘合剂组成。
1. 简述安全火柴的燃烧的原理,并写出主要方程式。
2. 安全火柴与早期火柴比优点在哪里?
3. 写出锑的外层价电子排布,它位于第几周期第几族,写出它常见的化合价。
三.(10分)铝碳酸镁是一种天然矿物, 其结构式为Al2Mg6 (OH) 16CO 3·4H2O ,它最早是由Feitknecht 等人在1942 年发现的。
它最广泛、最主要的用途是作为新型抗酸药, 用于治疗胃溃疡、十二脂肠溃疡、胃酸过多症及胃炎等。
1. 试用氢氧化铝和氢氧化镁等试剂写出制备铝碳酸镁的反应方程式;
2. 简要推测其溶解度和酸反应的性质;
3. 在铝碳酸镁热分解过程中,第一次是失去镁铝水滑石晶体中间层中的结晶水, 吸热分解
失重约为12. 0 %, 第二次热分解阶段是失去结构水、碳酸根分解, 吸热分解失重约为31.
8 %, 写出分解的产物。
4. 铝碳酸镁与传统的抗酸药如氢氧化铝或碳酸镁相比, 具有紧密的品格结构, 晶体中羟
基堆积形成密置双层, 镁、铝离子以随机方式分布在八面体空隙中, 形成带正电的基本层〔M g6A l2 (OH ) 16〕2+ , 两个基本层之间夹以由碳酸根离子和水分子形成的带负电的中间层〔CO 32- + 4H2O 〕2- , 它们自身在胃内能形成体系。
并且本品能使胃液的pH值在较长时间内维持在之间, 被称为理想的中和胃酸药物。
四.(10分)1. 氰化法是提取贵金属的一种方法,设计步骤从含有Au、Ag的某种矿石中提取Au和Ag ,并以反应式表示。
2. 氰化物剧毒,废液可硫代硫酸钠处理,写出反应方程式。
五.(10分)比较下列多对物质指定性质的高低和大小,并简述理由。
1. 键角:NO2+和NO2-
2.沸点和气化热:HF和H2O
六.(10分)若同时打开二瓶同一厂家于同一日期生产的啤酒,其中A瓶温度为30℃,B 瓶温度为0℃。
问:
1. 打开并倒出时,哪瓶啤酒的泡沫多?
a. A比B多
b. A比B少
c. 两瓶一样多
d. 无法判断
2. 写出CO2(g)在水中溶解达平衡的反应方程式。
3.CO2气敏电极就是根据2中的反应方程式而设计的,请简单说明原理其应用。
4.B瓶啤酒在0℃时为什么是液体?
七.(10分)有人用络合滴定方法测定某混合试液的浓度,实验方法如下:
移取Bi3+、Pb2+混合试液50.00ml,以0.01000mol/L EDTA滴定至终点时,用去25.00ml。
另取等份50.00ml试液,加入铅汞齐后,当Bi3+被置换完全,立刻用0.01000mol/L EDTA滴定至终点,消耗30.00ml。
计算原试液中Bi3+、Pb2+的物质的量浓度。
八.(10分)2,3-二氢呋喃是抗肿瘤药物的中间体,也用于电子化学品和香料中,可由丙烯为原料合成:
CH 2
CHCH 2Br
(1) CH 2O 3KOH 25℃
(C 4H 7BrO)
O
KOH
(C 4H 8O)
CH 2CHCH A
B
C Br
Br
D
E F
2,3-二氢呋喃
O
O
四氢呋喃
呋喃
1. 请写出上述反应式中A —E 所代表的试剂及反应条件或产物的结构式; 2. 请用系统命名法命名化合物F ;
3. 如何将2,3-二氢呋喃转变为四氢呋喃?请用反应式表示;如何用简单的化学方法检验
2,3-二氢呋喃是否完全转化?
4. 四氢呋喃还可以由化合物G(C 4H 10O 2)在少量硫酸存在下制得或由化合物H (C 4H 9ClO)在
氢氧化钠作用下制得,请分别写出化合物G 和H 的结构式。
九.(10分)由3,3-二甲基-1-丁烯可以转化为下列化合物,请分别写出实现这些转化所需要的试剂和必要的反应条件。
(不必写出反应式,只需列出试剂和条件,如需多步反应才能完成转化,请用序号表示先后顺序,实现这些转化一般不超过两步。
)
(CH 3)3CCH 2CH 2Br
(CH 3)3CCH 2CH 2OH
(CH 3)33
Br
(CH 3)33
(CH 3)32OH
OH
(CH 3)32Br Br
(CH 3)3CCO 2H
(CH 3)3CCHO
(CH 3)3CCH 2CH 2CN
(CH 3)3CCH 2CO 2H
OH
(a)(b)(c)(d)(e)(f)(g)(h)(i)(j)
十.(10分)醇类化合物在香料中占有重要的地位,下面所列的是一些天然的或合成的醇类香料:
A
B
C
D
OCH 3
CH 2CH 2OH
OCH 2CH 2OH
CH 2CH 3CH 3OH
CH 2CH 2CH 3
CH 3
OH
OH
E
1. 写出化合物A 的系统命名及被热高锰酸钾溶液氧化所得产物的结构式;
2. 化合物B 和C 均可由丙酮、溴代烃及必要的无机试剂为原料合成,请分别写出合成B
和C 所需溴代烃的结构式;
3. 化合物D 和E 的合成方法如下,请分别写出合成反应式中F —M 所代表的化合物。
CH 2CHCH 3+
H 3PO 4
F
G
H
I
2(2) H 3O
OH
+CH 2
CH 2
2OH
F K
L
(1) F 23+
D E
2007年福建省高中学生化学竞赛(预赛)试题答案
一、 二、 三、
五、六、
八、
十、。
