分子球棍模型的使用(五)
化学分子结构的三维模型

化学分子结构的三维模型化学分子结构的研究对于理解分子性质和化学反应机制具有重要意义。
传统的平面图只能提供分子的二维结构信息,而无法准确描述分子的空间排列。
为了更好地展示分子结构,化学家们发展出了各种三维模型。
本文将介绍几种常见的化学分子结构的三维模型以及它们的使用方法。
一、简化球棍模型简化球棍模型是最基本的三维模型形式。
它由球形表示原子,棍状连接表示化学键。
这种模型简单直观,可以清楚地展示分子的空间构型。
在构建简化球棍模型时,我们需要确定原子种类、原子间的键类型和键的长度。
一种常见的简化球棍模型软件是Jmol,通过输入化学式和键的信息,它可以生成相应的三维模型。
二、空间填充模型空间填充模型通过在球棍模型的基础上添加了原子半径,使得分子更加真实地呈现出来。
空间填充模型中,原子球的大小根据原子半径确定,分子中原子之间的重叠可以很直观地观察到。
由于空间填充模型较为复杂,常用的软件有PyMOL和VMD等专业分子模拟软件,它们可以通过输入分子坐标和半径的信息生成具体的空间填充模型。
三、球棍加颜色模型球棍加颜色模型是在球棍模型的基础上,为原子和棍状连接添加不同的颜色,用来表示原子的种类和性质。
根据元素周期表,不同的原子可以被赋予不同的颜色,例如氢原子可以用白色表示,氧原子可以用红色表示。
通过这种模型,可以更好地理解分子中各个原子的相互作用及元素组成。
同样地,软件Jmol和PyMOL都支持生成球棍加颜色模型。
四、立体投影模型立体投影模型是通过将分子投影到平面上来描述分子的结构。
在立体投影模型中,分子的平面结构和空间构型都可以展现出来,更有利于观察分子的立体性质。
根据投影的不同方式,立体投影模型可以分为Newman投影、Fischer投影和锥形投影等。
在有机化学中,Fischer 投影是一个常用的表示手性分子的方法。
这种模型可以手绘,也可以通过分子模拟软件进行绘制和展示。
总结:化学分子结构的三维模型对于理解分子性质和化学反应机制具有重要意义。
甲烷乙烷丙烷球棍模型

甲烷乙烷丙烷球棍模型甲烷、乙烷和丙烷是我们生活中常见的有机化合物。
它们是碳氢化合物,由碳原子和氢原子组成。
为了更好地理解这些分子的结构和属性,科学家们发展了一种称为球棍模型的表示方法。
这种模型通过使用球体代表原子,以及棍子代表化学键来描绘分子的三维结构。
在本文中,我们将深入探讨甲烷、乙烷和丙烷的球棍模型,了解它们的结构和性质。
一、甲烷(CH4)甲烷是最简单的烷烃,也是天然气的主要成分之一。
它由一个碳原子和四个氢原子组成。
在球棍模型中,我们可以用一个球体代表碳原子,四根棍子从碳原子上延伸,每根棍子连接一个氢原子。
这种球棍模型直观地展示了甲烷分子的结构,碳原子位于中心,四个氢原子均匀地环绕在周围。
甲烷分子具有高度对称性,所有碳-氢键的长度都相等,所有氢原子的角度也都相等。
这种高度对称的结构使得甲烷具有稳定的性质,它是一种无色、无味、无臭的气体。
由于甲烷分子中碳原子与周围的氢原子之间共享电子,它具有较强的上向键电子云,这使得甲烷分子在化学反应中不太活泼。
二、乙烷(C2H6)乙烷是由两个碳原子和六个氢原子组成的烷烃。
与甲烷相比,乙烷的球棍模型稍微复杂一些。
我们可以用两个球体分别代表两个碳原子,然后用棍子将它们连接起来。
每个碳原子还连接了三个氢原子,这些氢原子通过棍子与碳原子相连。
乙烷分子的结构也具有一定的对称性,两个碳-碳键的长度相等,以及周围氢原子的排列相对对称。
然而,与甲烷不同的是,乙烷分子的结构更加灵活,碳原子和氢原子之间可以自由旋转。
这种结构的灵活性使得乙烷在化学反应中具有更大的活性。
乙烷是一种无色、无味的气体,通常作为燃料在工业和家庭中使用。
三、丙烷(C3H8)丙烷是由三个碳原子和八个氢原子组成的烷烃。
与甲烷和乙烷相比,丙烷的球棍模型更加复杂。
我们可以用三个球体来代表三个碳原子,并使用棍子将它们连接起来。
每个碳原子除了与相邻的碳原子相连外,还连接了三个氢原子。
丙烷分子的结构相对复杂,由于存在三个碳原子,它的形状更加不规则。
陕西省2024年普通高中学业水平合格性考试化学实验操作考试评分细则
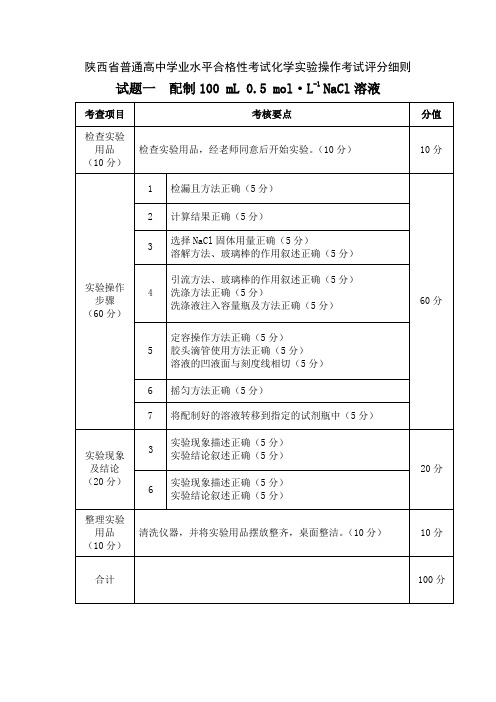
考核要点
分值
检查实验用品
(10分)
检查实验用品,经老师同意后开始实验。(10分)
10分
实验操作步骤
(50分)
1
(1)
连接计算机、数据采集器及温度传感器正确
(10分)
50分
(2)
进入实验软件系统正确(5分)
2
⑴
固体加入方法正确(5分)
温度传感器插入方法正确(5分)
⑵
添加“温度—时间”曲线,选择窗口平铺,点击“采集数据”(10分)
滴加水方法正确(5分)
3
移除温度传感器,断开温度传感器、数据采集器与计算机的连接并放回原位(10分)
实验现象及结论
(30分)
1
实验图像合理、清晰(10分)
30分
2
正确保存实验图像(10分)
3
实验结论叙述正确(10分)
整理实验用品
(10分)
清洗仪器,整理实验器材,并将实验用品摆放整齐。(10分)
10分
100分
陕西省普通高中学业水平合格性考试化学实验操作考试评分细则
试题四(A)搭建球棍模型认识有机化合物分子结构的特点
考查项目
考核要点
分值
检查实验
用品
(10分)
检查实验用品,经老师同意后开始实验。(10分)
10分
实验操作
步骤
(45分)
1
甲烷分子的球棍模型搭建正确(5分)
二氯甲烷分子的球棍模型搭建正确(5分)
合计
100分
3
实验现象描述正确(5分)
实验结论叙述正确(5分)
20分
6
实验现象描述正确(5分)
实验结论器,并将实验用品摆放整齐,桌面整洁。(10分)
球棍模型知识点总结

球棍模型知识点总结球棍模型是一种用于描述多原子分子的结构和性质的简化模型。
它假设分子由一系列质点(原子)构成,这些质点通过弹簧相互连接。
球棍模型可以用于研究分子的力学性质、振动特性、热力学性质等,是化学、生物、材料科学等领域中广泛使用的理论工具。
1. 原子模型在球棍模型中,原子被简化为质点,忽略了原子的内部结构和电子云。
原子的质量和位置是球棍模型中的基本参数,通常用球形质点来表示。
原子之间的相互作用通过弹簧来描述,弹簧的刚度和原子之间的平衡距离是定义分子结构和性质的重要参数。
2. 分子结构通过球棍模型可以描述分子的结构特征,例如键长、键角、二面角等。
分子的结构参数可以通过实验测量和计算得到,对于具有特定结构的分子,通过球棍模型可以快速预测其结构。
3. 分子振动球棍模型可以用于研究分子的振动特性。
分子中原子的振动可以用简谐振动模型来描述,通过求解分子的振动方程可以得到分子的振动频率和振动模式。
这些振动特性对于理解分子内部的结构和相互作用非常重要。
4. 弹簧势能球棍模型假设相邻原子之间的相互作用可以用弹簧势能来描述,即原子之间的相互作用可以看作是由于弹簧的伸缩而产生的。
通过求解弹簧势能可以得到分子的总势能和势能曲面,这对于理解分子的稳定性和反应性非常重要。
5. 热力学性质利用球棍模型可以研究分子的热力学性质,例如热容、热膨胀、热导率等。
分子的热力学性质与其内部结构和振动特性有关,球棍模型可以帮助预测和解释这些性质。
6. 分子动力学球棍模型可以用于模拟分子的动力学行为,包括分子的运动、振动、旋转等,通过求解分子的运动方程可以了解分子的动力学行为和性质。
7. 应用领域球棍模型在化学、生物、材料科学等领域都有广泛的应用。
在计算化学中,球棍模型可以用于快速预测分子的结构和性质;在药物设计中,可以用于研究分子的相互作用和反应机制;在材料科学中,可以用于设计和优化材料的性能和结构。
8. 模型发展随着计算机技术的发展,球棍模型不断得到扩展和改进。
分子球棍模型的使用(三)

分子球棍模型的使用(三): 学习丁烷的构象初步知识 学习丁烷的构象,将使构象知识有一个提升。
这次学习的方法,是选用网上关于丁烷构象分析的图示,我们以实际的分子球棍模型一步步对照练习,从而真正弄懂这个资料的讲述。
在学习过程中,我们要有一个自我提高的感觉。
资料一:正丁烷有4个典型构象,其形成可用下面的图示表示,每两个相邻构象是旋转60度形成的。
现在,我们用练习对照的方法,学习这个图示:1, 先搭建一个对位交叉式的球棍模型,其模型的照片如下图所示:注意:这个模型是按全交叉式搭建的,即相邻两个碳之间都是交叉相连的,搭建好的标准是:○1 4个碳原子都成锯齿形,且在同一个平面上;○2 每个碳原子都各有一个氢原子落在桌面上且交叉地位于碳链的两侧,看起来很有对称性。
○3 当向内(向自己方向)翻转90度时,变成2,4两个碳原子的4个氢原子落在桌面上;再向内翻转90度时,又变成每个碳原子的各一个氢原子落在桌面上;再翻转90度时,变成1,3碳原子的各两个氢原子落在桌1234面上;再翻转90度时还原为开始的状态。
每次翻转都调整到如上面的氢原子落在桌面上则是搭建准确了的。
这一步的搭建准确是很重要的,在接下来的转动中就很符合图中所示了。
图中1,4两个碳及其氢换成其他的颜色,能更好地表示位置区分,不换也可以,只要标记出碳3的一个氢原子能看到转动时的角度就行了。
2,这个图的上面一排是纽曼式投影,纽曼式投影的方法是:右手拿着碳2,让碳链与身体平行,眼睛顺着C2-C3键看去,让C2,C3两原子重合,这时看到各原子在空间的位置就是纽曼式投影的结果。
这个图的下面一排是纽曼式投影对映的球棍模型的照片。
3,现在我们从左边一个“对位交叉”图看起:右手拿着碳2,让碳链与身体平行,眼睛顺着C2-C3键看去,让C2,C3两原子重合,一直看到各原子在空间的位置很像左边这个图的样子为止。
这一步很重要,弄清楚怎样拿模型,怎样看模型,把对位交叉式看懂了,其余的就好办了,一点不要含糊,这就弄懂什么叫纽曼式投影了。
高一化学化学键与分子间作用力试题答案及解析

高一化学化学键与分子间作用力试题答案及解析1.下列说法不正确的是A.化学反应中一定有化学键断裂,同时也有化学键形成B.含有共价键的化合物必是共价化合物C.含有阴离子的化合物一定含有阳离子D.金属元素和非金属元素形成的化合物不一定是离子化合物【答案】B【解析】A.化学反应的过程就是反应物的化学键断裂和生成物中的化学键形成的过程,因此在化学反应的过程中一定有化学键断裂,同时也有化学键形成,正确;B.含有共价键的化合物可能是共价化合物,也可能是离子化合物,错误;C.含有阴离子的化合物中根据电荷守恒一定含有阳离子,正确;D.金属元素和非金属元素形成的化合物可能是离子化合物,也可能是共价化合物,因此不一定是离子化合物,正确。
【考点】考查化合物与化学键的关系的知识。
2.下列化合物中,既含有离子键又含有共价键的是A.BaCl2B.H2O C.Ca(OH)2D.Na2O【答案】C【解析】A、氯化钡中只含有离子键,错误;B、水中只含有共价键,错误;C、氢氧化钙中钙离子与氢氧根离子之间是离子键,O与H之间是共价键,既含共价键又含离子键,正确;D、氧化钠中只含有离子键,错误,答案选C。
【考点】考查物质中化学键的判断3.按要求回答下列问题:(1)有下列六种物质:①碳60(C60)晶体②硼晶体③Na2O晶体④ CaF2晶体⑤P4O10晶体⑥碳化硅晶体。
其中属于离子晶体的是,属于分子晶体的是,属于原子晶体的是____。
(2)有下列分子:HCN、P4、SO3、PCl3、BF3,其中属于非极性分子的是。
(3)有下列离子:SO32-、SO42-、CO32-,其中VSEPR模型为正四面体形的是,中心原子的杂化轨道类型属于sp2杂化的是。
(4)CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为______;与每一个钙离子距离最近并且距离相等的钙离子有____个;CaO晶体和NaCl晶体的晶格能分别为:CaO:3 401 kJ/mol、NaCl:786 kJ/mol。
中学化学教学中有效的分子模型建构方法

中学化学教学中有效的分子模型建构方法概述:化学是一门抽象而又具有实验性的科学,而分子模型则是化学中重要的概念之一。
分子模型的建构有助于学生理解化学现象和掌握化学知识。
本文将探讨中学化学教学中有效的分子模型建构方法,旨在提高学生的学习效果和兴趣。
一、球棍模型法球棍模型法是最常用的分子模型建构方法之一。
它通过使用不同颜色和大小的球代表原子,用棍子连接原子来表示化学键。
这种方法直观而简单,可以帮助学生理解分子的结构和化学键的形成。
例如,在讲解水分子的结构时,可以用两个红色球代表氧原子,用两个白色球代表氢原子,用棍子连接它们来表示水分子的构成。
这样的模型可以让学生更好地理解水分子的极性和氢键的形成。
二、立体模型法立体模型法是一种更为直观的分子模型建构方法。
它通过使用不同形状的物体来表示分子的结构,使学生能够更好地理解分子的三维形态。
例如,在讲解甲烷分子的结构时,可以使用四个等边三角形代表氢原子,一个正四面体代表碳原子,将它们组装在一起来表示甲烷分子的构成。
这样的模型可以让学生更加清晰地认识到分子的空间排布和键角的大小。
三、计算机模拟法随着科技的发展,计算机模拟法在化学教学中的应用越来越广泛。
通过使用化学模拟软件或在线分子模型构建工具,学生可以在电脑上进行分子模型的建构和观察。
这种方法不仅能够提供更多的分子结构选择,还能够模拟一些实验无法观察到的现象。
例如,在讲解有机物的立体异构时,可以利用计算机模拟软件构建不同的结构,并观察它们在空间中的排布和性质的差异。
这样的模拟实验可以让学生更加深入地理解分子结构与性质之间的关系。
四、实物模型法实物模型法是一种通过使用真实的物体来构建分子模型的方法。
这种方法可以让学生通过触摸和操作来更好地理解分子的结构和性质。
例如,在讲解离子化合物的结构时,可以使用磁性球和棒子来表示阳离子和阴离子,将它们组装在一起来构建离子晶体的结构。
这样的实物模型可以让学生更加直观地感受到离子间的吸引力和排列规律。
分子球棍模型的使用(六)

分子球棍模型的使用(六):葡萄糖结构的初步知识(2)一,几个最常见的基本概念1,什么是葡萄糖的D式和L式甘油醛有两种结构式,如下图所示。
先看C-2碳原子的结构特点,与它相连的四个原子或基团是不相同的,这样的碳原子叫做手性碳原子。
其中,羟基在左边的叫做L-甘油醛,羟基在右边的叫做D-甘油醛。
这两种甘油醛互为镜面对称。
葡萄糖和果糖的空间构型,是以手性碳原子C-5(即离羰基最远的手性碳原子)上的-OH在空间的排列与甘油醛的手性碳原子上的-OH相比较而确定的。
如果与D-甘油醛相同,则为D-型,如与L-甘油醛相同,则为L-型。
如下图:CHOO因为自然界的葡萄糖都是D-型的,所以经常提到的是D-型葡萄糖,D-型葡萄糖的结构和D-甘油醛相同,L-型葡萄糖的结构和L-甘油醛相同。
2,怎样确定一种葡萄糖是D-型还是L-型,这是一个重难点!这要分两种情况,一是给出的是实物如何确定,二是给出的是某种表示式如何确定。
○1当给出的是实物时,就用旋光仪器来检验它的旋光方向,如果是右旋的,就是D-型葡萄糖,如果是左旋的,就是L-型葡萄糖。
但注意的是,对于葡萄糖可以这样确定,但不能是任何糖类都可以用旋光方向来确定,因为构型和旋光性不是一回事。
也就是说,D-型糖类的旋光性既有右旋的也有左旋的。
○2当给出的是一种表示式,一般要分成以下几种:如果是开链式的,已如上述,看它的C-5的羟基在左边还是在右边;如果是哈沃斯式,由于C-5的羟基已不再存在,又由于C-1的半缩醛羟基受α,β的影响,也不能用于判断,故只能用C-2 、C-3和C-4的羟基判断,我们就用C-3来判断吧:C-3的羟基在上,就是D-型葡萄糖;C-3的羟基在下,就是L-型葡萄糖。
如果是一种椅式构象式,则C-3的羟基向上倾是D-型葡萄糖;C-3的羟基向下倾是L-型葡萄糖;如果是一种球棍模型,碳的编号是按顺时针方向,则C-3是倒立的为D-型葡萄糖;C-3是直立的为L-型葡萄糖;3,什么是α-葡萄糖和β-葡萄糖α-葡萄糖和β-葡萄糖通常都是指自然界存在的D-型葡萄糖,而且都用环状椅式结构来判断它们,它们的结构只有C-1的羟基空间位置不同,如果C-1的羟基在向下的a键上为α-葡萄糖,如果C-1的羟基在e键上为β-葡萄糖。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分子球棍模型的使用(五):葡萄糖结构的初步知识(1)
作者敬言:编写《分子球棍模型的使用》,意在与中学师生共享共勉,目前作为大家开展课外活动的参考资料,也为今后立志从事生命科学和生物科技的同学打下一点入门的基础,算是一个“中升大”的“兴趣班”吧!
“葡萄糖在生物学领域具有重要地位,是活细胞的能量来源和新陈代谢中间产物,即生物的主要供能物质”,这段话已经说明了学习葡萄糖结构和性质的重要意义了。
我们在中学算是接触到了葡萄糖,继续学习葡萄糖将会感到有很多结构和性质上的难点知识,以我自己的体会,如果老师照本宣科地讲,学生即使认真地听,也很难听懂的。
我这里用分子球棍模型作为学习葡萄糖结构和性质的工具是很有效的,大家要有一个动手动脑的学习习惯,讲到哪种有机物的性质和结构,先搭建好它的分子球棍模型。
事实上,你在搭建模型的过程中,不但是一个动手的过程,更是一个动脑的过程,这样边学这做,学得快,记得牢,是一种不错的学习方法。
一,葡萄糖的结构(1)
1,葡萄糖的链式结构,
我们已知的是一种开链式结构,其结构简式大家很熟悉(略),但这个简式不能反映各原子或基团在空间的排布。
后来,有一个德国化学家费歇尔,经过毕生的
研究,形成“费歇尔投影式”,为此他得了1902年的化学诺贝尔奖。
他把葡萄糖的
结构用下面的式子表示:
左边的表示图,标出了碳原子的序号、各原子或基团的左右位置,有星号的是手性
碳原子(碳原子的四个键连接着的四个基团各不相同);右边的表示法是以“△”
代表-CHO,-CH2OH用“○”表示,羟基用“-”表示,而碳、氢原子则不写出,显然,
更简化了费歇尔表示法。
现在,我们第一个学习内容,就是由费歇尔表示法来建立球棍模型,尽管这个球棍模型远远不是葡萄糖分子的真实样子,但它能加深对于葡萄糖分子结构的想象,这是一种很重要的学习方法。
开始搭建这个模型是有一定难度的!当你按上面这个费歇尔式搭建葡萄糖的分子球棍模型时,是否感到有些不顺利!下面一边说明碰到的问题是什么,一边指出
解决方法:○1为了要满足各原子的排列关系,搭成的模型没有规律,“扯不直,
拉不伸”,六个碳原子不在一个平面上,纽来纽去的!这是经常碰到的情况。
解决的办法是:先把这六个碳原子连成锯齿形,并使所有的碳原子都在一个平面上,再插上每个碳原子的键,这个操作很容易的吧;
○2按照左图来看,碳链是一条直线,“在左”“在右”是很明显的,
而实际上我们连接出来的是一个“弯来弯去的”碳链,且各个键又是成109.5度,不是90度,所以“在左”“在右”怎么判断呢?
解决的方法是:你观察每个碳原子的键,我们把向下倾的定为“向左”,向上倾的则定为“向右”,这个方法好极了,就按照这样连好各个原子或基团,整个搭
建只分成这两步完成了。
照上面的方法连好后,正确的模型是:每一个碳原子都各有一个氢原子或羟基落在桌面上(最后一个是两个氢在桌面上),否则要稍加调整。
下面是作者搭建的模型照片:
图1 葡萄糖的链式结构图
注意:一定要亲手搭建这个模型,它会加深你对有机化合物的空间概念,搭建好后,你对葡萄糖的环状结构一定有一个崭新映象的收获感。
现在你再看“羟基在左在右”的问题好不好判断?健向下倾的就是在左,键向上倾的就是在右,这个在左在右的概念从球棍模型来观察是十分直观的,不用你去想象。
而这个在左在右的概念又是一个十分重要的概念。
2,葡萄糖的环状结构:
科学家在实验中发现,多数情况下,葡萄糖不是开链式结构,而是环状结构,其原因是葡萄糖中既有醛基,又有羟基,它们会发生醇醛缩合反应,实验测出,大多数情况下,是醛基和第5个碳的羟基生成半缩醛,即一个醛基和一个羟基的反应,但这个反应是动态平衡,如下图形所示:
图2 半缩醛平衡的示意图
这个反应的实质,我们用球棍模型进行练习从而加深认识:打开醛基的碳氧双键,将碳-5的羟基上的氢原子加在醛基的氧原子上,形成一个红色的半缩醛羟基;然后醛基的碳原子和碳-5的氧原子相连接。
我们这样用球棍模型多练习几次,把半缩醛反应的实质和过程就清清楚楚的弄明白了。
这种动手动脑式的学习,效果很明显,比起凭空想象是大不相同的。
下面是作者搭建的葡萄糖分子环状结构的球棍模型照片:
图3α-葡萄糖β-葡萄糖
这个半缩醛模型的结构和开链式结构比较已经发生了很大的变化,有很多基本知识要弄清楚:
○1它生成的半缩醛葡萄糖是两种,如上所示,左边的那一个的半缩醛羟基是处在碳-1
的a键上,竖直向下;右边的那一个半缩糖羟基是处在碳-1的e键上,其它的结构都相同。
○2半缩醛的六元环不是图2所示的平面,从图3的照片中显然看出,它是一个和前面所搭建的环已烷相似的椅式六元环,如下图所示:
6 5 4 3 2 1
○3碳原子的编号规定:这个编号都是统一的,也就是前面费歇尔式中的编号,它的规定
仍然是我们学过的以离官能团最近来编号。
确定环中的碳原子顺序分成三步,首先找到环中的氧原子,接着看与环中氧原子相连接的两个碳原子中有羟基的那个碳原子就是碳1,其他的碳原子依次为2 3 4 5 6,最后一步你要问,碳原子序号是顺时针还是反时针,这要看环中氧原子的两个键的倾向:向下倾时是顺时针;向上倾时则是反时针。
○4六元环的结构特点:六元环是椅式结构,各个碳原子相互是交叉排列;当氧原子
的两个键向下倾时,与氧原子相连和相对的三个碳原子是倒立的,与氧原子相间的两个碳原子是直立的;直立的3个原子在一个平面上,倒立的3个碳原子在另一个平面上。
○5各个原子和基团的空间位置以环为准,称为“在环的上方或下方”,不再称为“在
左”“在右”:
α葡萄糖各原子或基团的空间排列如下
碳1的羟基在环的下方且属a键,氢原子在环的上方,属e键;
碳2的羟基在环的下方且属e键,氢原子在环的上方,属a键;
碳3的羟基在环的上方且属e键,氢原子在环的上方,属a键;
碳4的羟基在环的下方且属e键,氢原子在环的上方,属a键;
碳5没有羟基,氢原子在环的下方,属a键;
-CH2OH在环的上方,因为C5-C6键能旋转,当碳6和碳5成交叉排列时的构象最稳定。
β葡萄糖各原子或基团的空间排列除碳1的氢和羟基位置与α-葡萄糖互换外,其他都相同。
○6β葡萄糖稳定性为什么比α葡萄糖大:其一是α-体的C-1位上羟基取a键,它与
C-3和C-5位上的氢原子(a键),有空间排斥作用(1,3-干扰)。
而β-体的C-1位上羟基取e键,没有这种作用,(这种排斥作用当你在模型中转动碳1的羟基时就能清楚地看出来!)其二是β-体环上所有比较大的基团都处在e键,相互之间距离最远,没有空间排斥作用。
○7对于α-及β-两个异构体来说,又以β-异构体占优势构象,故在平衡体系中存在量也较多,我们可以用下图表示出来:
上面这个平衡图示可知,葡萄糖的存在形式,以环状结构为主,环状结构中β葡萄糖的量大于α葡萄糖。
1,不看资料,自己搭建α葡萄糖和β-葡萄糖,注意这是一个必须完成的操作!
2, 仔细观察葡萄糖的结构,根据它的六元环是椅式结构,且大的基团一般都e键上,你怎样记住环上各个碳原子的氢原子和羟基的空间位置?这个问题的回答有多种叙述方法,但都包括以下知识点:
○1六元环是椅式结构,相邻原子都是交叉相连,故1,3,5原子和2,4,6原子分别共平面。
○2椅式六元环中,若1,3,5为倒立碳原子,则2,4,6为直立碳原子
○3直立碳原子a键向上,与之连接的原子或基团在环的上方,e键下倾,与之连接的原子或基团在环的下方; 倒立碳原子与此相反。
○4碳原子的直立倒立是相对的:从环上氧原子来判断,当氧原子的键向下倾时,1,3,5碳原子是倒立的;当氧原子的键向上倾时,1,3,5碳原子是直立的;
○5大的基团一般都连在e键上,故除α-葡萄外,羟基都在e键上,
本题的回答方法是不一样的,例如下面的参考答案是以上述5点为判断依据,而以各个碳原子上的原子或基团来分述,回答如下:
β-葡萄糖的主体结构是一个椅式五碳一氧六元环,其中:
碳1的氢原子在a键上,位于环的下方;羟基在e键上,位于环的上方;
碳2的氢原子在a键上,位于环的上方;羟基在e键上,位于环的下方;
碳3的氢原子在a键上,位于环的下方;羟基在e键上,位于环的上方;
碳4的氢原子在a键上,位于环的上方;羟基在e键上,位于环的下方;
碳5的氢原子在a键上,位于环的下方;无羟基,有一个CH2OH在e键上,位于环的上方。
这个回答,就是前面讲过的,你可以总结出一些规律出来,也许是更精练的答案。
