高考化学考点电解原理和规律(基础)
2024高考化学考点必练专题15电解池知识点讲解
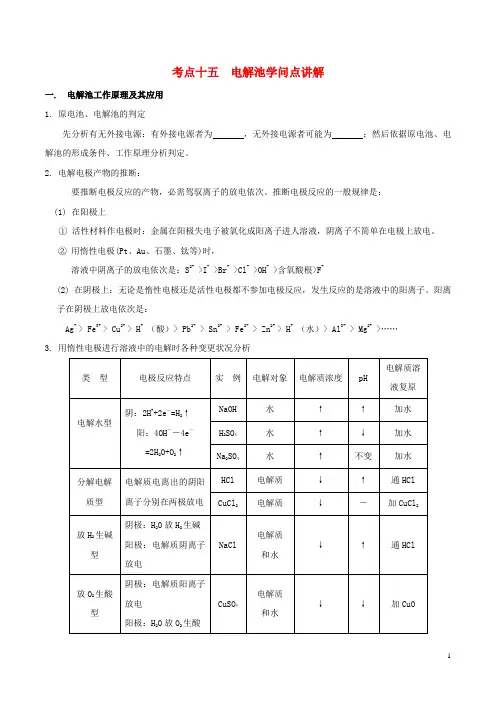
考点十五电解池学问点讲解一. 电解池工作原理及其应用1. 原电池、电解池的判定先分析有无外接电源:有外接电源者为,无外接电源者可能为;然后依据原电池、电解池的形成条件、工作原理分析判定。
2. 电解电极产物的推断:要推断电极反应的产物,必需驾驭离子的放电依次。
推断电极反应的一般规律是:(1) 在阳极上①活性材料作电极时:金属在阳极失电子被氧化成阳离子进人溶液,阴离子不简单在电极上放电。
②用惰性电极(Pt、Au、石墨、钛等)时,溶液中阴离子的放电依次是:S2- >I- >Br- >Cl- >OH- >含氧酸根>F-(2) 在阴极上:无论是惰性电极还是活性电极都不参加电极反应,发生反应的是溶液中的阳离子。
阳离子在阴极上放电依次是:Ag+ > Fe3+ > Cu2+ > H+(酸)> Pb2+ > Sn2+ > Fe2+ > Zn2+ > H+(水)> Al3+ > Mg2+>……3. 用惰性电极进行溶液中的电解时各种变更状况分析典例1(2025届内蒙古赤峰二中高三上学期其次次月考)某化学课外活动小组拟用铅蓄电池进行电絮凝净水的试验探究,设计的试验装置如图所示,下列叙述正确的是A. Y 的电极反应: Pb-2e- = Pb2+B.铅蓄电池工作时SO42-向 Y 极移动C.电解池的反应仅有2Al+6H2O 2Al(OH)3+3H2D.每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成【答案】D典例2(2025届内蒙古自治区赤峰其次中学高三上学期其次次月考)某化学课外活动小组拟用铅蓄电池进行电絮凝净水的试验探究,设计的试验装置如图所示,下列叙述正确的是A. Y 的电极反应: Pb-2e- = Pb2+B.铅蓄电池工作时SO42-向 Y 极移动C.电解池的反应仅有2Al+6H2O2Al(OH)3+3H2↑D.每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成【答案】D二. 电解原理在工业生产中的应用1.电解精炼反应原理(电解精炼铜)阳极(粗铜,含Fe、Zn、C等):Cu-2e—=Cu2+,阴极(纯铜):Cu2++2e—=Cu工作一段时间后,溶液中电解质的成分CuSO4、ZnSO4、FeSO4,Cu2+的浓度减小。
高考化学复习考点知识归类与练习---电解池工作原理

高考化学复习考点知识归类与练习电解池工作原理1.电解 (1)定义:在直流电源的作用下,电解质溶液(或熔融的电解质)在阳、阴两极分别发生氧化反应和还原反应应的过程。
(2)能量转化形式:在此过程中,将电能__能转化为___化学__能。
2.电解池的构成条件①与直流电源相连的两个电极②两个电极插入电解质溶液 (或熔融的电解质)中③形成闭合回路_。
3.电解池中电流、电子和离子的移动方向(如右下图)电流(I):从电源正极流出到阳极,经过电解质溶液,再通过阴极回到电源负极形成闭合回路。
电子:电源负极流出,阴极得电子;阳极失电子流入电源正极(“电子不下水”)---外电路。
离子:口诀:“阴阳相吸”-----阳离子移向阴极,阴离子移向阳极(“离子不上岸”)----内电路。
溶液为例):4. 电解池工作原理(以电解CuCl2总反应方程式:CuCl2=====通电Cu+Cl2↑阳极阴离子失去电子e-发生氧化反应,阴极阳离子得电子发生还原反应。
阳极反应类型口诀:“阳氧失e-”-------意思为阳极发生氧化反应失去电子。
5.电解时两极粒子放电顺序:阴离子失去电子或阳离子得到电子的过程叫放电。
离子的放电顺序取决于离子本身的性质即离子得失电子的能力,另外也与离子的浓度及电极材料有关。
(1)阴极:阴极上放电的是溶液中的阳离子,与电极材料无关。
氧化性强的先放电,放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+(2)阳极:若是活性电极作阳极,则活性电极首先失电子,发生氧化反应。
若是惰性电极作阳极,则是溶液中的阴离子放电,离子还原性强的先放电,常见离子的放电顺序是注意:一般情况下,离子按上述顺序放电,但如果离子浓度相差十分悬殊,离子浓度大的也可以先放电。
如理论上H +的放电能力大于Fe 2+、Zn 2+,但在电解浓度大的硫酸亚铁或硫酸锌溶液中,由于溶液中c (Fe 2+)或c (Zn 2+)≥c (H +),则先在阴极上放电的是Fe 2+或Zn 2+,因此阴极上的主要产物为Fe 或Zn ;但在水溶液中,Al 3+、Mg 2+、Na +等是不会在阴极上放电的。
2025版高考化学总复习第6章化学反应与能量第22讲电解池金属的腐蚀与防护考点一电解原理及电解规律

第22讲电解池金属的腐蚀与防护考点一电解原理及电解规律自主小练1.易错辨析:正确的打“√”,错误的打“×”。
(1)电解池中的氧化反应和还原反应不一定同时发生。
( × )[提示]电解池中的阳极发生氧化反应,阴极发生还原反应,二者同时进行。
(2)阳极失去的电子经过直流电源,流向阴极。
( × )[提示]阳极失去的电子流向直流电源的正极,电子不能通过直流电源内部的离子导体,直流电源的负极失去电子流向阴极。
(3)电解池中的电解质可能是熔融状态或固体电解质。
( √ )[提示]电解质溶液、熔融状态的电解质、固体电解质均是离子导体。
(4)电解池中阳离子移向阳极。
( × )[提示]阳离子定向移动方向与电流一致。
(5)电解池中的阳极和直流电源中的负极均发生氧化反应。
( √ )[提示]电解池中的阳极和直流电源中的负极均失去电子。
(6)Zn+H2SO4===ZnSO4+H2↑能设计成电解池。
( √ )[提示]电解池是把电能转化为化学能,所以不论自发、不自发进行的氧化还原反应理论上均可设计成电解池;如用Zn作阳极、惰性电极作阴极,电解硫酸溶液,电池反应即为上述反应。
(7)阴极不管是什么材料,电极本身都不反应。
( √ )[提示]阴极不管是什么材料,电极本身都不反应,一定是溶液中的阳离子放电。
(8)阳极不管是什么材料,电极本身都不反应。
( × )[提示]阳极如果是活性电极,电极本身参加反应。
(9)电解过程中阴离子向阴极定向移动。
( × )[提示]电解过程中阴离子向阳极定向移动,阳离子向阴极定向移动。
(10)直流电源跟电解池连接后,电子从电源负极流向电解池阳极。
( × )[提示]电解时电子从电源负极流向电解池阴极。
(11)电解CuCl2溶液,阳极逸出的气体能够使湿润的淀粉碘化钾试纸变蓝色。
( √ )[提示]电解CuCl2溶液时,在阳极Cl-失电子变为Cl2。
电解原理及其应用 新高考化学 考点详细分析 深入讲解 提升解题能力 化学高考必看 最新版

中性的pH不变;②电解过程中,无H2和O2产生,pH几乎不变;③电解过程 中,只产生H2,溶液中OH-浓度增大,pH变大;④电解过程中,只产生O2,溶 液中H+浓度增大,pH变小。
解题能力提升
命题角度3 “活泼阳极”电解池电解产物的判断 示例3 [2017全国卷Ⅱ,11,6分]用电解氧化法可以在铝制品表面形成 致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。 下列叙述错误的是 A.待加工铝质工件为阳极 B.可选用不锈钢网作为阴极 C.阴极的电极反应式为Al3++3e- Al D.硫酸根离子在电解过程中向阳极移动
必备知识通关
2.惰性电极电解电解质溶液的规律
必备知识通关
深度学习·分析解释 电解后电解质溶液的恢复 解决电解质溶液恢复原状的问题,应遵循“缺什么加什么,缺多少加多少” 的原则。一般加入由阴极产物所含元素与阳极产物所含元素组成的化合 物。如用惰性电极电解CuSO4溶液(不考虑电解水),要恢复电解质溶液,可 向电解后的溶液中加入CuO。但不能加入Cu(OH)2,因Cu(OH)2能与生成 的H2SO4反应使溶液中水的量增加。加入物质的物质的量需根据电路中 的得失电子守恒进行计算。
反应式为2H++2e-
H2↑,选项C错误。电解时,电解池中的阴离子向阳
极移动,选项D正确。
答案 C
解题能力提升
考法归纳·迁移创新
“活泼阳极”产物的判断
用金属活动性顺序表中Ag或Ag以前的金属(如Cu、Fe、Al等)作电解池
专题11电解原理及应用-2022年高考化学核心考点归纳与最新模拟测试(全国通用)(原卷版)
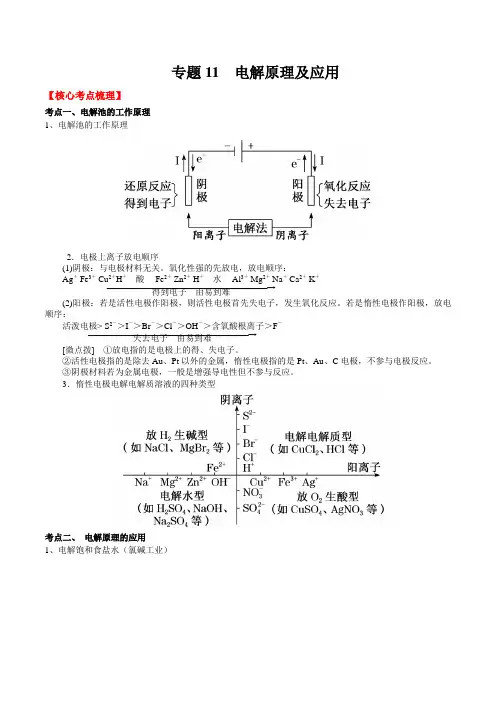
专题11 电解原理及应用【核心考点梳理】考点一、电解池的工作原理 1、电解池的工作原理2.电极上离子放电顺序(1)阴极:与电极材料无关。
氧化性强的先放电,放电顺序: ―――――――――――――――――――――→Ag + Fe 3+ Cu 2+H +酸 Fe 2+ Zn 2+ H +水 Al 3+ Mg 2+ Na + Ca 2+ K+得到电子 由易到难(2)阳极:若是活性电极作阳极,则活性电极首先失电子,发生氧化反应。
若是惰性电极作阳极,放电顺序:―――――――――――――――――――――→活泼电极> S 2->I ->Br ->Cl ->OH ->含氧酸根离子>F-失去电子 由易到难[微点拨] ①放电指的是电极上的得、失电子。
②活性电极指的是除去Au 、Pt 以外的金属,惰性电极指的是Pt 、Au 、C 电极,不参与电极反应。
③阴极材料若为金属电极,一般是增强导电性但不参与反应。
3.惰性电极电解电解质溶液的四种类型考点二、 电解原理的应用 1、电解饱和食盐水(氯碱工业)阳极反应式:2Cl --2e -===Cl 2↑(氧化反应)阴极反应式:2H ++2e -===H 2↑(还原反应)总反应方程式:2NaCl +2H 2O =====电解2NaOH +H 2↑+Cl 2↑ 2、电解精炼铜(1)电极材料:阳极为粗铜;阴极为纯铜。
(2)电解质溶液:含Cu 2+的盐溶液。
(3)电极反应:阳极:Zn -2e -==Zn 2+、Fe -2e -==Fe 2+、Ni -2e -==Ni 2+、Cu -2e -==Cu 2+; 阴极:Cu 2++2e -==Cu 。
(4)阳极泥的形成:在电解过程中,活动性位于铜之后的银、金等杂质,难以在阳极失去电子变成阳离子而溶解,它们以金属单质的形式沉积在电解槽底部,形成阳极泥。
3、电镀图为金属表面镀银的工作示意图,据此回答下列问题:(1)镀件作阴极,镀层金属银作阳极。
高考化学一轮复习(第四辑)考点五十五 电解池及电解原理(含解析)

考点五十五电解池及电解原理聚焦与凝萃1.理解电解原理,会推断电解池、电极产物、电极四周溶液pH值及整个溶液pH值的变化;2.正确书写电极反应式。
解读与打通常规考点一、电解池:把电能转变成化学能的装置叫做电解池。
二、电解原理以电解氯化铜溶液为例,装置如下图。
原理分析: CuCl2是强电解质且易溶于水,在水溶液中电离生成Cu2+和Cl-:CuCl2=Cu2++2Cl-。
通电前后溶液里离子移动示意图通电前,Cu2+和Cl-在水里自由地移动着(如图Ⅰ所示);通电后,这些自由移动着的离子,在电场的作用下,改做定向移动。
依据异性相吸的原理,带负电的氯离子向阳极移动,带正电的铜离子向阴极移动(如图Ⅱ所示)。
在阳极,氯离子失去电子而被氧化成氯原子,并两两结合成氯分子,从阳极放出。
在阴极,铜离子获得电子而还原成铜原子,就掩盖在阴极上。
他们的反应可分别表示如下:阳极:2Cl--2e-=Cl2↑ (氧化反应)阴极:Cu2++2e-=Cu (还原反应)电解CuCl2溶液的化学反应方程式为:CuCl 2电解Cu+Cl2↑三、电解池构成:1.电极且分别与电源的正、负极相连:(1)阴极:与电源的负极相连,在阴极上发生还原反应;(2)阳极:与电源的正极相连,在阳极上发生氧化反应。
2.电解质溶液或熔融电解质3.闭合回路4.直流电源隐性考点1.放电挨次(1)阴极放电挨次(即氧化性挨次)Ag+>Hg2+>Fe3+>Cu2+>(H+)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+(2)阳极放电挨次(即还原性挨次)金属单质(除Pt、Au外)>S2->I->Br->Cl->OH->含氧酸根>F-用石墨、金、铂等还原性很弱的材料制作的电极又叫做惰性电极,理由是它们在一般的通电条件下不发生化学反应。
高考化学电解质知识
高考化学电解质知识高考正在悄然袭来,高考生要抓好剩下的时间认真复习,江苏地区的考生也正在认真备考,想知道化学这门科目需要复习哪些知识点吗?下面是小编整理分享的高考化学电解质知识,欢迎阅读与借鉴,希望对你们有帮助!高考化学电解质知识第一片:电解质和非电解质1.电解质:在水溶液里或熔融状态下,能导电的化合物。
2.非电解质:在水溶液里和熔融状态下,均不能导电的化合物。
析疑:⑴二者均必须是化合物,混合物、单质,既不是电解质,也不是非电解质(非非此即彼),⑵二者的区别是其导电性,和溶解性无关,⑶是有的条件下的导电性(非自然的),⑷注意电解质的“和”与非电解质的“或”,⑸必须是物质的本身导电性,不是发生化学反应后,生成物质的导电。
⑹酸、碱、盐的电解质,有机物一般是非电解质,⑺二氧化硫、二氧化碳、氨气是非电解质。
3.附:物质的导电性⑴导电原因是带电粒子的定向移动,⑵有导体、半导体的导电(电子的定向移动→属物理变化)和电解质的导电(离子的定向移动→属化学变化)两种情况。
⑶电解质的导电分两种情况,水溶液里和熔融状态,⑷熔融状态下能导电的一定是离子化合物→离子化合物和供价化合物的鉴别,⑸导电能力的大小,两方面决定,离子所带电荷的多少及离子浓度的大小。
第二片:强电解质和弱电解质1.强电解质:在水溶液里,可以完全电离的电解质。
2.弱电解质:在水溶液里,部分电离的电解质。
析疑:⑴二者的区分标准是电离程度,⑵电离的环境只能是水溶液(熔融状态下要么不电离,要么是全部电离),⑶体系中是否存在电解质的电离平衡(一定存在水的电离平衡的),⑷体系中是否存在电解质分子(分子一定有H2O)⑸与电解质的溶解性无关。
⑹强酸、强碱、绝大部分盐是强电解质,弱酸、弱碱、极少数盐(醋酸铅等)是弱电解质。
第三片:电离1.电离:电解质在水溶液或熔融状态下离解成自由移动离子的过程。
2.电离方程式:用来表示电解质电离的方程式。
3.电离平衡:一定温度下,弱电解质在水溶液中,分子化速率和离子化速率相等,溶液中各组分保持不变。
高考化学考点电解原理的应用(基础)
高考总复习电解应用【考纲要求】1.巩固电解池的工作原理和电解规律。
2.了解电解原理在氯碱工业、电镀、电冶金属等方面的应用。
【考点梳理】考点一:氯碱工业1.定义工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
2.电解饱和食盐水(1)反应原理饱和食盐水成分:溶液存在Na+、Cl-、H+、OH-四种离子。
电极反应式:阴极:2H++2e-=H2↑(还原反应);阳极:2Cl--2e-=Cl2↑(氧化反应)。
电解总化学方程式:(2)实验简易装置如图所示在烧杯里装入饱和食盐水,滴入几滴酚酞试液。
用导线把铁钉、石墨捧、电流表接在直流电源上。
观察现象,并用湿润的碘化钾淀粉试纸检验阳极放出的气体。
(3)实验现象阳极(石墨棒)上有气泡逸出、该气体呈黄绿色,有刺激性气味,使湿润的碘化钾淀粉试纸变蓝;石墨棒附近的溶液由无色变为黄绿色。
阴极(铁钉)上逸出气体,该气体无色、无味;阴极附近的溶液由无色先后变为浅红色、红色,且红色区域逐渐扩大。
要点诠释:①阴极区域变红原因:由于H+被消耗,使得阴极区域OH-离子浓度增大(实际上是破坏了附近水的电离平衡,由于K W为定值,c(H+)因电极反应而降低,导致c(OH-)增大,使酚酞试液变红)。
②湿润的碘化钾淀粉试纸变蓝原因:氯气可以置换出碘化钾中的碘,Cl2+2KI=2KCl+I2,I2使淀粉变蓝。
3.生产过程(1)NaCl溶液的精制粗盐中含泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,会影响NaCl溶液的电解。
精制食盐水时经常加入BaCl2、Na2CO3、NaOH等,使杂质成为沉淀,过滤除去,然后加入盐酸调节盐水的pH。
粗盐(含泥沙、①加入NaOH,除去Mg2+、Fe3+②加入BaCl2,除去SO42―阳离子精制要点诠释:除杂质时所加试剂的顺序要求是:①Na2CO3必须在BaCl2之后,以除去Ca2+和前面引入的Ba2+等;②过滤之后再向滤液中加入盐酸,以免沉淀重新溶解。
高中化学总复习:电解池(一)—电解原理和规律(提高)知识点巩固练习
高考总复习 电解原理和规律编稿:柏兴增 审稿:武小煊【考纲要求】1.了解电解池的工作原理,结合原电池工作原理,加深对化学能与电能相互转化的理解。
2.掌握离子的放电顺序,能写出电极反应式和电解池总反应方程式。
3.掌握电解产物的判断和计算。
【考点梳理】考点一:电解原理1.电解的定义:使电流通过电解质溶液(或熔融的电解质)而在阴、阳两极引起氧化还原反应的过程叫电解。
电解是最强有力的氧化还原手段,可将不能自发进行的氧化还原反应得以发生。
2.电解池的装置特点:有外接电源,将电能转化为化学能。
3.形成条件:(1)与电源两个电极相连;(2)电解质溶液(或熔融的电解质);(3)形成闭合回路。
4.阴阳极的判断及反应:考点二:原电池与电解池的比较原电池 电解池 能量转化 化学能→电能 电能→化学能 反应特征自发进行非自发进行装置举例电极电池的正、负极由电极材料决定 负极:较活泼的金属正极:较不活泼的金属、金属氧化物、非金属导体阴、阳极由所连电源决定阴极:接直流电源负极 阳极:接直接电源正极电极反应 负极:失去电子、发生氧化反应 正极:得到电子、发生还原反应阳极:阴离子或金属单质失电子发生氧化反应 阴极:阳离子得电子发生还原反应 电子流向负极e -−−−−→外电路正极考点三:电解规律1.电极材料(1)活性电极:既导电又能反应(针对阳极,指金属活动顺序表Ag 及Ag 以前的金属。
)(2)惰性电极:只导电不溶解(惰性电极一般指金、铂、石墨电极,而银、铜等均是活性电极。
) 2.离子放电顺序(1)阳极:阴离子放电顺序(活性金属)> S 2—>I —>Br —>Cl —>OH —>含氧酸根>F —(实际上在水溶液中的电解,OH —后面的离子是不可能放电的,因为水提供OH —的会放电) (2)阴极:阳离子放电顺序阴极本身被保护,直接根据阳离子放电顺序进行判断,阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸中)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水中)>Al3+>Mg2+>Na+>Ca2+>K+。
2025版高考化学一轮总复习电解原理及电解规律微考点1电解池工作原理电极反应式的书写(含答案)
高考化学一轮总复习提升训练:微考点1 电解池工作原理、电极反应式的书写(2022·海南卷,9)一种采用H 2O(g)和N 2(g)为原料制备NH 3(g)的装置示意图如下。
下列有关说法正确的是( A )A .在b 电极上,N 2被还原B .金属Ag 可作为a 电极的材料C .改变工作电源电压,反应速率不变D .电解过程中,固体氧化物电解质中O 2-不断减少[思路点拨] 基于电极产物判断阴、阳极。
b 电极上N 2→NH 3,发生还原反应,则b 电极是阴极,a 电极是阳极。
固体氧化物作电解质,并非电解质的水溶液。
a 电极阳极 反应为2O 2--4e -===O 2↑ b 电极 阴极 反应为N 2+3H 2O +6e -===2NH 3+3O 2-[解析] 232O 2-→O 2,金属Ag 是活性电极,若Ag 作a 电极的材料,电极反应式为Ag -e -===Ag +,阳极被损耗,B 错误;改变工作电源电压,电路中电流改变,则反应速率改变,C 错误;结合阴、阳极反应可知,电解总反应为2N 2+6H 2O=====电解4NH 3+3O 2,固体氧化物电解质中O 2-的量不变,D 错误。
【对点训练】1.按要求书写电极反应式和总反应方程式:(1)用惰性电极电解熔融MgCl 2阳极反应式: 2Cl --2e -===Cl 2↑ ;阴极反应式: Mg 2++2e -===Mg ;总反应离子方程式: 2Cl -+Mg 2+=====电解Mg +Cl 2↑ 。
(2)用铜作电极电解盐酸溶液阳极反应式: Cu -2e -===Cu 2+;阴极反应式: 2H ++2e -===H 2↑ ;总反应离子方程式: Cu +2H +=====电解Cu 2++H 2↑ 。
(3)用铁作电极电解NaCl 溶液阳极反应式: Fe -2e -===Fe 2+;阴极反应式: 2H 2O +2e -===H 2↑+2OH - ;总反应方程式: Fe +2H 2O=====电解H 2↑+Fe(OH)2 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电解原理和规律【考纲要求】1.了解电解池的工作原理,结合原电池工作原理,加深对化学能与电能相互转化的理解。
2.掌握离子的放电顺序,能写出电极反应式和电解池总反应方程式。
3.掌握电解产物的判断和计算。
【考点梳理】考点一:电解原理1.电解的定义:使电流通过电解质溶液(或熔融的电解质)而在阴、阳两极引起氧化还原反应的过程叫电解。
电解是最强有力的氧化还原手段,可将不能自发进行的氧化还原反应得以发生。
2.电解池的装置特点:有外接电源,将电能转化为化学能。
3.形成条件:(1)与电源两个电极相连;(2)电解质溶液(或熔融的电解质);(3)形成闭合回路。
4.阴阳极的判断及反应:考点二:原电池与电解池的比较原电池 电解池 能量转化 化学能→电能 电能→化学能 反应特征自发进行非自发进行装置举例电极电池的正、负极由电极材料决定 负极:较活泼的金属正极:较不活泼的金属、金属氧化物、非金属导体阴、阳极由所连电源决定阴极:接直流电源负极 阳极:接直流电源正极电极反应负极:失去电子、发生氧化反应 正极:得到电子、发生还原反应阳极:阴离子或金属单质失电子发生氧化反应 阴极:阳离子得电子发生还原反应 电子流向 负极e-−−−−→外电路正极考点三:电解规律1.电极材料(1)活性电极:既导电又能反应(针对阳极,指金属活动顺序表Ag 及Ag 以前的金属。
)(2)惰性电极:只导电不溶解(惰性电极一般指金、铂、石墨电极,而银、铜等均是活性电极。
) 2.离子放电顺序(1)阳极:阴离子放电顺序(活性金属)> S 2—>I —>Br —>Cl —>OH —>含氧酸根>F —阴极←—|←—阳极离子放电e ―e ―(实际上在水溶液中的电解,OH—后面的离子是不可能放电的,因为水提供OH—的会放电)(2)阴极:阳离子放电顺序阴极本身被保护,直接根据阳离子放电顺序进行判断,阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸中)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水中)>Al3+>Mg2+>Na+>Ca2+>K+。
要点诠释:阴阳离子在两极上放电顺序复杂,与离子性质、溶液浓度、电流强度、电极材料等都有关,不应将放电顺序绝对化,以上仅是一般规律。
3.电极反应式和电解总方程式(1)电极反应式的书写①首先判断阴、阳极,分析电极材料,判断是电极材料放电还是溶液中的离子放电。
阳极为金属活性电极时,电极材料放电。
②再分析溶液中的离子种类,根据离子放电顺序,分析电极反应,并判断电极产物,写出电极反应式。
③电解水溶液时,应注意放电顺序中H+、OH―之后的离子一般不参与放电反应。
(2)电解化学方程式的书写①必须在长等号上标明“电解”。
②仅是电解质被电解,电解化学方程式中只写电解质及电解产物。
如电解CuCl2溶液:CuCl2电解Cu+Cl2↑③仅有水被电解,只写水及电解产物即可。
如电解NaOH溶液、稀H2SO4:2H2O电解2H2↑+O2↑。
④电解质、水同时被电解,则都要写进方程式。
如电解AgNO3溶液:4AgNO3+2H2O电解4Ag+O2↑+4HNO3。
解题依据是得失电子守恒,解题方法一般有如下几种:(1)根据电子守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。
(2)根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式计算。
(3)根据关系式计算:根据得失电子守恒关系,在已知量与未知量之间,建立计算所需的关系式。
【典型例题】类型一、电解原理例1.某同学按下图所示的装置进行电解实验。
下列说法正确的是()A.电解过程中,铜电极上有H2产生B.电解初期,总反应方程式为:Cu+2H2SO4电解CuSO4+H2↑C.电解一定时间后,石墨电极上有铜析出D.整个电解过程中,H+的浓度不断增大【思路点拨】与电源正极相连的电极为阳极,阳极Cu失电子发生氧化反应。
【答案】B、C【解析】本题主要考查电解的基本原理,由题目所给图示可知,活泼金属铜作阳极,发生反应:Cu-2e-==Cu2+。
同时溶液中的H+在阴极石墨上发生反应:2H++2e-==H2↑,总反应的化学方程式为:Cu+H2SO4电解CuSO4+H2↑,所以A项不正确,B项正确,D项不正确;随着电解过程不断进行,溶液中的Cu2+浓度不断增大,一定时间后即当c (Cu2+)较大时,由于Cu2+的氧化性大于H+,故此时阴极发生反应:Cu2++2e-==Cu,所以C项正确。
【总结升华】解答有关电解问题的步骤:(1)首先要判定是否为电解池,有外接直流电源则为电解池,否则不是电解池。
(2)对于电解池,首先要考虑阳极材料,若为惰性电极,溶液中的阴离子被氧化;若为活性电极,则被氧化的是电极本身。
(3)若溶液中的阴、阳离子有多种,则据离子放电顺序判定什么离子先放电,什么离子后放电,并写出电极反应式。
(4)根据电极反应式解答相关问题。
举一反三:【变式1】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图,电解总反应为:2Cu+H2O 通电Cu2O+H2↑。
下列说法正确的是()A.石墨电极上产生氢气B.铜电极发生还原反应C.铜电极接直流电源的负极D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成【答案】A【解析】由总反应知失电子的为Cu,得电子的是H2O中的氢元素。
因此Cu极为电解池的阳极,接电源的正极,石墨为阴极,接电源的负极。
当有0.1 mol电子转移时,应有0.05 mol Cu2O生成。
【变式2】某学生为完成2HCl+2Ag==2AgCl↓+H2↑,设计如图所示的四个实验,你认为可行的实验是()。
【答案】D【解析】该反应不能自发进行,必须电解,且阳极为Ag。
类型二、酸、碱、盐溶液的电解规律例2.用铂电极电解下表中各组物质的稀溶液(如图)一段时间后,甲、乙两池中溶液的选项 A B C D甲KOH H2SO4Na2SO4CuSO4乙CuSO4AgNO3HCl HNO3【答案】D【解析】甲中电解KOH时,实质为电解水,电解质溶液浓度增大,溶液pH增大,A不正确;甲中为硫酸时,甲中pH减小,①为阳极生成氧气,④为阴极生成银单质,当有1 mol氧气生成时会生成4 mol的银单质,B 不正确;甲中为Na2SO4时,通电之后溶液pH不发生变化,C不正确;甲为硫酸铜溶液时,①为阳极:4OH――4e―==2H2O+O2↑,阴极:Cu2++2e―==Cu,溶液pH减小,乙中为硝酸,电解时溶液pH减小,④为阴极:2H++2e―==H2↑,当转移电子数相同时,在①和④两极的电极产物的物质的量之比为1∶2,D正确。
【总结升华】用惰性电极电解酸、碱、盐溶液,其溶液pH变化的判断方法是:先分析原溶液的酸碱性,再看电极产物,即无氧只放氢,pH升;无氢有氧放,pH降;氢、氧一齐放,是碱pH升,是酸pH降。
举一反三:【变式1】右图为直流电源电解稀Na2SO4水溶液的装置。
通电后在石墨电极a和b附近分别滴加一滴石蕊试液,下列实验现象中正确的是()A.逸出气体的体积a电极的小于b电极的B.一电极逸出无味气体,另一电极逸出刺激性气味气体C.a电极附近呈红色,b电极附近出现蓝色D.a电极附近呈蓝色,b电极附近出现红色【答案】D【变式2】用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是()。
A.CuCl2 [CuO] B.NaOH [NaOH] C.NaCl [HCl] D.Na2SO4 [NaOH]【答案】C【解析】A应补充适量的CuCl2,B、D均应补充适量的水;C中阳极:2Cl--2e-==Cl2↑,阴极:2H++2e-==H2↑,损失的是HCl,因此需要补充适量的HCl。
【总结升华】溶液恢复为与原来溶液完全一样的是指:反应后的溶质要恢复原来的溶质,并且其浓度也要恢复为原来的浓度。
类型三、电解的有关计算例3.用两支惰性电极插入500mL的AgNO3溶液中,通电电解。
当电解质溶液的pH由6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),则电极上析出银的质量是()A.27mg B.54mg C.108mg D.216mg【思路点拨】忽略电解前的氢离子,即生成的氢离子浓度为10-3mol/L。
利用电解方程式进行计算。
【答案】B【解析】由总的电解反应式:4AgNO3+2H2O4Ag+ O2↑+4HNO3得计算关系式:4Ag~O2~4H+~4e—因为有HNO3生成,所以pH要变小。
生成HNO3的物质的量为(10-3-10-6)×0.5 mol≈0.5×10-3mol(即忽略原溶液中的氢离子),所以析出银的质量为0.5×10-3mol×108g/mol=54mg【总结升华】依电子得失守恒,可得常见的计算关系式:2Cu~2H2~2Cl2 ~4Ag~O2~4H+~4OH- ~4e—举一反三:【高清课堂:399161 例3】【变式1】电解2L 4mol/L的NaCl溶液,当电路中通过0.02mol电子时,若不考虑由于电解而引起的溶液体积的变化,则溶液的pH为A.2 B.7 C.11 D.12【答案】D【高清课堂:399161 例4】【变式2】Na2SO4和CuSO4的混合溶液1L,硫酸根离子的浓度为2mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中C(Na+)为A.0.5mol/L B.1mol/L C.1.5mol/L D.2mol/L【答案】D。
