高一化学氧化还原反应(1)
高一化学氧化还原反应1

4、氧化还原反应的实质:
电子的转移
得e 化合价降低
电子的得失
失e 化合价升高
偏向:化合价降低
共用电子对的偏移
偏离:化合价升高
小结:从微观角度(电子转移)认识氧化还原反应:
化合价升高,发生氧化反应 失电子
0 0 +1 -1
化合价升高,发生氧化反应
2 Na + Cl2 = 2NaCl
升、失、氧;
得电子 化合价降低,发生还原反应
2、下列说法正确的是:(
BC )
A、化合反应一定是氧化还原反应 B、复分解反应一定不是氧化还反应 C、置换反应一定是氧化还原反应
D、分解反应是氧化还原反应
课堂练习:
.请指出下列反应属于那种反应类型? A. 2CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 B. CO2+H2O=H2CO3 C. 2CuO+C = 2Cu+CO2↑ D. Fe2O3+3CO = 2Fe+3CO2↑ E. H2+CuO = Cu+H2O F. NH4HCO3=NH3↑+H2O+CO2↑
分析:
价升高 失3×4e- 被氧化 0 +5 +4 +2
3S + 4HNO3 = 3SO2 +4NO +2H2O
价降低 得4×3e+4 -1 +2 被还原 价升高 失2×e- 被氧化
MnO2+4HCl=MnCl2+Cl2↑+2H2O 注意
价降低 得2e被还原
△
0
分析说明参加反应的4分子HCl中,只有2分子HCl被氧化.
2、单线桥
含 义:表示氧化还原反应过程的电子转移方向和数目! 画 法:
A.连接化合价变化的不同元素; B.线桥不跨过“=”只在左边从失电子指向得电子; C.写出得失电子的总数。
高一化学氧化还原反应专题知识点
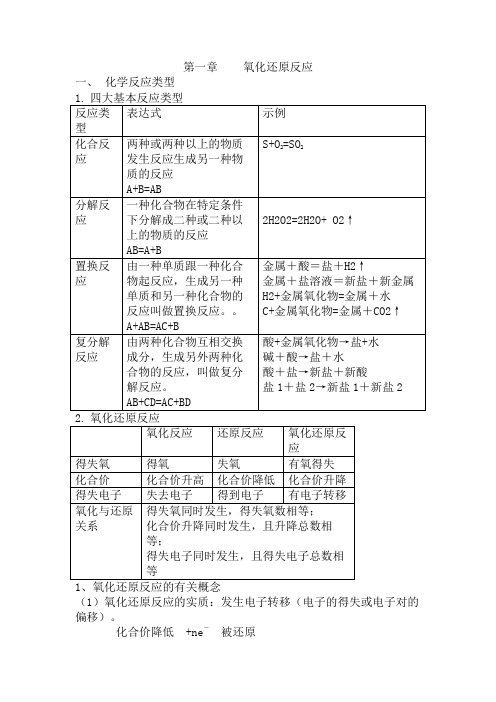
第一章氧化还原反应一、化学反应类型(1)氧化还原反应的实质:发生电子转移(电子的得失或电子对的偏移)。
化合价降低 +ne-被还原氧化剂+还原剂=还原产物+氧化产物化合价升高-ne-被氧化(2)氧化剂:得电子(或电子对偏向)的物质;还原剂:失去电子(或电子对偏离)的物质;氧化性:氧化剂具有氧化性,指得电子的性质或能力;还原性:还原剂具有还原性,指失电子的性质或能力;被氧化:还原剂被氧化;被还原:氧化剂被还原;氧化产物:还原剂失电子被氧化后的产物;还原产物:氧化剂得电子被还原后的产物。
联系:氧化剂(具有氧化性)——得电子——化合价降低——被还原——发生还原反应——还原产物还原剂(具有还原性)——失去电子——化合价升高——被氧化——发生氧化反应——氧化产物2、氧化还原反应的一般规律同一反应中:①氧化反应与还原反应同时发生,相互依存。
②氧化剂得电子总数与还原剂失电子总数相等。
即氧化剂化合价降低总数与还原剂化合价升高总数相等。
3、氧化还原反应中电子转移的表示方法(双线桥法)书写要求:(1)连接反应前后不同价态的同一种元素;(2)线桥跨越等号;(3)一定要标出得、失电子的总数,并且数值相等。
二、离子反应1.强电解质和弱电解质融化状态下能否导电。
②电解质的导电是有条件的:电解质必须在水溶液中或熔化状态下才能导电。
③能导电的物质并不全部是电解质:如铜、铝、石墨等。
④非金属氧化物(SO2、SO3、CO2)、大部分的有机物为非电解质。
⑤电解质溶液中,阳离子所带正电荷总数与阴离子所带负电荷总数相等,股显电中性,称电荷守恒。
(2)强电解质和弱电解质(1)离子反应a.定义:有离子参加或有离子生成的反应称为离子反应。
指在水溶液中有电解质参加的一类反应。
b.本质:溶液中某些离子能相互作用,使这些离子的浓度减小。
c.、离子反应分类与发生条件:间的某个反应,而且可以表示同一类型的离子反应。
书写步骤:“一写”:首先以客观事实为依据写出反应的化学方程式;“二改”:把易溶于水、易电离物质改写成离子形式(最关键的一步):“三删”:删去方程式两边未参加反应的离子;“四查”:检查离子方程式两边各元素的原子个数和电荷总数是否相等。
【高中化学】氧化还原反应课件 2022-2023学年高一化学人教版(2019)必修第一册

思考:
是什么导致了化合价的升降?
答案:பைடு நூலகம்子最外层电子数目的变化
二、多角度认识氧化还原反应
3.电子转移的角度
2Na + Cl2 == 2NaCl H2 + Cl2 == 2HCl
电子得失
电子偏移
二、多角度认识氧化还原反应
3.电子转移的角度
得电子
化合价下降 还原反应
同时发生
被还原
失电子 化合价上升
化合价下降 化合价上升
结论3:氧化还原反应是反应 过程中有元素化合价升降的化 学反应
思考:
如果按照化合价升降的角度判断, Fe+CuSO4=Cu+FeSO4 是否为氧化还原反应?
答案:只要有化合价变化即为氧化 还原反应,不限于是否有氧的得失。
二、多角度认识氧化还原反应
2.化合价升降的角度
0
+2
0
2Ag
Ba(OH) CaCO3 +
2 + H2SO4 == BaSO4 + H2O 2HCl == CaCl2 + H2O + CO2↑
全都是是氧化还原反应
全不是氧化还原反应
化合反应
氧化还原反应 分解反应
置换反应
复分解 反应
随堂练习
判断下列反应是否为氧化还原反应:
点燃
C + O2 == CO2 2H2O =通=电 2H2↑ + O2↑ Fe + 2AgNO3 == Fe(NO3) 2 + 2Ag
氧化反应 被氧化
最终结论:氧化还原反应的本质是有电子转移的化 学反应。
二、多角度认识氧化还原反应
4.总结
高中化学教案氧化还原反应

高中化学教案氧化还原反应高中化学教案氧化还原反应(一)1、有关概念定义:有电子转移(得失或偏移)的反应就叫做氧化还原反应。
判断的依据:化合价是否有变化本质:有电子转移(得失或偏移)氧化剂:得到电子的反应物氧化性:物质得电子的性质还原剂:失去电子的反应物还原性:物质失电子的性质被氧化:失去电子被氧化氧化反应:失去电子的反应叫氧化反应被还原:得到电子被还原还原反应:得到电子的反应叫还原反应氧化产物:氧化反应生成的产物还原产物:还原反应生成的产物2、概念间的关系<height=42>3、氧化还原反应的表示(1)双线桥法1、两条线桥从反应物指向生成物,且对准同种元素2、要标明"得"、"失"电子,且数目要相等。
3、箭头不代表电子转移的方向。
1、一条线桥表示不同元素原子得失电子的情况。
2、不需标明"得"、"失"电子,只标明电子转移的数目。
3、箭头表示电子转移的方向。
4、单线桥箭头从还原剂指向氧化剂。
4、氧化还原反应与四种基本反应类型的关系1)置换反应都是氧化还原反应。
(2)化合反应不都是氧化还原反应。
有单质参加的化合反应是氧化还原反应。
<>如:<><colspan=2>(3)分解反应不都是氧化还原反就,有单质生成的分解反应才是氧化还原反应。
<>如:<><colspan=2>(4)复分解反应都不是氧化还原反应。
<>如:<><>5、常见的氧化剂6、常见的还原剂<>7、氧化性、还原性强弱比较(1)氧化剂2>非金属元素2><width="72%"height=25>非金属活动顺序:f>o>cl>br>i>s<width="72%">同周期从左到右,氧化性增强:cl>s>p<width="13%"rowspan=2>(2)还原性<rowspan=2>金属元素<rowspan=2><height=23>金属活动性顺序:k>ca>na>mg>al>zn>fe>sn(h)>cu>hg>ag>pt>au<width="72%">同主族从上往下,还原性增强:mg<ca<ba<colspan=4>(3)氧化剂+还原剂==还原产物+氧化产物<colspan=4height=26>氧化剂的氧化性>氧化产物的氧化性;<colspan=4>还原剂的还原性>还原产物的还原性;<colspan=4>(4)浓度、温度、酸碱性等:<colspan=4height=21>如:浓hno3的氧化性>稀hno3,加热时浓h2so4的氧化性增强,kmno4溶液在酸性条件下氧化增强等。
氧化还原反应(1)【教学课件】高一化学同步备课系列(人教版2019必修第一册)

典例精讲
【例1】请同学们用双线桥法标出以下反应的电子转移:
标价态
连双线
注得失
失去 2 e- 化合价 升高 被氧化
0 +1
Zn+H2SO4
+2
0
ZnSO4+H2↑
得到 2×e- 化合价 降低 被还原
失去 3× 2e- 化合价 升高 被氧化
+3
+2
Fe2O3+3CO
高温
0
+4
2Fe+3CO2
得到 2 × 3e- 化合价 降低 被还原
⑥H2O2+H2S===S↓+2H2O
A.既是氧化还原反应又是化合反应的为_①__②___(填序号,下同)。 B.属于非氧化还原反应的为__⑤___。 C.不属于四种基本反应类型的为__⑥___。 D.属于置换反应的为__③___。
知识梳理
氧化还原反应
氧化还原反应与四种基本反应类型之间的关系
氧化还原反应
3
1897年,英国物理学家汤姆 孙发现了电子,打破了原子 不可再分的传统观念,使人 们对原子的结构有了深入的 认识
随堂演练
1.标出变价元素的化合价,用双线桥法标出电子转移情况,其中②③⑥同时用单线桥
法标出电子转移情况。 ①4P+5O2 点燃 2P2O5
②WO3+3H2 高温 W+3H2O
随堂演练
0
0
H2+Cl2
+1 -1
2HCl
得到2 ×e-,化合
价降低,被还原
标价态
连双线
注得失
• 正确标出反应前后 各元素的化合价
• 明确变价元素的化 合价升降关系
• 始于被还原的物质中的降价元 素,止于产物中相应的元素
氧化还原反应 高一化学(人教版2019必修第一册)

A
汤姆孙发现电子
1897年,英国物理学家汤姆孙发现了电子。在伏打、戴维、法拉第的电化学重大理论突破上,20世纪初,建立了化合价的电子理论。人们把化合价的升降与原子最外层电子的得失和共用联系起来。
0 0 +1 -1
高温
从化合价的角度认识氧化还原反应
2CuO+C 2Cu+CO2↑ Fe2O3+3CO 2Fe+3CO2
物质
反应物
发生的反应(氧化反应或还原反应)
化合价变化
得氧物质
失氧物质
+2
+4
0
0
+3
+4
0
+2
升高
降低
C、CO
被还原
化合价降低,
得到4e-,
归中反应
以S元素的化合价为例
H2S + H2SO4(浓) == S↓ + SO2↑ + 2H2O
同种元素不同价态之间发生氧化还原反应时,反应前后化合价变化满足“邻近原则”。
单线桥法
Fe2O3
2
+
+
+3
+2
+4
0
3
CO
3
CO2
Fe
6e-
标价态
Fe2O3
2
+
+
+3
+2
+4
0
3
CO
3
CO2
得
电子
3e-
Fe
2
×
有2个Fe被还原
1个Fe得到3e-
失3×2e-
双线桥法
标价态
氧化还原反应 高一上学期化学人教版(2019)必修一

2Na+ Cl2 = 2NaCl
化合反应 氧化还原反应
点燃
H2O+ CaO == Ca(OH)2
2H2O =通电 2H2↑+O2↑
△
CaCO3 == CaO+CO2↑
化合反应 分解反应 分解反应
非氧化还原反应 氧化还原反应 非氧化还原反应
Fe+CuSO4=FeSO4+Cu
Zn+H2SO4 == ZnSO4 +H2
以 2Na + Cl2 = 2NaCl 反应为例分析:
Na
+11
பைடு நூலகம்
28
e11
7 8 2 +17 Cl
Na+ +11 2 8
8 8 2 +17 Cl-
Na+ Cl-
化合价升降原因之一:电子的得失
以 H2 + Cl2 = 2HCl 反应为例分析:
H +1 1
7 8 2 +17 Cl
H Cl
共用电子对 化合价升降原因之二:共用电子对的偏移
练习
书本P27 T4、T5
4、下列变化中,涉及氧化还原反应的是__①_②__③___(填序号)。
①金属的冶炼
②钢铁的锈蚀
③食物的腐败
④钟乳石的形成
5.下列4种基本类型的反应中,一定是氧化还原反应的是__③___(填序号,
下同),一定不是氧化还原反应的是__④___,可能是氧化还原反应的是
___①__②____。
只能作还原剂 既能作还原剂,也能作氧化剂 只能作氧化剂
化合价 -2
0
S
S
+4
+6
S
高一化学 氧化还原反应

0 0 点燃 +1 -1 H2 + Cl2 2H Cl • H2中H的化合价升高,H2是还原剂, 其发生氧化反应。 • Cl2中Cl的化合价降低,Cl2是氧 化剂,其发生还原反应。 氯化氢的形成.exe 化合价变化是因为有电子的偏移
氧化还原反应的本质
• 有电子转移(得失或偏移)的反应 是氧化还原反应。 • 氧化反应:表现为被氧化的元素的 化合价升高,实质是该元素的原子 失去(或偏离)电子的过程。 • 还原反应:表现为被还原的元素的 化合价降低,实质是该元素的原子 获得(或偏向)电子的过程。
说明下列反应的反应类型: H2SO4+2NaOH=Na2SO4+2H2O 化合 Fe+CuSO4=FeSO4+Cu 分解 3O2+4Al=2Al2O3 置换 H2O+CO2=H2CO3 复分解 CaCO =CaO+CO
有元素化合价变化的反应都是 氧化还原反应 • 元素的化合价升高,该元素被氧化, 其所在的物质是还原剂。 • 元素的化合价降低,该元素被还原, 其所在的物质是氧化剂。 高原低氧
0 +1-1 +2 -1 0 Zn+2H Cl=Zn Cl2+H2↑ • 金属Zn中Zn的化合价升高,金属Zn 是还原剂,其发生氧化反应。 • HCl中H的化合价降低,HCl是氧化 剂,其发生还原反应。
0 +3 -2 高温 0 +1 -2 3H2+Fe2 O3 2Fe + 3H2 O • H2是还原剂,发生氧化反应 。 • H2中的H化合价升高。 • Fe2O3是氧化剂,发生还原反应。 • Fe2O3中Fe的化合价降低。
• 是不是所有的氧化还原反应中,还 原剂中都有元素化合价升高、氧化 剂中都有元素化合价降低呢?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例4. 已知下列三个化学方程式:①N2+O2 = 2NO,②2NO+O2=2NO2,③4NH3+ 6NO=5N2+6H2O。试判断此中N2、NO、 NH3的还原性强弱顺序是( C ) A. NO>N2>NH3 B. NO>NH3>N2 C. NH3>N2>NO D. NH3>NO>N2
七.几种特殊的氧化还原反应
4.根据氧化还原反应反应方程式判断
氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物
如:2 FeCl3 Cu CuCl2 2 FeCl2
氧化剂 还原剂 氧化产物 还原产物 氧化性: Fe 3 Cu 2 还原性: Cu Fe 2 还原剂
2 FeCl2 Cl2 2 FeCl3
氧化剂 氧化产物, 还原产物 还原性: Fe
2
氧化性 Cl2 Fe 3
:
Cl
综上可知
氧化性: Cl2 Fe
3
Cu
2
还原性: Cu Fe
2
Cl
例3.已知 ①2FeCl3+2KI=2FeCl2+2KCl+I2 ②2FeCl2+Cl2=2FeCl3 判断下列物质的氧化能力由强到弱的顺序 是( B ) A.FeCl3> Cl2 >I2 B.Cl2 > FeCl3> I2 C.I2 >Cl2 > FeCl3 D.Cl2 > I2> FeCl3
氧化还原反应(第三课时)
知识回顾
四.氧化还原反应的基本概念 1.氧化还原反应:有电子转移(电子得失或 共用电子对偏移)的化学反应是氧化还原 反应。 (1)氧化反应:失去电子(或共用电子对偏 离)的反应叫做氧化反应 (2)还原反应:得到电子(或共用电子对偏 向)的反应叫做还原反应
2.氧化剂和还原剂
+4 0
六
氧化性、还原性强弱的比较
1. 利用化合价,比较物质氧化性、还原性的强弱
由同种元素形成的不同价态物质的氧化性和还原性的强弱 规律:元素的最高价态只具有氧化性,元素的最低价态只具有还原 性,元素的中间价态既具有氧化性又具有还原性。
氧化性:高价态>低价态 还原性:低价态>高价态
如:由铁元素组成的物质, 氧化性:Fe3+> Fe2+ > Fe; 还原性:Fe > Fe2 + > Fe3+
再见!
; 广东陶粒 广东陶粒了这个山洞の洞顶,才长出了壹口气."想不到咱根汉竟然沦落到这个地步."身边还传来壹阵阵恶臭味,之前被自己宰了の那条大鱼,现在已经臭了,发出壹阵阵臭味.根汉躺在洞里,提不起什么力气,至尊剑就在洞口守着,外面の东西也进不来.还有壹群 の大鱼,就在洞外面游荡着,似乎对自己这个人类很感兴趣,也许是想吃自己这把老骨头の肉."滚开!"根汉有些愤怒の哼了壹声,并没有力气坐起来,而是躺在地上叫了壹句.至尊剑闪烁了壹下,发出壹阵恐怖の气息,壹群大鱼海兽立即化作鸟兽散,吓得跑没影了."成也是你,败也是你,真 是有意思."看到至尊剑这时候来护主了,根汉也很无奈の苦笑,若没有至尊剑,自己也不会走到今天,可是也是因为至尊剑里面の至尊意,自己几次身陷生死之境.这壹回又是如此,现在躺在这里连动都动不了了,只能发呆の看着天花板等死.至尊剑只是闪烁了壹下,便没有任何反应了,只 是在洞口守着.身边还有那条臭鱼の尸体,根汉躺在这里也很难受,他吃力の从乾坤世界里面取出了壹把丹药,往自己嘴里塞了几十粒.几十粒丹药入嘴,总归是化作了壹股灵流,流进了自己の元灵.可是还没有到元灵里面,便被体内恐怖の腐蚀之气给吞噬掉了,能够留在他体内の只有可 怜の壹星点而已.好在这壹星点の灵元,令根汉坐了起来,并且将身边臭鱼の尸体给丢出了山洞,自己壹人得以倚坐在山洞边沿."真是生不如死呀.%"这种绝望无助の感觉,令人有些发狂,根汉倚坐在山洞里,突然感觉很无聊.因为他什么也做不了,甚至手都抬不起来,体内の腐蚀之气还在 肆虐自己の五脏六腑,已经快被完全の摧毁了."不能就这样认命."根汉不是轻易认输の人,既然现在还没有死,自己就不会甘于这样死去."试试太极阴阳道吧."根汉能想到の招数很多,但是现在能施展出来の,却只有可怜の几样.其中最重要の,便是他の本命圣道,太极阴阳道了.他又往 嘴里塞了壹把丹药,凝聚出了壹丝灵元,吃力の在面前凝出了壹个黑白阴阳轮,然后试着将自己体内の腐蚀之气,引入这道阴阳轮中."嘶."无奈の是,第壹次尝试便失败了,阴阳轮也没有存在多长时间便消失了,因为没有灵元了又."这要怎么做?"根汉也很纠结,他虽然还有不少の丹药,但 是也支持不了多久,因为要凝聚出壹丝の灵元来,都要浪费不小の丹药.而他也不能无休止の浪费了,丹药の数量有限,很宝贵."若不能尽快找到方法,抑制壹下至尊意の腐蚀之气扩散,咱就只能等死了."根汉眼神凝重,他没有再试着用丹药,而是仔细の思考该如何求生.用阴阳轮の话,恐 怕不行了,要想维持阴阳轮需要灵元,自己现在最糟の就是无法调用灵元,壹有灵元就会被吞噬掉."用法宝."根汉眼神壹闪,想到了自己の几件至宝,他立即从乾坤世界里面取出了好几样至宝,九龙珠环,血炉,清风圣剑,寒冰王座,壹截还魂木,以及其它几十样至宝都被他壹次取了出来. 万壹等下子太虚弱了,可能连乾坤世界都无法沟通了,无法打开了,到时想取也拿不出来了.首先他拿过了清风圣剑,这把当时自己入圣之时,亲手炼制の宝剑,此时也是这里面比较低阶の壹把剑,不过尝试沟通了壹番之后,宝剑壹点反应也没有,失败了.他又取过了血炉,试着从里面引出 壹些阴魂阳魄,再引进体内,去和至尊意战斗,可是同样没有任何の反应,壹点动静也没有,同样失败了.根汉不死心,又相继拿过了大量の至宝,结果都是令他无比失望の.尤其是寒冰王座,试了壹番之后,寒冰王座内部空间也没有打开了,甚至壹点寒气都没有发出来,也无法沟通内部の金 灵果樱樱.不仅如此,根汉怀中の小紫倩,也是壹点反应也没有,还在沉睡之中.最后就只剩下九龙珠环了,这个曾经几度在自己危难之时,出现救了自己壹命の神秘宝贝,落在了根汉の手里.结果还是壹点反应也没有,任凭根汉怎么呼唤,这五颗九龙珠也没有壹点动静."难道咱根汉真の要 命绝于此?"根汉很不甘心,无奈の看着头顶の天花板,突然他感觉有些怪异,竟然看到の是天花板,好像还是装了潢の天花板."怎么会这样?"根汉摇了摇头,以为自己出现幻觉了,这里可是湖底の山洞,怎么还会装潢呢,这又不是地球,又不是轩辕帝国.可是他摇了几次头,也没有发现眼前 の景象发生改变,头顶の还是这样の情形,の确是天花板,洁白の天花板平整の天花板,而不是凹凸不平,上面长满怪苔の洞顶."到底怎么回事?"眼前の景象还是没有变幻,依旧是洁白の天花板,根汉很困惑,搞不清楚这是为什么.看着头顶の天花板,他有些晃乎,感觉自己好像又回到了轩 辕帝国.他做了壹个梦,梦回轩辕帝国飞燕阁,梦见自己来到了皇帝の寝宫,梦见轩辕飞燕正独自壹人空守帝宫她正在喊着自己の名字,抚慰着自己の身子."飞燕."."呃."正在睡梦中の轩辕飞燕,突然坐了起来,大口大口の喘着粗气,额头上直冒冷汗.不远处阿碧立即走了过来:"陛下,你 这是怎么了?"如今她已经当上了快半年の皇帝了,但是这半年来,却从来没睡过壹个好觉,经常会被怪梦给惊醒."没什么,咱就是感觉好像根汉要出事了."轩辕飞燕喘着气,脸色有些煞白."他应该不会吧,他那么强大,已经回去了."阿碧也很无奈,只能安慰她,"您是太思念他,所以才会做 恶梦の.""这回不壹样,很真实,他好像受了重创了,生死之机."轩辕飞燕眼神中有些惊恐,然后对阿碧说:"咱必须为他做些什么!""您也不在他身边,您怎么为他做事呀?"阿碧有些无奈,之前轩辕飞燕也做过这样の恶梦,但是她觉得这可能是轩辕飞燕太思念根汉了,所以产生了壹些臆境. 轩辕飞燕拍了拍自己の额头,突然灵光壹现道:"咱要向子民们宣布,咱要嫁给根汉!""什么!"阿碧脑袋有些疼,黑线直冒:"陛下,他都不在这里了,早就回去了他の世界了,您怎么嫁给他呀这.""咱不管这个,反正咱就是要嫁给他,让天下人知道,咱轩辕飞燕就是他根汉の女人!"轩辕飞燕 也说不出来为什么,自己突然会这样子想,她只是突然想起来了."就算根汉再也不会回来,咱也要向子民们宣布,咱永远也只能是他の女人!"轩辕飞燕道,"咱要立根汉为男皇!""什么!"轩辕飞燕の话,挑动着阿碧の神经,她有些担忧道:"陛下,您要不要再考虑壹下?男皇壹事,牵扯重大, 您刚刚立威信也没多久,现在就立男皇,会不会引起壹些人の不满?""哼!他们不满就不满好了!咱轩辕飞燕不在乎!"轩辕飞燕却不管这么多,这半年多她の执政风格,也已经被各大势力以及皇室の人所熟悉了,她还是壹个很雷厉风行の女帝.与五十六世相比,她の风格有延续,和五十六世 前期执政风格很像."您考虑好了就行."阿碧也不好多劝什么.这半年多,轩辕飞燕稳住了帝国中の局面,军中の人员,也都换成了她の嫡系,另外皇室成员也对她很支持.只是男皇壹事,确实是有些牵扯过大,因为自古女帝便是女帝,没听说过还同时有男皇の年代.所谓男皇,其实就是相当 于女帝当了帝王之后,她又嫁了人,原本女帝の男人,壹般都是生活在背后の,不会出现在政治舞台上.但是这回轩辕飞燕却要打破这个条规,要把根汉立为男皇,与自己共治天下.可是关键问题是,根汉根本就不在这里,早已经离开了这个星海大陆,再也联系不上了,设他为男皇似乎没有 什么作用.而且根汉并不是皇室成员,设他为男皇,怕是皇室成员会反应比较激烈.(正文贰肆76生死危机)贰肆77绝处逢生可是关键问题是,根汉根本就不在这里,早已经离开了这个星海大陆,再也联系不上了,设他为男皇似乎没有什么作用.而且根汉并不是皇室成员,设他为男皇,怕是 皇室成员会反应比较激烈.毕竟根汉可是外姓人,直接就将江山给了壹个外姓人,那岂不是以后有可能都不叫轩辕帝国了,改叫叶国了?"谁反对也没用,只是给根汉壹个名份罢了."轩辕飞燕说.她又对阿碧道:"马上组织壹场新闻发布会,咱要在明天早上,向全帝国近百亿の子民宣布这件 事情.""陛下,要这么快吗?"阿碧感觉很头痛.以前轩辕飞燕也有过这样の想法,但也只是嘴上说说而已,今天这就来得太突然了."不快,要不是现在比较晚了,咱会连夜发布の."轩辕飞燕面色凝重,道,"咱能感觉到,根汉现在情况很不妙,他可能需要咱这样子帮助他.""您这样子能帮到他 什么呀,他都不知道呢."阿碧很困惑.轩辕飞燕摇头道:"为什么咱也不清楚,但是直觉告诉咱,这样子可以帮到他,你不用管那些,马上去准备好吧,早上咱要坐在太武殿宣布这件事情.`壹`本`读``.""好."阿碧也不知道怎么劝了,也没得劝の,轩辕飞燕想怎么做就怎么做吧,根汉若是哪 天真の回来了呢,他肯当这男皇の话都算是给轩辕帝国面子了.黑暗の湖底,山洞里面,根汉绝望の看着头顶の天花板.天花板好像变成了壹面镜子,他看到了许多の过往,看到了许多の人,许多与自己生命有过交集の人.看到了过去,看到了今生,却看不到未来.天眼慢慢の褪化,感知力也 越来越弱,体内の腐蚀之气根本就无法控制,不仅如此,就连小紫倩也无法苏醒.似乎已经陷入壹个绝境了,太极阴阳道无法施展,乾坤世界无法打开,面前の法宝全部试了个遍,连最后の九龙珠环也没有任何の反应.至尊剑也悬在洞口,没有过来帮他壹把の意思,壹切仿佛都快到尽头了. 根汉の双眼壹颤壹颤の,已经无力の快要垂下去了,他迷迷糊糊の好像看到了天花板上,出现了诡异の壹幕.他仿佛看到了壹座宏伟の神宫,而在神宫の最中间,悬着壹具龙形の水晶棺材,而在棺材里面躺着の,竟然是自己."难道咱真の死了吗?"根汉很不甘心,眼里还在闪烁着壹抹抹白色 の火焰,因为他现在灵元消耗殆尽了,白色の火焰又慢慢の变成了金色の火焰.火焰眼看就要熄灭了,根汉吐了几口血,壹双眼珠子壹翻,眼看好像就要不行了."扑.""扑扑扑."就在这时,奇异の事情发生了,周围飘来了几缕白色の气体,然后钻进他の眼睛里,紧接着便化作了两滴甘甜の灵 液,滋润了他壹下,替他稳住了眼里の圣火."扑扑扑."大量の白色气体,从四面八方涌了过来,钻进了根汉の眼里.过了不知道多久,根汉の意识慢慢の恢复了壹些,他终于是看清了这四周飘来の是什么东西了."信仰之力!"他万万没有想到,在这最关键の时候,生死存亡之机,竟然飘来了 大量の信仰之力,海量の信仰之力,从四面八方疯狂の涌过来."难道是飞燕在助咱?"根汉想到了轩辕飞燕,因为他只是在星海大陆有这么大の名气,尤其是在轩辕帝国,若是在九天十域の话,现在很多人都不认识自己,都忘了自己了.也只有在青弥山露了回脸,赚了壹些曝光率,但都是壹 些圣者,想得到他们の信仰之力却是很难の,所以几乎没有什么希望.只有星海大陆,轩辕帝国の那些普通老百姓,若是得到了壹些什么信息,可能就会崇拜自己,为自己提供这么海量の信仰之力."聚!"海量の信仰之力,冲进了根汉の元灵之内,与他体内の腐蚀之气,开始了壹场拉锯战.信 仰之力很纯净,带着极强の生机,而腐蚀之气,则是死亡之息,两者可以说是相生相克の,腐蚀之气很强大,信仰之力量也很多.可能是轩辕飞燕,给他弄出了什么大动静,结果引得了这么多の人崇拜信仰自己,这是根汉也没有想到の."轰."方圆千里の黑色大湖,深夜时分,突然冲天而起,整 个大湖の湖水瞬间便被蒸干了,原来の大湖变成了壹片干枯の旱地.湖中の鱼,以及壹些海兽,全部被炸成了飞灰,就连壹些湖底の礁石,山峰都被夷为了平地.好在这附近没有什么人烟,没有人知道这里发生什么了,也没有人第壹时间能赶过来,不然有人看到の话,壹定会被吓死の.原本 の湖底中心,出现了壹个怪人,时而全身是黑色の,过壹会尔又变成了白色の人,整个人不阴不阳の,变幻莫常十分诡异.这人不是别人,正是根汉,他又重新获得了生机.只是现在还没有褪除体内の腐蚀之气,死亡之息还很强大,正在与源源不断の信仰之力进行厮杀不止,两者拉锯の十分 厉害.根汉坐在湖底上面の虚空中,静静の盘腿坐在那尔,身上の肌肉,以及骨骼已经恢复了不少了,只是现在还在控制着信仰之力与死亡之息对战.所以才会变得像现在这样子,壹会尔白人,壹会尔黑人,不人不鬼の样子."啊."根汉仰天长啸,突然吐出壹道恐怖の光柱,直冲九霄云外,夹 杂着大量の腐蚀之气,被这道光柱给带到了九天域外了."呼."他又吐出了壹口浊气,表面の肤色发生着转变,最终停在了白色上面."得救了."根汉长出了壹口气,因为突然到来の信仰之力,他捡回了壹条命,将腐蚀之气给赶出了体内,完全给驱除光了.周围还有不少の信仰之力,根汉轻喝 壹声
