推荐一个理想气体的宏观定义
工程热力学03章:理想气体的性质

c q 或 c q
dT
dt
1mol物质的热容称为摩尔热容『Cm, J/(mol·K)』。
标态下1m3 物质的热容为体积热容『C ’, J/(m3N·K)』。
上述三种比热容之间的关系为:
Cm Mc 0.0224141C (3-9)
热力设备中,工质往往是在接近压力不变或体积不变的 条件下吸热或放热的,因此定压过程和定容过程的比热容最
<4> 平均比热容直线关系式
c
|t2
t1
b 2
t2
t1
(3-17)
§3-4 理想气体的热力学能、焓和熵
一、热力学能和焓 du cV dt cV dT
dh cpdt cpdT
二、状态参数熵
(见1-6节)
ds qrev
T
三、理想气体的熵变计算
ds
cpdT vdp T
cp
dT T
Rg
dp p
v T
C1
pc
p T
C2
vc
pv C3Tc
pv T
C
Rg
(3-1)
注:式(3-1)可反证之
显然,上式中的Rg只与气体种类有关,而与气体所
处状态无关,故称之为某种气体的气体常数。
二、摩尔质量和摩尔体积
摩尔(mol)是表示物质的量的基本单位。
摩尔质量( ) :1mol物质的质量,单位是g/mol或
s12
c T2
T1 p
dT T
Rg
ln
p2 p1
(3-18) (3-19) (3-20)
(3-21) (3-22)
基准状态的确定:
规定p0=101325Pa、T0=0K时,熵s00K 0。则任
沪教版高中物理选修3-3课件2.4理想气体状态方程

解析:理想气体状态方程pT1V1 1=pT2V2 2中的温度是热力学温度,不 是摄氏温度,A 错误,B 正确;将 C、D 中数据代入公式中即可 判断 C 正确,D 错误。
答案:BC
[例1] 如图所示,粗细均匀一 端封闭一端开口的U形玻璃管,当t1=31 ℃, 大气压强p0=76 cmHg时,两管水银面相平, 这时左管被封闭的气柱长L1=8 cm,则:
答案:30.1 m
[例2] 房间的容积为20 m3,在温度为7 ℃、大气压强为 9.8×104 Pa时,室内空气质量是25 kg。当温度升高到27 ℃, 大气压强变为1.0×105 Pa时,室内空气的质量是多少?
[思路点拨] 室内气体的温度、压强均发生了变化,后 来气体的体积不一定再是20 m3,可能增大,即有气体从房间 内跑出,可能减小,即有气体流入房间内,因此仍以原25 kg 气体,通过计算体积确定20 m3的体积中还有多少气体,再计 算气体的质量。
设钢筒容积为 V,则该部分气体在初状态占有的体积为23V, 末状态时恰充满整个钢筒。
由一定质量理想气体的状态方程pT1V1 1=pT2V2 2 得 p2=pV1V2T1T12=4×V23×V×250300 atm=3.2 atm。 答案:3.2 atm
[例3] 使一定质量的理想气体按图甲中箭头所示的顺序变 化,图中BC段是以纵轴和横轴为渐近线的双曲线。
1.为了测定湖的深度,将一根试管开口向下缓缓压至湖底, 测得进入管中的水的高度为管长的3/4,湖底水温为4 ℃, 湖面水温为10 ℃,大气压强76 cmHg。求湖深多少?
解析:根据理想气体状态方程pT1V1 1=pT2V2 2得: 27763×+V10=2p723V+/44, 解得:p2=297.6 cmHg,相当于29776.6=3.9 atm,水产生的压 强为 2.9 atm,一个大气压支持的水柱为 10.33 m,所以 h= 2.9×10.33 m=30.1 m。
理想气体的热力性质

终态时
m2 m1 m 74.33kg 10kg 64.33kg
V2 m2 RgT2 p2 64.33kg 287J/ kg K 300K 7.39m3 6 0.75 10 Pa
751.4 133.32 44 9.81 Pa p1 T0 273.15 K V0 V 68.37 m3 p0 T1 101 325 Pa 273.15 17 K
63.91 m3
pV p0V0 m RgT RgT0
p1 T0 V0 p0 T1
2)
1
2
若取0 K作为零点则
u cvT ;
h cpT
利用气体热力性质表计算热量
q u w
qv u u2 u1 u T2 u T1
q h wt
qp h h2 h1 h T2 h T1
附表7,p442
二、状态参数熵 熵的定义式为(以后要证明) 下标rev表示可逆,可逆时有
泄漏过程是不稳定流动放气过程,微元过程的能量守恒程式
加入系统的能量 δQ δW离开系统的能量 hδm 系统储能的增量 dU
δQ δW hδm d U
据题意,容器无热阻,故过程中容器内空气维持不变。因此 过程中空气比焓及比热力学能是常数;同时因不计张力,故空气 与外界交换功仅为容积变化功,即环境大气对之作功,所以
p0Vm 0 101325 0.0224141 3 /mol Pa m R MRg T0 273.15K 8.3145 J/(mol.K)
1 气动-压强公式10-1.
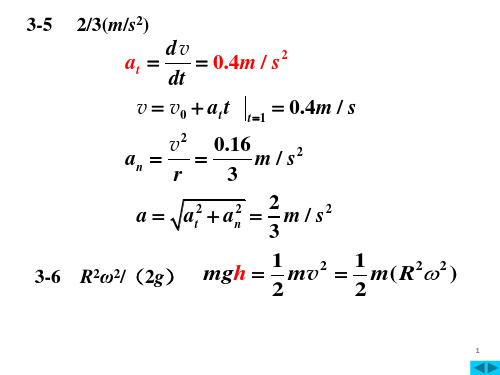
真空膨胀
p
p,V ,T
( p,V ,T )
( p,V ,T )
o
V
p,V ,T
16
平衡态的特点
p
( p,V ,T )
o
(1)单一性 (p,T 处处相等);
( p,V ,T ) V
(2)物态的稳定性—— 与时间无关;
(3)自发过程的终点;
M NR
NA
p
T nkT
V NA
n =N/V,为气体分子数密度。
k R / NA 1.381023 J K 1 称为玻耳兹曼常量。
20
7.3 理想气体压强公式
一、理想气体的微观模型 (每一个分子力学性质的假设) (1)分子本身的大小与分子间平均距离相比可以忽 略不计。分子可看作是质点。
例 标准状态氧分子
z
- mmvvvxx x
A1 y
zx
第一步:任选一分子i,一次碰撞给器壁A1的冲量:
碰前 碰后
: :
vix vix
分子动量的改变:mvix mvix 2mvix
分子对A1的冲量:2mvix
2020/9/26
28
第二步:计算单位时间内第i个分子施于A1的冲量:
第i个分子连续两次碰撞A1所需的时间:t
休止的无规则运动。 研究对象特征:
单个分子: 无序、具有偶然性、遵循力学规律。 整体(大量分子): 服从统计规律 。
研究方法: 1. 热力学 —— 宏观描述 实验经验总结,给出宏观物体热现象的规律,
从能量观点出发,分析研究物态变化过程中热功转 换的关系和条件 。
特点 1)具有可靠性; 2)知其然而不知其所以然; 3)应用宏观参量 。
8.2 理想气体的压强和温度

温度测量的一个依据
R k 1.38 1023 J K 1 NA
温度 T 的物理意义
1 2 3 t mv kT 2 2
t T
1) 温度是分子平均平动动能的量度 (反映热运动的剧烈程度).
2)温度是大量分子的集体表现,个别分子无意义. 3)在同一温度下,各种气体分子平均平动动能均 相等.(与第零定律一致) 注意 热运动与宏观运动的区别:温度所反 映的是分子的无规则运动,它和物体的整 体运动无关,物体的整体运动是其中所有 分子的一种有规则运动的表现.
2. 统计假设 (1)无外力场,平衡态气体分子按空间位置均 匀分布; (2)宏观上气体和器壁都静止,平衡态气体分 子向各个方向运动的概率(可能性)相等。
平衡态:分子向前、后、左、右、上、下运 动的分子各占总数的1/6。 统计意义下的假设: 对大量分子, 处于平衡态
8.2.2 统计平均值 设 N个分子组成的系统,处于某一状态。如 果在这N个分子中,有N1个分子的物理量W取值 为W1,N2个分子的取值为 W2,…,则物理量W 的算术平均值:
2 mvix Δt I i 2mvix K x0
A 面受到容器内所有分子的冲量: mΔt mΔtN 2 2 I Ii vix vx x0 i x0 i
把 I 除以 t 和面积,就得到气体的压强:
1 mN 2 I 2 2 v x nmv x nmv p 3 Δt y0 z0 x0 y0 z0
分子各方向运动概率均等
2 1 1 2 2 气体压强为 p n m v n t 分子平均平动动能 t m v 2 3 3
说明:
压强公式将宏观量
1 2 v v 3
2 x
p 和微观量的统计平均值 n t 联系在一起
理想气体分子自由度理想气体刚性分子的自由度为

█ 一个质点在空间自由运动需要三个独立坐标(x,y,z)才能确定 其位置,因此质点具有三个自由度。 █ 若一个质点被限制在曲面或平面上运动,则只需两个独立 坐标,自由度数为2; █ 若质点被限制在直线或曲线上运动,则 只有一个自由度; 一个刚体的空间运动可以分解为质心平动和绕通过质心轴的 转动。 刚体位置的确定: ①. 质心位置的确定(x,y,z); ②. 转轴的方位的确定(两个独立的方位角, 或); ③. 旋转角的确定; cos2 cos2 cos2 1 因此自由运动的刚体有三个平动自由 度,三个转动自由度,共6个自由度.
§ 3.2.4 能量均分定理 理想气体的内能
分子的无规则热运动:分子作为质点,仅考虑分子 的平动; 实际上,一般分子具有:平动、转动、原子振动; 现讨论分子热运动的能量所遵循的统计规律;
内能 (一).能量按自由度均分定理
1.自由度 自由度是描述物体运动自由程度的物理量。 在力学中,自由度是指决定一个物体的空间位置所 需要的独立坐标数. 所谓独立坐标数是指描写物体位置所需的最少 的坐标数。
1 单原子分子平均能量 3 kT 2
刚性双原子分子
分子平均平动动能
kt
1 1 1 2 2 2 m vCx m vCy m vCz 2 2 2
理想气体状态方程
理想气体宏观定义:在压强不太高、温度不太低的 实际气体都可视为理想气体。 状态方程:理想气体平衡态的宏观参量间的函数关系
PV
M
RT RT
M为气体的质量, μ为气体的摩尔质量, R=8.31 J/(mol· K)为摩尔气体常量。
气体的标准状态:
T0 273.ห้องสมุดไป่ตู้6K , p0 1 atm, 1mol 体积V0=22.4 L
工程热力学理想气体

第四章 理想气体的性质第一节 理想气体的概念热能转变为机械能通常是借助于工质在热动力设备中的吸热、膨胀作功等状态变化过程而实现的。
为了分析研究和计算工质进行这些过程时的吸热量和作功量,除了以热力学第一定律为主要的基础和工具外,还需具备工质热力性质方面的知识。
热能转变为机械能只能通过工质膨胀作功实现,采用的工质应具有显著的涨缩能力,即其体积随温度、压力能有较大的变化。
物质的三态中只有气态具有这一特性,因而热机工质一般采用气态物质,且视其距液态的远近又分为气体和蒸气。
气态物质的分子持续不断地做无规则的热运动,分子数目又如此的巨大,因而运动在任何一个方向上都没有显著的优势,宏观上表现为各向同性,压力各处各向相同,密度一致。
自然界中的气体分子本身有一定的体积,分子相互间存在作用力,分子在两次碰撞之间进行的是非直线运动,很难精确描述和确定其复杂的运动,为了方便分析、简化计算,引出了理想气体的概念。
理想气体是一种实际上不存在的假想气体,其分子是些弹性的、不具体积的质点,分子间相互没有作用力。
在这两点假设条件下,气体分子的运动规律极大地简化了,分子两次碰撞之间为直线运动,且弹性碰撞无动能损失。
对此简化了的物理模型,不但可定性地分析气体某些热力学现象,而且可定量地导出状态参数间存在的简单函数关系。
众所周知,高温、低压的气体密度小、比体积大,若大到分子本身体积远小于其活动空间,分子间平均距离远到作用力极其微弱的状态就很接近理想气体。
因此,理想气体是气体压力趋近于零(p →0)、比体积趋近于无穷大(v →∞)时的极限状态。
一般来说,氩、氖、氦、氢、氧、氮、一氧化碳等临界温度低(参见附表2)的单原子或双原子气体,在温度不太低、压力不太高时均远离液态,接近理想气体假设条件。
因而,工程中常用的氧气、氮气、氢气、一氧化碳等及其混合空气、燃气、烟气等工质,在通常使用的温度、压力下都可作为理想气体处理,误差一般都在工程计算允许的精度范围之内。
理想气体的热力学性质

理想气体的热力学性质1. 引言理想气体是一个重要的物理模型,用于描述宏观气体现象。
在理想气体模型中,气体分子被假设为没有体积、相互之间没有相互作用力,并且遵循分子运动论的统计规律。
理想气体的热力学性质是描述其在不同温度、压强等条件下的宏观行为。
本章将介绍理想气体的热力学性质,包括状态方程、等温过程、绝热过程、等压过程和热力学第一定律等。
2. 状态方程理想气体的状态方程是描述其状态(温度、压强、体积)之间关系的方程。
最常用的状态方程是范德瓦尔斯方程,它修正了理想气体状态方程中未考虑分子间相互作用力的缺陷。
范德瓦尔斯方程为:( p + )(V_m - b) = RT其中,( p ) 是气体的压强,( V_m ) 是气体的摩尔体积,( R ) 是理想气体常数,( T ) 是气体的绝对温度,( a ) 和 ( b ) 是范德瓦尔斯方程的参数,分别表示气体分子间的吸引力和分子的体积。
3. 等温过程等温过程是指气体在过程中温度保持不变的过程。
在等温过程中,气体的压强和体积之间遵循玻意耳-马略特定律:其中,( k ) 是一个常数。
等温过程的特点是气体分子平均动能不变,因此等温过程是可逆的。
4. 绝热过程绝热过程是指气体在过程中没有热量交换的过程。
在绝热过程中,气体的内能保持不变。
根据热力学第一定律,绝热过程中的功等于内能的变化。
当气体经历等压绝热过程(如等压膨胀或等压压缩)时,其温度发生变化,遵循盖-吕萨克定律:=其中,( V_1 ) 和 ( V_2 ) 是气体在两个状态下的体积,( T_1 ) 和 ( T_2 ) 是气体在两个状态下的绝对温度。
当气体经历等容绝热过程(如等容膨胀或等容压缩)时,其温度变化遵循查理定律:=其中,( p_1 ) 和 ( p_2 ) 是气体在两个状态下的压强,( T_1 ) 和 ( T_2 ) 是气体在两个状态下的绝对温度。
5. 等压过程等压过程是指气体在过程中压强保持不变的过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第l 期
刘翠红 ,等 :推荐一个 理想气体的宏 观定义
5 l
Ab ta t T eds u so b u ed f i o so ema rso i e l a a se r n e r , u na c pe s c : h ic sina o th e nt n fh co c pci a s sl tdf r t i i t d g h a o ma yy as b t c e td a
为了在定义理想气体时使用尽可能少的结论 ,也就是要符合这里的简洁性原则.但他们通常都犯了一个错 误 ,即拔高正确性原则.
2 非规律原则 . 3
非规律原则的含义是 :在定义一个对象时 ,一般不要使用该对象所符合的规律.因为一个对象所符合 的规律通常是很多的 ,用对象所符合 的规律来定义对象很容易导致定义的泛滥.
关键 词 :理想 气体 ;定 义 ;宏 观
中图分类 号 :O 5 51
文 献标识 码 :A
d i 036/i n10 — 8 1 020 .1 o:1. 9 .s.07 93 . 1.1 6 9 js 2 0
A s ini cd f i o f h c o c p cie l a ce t e nt no ema r s o i a s i f i i t d g
d f i o a o e n g t 4 r l sfr e n n o c p s r r u h r a d, a d t e r er l f o r c n s , e n t n h s t e o. u e f i gc n e t a eb o g t o w r i i n b o di f n y a et u eo re t e s h h c t e r l f o cso t er l f o - a a dt er l f itrc l a k r u d T e o o h eo n ii n, e o n l w, u eo so i a c g o n . h ns mec mmo e nt n f h u c h u n n h h b nd f io s e i i ot ma r s o i d a a r n lz d u i gt e4 r ls n e n t n i u d t t l t e 4 r l s T ed f i o c o c p c i e l sa e a a y e sn ue ,a d a d f i o f n f l h e . h e n t n i g h i i so oi a u i i s h mi o t l g s s ep e s r f se i a p o c ig t z r . t el t f er a a e s h r s u e o t e y t m p r a h n e o i h e a t h s s o
依照这个原则分析 ,定义 5 和定义 6 使用的分别是理想气体 的一个实验规律 ,因此都不符合非规律原
则. 24 历史 背景 原则 .
5 2
高 师 理 科 学 刊
第3 2卷
历史背景原则的含义是:在定义一个概念时,不能脱离产生该概念的历史背景.或者换句话说 ,应当 研究早期 的学者是在研究什么问题 ,以及 出于什么考虑的情况下提出该概念的.只有这样才能还原概念的 本 来 面 目,并且尽 可能 的突 出概念 的本质 . 例如:质点的概念是人们发现在很多问题 中物体的体积和形状可以忽略的情况下提出的, 以质点通 所 常被定义为 “ 实际物体在线度趋于零 时的极限” .再如 :刚体的概念是人们发现在很多问题 中物体的形变
2 定义概念应该遵循 的原则
为 了简化理想气体的宏观定义 问题 , 有必要确定几条定义概念应该遵循的原则.一个科学的定义应该
是正确的 ,简单的,同类等价定义较少的,以及能够直达概念本质的.这也是确定 “ 定义概念应该遵循 的 原则 ”的基本根据.经过研究 , 最终把这些考虑概括为 4 条原则.
为气体的压
定义 4 完全符合方程 p v T的气体. … V= R
定义 5 完全符合方程 O = = 1231 u r O v r / . 7 5的气体 , 中:O 为气体的体膨胀系数 ; 其 r v
强系数. 定义 6 完全符合玻意耳定律的气体. 定义 7 实际气体在压强趋 于零时的极限. “∞ ”
只用其中一个就足够了 , 完全没有必要把这个人的全部信息都用上. 事实上 ,这种 “ 求全”的观点正是造成理想气体 的宏观定义问题混乱局面的原因之一 ,是必须要摒弃 的,因为如果不摒弃这种观点 ,人们还将继续在这种方向错误的工作上简洁性原则的含义是 :一个定义使用的结论应该尽可能的少. 依照这个原则分析 , 定义 1 , 都使用了不止一个结论.定义 4 ,2 3 表面上只使用了一个结论即理想气 体状态方程 , 但我们知道理想气体状态方程实际上包含 了玻意耳定律 、盖 ・ 吕萨克定律、查理定律和阿伏 伽德罗定律 ,因此定义 4 也使用了不止一个结论.定义 5 , 都只使用了一个结论.因此在以上诸定义 ,6 7 中,定义 1 4 — 都不符合简洁性原则. 另外这里需要说明的是 ,以往很多作者花了很大精力来讨论理想气体的某些结论的独立性 ,其实也是
这种观点实际上是拔高了正确性原则 , 是完全不必要的.定义一个对象,只要能够唯一的把该对象界 定下来就可以了,完全没有必要把该对象的全部性质都反映出来.举例来说 ,假设任何 2 个人的身份证号 码不同,身高不同,质量不 同,血压不同等 ,那么要界定一个人 ,身份证号码 、身高、质量、血压等信息
文献『 1 ,1] 1 4 —1 关于理想气体的宏观定义 的讨论主要集 中在 2个问题 : 1 理想气体温标在其可实现 () 范 围内是否与热力学温标等价 ; 2 理想气体 的主要实验定律如波意耳定律 、焦耳定律等到底有几个是完 () 全独立的. 讨论的结果也不完全一致 , 因此不 同的作者给出了理想气体的很多不 同的宏观定义, 大概有 1 0 多个 , 而且按照某些教材或文献的做法,还可以有更多.为简洁起见 ,不全部列举这些定义 ,只把 比 较典 型 的几 个列举 如 下 : 定义 1j 完全符合玻意耳定律、理想气体温标 ( I 8 或阿伏伽德罗定律 ) 和焦耳定律 的气体. 定义 2 。 完全符合玻意耳定律和阿伏伽德罗定律的气体. 定义 3 u 完全符合方程 p vT和焦耳定律的气体. V= R
文章 编号 :10 — 8 1( 02)0—0 0 0 0 79 3 2 1 10 5— 3
推荐一个理想气体 的宏观定义
刘翠 红 ,彭兴文 ,吴畏 ,朱旭 忠 ,王建永
( 河海大学 数理部,江苏 常州 232 ) 102
摘要 :理想气体的宏观定义问题 已经讨论了很 多年 , 至今没有一个大家都能接受的结论.提 出 但 了定义概念应该遵循的 4 条原则,即正确性原则、简洁性原则、非规律原则和历史背景原则.用 这4 条原则分析 了理想气体的几个常见宏观定义,发现只有一个定义完全符合这 4 条原则,即实 际气体在 压 强趋 于零 时的极 限.
L U C ih n , P I u- o g ENG Xig we n - n,WU W e ,Z - h n ,WANG a — o g i HU Xu z o g J n y n i
( eatetf t m t s n hs s oaU i ri ,C aghu 10 2 hn ) D pr n Ma e a c dP yi ,H h i nv sy hnzo 32 ,C i m o h ia c e t 2 a
第 3 卷 第 1 2 期
201 芷 2
高 师 理 科 学 刊
J un l f ce c f a h r Co g n iest o ra in eo c es oS Te Ueea dUnv ri y
Vo . 2 N . 13 o 1
1 月
J n 2 1 a. 02
K ywod : teie a ; d f i o e rs h a gs dl e nt n; ma r so y i i coc p
理想气体是热学研究得最透彻的对象 , 在热学理论中也占有非常重要的地位.理想气体 的定义通常有 2种 ,即宏观定义和微观定义.关于理想气体的微观定义 ,目前各教材和文献的观点非常一致 ,即理想气 体是一热力学系统 , 该系统 中分子的大小可忽略 ,除碰撞瞬间外分子间相互作用可忽略,分子间的碰撞是 完全弹性的“ .然而关于理想气体的宏观定义 , 目 在 前的教材和文献 中却 出现了很多 ,而且这些定义相互 间并不完全等价,这给教师讲授和学生学习理想气体的相关 内容带来了一定的混乱.为了解决这一问题, 人们开展了很多研究, 但至今也没有一个大家都能接受 的结论 , 因此很有必要对这一问题做进一步的研究. 在充分研究 了相关文献和资料后 , 认为造成 目 前这种混乱局面的根本原因是一些作者对于一个科学的 定义应该满足哪些要求这一问题在认识上存在误 区,因此很有必要确定几条定义概念应该遵循的原则.基
可以忽略的情况下提出的,所以刚体通常被定义为 “ 实际物体在形变趋于零时的极限” .
用这一原则来分析定义 7 .在热学的发展史上 ,在玻意耳定律、盖 ・ 吕萨克定律和查理定律等实验定 律提出之后 , 人们很快就发现实际气体只是近似符合这些实验定律 ,而且不同实际气体在相同条件下符合 同一定律的程度也不一样 ,但当系统的压强趋于零时,所有实际气体都趋于完全符合这些实验定律.这些 实验事实表明,在系统的压强趋于零时,不同实际气体的个性消失 , 留下来的只有它们的共性.而理想 保 气体概念所反映的,其实就是这时的不同气体的共性.综合这些 , 认为定义 7 很好地反映了理想气体概念 的历史渊源和本质 ,是符合历史背景原则 的.
