最新外植体的选择与培养
外植体选择的原则

外植体选择的原则外植体选取的原则是什么?1、选择优良的种质无论是离体培养繁殖种苗,还是进行生物技术研究,培养材料的选择都要从主要的植物入手,选取性状优良的种质或特殊的基因型。
对材料的选择要有明确的目的,具有一定的代表性,以提高成功的几率,增加其实用价值。
2、选择健壮的植株选取发育正常的器官或组织,再生能力强,组培易成功。
组织培养用的材料,最好是从生长健壮的无病虫的植株上选取发育正常的器官或组织。
因为这些器官或组织代谢旺盛,再生能力强,培养后比较容易成功。
此现象可能是由于外植体内部的植物激素水平能够在接种后得以维持所致。
3、选择适宜的部位植物组织培养几乎在植物体的各个部位都获得了成功,这些部位包括茎尖、茎段、皮层及维管组织、髓细胞、表皮、块茎的储藏薄壁细胞、花瓣、根、茎、子叶、鳞茎、胚珠和花药等。
但是不同种类的植物以及同一植物的不同器官对诱导条件反应是不一致的,有的部位诱导分化率高,有的部位很难脱分化,或者再分化频率很低。
4、选择适当的时期组织培养选择材料时,要注意植物的生长季节和生长发育阶段,对大多数植物而言,应在其开始生长或生长旺季采样,此时材料内源激素含量高,容易分化,不仅成活率高,而且生长速度快,增殖率高。
若在生长末期或已进入休眠期时采样,则外植体可能对诱导反应迟钝或无反应。
花药培养应在花粉发育到单核靠边期取材,这时比较容易形成愈伤组织。
百合在春夏季采集的鳞茎、片,在不加生长素的培养基中,可自由地生长、分化;而其他季节则不能。
叶子花的腋芽培养,如果在1~2月采集,则腋芽萌发非常迟缓;而在3~8月采集,萌发的数目多,萌发速度快。
对于大多数植物而言,应在其生长季节开始时采样。
在生长末期或已进入休眠期时取样,外植体可能对诱导反应迟钝或无反应,较难成活。
5、考虑器官的生理状态和发育年龄一般认为,生理年龄小的幼嫩组织较生理年龄大的成熟衰老组织具有较高的形态发生能力。
随着组织年龄的增加,器官的再生能力逐渐减弱甚至完全失去再生能力。
外植体的选择与培养
细胞分裂素浓度较高时; 琼脂浓度低时; 温度低、光照时间长时; 气体交换不良时; 培养基中无机离子种类及比例不当时。
第三节 外植体的选择与培养
3、预防措施:
①适当控制培养基中无机营养成分; ②适当提高培养基中蔗糖和琼脂浓度; ③适当降低细胞分裂素和赤霉素浓度,增加生
长素量; ④增加自然光照,控制光照时间; ⑤降低培养温度,进行变温培养; ⑥增加容器通风,最好进行CO2施肥。
第三节 外植体的选择与培养
表面灭菌剂的种类较多,可选取1—2种使用。
常用灭菌剂使用浓度及效果比较表
灭菌剂 次氯酸钙 次氯酸钠
氯化汞 抗菌素
使用浓度(%)
9~10 2
0.1~1 4~50mg/L
持续时间 (min)
5~30 5~30 2~10 30~60
去除的难易
易 易 较难 中
效果
很好 很好 最好 较好
第1章 植物组织培养实验室 构建及操作技术
第三节 外植体的选择与培养
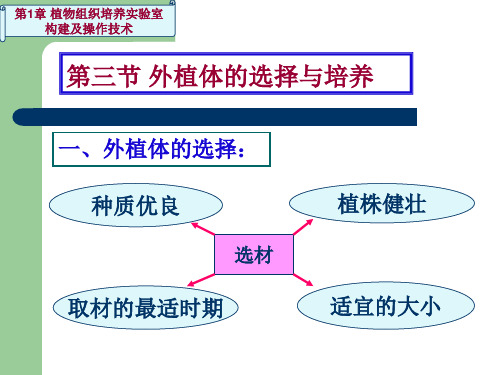
一、外植体的选择: 种质优良
选材
取材的最适时期
植株健壮 适宜的大小
第三节 外植体的选择与培养
二、外植体灭菌
1:对材料进行预处理 2:材料表面灭菌: 1)水洗,滤纸吸干; 2)70%酒精浸30~60s; 3)用灭菌剂处理; 4)用无菌水冲洗.
小麦试管苗
第四节、试管苗驯化与移栽
二、炼苗(驯化)
驯化的目的: 通过减肥、增光、降温、控水等措施,提高
试管苗对外界环境条件的适应性,提高光合 作用的能力,提高试管苗的移栽成活率。
第四节、试管苗驯化与移栽
三、试管苗的移栽
(一)移栽方法: 1、直接移栽法 2、常规移栽法 3、嫁接移栽法
植物组织培养:第4章 外植体的选择、灭菌及培养

一 常用的灭菌方法 物理方法
化学方法
湿热灭菌(常压或高压蒸煮) 干热灭菌(烘烧和灼烧) 射线处理(紫外线、超声波、微波) 过滤除菌 大量无菌水冲洗
注意:完全排除锅内空气,使锅内全部是水蒸气, 灭菌才能彻底。
在使用高压蒸汽灭菌锅灭菌时,灭菌锅内冷 空气的排除是否完全极为重要,因为空气的膨胀 压大于水蒸汽的膨胀压,所以,当水蒸汽中含有 空气时,在同一压力下,含空气蒸汽的温度低于 饱和蒸汽的温度。
高压灭菌放气有几种不同的做法,但目的 都是要排净空气,使锅内均匀升温,保证灭菌 彻底。常用方法是:关闭放气阀,通电后,待 压力上升到0.05MPa时,打开放气阀,放出空 气,待压力表指针归零后,再关闭放气阀。关 阀再通电后,压力表上升达到0.1MPa时或压力 为0.1-0.15MPa,15-20min。
因此,植物材料必须经严格的表面灭菌处理, 再经无菌操作接到培养基上,这一过程叫做接种。
第一步:自来水冲洗
将采来的植物材料除去不用的部分,将需要的部分仔 细洗干净,如用适当的刷子等刷洗。把材料切割成适当大 小,即灭菌容器能放入为宜。
置自来水龙头下流水冲洗几分钟至数小时,易漂浮或 细小的材料,可装入纱布袋内冲洗。流水冲洗在污染严重 时特别有用。洗时可加入洗衣粉清洗,然后再用自来水冲 净洗衣粉水。洗衣粉可除去轻度附着在植物表面的污物, 除去脂质性的物质,便于灭菌液的直接接触。
(3)配制培养基时应注意成分的适当分组与加入的顺序。 如将磷、钙和铁放在最后加入。
(4)注意高压灭菌后培养基pH值的变化及回复动态。如 高压灭菌后的pH值常由5.80升高至6.48。而96h后又 回降至5.8左右。这样在实验中就可以根据这一规律 加以掌握。
最新组培实验外植体选择处理及接种培养知识讲解

• 2.污染的预防措施
• 发现污染的材料应及时处理,否则将导致培养室环境污染。 对一些特别宝贵的材料,可以取出再次进行更为严格的灭 菌,然后接入新鲜的培养基中重新培养。要处理的污染培 养瓶最好在打开瓶盖前,先集中进行高压灭菌,再清除污 染物,然后洗净备用。现就根据污染途径,阐述污染的几 种预防措施。
常规的表面灭菌处理方法 ①把材料放进75%的酒精中约30~ 60s。 ②用2.5%的CaCl0(次氯酸钙)溶液浸泡15~20min。 ③无菌蒸馏水冲洗3~5次。 ④灭菌时进行摇动,使植物材料与灭菌剂有良好的接触。 ⑤在灭菌剂里滴入数滴0.1%的Tween20(吐温)或Tween80湿润 剂,能增强灭菌效果。
尔敏或75%的酒精擦洗,然后用紫外灯照射约20min。使 用前用75%的酒精喷雾,使空间灰尘落下。一年中要定 期一、二次用甲醛和高锰酸钾熏蒸。 • (7)操作人员在接种时一定要严格按照无菌操作的程 序进行
二、外植体的接种和培养 (一)外植体的接种 (二)外植体的培养
(一)外植体的接种
外植体的接种——是把经过表面消毒后的植物材料切碎 或分离出器官、组织、细胞,并将它们转放到无菌培养 基上的全部操作过程。整个接种过程均须无菌操作。操 作过程中引起的污染,主要由空气中的细菌和工作人员 本身引起的。因此除接种室空气消毒外,应特别注意防 止工作人员本身引起的污染。
常用灭菌药剂的使用和效果
灭菌剂
次氯酸钠 次氯酸钙 漂白粉 氯化汞 酒精 过氧化氢 溴水 硝酸银 抗菌素
使用浓度(%)
2—3 2
饱和浓度 0.1—1 70—75 10—12 1—2
植物组织培养-外植体的选择与建立
第三节 外植体(培养物)的建立
污染(Infection) 能否有效地控制微生物污染是植物离体培养是否成功的关键技术之一。对于离体培养的 探索性研究实验,污染会导致实验失败;对于大规模的离体繁殖生产来说,污染使生产 成本大大增加。因此,无论是科研机构还是生产厂家都十分重视微生物污染问题。 植物离体培养中的污染可分为外植体、培养基、无菌操作和培养环境四个方面。其中培 养基和无菌操作方面的污染,目前已得到十分有效的控制。外植体方面污染最复杂,也 最难控制,其可能是细菌引起的,也可能是真菌引起的;微生物可能是附生性的,也可 能是内生性的。近年来,国外较重视各种微生物的鉴定,并根据不同的微生物种类采取 相应的控制措施,这方面的研究进展较快。
(3)、污染估算及对策:
污染估算:首次接种通常污染率 40—60% 按40%计:接种100个材料 1个材料/容器:
污染量=100X40%=40 获得量=100-40=60。 2个材料/容器: 2污染:1X40%X40%=16% 1污染:2X40%X40%=32% 2未污染:60%X60%=36% 弃掉 污染率=100-36=62% 污染量=100X62%=62
添加标题
不具原基结构的外植体:根、茎、 叶、花、果等器官,需要脱分化。
第二节 外植体 (培养物)的 选择
第二节 外植体(培养物)的选择
第二节 外植体(培养物)的 选择
第二节 外 植体(培养 物)的选择
第二节 外植体(培 养物)的选择
4、根据外植体的大小选择: 外植体大小 外植体建立 外植体大小与外植体建立
第三节 外植体(培养物)的建立
第三节 外植体(培养物)的建立
三. 褐化发生的可能因素: 与组培植物品种有关: 不同的植物种与品种之间常有很大差异,有人把此归结为基因型的
4 外植体的选择和灭菌

吐温的使用:0.1%,表面活性剂, 吐温的使用:0.1%,表面活性剂,浸润作用 无菌水: 无菌水:在用灭菌剂之前和之后均需用无菌水冲 洗数遍. 洗数遍.
8
二,外植体的灭菌方法
具体的灭菌方法和步骤: 具体的灭菌方法和步骤:依不同的材料而不同
P61:图4-1 P61: 植物外植体消毒的一般程序
9
第三节 外植体的接种和培养
二,外植体的接种
擦—冲—开—灭—切— 冲 开 灭 切 烧—取—烧—夹—放—烧—包 取 烧 夹 放 烧 包
10
三,培养条件
温度:25±2℃; 温度:25±2℃; 光照:包括光照,光质和光周期; 光照:包括光照,光质和光周期; 培养基的pH:5.6-6.0;但若培养基中含有铁 培养基的pH:5.6-6.0;但若培养基中含有铁 pH:5.6 离子, pH应在5.2以下 应在5.2以下. 离子, pH应在5.2以下. 湿度:培养容器的湿度常保持在100%; 湿度:培养容器的湿度常保持在100%; 培养 室的湿度70 70室的湿度70-80%. 气体: 气体:氧;二氧化碳;乙烯等. 二氧化碳;乙烯等.
2
Байду номын сангаас
外植体种类
带芽外植体 胚 分化器官, 分化器官,组织 花粉, 花粉,雌配子体中的单倍体细胞
3
外植体的部位选择
原则上可用植物的任何部位; 原则上可用植物的任何部位 但不同种类植物及同 一植物的不同部位对诱导条件反应不同; 一植物的不同部位对诱导条件反应不同 选择优良种 质,增殖能力强的外植体 外植体应容易得到 应考虑得到无毒苗 注意:外植体的幼化程度,年龄 与着生部位. 注意:外植体的幼化程度, 与着生部位. 易形成花器官. 植物主轴 向上的部分 生理年龄老 易形成花器官 向基部的部分 生理年龄小 易形成根等器官. 易形成根等器官 幼年组织较老年组织具有较高的形态发生能力
组培苗生产技术—外植体的选择、处理与接种(植物组织培养课件)

3、蔬菜(龙牙百合) 龙牙百合特征:鳞茎,无皮,广卵形,外部鳞片长,将整个鳞茎 包裹,直径5~15厘米,白色,茎高90厘米左右,直立茎上叶 多而散生,披针形,叶色从浓绿,光滑。花单生茎顶。花朵 呈喇叭状长筒形,白色,有清香。
不能损伤组织材料,保持外植体的生活力,使外 植体在良好的培养条件下很快恢复生机,正常 生长和繁殖.
• 消毒剂的要求 • 要求:具有良好的消毒作用,既不会杀死植物的
组织细胞,又易被无菌水冲洗掉,不影响消毒后 外植体的生长和分化.
常用灭菌药剂的使用和效果
灭菌剂 使用浓度(%) 清除的难易 消毒时间 效 果
2、茎段(采用嫩茎的切段促进腋芽萌发,取材容易) 3、叶(幼嫩叶片组织通过愈伤组织或不定芽分化产生植株,
取材容易,操作方便,但易发生变异); 4、花球和花蕾 5、种子、根、块根、块茎、花瓣等。
(二)实例分析 1、花卉(非洲菊) • 常用茎尖、嫩叶、花托进行非洲菊的组织培养,也有利用
种子进行组织培养的。 • 茎尖培养操作麻烦,但对于脱毒苗的生产是最有效的。 • 花托培养可直接成苗, 既可保持种性,又易行、 耗时短,是首选的外植体。
• 首先要选择花大、花色艳丽、市场流行的品种,然后再选 择无病虫害、植株生长健壮、花色纯正的优良品种单株进 行取材。
• 一旦选出优株后,应进行挂牌标记,并一直在其上采取花 蕾。作为外植体的花蕾要选取直径在1㎝左右,而且未露 心的小花蕾,太大或是太小的花蕾均不能获得满意的效果 。
2、水果(草莓)
(1)选择结果性优良的草莓母株上新抽出的匍匐茎作外植体,以每年6~7 月份最为适宜。
龙牙百合的许多器官、组织都可作为外植体, 如鳞片、花梗、叶片、茎尖、腋芽、花瓣、花托 、花丝、花药、胚、子房、根尖等,其中采用鳞 片作外植体的较多。
植物组织培养外植体的选择与建立PPT.

优选植物组织培养外植体 的选择与建立Ppt
第二节 外植体(培养物)的选择
根据细胞全能性学说,植物体的每一个细胞 都含有全部的遗传信息,都能再生出一个 新植株。但是,要使每个细胞的全能性都 表现出来,在目前还是不易做到的事。因 而,外植体(初始培养物)的选择非常重 要。
这些要求都有协商的余地。例如,如你认为应聘者要求更高的工资而放弃小汽车可以接受的话,最后的结果是公司和新雇员都会从中 受益。 有人指挥要听从,不可擅自行动。没人指挥也不能乱跑,以免你推我踩,造成伤亡。赶快钻到排椅下面,闭眼趴下。
时间或季节
第二节 外植体(培养物)的选择
4、根据母株位置选择:
具原基结构的外植体:茎尖、 侧芽、原球茎、鳞芽、分生 组织
第三节 外植体(培养物)的建立
(1)、产生污染的因素: ①外植体:通常多年生的木本材料比一二年生的草本材料带菌多;
老的材料比幼嫩的带菌多;田间生长的材料比温室的带菌多; 带泥土的材料比清洁的带菌多。一年中以雨季的材料带菌多, 一天中以中午阳光最强时的材料带菌少。 ②培养基:高压蒸汽灭菌的温度、压力、时间和正确使用情况, 以及过滤灭菌中过滤膜孔径、过滤灭菌器械的灭菌处理、过滤 灭菌操作等均影响培养基的灭菌效果。 ③操作环节:接种室是否清洁、干燥、密闭,是否经常用紫外线 灯照射、甲醛熏蒸、70%酒精喷雾杀菌等,操作是否等熟练。 ④培养环境:培养室要求清洁、密闭。每天用70%酒精喷雾除菌、 降尘,每周用少量甲醛熏蒸灭菌。如有空气过滤装置效果更好。 培养室相对湿度太高时,污染加重。
第二节 外植体(培养物)的选择
杜鹃花 ‘Rhodoendron’
第二节 外植体(培养物)的选择
2、根据母株的年龄和生长发育阶段选择:
