转铁蛋白测定试剂盒(免疫比浊法)产品技术要求新产业
可溶性转铁蛋白受体(sTfR)测定标准操作程序SOP文件

可溶性转铁蛋白受体(sTfR)测定标准操作程序SOP文件1 测定方法颗粒增强的免疫比浊法。
2 测定原理标本中的可溶性转铁蛋白受体(sTfR)与试剂中包被有抗sTfR抗体的胶乳颗粒相遇,发生特异性的抗原-抗体反应,形成抗原-抗体复合物,使溶液的浊度发生改变。
该浊度的高低在一定抗体存在时与抗原的含量成正比,待反应完成后测定其浊度,从而使sTfR得以测定。
3 标本血清及肝素-Li/Na抗凝血浆,处理方法见标本处理程序。
稳定性:15 - 25℃ 3天2 - 8℃ 7天-20℃ 4周(允许冻融1次)4 试剂4.1 试剂来源:ROCHE配套试剂(详见试剂说明书)。
贮存条件及稳定性:未打开试剂盒:2-8℃储存至效期末R1:打开后机上稳定90天R2:打开后机上稳定90天准备:直接使用。
4.2 校准物来源:S1: 0.9%的NaClS2-6: ROCHE配套sTfR专用校准品贮存条件:校准物在2-8℃保存至效期末。
准备: 直接使用。
定标频率:A 试剂批号更换 B 由质控结果决定4.3 质控物来源:ROCHE sTfR专用质控品其它适合的质控品贮存条件:置2-8℃冰箱至有效期。
准备:直接使用。
质控间隔时间及限制:应视不同地区及各自实验室情况而定。
质控结果应在限定的范围之内,如果超出范围,实验室应根据情况采取措施。
5 仪器ROCHE MODULAR P或日立7060生化分析仪。
6 操作见ROCHE MODULAR P生化分析仪作业指导书。
参数设置见附表。
7 参考范围男性:2.16-4.54mg/l女性:1.79-4.63mg/l8 线性范围本法线性范围为0.5-40mg/l,不准确度允许范围X±3SD,不精密度CV=3.06%,灵敏度为0.068mg/l。
9 注意事项9.1 血清标本出现溶血、脂血或黄疸的干扰情况参见抗干扰能力。
9.2 换算公式:mg/dl × 10=mg/l9.3 仅应用于体外诊断。
艾威德转铁蛋白(TRF)测定试剂盒(免疫比浊法)说明书

转铁蛋白(TRF)测定试剂盒(免疫比浊法)说明书【产品名称】转铁蛋白(TRF)测定试剂盒(免疫比浊法)【包装规格】a)试剂1:1×15mL试剂2:1×5mLb)试剂1:2×45mL试剂2:2×15mLc)试剂1:4×60mL试剂2:4×20mLd)试剂1:2×60mL试剂2:2×20mL【预期用途】用于体外定量测定人血清中转铁蛋白的含量。
转铁蛋白由肝脏合成,合成量取决于体内对铁的需求以及铁的储备。
因此,对转铁蛋白浓度的检测可提示是否铁负荷过度或铁缺乏。
转铁蛋白饱和度测定常用于筛查血色病;排除铁分布异常的铁负荷过度,例如肝病;监视对肾衰竭者使用促红细胞生成素治疗效果[1]。
测定转铁蛋白常用于铁缺乏症、怀孕、类脂肪的肾病、急性疟疾的辅助诊断。
【检验原理】样本中转铁蛋白与试剂中相应抗体(羊抗人转铁蛋白抗体)在液相中相遇,结合成抗原-抗体复合物,形成一定的浊度。
浊度的高低与样本中转铁蛋白的含量成正相关。
【主要组成成分】试剂1主要组分磷酸盐缓冲液100mmol/L 聚乙二醇6000(PEG6000)适量表面活性剂及稳定剂适量试剂2主要组分磷酸盐缓冲液100mmol/L 羊抗人转铁蛋白抗体 1.3mg/mL 表面活性剂及稳定剂适量注:不同批号试剂盒中各组分未经试验不可互换。
【储存条件及有效期】1.试剂原包装在2~8℃储存,有效期为12个月,生产日期、有效期见标签。
2.开口后的试剂在仪器仓中(2~8℃)可稳定30天。
【适用仪器】艾威德AS-420/AS-660/AS-1200;日立HITACHI7020型/7060型/7180型/7600型/LABOSPECT008AS型;贝克曼AU400/AU480/AU640/AU680/ AU2700/AU5400/AU5800/AU5811/AU5821;佳能TBA-FX8/TBA-120FR/ TBA-2000FR;罗氏cobas8000c702/cobas8000c701/cobas8000c502;西门子SIEMENS ADVIA1800/ADVIA2400;雅培ABBOTT ARCHITECT c8000/ARCHITECT c16000/ARCHITECT ci8200;西森美康SYSMEX BM6010/C;科华KHB卓越310/卓越330/卓越400/卓越450/ZY-1200/ZY-1280;迪瑞CS-240/CS-T300/CS-300B/CS-380/CS-400A/CS-400B/CS-600A/ CS-600B/CS-800A/CS-800B/CS-1200/CS-1200ISE/CS-1300B/CS-1400;迈瑞MINDRAY BS-220/BS-330/BS-350E/BS-380/BS-390/BS-400/BS-430/BS-600/ BS-800/BS-2000M;颐兰贝ES-200/ES-380/ES-480;赛诺迈德SUNMATIK-9050型;雷杜Chemray420;英诺华D280;特康TC6010L;锦瑞GS400;普康6066。
免疫球蛋白A测定试剂盒(免疫比浊法)产品技术要求xksm

免疫球蛋白A测定试剂盒(免疫比浊法)
组成:
试剂1(R1)主要成分:Tris缓冲液(pH 6.0~9.0)4mmol/L;
试剂2(R2)主要成分:抗IgA抗血清适量。
适用范围:用于体外定量检测人血清中免疫球蛋白A的浓度。
2.1 外观
外包装完整无破损,标签清晰;试剂1应为无色透明溶液;试剂2应为无色透明溶液。
2.2 净含量
应不低于试剂瓶标示装量。
2.3 试剂空白
在340nm处测定试剂空白吸光度,应≤0.20。
2.4 分析灵敏度
测定浓度为450mg/dl的样品,吸光度变化(ΔA)应不低于0.15。
2.5 线性
2.5.1在[18.0,621.0]mg/dl范围内,线性回归的相关系数应不低于0.990;
2.5.2测试浓度[50.0,621.0]mg/dl的样品,相对偏差应不超过±15%;测试浓度[18.0,50.0)mg/dl的样品,绝对偏差应不超过±7.5mg/dl。
2.6 重复性
2.6.1 批内重复性
变异系数(CV)应不超过5%。
2.6.2 批间差
对同一份样品进行重复测定,相对极差(R)应不超过10%。
2.7 准确度
回收率应在85%~115% 范围内。
2.8空白限
试剂空白限为18mg/dL。
2.9 稳定性
原包装试剂在2℃~8℃条件下有效期为18个月,取到效期后6个月内的试剂盒检测,应符合本技术要求2.1、2.3、2.4、2.5、2.6.1、2.7、2.8之规定。
免疫七项校准品产品技术要求北京万泰德瑞诊断

免疫七项校准品适用范围:本产品与本公司生化项目测定试剂盒配套使用,用于临床检验系统的校准。
本产品包含以下7个项目:免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、补体C3(C3)、补体C4(C4)、前白蛋白(PALB)、转铁蛋白(TRF)。
1.1 包装规格1.0mL×1;1.0mL×6。
1.2 组成成分校准品(冻干粉):在血清基质中,添加表1中的物质。
表1 组成及目标浓度范围批特异,具体浓度见值单。
2.1 外观冻干粉,复溶后为浅黄色或黄色液体。
2.2 水分含量水分含量应≤5%。
2.3 量值溯源按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》要求,提供校准品的来源、赋值过程及测量不确定度。
本校准品中免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、补体C3(C3)、补体C4(C4)、转铁蛋白(TRF)溯源至ERM-DA470k,前白蛋白(PALB)溯源至GBW(E) 090619。
2.4 赋值结果及其不确定度的表示方式赋值结果及其不确定度的表示方式应符合(赋值结果±扩展不确定度)。
2.5 正确度检测相应项目的参考物质,量值传递的正确度应符合≤1。
2.6 均匀性2.6.1 瓶内均匀性瓶内均匀性(变异系数)应≤10%。
2.6.2 瓶间均匀性瓶间均匀性(变异系数)应≤15%。
2.7 稳定性2.7.1 效期稳定性原包装校准品在2℃~8℃密闭避光保存,有效期为24个月,稳定期内赋值结果的变化趋势应不显著。
2.7.2 复溶稳定性2.7.2.1校准品复溶后,在15℃~25℃条件下密闭避光保存,可至少稳定3天,稳定期内赋值结果的变化趋势应不显著(P≥0.05)。
2.7.2.2 校准品复溶后,在2℃~8℃条件下密闭避光保存,可以稳定7天,稳定期内赋值结果的变化趋势应不显著(P≥0.05)。
转铁蛋白检测试剂盒(胶体金法)注册指导原则

转铁蛋白检测试剂盒(胶体金法)注册指导原则转铁蛋白检测试剂盒(胶体金法)是一种用于检测人体血液中转铁蛋白含量的试剂盒。
转铁蛋白是一种铁载体蛋白,它在人体内的主要作用是将铁从肝脏转运到骨髓中的红细胞中,以供红细胞合成血红蛋白。
转铁蛋白含量的测定可以用于诊断贫血、铁代谢障碍等疾病,也可以用于评估铁剂治疗的疗效。
转铁蛋白检测试剂盒(胶体金法)的注册指导原则如下:一、试剂盒的组成转铁蛋白检测试剂盒(胶体金法)由试剂盒、标准品、样品处理液、质控品和说明书等组成。
试剂盒应包括胶体金试剂、反应板、吸头、洗涤缓冲液、稀释液等。
二、试剂盒的性能指标转铁蛋白检测试剂盒(胶体金法)的性能指标应符合国家相关标准和规定。
其中,灵敏度、特异性、准确性、重复性和稳定性等是重要的性能指标。
三、试剂盒的使用方法转铁蛋白检测试剂盒(胶体金法)的使用方法应详细说明,包括样品的采集、处理、稀释、反应条件、结果判读等。
同时,应提供标准品和质控品的使用方法和参考值。
四、试剂盒的质量控制转铁蛋白检测试剂盒(胶体金法)的质量控制应包括质控品的制备、使用和评价。
质控品应具有稳定的性质和可重复的结果,用于检验试剂盒的准确性和重复性。
五、试剂盒的注册申请转铁蛋白检测试剂盒(胶体金法)的注册申请应符合国家相关法规和规定,包括试剂盒的组成、性能指标、使用方法、质量控制、临床试验结果等。
同时,应提供完整的说明书和标签,以便用户正确使用试剂盒。
总之,转铁蛋白检测试剂盒(胶体金法)的注册指导原则是保证试剂盒的质量和安全,提高试剂盒的准确性和可靠性,为临床诊断和治疗提供有力的支持。
免疫球蛋白(IgG、IgM、IgA)检测试剂盒(免疫比浊法)产品技术要求

医疗器械产品技术要求编号:免疫球蛋白(IgG、IgA、IgM)检测试剂盒(免疫比浊法)1.产品型号/规格及其划分说明序号规格12×200Tests2R1:2×80ml、R2:2×20ml3R1:2×60ml、R2:2×15ml4R1:2×40ml、R2:2×10ml5R1:2×50ml、R2:1×25ml6校准品(选配):1×1ml2.性能指标2.1外观试剂R1溶液应无色、无颗粒、无杂质、无沉淀和悬浮物;试剂R2溶液应呈淡黄色、无颗粒、无杂质、无沉淀和悬浮物;校准品为米白色至浅黄色冻干粉末。
2.2净含量试剂盒各试剂装量应不小于标示值。
2.3试剂空白吸光度应为≤0.4,IgA、用蒸馏水作为样品加入试剂测试,IgG试剂空白吸光度A570nm应为≤0.4。
IgM试剂空白吸光度A340nm2.4分析灵敏度测试IgG:4.85g/L、IgA:0.94g/L、IgM:0.47g/L被测物时,吸光度差值(△A)IgG应不小于0.20、IgA应不小于0.20、IgM应不小于0.05。
2.5线性范围IgG:在(0~35.0)g/L范围内,其线性相关系数r≥0.990;浓度≥5.0g/L 时,相对偏差≤20%;浓度<5.0g/L时,绝对偏差≤1.0g/L。
IgA:在(0~8.0)g/L范围内,其线性相关系数r≥0.990;浓度≥1.3g/L 时,相对偏差≤20%;浓度<1.3g/L时,绝对偏差≤0.4g/L。
IgM:在(0~4.8)g/L范围内,其线性相关系数r≥0.990;浓度≥0.4g/L时,相对偏差≤20%;浓度<0.4g/L时,绝对偏差≤0.2g/L。
2.6测量精密度2.6.1重复性用控制血清重复测试所得结果的重复性(变异系数,CV)应≤6.0%。
2.6.2批间差批间差应≤10.0%。
2.7准确度用参考物质进行测试,其相对偏差应≤20.0%。
转铁蛋白检测试剂盒(免疫比浊法)说明书

转铁蛋白检测试剂盒(免疫比浊法)说明书转铁蛋白检测试剂盒(免疫比浊法)说明书【产品名称】通用名称:转铁蛋白检测试剂盒(免疫比浊法)英文名称:TRF Kit【包装规格】R1:R2 ,1×30ml;1×10ml1×60ml;1×20ml 2×60ml;2×20ml【预期用途】转铁蛋白检测试剂盒临床上用于定量测定人体血清中转铁蛋白的含量。
转铁蛋白(TRF)连接上铁离子之后可以防止铁中毒以及通过肾的流失。
其水平的升高常见于铁缺乏症、怀孕、雌性激素的控制以及类脂肪的肾病。
其水平的降低常见于睾丸激素的控制、感染、急性的炎症、某些类型的肾炎、血色素缺失、急性的疟疾以及营养不良。
【检验原理】人体中的转铁蛋白与试剂中抗人转铁蛋白抗体在缓冲液中快速形成抗原抗体复合物,使反应液出现浊度。
当反应液中保持抗体过剩时,形成的复合物随抗原量增加而增加,反应液的浊度亦随之增加,在340nm以终点法检测吸光度变化,与校准品对照,即可计算出未知蛋白的含量。
【主要组成成分】组成主要成分R1 NaH2PO4缓冲液R2 抗人转铁蛋白抗体注意不同批号的试剂盒的组分不能混用。
校准品:用户自行购买利德曼公司的多项高值免疫标准液,标准值见说明书;质控品:用户自行购买利德曼公司多项免疫质控血清,质控值见说明书;【储存条件及有效期】1.包装试剂均应在2?,8?避光储存,可稳定至标签所示失效日期;2( 试剂有效期为12个月;3( 开瓶有效期:10天(开瓶后在2?,8?保存);【适用仪器】包装规格适用机型1×30ml;1×10ml 日立7060、1×60ml;1×20ml 日立7170、东芝-40 2×60ml;2×20ml 日立7020、奥林巴斯AU640、贝克曼CX4 【样本要求】1、标本为离心或分离除去血液凝块的新鲜血清。
2、血清样本在2~8?储存不超过一周。
中华人民共和国医疗器械注册证(体外诊断试剂)
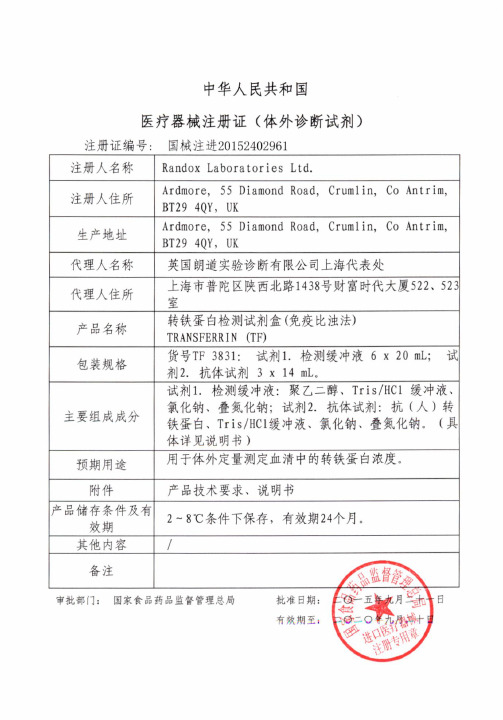
中华人民共和国
医疗器械注册证(体外诊断试剂)注册证编号: 国械注进20152402961
注册人名称Randox Laboratories Ltd.
注册人住所Ardmore, 55 Diamond Road, Crumlin, Co Antrim,BT29 4QY, UK
生产地址Ardmore, 55 Diamond Road, Crumlin, Co Antrim,BT29 4QY, UK
代理人名称 英国朗道实验诊断有限公司上海代表处
代理人住所 上海市普陀区陕西北路14 38号财富时代大厦522、52 3 室
产品名称 转铁蛋白检测试剂盒(免疫比浊法) TRANSFERRIN (TF)
包装规格 货号TF 3831: 试剂1.检测缓冲液6 x 20 mL; 试 剂2.抗体试剂3 x 14 mL。
主要组成成分 试剂1.检测缓冲液:聚乙二醇、Tris/HCl缓冲液、 氯化钠、叠氮化钠;试剂2.抗体试剂:抗(人)转
铁蛋白、Tris/HC1缓冲液、氯化钠、叠氮化钠。
(具 体详见说明书)
预期用途
用于体外定量测定血清中的转铁蛋白浓度。
附件 产品技术要求、说明书
产品储存条件及有
效期
2—8℃条件下保存,有效期24个月。
其他内容 |
备注
审批部门: 国家食品药品监督管理总局批准日期:二O-五年九月二十一日
有效期至: 二0二O午九月二十日。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.性能指标
2.1外观
a)试剂盒各组分应齐全、完整;液体无渗漏;包装标签应清晰、准确、牢固。
b)试剂瓶内的试剂应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
2.2装量
试剂装量应符合表 2 的要求。
表 2 装量要求
试剂组分数量(瓶)每瓶装量R1 3 ≥ 60 mL
R2 3 ≥ 20 mL
R1 1 ≥ 60 mL
R2 1 ≥ 20 mL 校准品 1 ≥3mL
2.3空白限
空白限≤0.05 g/L。
2.4线性区间
试剂盒线性在[0.00,4.00] g/L 区间内,应符合如下要求:
a)线性相关系数r≥0.990;
b) [0.00,1.00] g/L 区间内,线性绝对偏差在±0.10g/L 范围内;(1.00,
4.00] g/L 区间内,线性相对偏差在±10%范围内。
2.5精密度
2.5.1重复性
试剂盒测试浓度在(2.70±0.70)g/L 范围内的样本时,变异系数CV≤5.0%。
2.5.2批间差
试剂盒测试浓度在(2.70±0.70)g/L 范围内的样本时,相对极差R≤6.0%。
2.6准确度
回收率在 90%~110%范围内。
