(鲁教版)初中化学全册思维导图
初中化学各单元知识框架图

第一单元走进化学世界知识脉络图第二单元我们周围的空气知识脉络图第三单元自然界的水知识脉络图第四单元物质构成的奥秘知识脉络图第五单元化学方程式知识脉络图第六单元碳和碳的氧化物知识脉络图第七单元燃料及其利用第八单元金属和金属材料九、溶液1、金属活动性顺序:2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
四、酸、碱、盐的溶解性1、常见盐与碱的溶解性:(如果不读出括号中的字,是不是一个较好记忆的顺口溜):钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙氢氧化镁、氢氧化铜、氢氧化铁四微溶物:Ca(OH)2(石灰水注明“澄清”的原因)CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)3、三个不存在的物质:所谓的氢氧化银、碳酸铝、碳酸铁五、分解反应发生的条件反应后有气体、水或沉淀生成。
(即有不在溶液中存在或在水溶液中不易电离的物质)(1)不溶性碱只能与酸性发生中和反应(2)不溶性盐,只有碳酸盐能与酸反应(3)KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物六、溶液的酸碱性与酸碱度的测定1、指示剂---溶液的酸碱性紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝无色的酚酞试液只遇碱溶液变红注:不溶性碱与指示剂无作用碱性溶液不一定是碱的溶液(特例:碳酸钠的水溶液显碱性)2、pH值---溶液的酸碱度pH>7溶液为酸性(越小酸性越强)pH=7溶液为中性pH<7溶液为碱性(越大碱性越强)七、离子的检验Cl-(在溶液中)---在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。
初中化学各单元知识点框架图
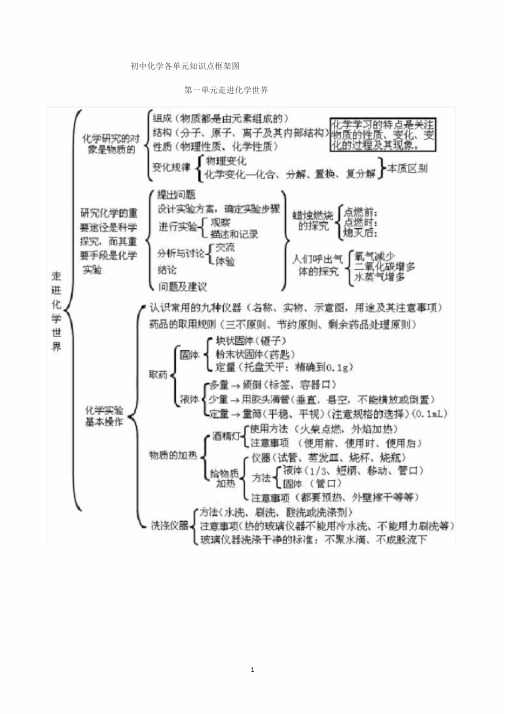
WORD格式初中化学各单元知识点框架图第一单元走进化学世界第二单元我们周围的空气第三单元自然界的水第四单元物质构成的奥秘第五单元化学方程式第六单元碳和碳的氧化物第七单元燃料及其利用第八单元金属和金属材料WORD格式第九单元溶液WORD格式第十单元酸、碱、盐(一)化学用语1电离方程式:2 H2SO2HSO;NaOHNaOH;44 Al322(SO)2Al3SO4342物质的俗称和主要成分:生石灰CaO;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH;胆矾、蓝矾CuSO4·5H2O;碳酸钠晶体Na2CO3·10H2O;氨水NH3·H2O。
(二)金属活动性1金属活动性顺序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)Cu>Hg>Ag>Pt>Au2金属活动性顺序的意义:在金属活动顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失去电子而变成离子,它的活动性就越强。
3金属活动性顺序的应用:⑴排在氢前的金属能置换出酸里的氢(元素)。
⑵排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
(三)酸、碱、盐的溶解性1常见盐与碱的溶解性钾(盐)、钠(盐)铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2八个常见的沉淀物氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁3四微溶物Ca(OH)2(石灰水注明:澄清“的原因)CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO 4(鉴别 2SO 和Cl 时,不用硝酸银的原因) 4MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4三个不存在的物质氢氧化银、碳酸铝、碳酸铁(四)复分解反应发生反应 有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质)1、不溶性碱只能与酸性发生中和反应;2、不溶性盐,只有碳酸盐能与酸反应;3、KNO 3、NaNO 3、AgNO 3、BaSO 4不能做复分解反应的反应物。
初中化学各单元知识点框架图

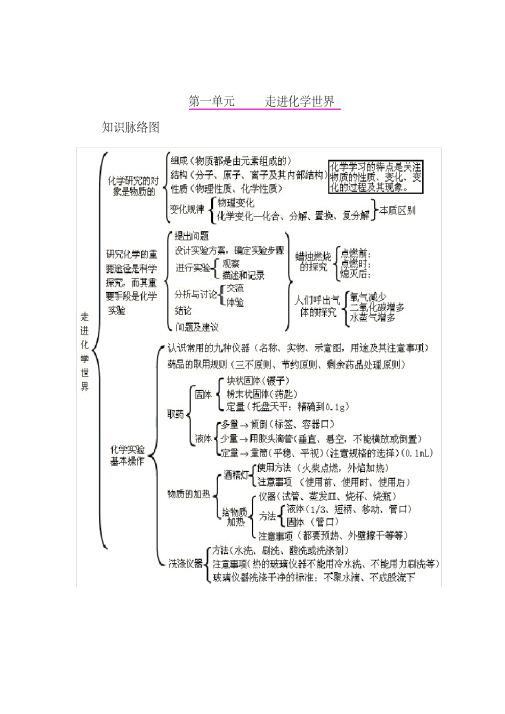
初中化学各单元知识点框架图第一单元走进化学世界第二单元我们周围的空气第三单元自然界的水第四单元物质构成的奥秘第五单元化学方程式第六单元碳和碳的氧化物第七单元燃料及其利用第八单元金属和金属材料第九单元溶液第十单元 酸、碱、盐(一)化学用语1电离方程式:-++=24422SO H SO H ;-++=OH Na NaOH ;-++=24334232)(SO Al SO Al2物质的俗称和主要成分:生石灰CaO ;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO 3;食盐的主要成分NaCl ;纯碱、口碱Na 2CO 3;烧碱、火碱、苛性钠NaOH ;胆矾、蓝矾CuSO 4·5H 2O ;碳酸钠晶体Na 2CO 3·10H 2O ;氨水NH 3·H 2O 。
(二)金属活动性 1金属活动性顺序:K >Ca >Na >Mg >Al >Zn >Fe >Sn >Pb(H)Cu >Hg >Ag >Pt >Au 2金属活动性顺序的意义:在金属活动顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失去电子而变成离子,它的活动性就越强。
3金属活动性顺序的应用:⑴排在氢前的金属能置换出酸里的氢(元素)。
⑵排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K 、Ca、Na除外)。
(三)酸、碱、盐的溶解性1常见盐与碱的溶解性钾(盐)、钠(盐)铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2八个常见的沉淀物氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁3四微溶物Ca(OH)2(石灰水注明:澄清“的原因)CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别-24SO和-Cl时,不用硝酸银的原因)MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4三个不存在的物质氢氧化银、碳酸铝、碳酸铁(四)复分解反应发生的条件反应有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质)1、不溶性碱只能与酸性发生中和反应;2、不溶性盐,只有碳酸盐能与酸反应;3、KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物。
(完整版)初中化学各单元知识框架图
2 、溶液 ( 多为无色 ) 浅绿色溶液 ---( 亚铁盐溶液 )FeCl2
溶液、 FeSO4 溶液黄色溶液 --- ( 铁盐溶液 )FeCl3
溶液、 Fe2(SO4)3 溶液、 Fe(NO3)3
溶液蓝色溶液 ---( 铜盐溶液 )CuCl2
溶液、 CuSO4 溶液、 Cu(NO3)2 溶液蓝绿色溶液 -CuCl2
溶质的 质量分数
不饱和溶液
饱和溶液 结晶
溶解度
十、酸 碱 盐 氧化物、酸、碱和盐的知识点可以从以下十个方面掌握: 一、化学用语 1、电离方程式
H 2 SO4 2 H SO42 ; NaOH Na OH ; Al 2 ( SO4 ) 3 2Al 3 3SO42
2、物质的俗称和主要成分生石灰 ??CaO熟石灰、消石灰、 石灰水的主要成分 ??Ca(OH)2石灰石、大理石 ??CaCO3食盐的主 要成分 ??NaCl 纯碱、口碱 ??Na2CO3烧碱、火碱、苛性钠 ??NaOH 胆矾、蓝矾 ??CuSO4.5H2O碳酸钠晶体 ??Na2CO3.10H2O氨 水 ??NH3.H2O
(2) 碱能与酸性氧化物反应生成盐和水 (3) 碱能与酸反应生成盐和水 (4) 某些碱能与某些盐反应生成新的盐和新的碱 3、盐的性质 (1) 某些盐能与较活泼的金属反应生成新的盐和金属 (2) 某些盐能与酸反应生成新的盐和新的酸 (3) 某些盐能与某些碱反应生成新的盐和新的碱 (4) 有些不同的盐之间能反应生成两种新的盐
六、溶液的酸碱性与酸碱度的测定 1、指示剂 --- 溶液的酸碱性紫色的石蕊试液遇酸性溶液变 红;遇碱性溶液变蓝 无色的酚酞试液只遇碱溶液变红注:不溶性碱与指示剂无作 用碱性溶液不一定是碱的溶液 ( 特例:碳酸钠的水溶液显碱性 ) 2、pH值 --- 溶液的酸碱度 pH>7溶液为酸性 ( 越小酸性越 强)pH=7 溶液为中性 pH<7溶液为碱性 ( 越大碱性越强 ) 七、离子的检验 Cl-( 在溶液中 )--- 在被测溶液中加入硝酸银溶液 , 如果生成 不溶于硝酸的白色沉淀,则原被测液中含氯离子。 SO42-(在溶液中 )--- 在被测溶液中加入氯化钡 ( 或硝酸钡、 或氢氧化钡 ) 溶液,如果生成不溶于硝酸 ( 或盐酸 ) 的白色沉淀, 则原被测液中含硫酸根离子。 CO32-(1)( 固体或溶液 )--- 在被测物质中加入稀酸溶液,如 果产生能使澄清石灰水变浑浊的气体,则原被测物质中含碳酸 根离子。
初中化学各单元知识框架图
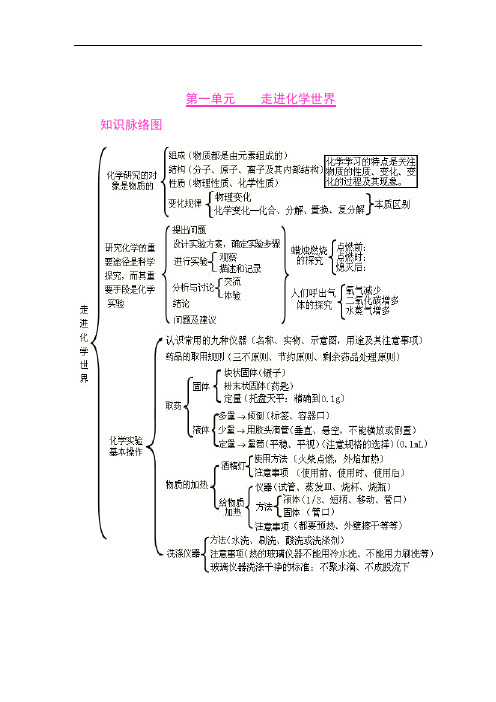
第一单元走进化学世界知识脉络图第二单元我们周围的空气知识脉络图第三单元自然界的水知识脉络图第四单元物质构成的奥秘知识脉络图第五单元化学方程式知识脉络图第六单元碳和碳的氧化物知识脉络图第七单元燃料及其利用第八单元金属和金属材料九、溶液十、酸 碱 盐氧化物、酸、碱和盐的知识点可以从以下十个方面掌握: 一、化学用语 1、电离方程式23224424342;;()23H SO H SO NaOH Na OH Al SO Al SO +-+-+-=+=+=+2、物质的俗称和主要成分生石灰??CaO 熟石灰、消石灰、石灰水的主要成分??Ca(OH)2石灰石、大理石??CaCO3食盐的主要成分??NaCl 纯碱、口碱??Na2CO3烧碱、火碱、苛性钠??NaOH 胆矾、蓝矾??CuSO4.5H2O 碳酸钠晶体??Na2CO3.10H2O 氨水??NH3.H2O二、化合物的分类三、金属活动性1、金属活动性顺序:KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
四、酸、碱、盐的溶解性1、常见盐与碱的溶解性:(如果不读出括号中的字,是不是一个较好记忆的顺口溜?)钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙氢氧化镁、氢氧化铜、氢氧化铁3、四微溶物:Ca(OH)2(石灰水注明“澄清”的原因)CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4、三个不存在的物质:所谓的氢氧化银、碳酸铝、碳酸铁五、分解反应发生的条件反应后有气体、水或沉淀生成。
第4单元我们周围的空气复习与巩固---2024--2025学年九年级化学鲁教版(2024)上册

B.图2中A→B段氧气浓度逐渐降低的可能原因是加热时排出一部分空气
C.图3分析可知,对氯酸钾分解催化效果更好的催化剂是分析MnO2
D.对比图2和图3可知,加入催化剂后氯酸钾分解所需的温度比不加入催
化剂更高
教学过程
例1.我校某班同学想探究红砖粉末是否也可作为过氧化氢分解的催化剂。请你
延长保质期;焊接金属时用氮气以隔绝空气;
③液氮是很好的制冷剂,可用于冷藏血液等;超导材料在液氮的
低温环境下能显示超导性能。
氧气的物理性质:①在标准状况(0℃、1.01×105Pa)下,氧气是一种
无色无味的气体,密度1.429g/L,比空气的密度(1.293g/L)略大;
②氧气不易溶于水,1L水中最多能溶解0.049L氧气。
个结论? 不赞同
(填“赞同”或“不赞同”)。理
由是不知道反应前后红砖粉末的化学性质是否改变。
(9)红砖粉末做催化剂过氧化氢溶液制取氧气时,红砖粉
末起 催化 作用。
教学过程
典
例
解
析
例2.请结合如图回答问题:
(1)仪器名称:① 酒精灯 ,② 分液漏斗 。
(2)实验室用A装置制取并收集O2,反应的符号表达式
调节气压
教学过程
工业制取氧气
知
识
梳
理
原理:通过降温加压使空气液化,然后使液态空气升温,利用空气中氧
气、氮气、稀有气体的沸点不同,使它们在不同温度下分别气化,从而
逐一从空气中分离出来。
氮气的物理性质:无色、无味的气体,难溶于水,密度比空气的略小
氮气的用途:①是生产氨气、硝酸和氮肥的重要原料;
②作保护气,如食品包装袋中充氮气可避免食品挤压破碎,且能
