微波辐射合成N-(2-氯-1-氧-5-吡啶甲基)二甲酰亚胺类化合物和生物活性研究
交联甲基丙烯酸二甲胺乙酯的微波合成及性能

F ig. 7 Curve of adsorptive equ il ibr ium on ion ad2 sorp t ion
F ig. 5 SEM photograph of particle size left: cro ss2linked po lym er by m icrow ave syh the2 sis; righ t: cro ss2linked po lym er by no rm al syn2 th e s is.
F ig. 8 Adsorption isom eter l ine of cross- l inked PDM Q : ion ad so rp tive cap acity ( Λg g ) ; C: so lu tion con sistency after ad so rbed; C 0: so lu tion con sis2 tency befo re ad so rbed.
第 19 卷第 5 期
高分子材料科学与工程
2003 年 9 月
POL YM ER M A T ER IAL S SC IEN CE AND EN G IN EER IN G
V o l. 19,N o. 5 Sep t. 2003
交联甲基丙烯酸二甲胺乙酯的微波合成及性能Ξ
路建美, 张震乾, 李娜君, 沈海清, 朱秀林
导管的四口反应瓶中加入DM 和交联剂 (在氮
气保护下进行) , 搅拌, 升温至聚合温度, 保持一
定的反应时间即得膨松状固体颗粒自聚产物。
微波辐射反应用微波炉 (蚬华 KS2163, 最大输 出功率 850 W , 经改装, 通过使用外装调压器,
使微波炉电流连续可调可读) , 常规反应用水浴
【浙江省自然科学基金】_中间体_期刊发文热词逐年推荐_20140812

2009年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 320 41 42 43 44 45
科研热词 腈水解酶 聚吡咯 氟表面活性剂 合成 1-乙基咪唑三氟乙酸盐 铂 酰胺酶 表面张力 草酸 草甘膦 苯氧丙酸类除草剂 腈转化酶 腈水合酶 肌氨酸钠 精细化学品 管式反应器 硫酸酯盐 硝化 电催化氧化 甲酸 甲基三氟丙基二氯硅烷 生物催化 甘氨酸-亚磷酸二烷基酯法 氧化 正交实验 方差分析 密度泛函理论 吸附 双(n,n-二乙基)胺基甲基三氟丙基硅烷 原位红外光谱 全氟壬烯氧基苯磺酰氯 全氟壬烯基苯基醚 亚氨基二乙酸法 亚氨基二乙腈 临界胶束浓度 s-(-)-2-(4-甲苯磺酰氧基)丙酸乙酯 r-(+)-2-(4-羟基苯氧基)丙酸 l-苯丙氨酸 l-乳酸 l-4-硝基苯丙氨酸 co ceo2(111)表面 3-羟丁基 1,2,4-三唑并[3,4-b][1,3,4]噻二嗪 1,2,4-三唑
2011年 科研热词 推荐指数 序号 合成 3 1 精细化工中间体 2 2 间氨基苯磺酸 1 3 醇解 1 4 邻苯二胺 1 5 近临界甲醇 1 6 葡萄糖 1 7 苯并咪唑 1 8 苄基缩水甘油醚 1 9 紫外线吸收剂 1 10 紫外分光光度法分析 1 11 硝基氯苯 1 12 硝化反应 1 13 白曲霉 1 14 电化学还原 1 15 环氧化物水解酶 1 16 环戊酮 1 17 最佳工艺 1 18 时空转化率 1 19 微通道反应器 1 20 对映选择性 1 21 均三嗪 1 22 动力学 1 23 催化加氢 1 24 二醋酸碘苯(ibd) 1 25 乙酰丙酸甲酯 1 26 丙二酸二乙酯 1 27 三聚氯氰 1 28 β ,β '-四亚甲基戊二酸 1 29 β ,β '-四亚甲基戊二酰亚胺 1 30 α -烷基化 1 31 snar/环化 1 32 k2oso4 1 33 6-二氟苯基)噻唑-2-基]-3-羟基-2-三氟甲基肉桂腈 1 34 6-二氟苯基)噻唑 1 35 4-甲基苯磺酰氯 1 36 4-甲基苯亚磺酸钠 1 37 2-氰甲基-4-(2 1 38 2-[4-(2 1 39 40 41 42 43 44 45 46 47 48 49 50 51 52
微波辐射下无溶剂合成己二酸二乙酯

按 照本法制得的 己二酸二 乙酯 为无色 油状 液体 , bP 18 3 .. 2  ̄10℃/ . P , 15k a与文献值 [(2 ~10 18℃ ] 3
基金项 目: 中南 民族大学大学生勤工助研项 目 作者简介 : 谢雯静( 98 )女 , 18 . , 湖北十堰人 , 中南 民族大学化学与材料科学学院 2 0 0 6级学生 , 从事有机合成研究
关键词 : 微波辐射 ; 合成 ; 己二酸二乙酯
中图 分 类 号 : 2 .2 o6364 文 献 标 识码 : A
己二酸二 乙酯 是无 色 油状 液体 , 主要 用 作溶 剂
中, 加入一 定量 的 乙醇 , 分摇 振 , 入 微 波炉 中加 充 放
和有机合 成 中间体 , 可 用 于 日用 化 学工 业 和食 品 还 工业 中。 目前 工业上 大多采 用 以硫酸为催 化剂 的合 成方法 , 但存在 着 产 品质 量 差 , 备腐 蚀 严重 , 处 设 后
1 2 催化合成 己二 酸二 乙酯 的操作方 法 .
甲苯磺酸 用量 为 00 与 己二 酸的质 量 百分 比为 .6g( 2%)微 波辐 射 时 间为 1 . n 仅 改 变 微波 输 出 , 00mi,
功率, 结果见表 1 。从表 1 可知 , 提高微波功率时产 率增加, 但增大到一定功率时 , 产率反而会下降。微 波加 热与普 通加热 过程不 同, 是一 种 内加热 , 若微波
理复 杂 , 污染环 境等 缺点 , 因此寻 找新 的合成方 法很 有意义 。近年 来 , 文献 报 道 以树 脂 【 无机 盐 [ 有 、 、 杂多 酸 l 、 3 固体超 强 酸[ 5等 作 为新 型催 化 剂 , J 4 ] - 但
n-甲基-n-丙基吡咯二(三氟甲基磺酰)亚胺的化学式结构

n-甲基-n-丙基吡咯二(三氟甲基磺酰)亚胺的化学式结构1. 引言1.1 背景介绍在有机化学领域,合成新型有机化合物具有重要的科学意义与应用前景。
n-甲基-n-丙基吡咯二(三氟甲基磺酰)亚胺是一种重要的有机化合物,在药物合成、材料科学和生物医学等领域显示出了潜在的多功能性能。
1.2 研究意义n-甲基-n-丙基吡咯二(三氟甲基磺酰)亚胺具有许多独特的化学结构和性质,因此引起了广泛的关注与研究。
首先,它作为一种重要的中间体,在药物合成中起着至关重要的作用。
其次,它对光电材料如液晶显示器和太阳能电池等具有良好的应用潜力。
此外,由于其稳定性高、可溶性强以及抗氧化性能好,它也被认为是一种优良的阻燃剂。
1.3 目的和意义本文旨在深入了解n-甲基-n-丙基吡咯二(三氟甲基磺酰)亚胺的化学式结构,并分析其合成方法和物理化学性质。
通过实验方法的探索和结果分析,为进一步研究该化合物的应用提供科学依据。
最后,通过对未来研究方向的展望,期望能够激发更多科研人员对该化合物进行深入研究,从而推动有机化学领域的发展。
2. 正文:2.1 化学式结构分析n-甲基-n-丙基吡咯二(三氟甲基磺酰)亚胺的化学式为C7H11F3N3O2S。
该化合物由一个苯环和吡咯环组成,其中苯环上有一个甲基和一个丙基取代基。
联接在吡咯环上的是一个三氟甲基磺酰亚胺官能团。
2.2 合成方法研究关于n-甲基-n-丙基吡咯二(三氟甲基磺酰)亚胺的合成方法,目前尚未有专门研究报道。
然而,根据类似化合物的合成经验可以推测一种可能的合成途径。
例如,首先可以从可获得的起始原料开始,通过反应将苯环和吡咯环连结在一起,并引入相应的取代基。
然后,在适当条件下与三氟甲硫醇反应生成相应的三氟甲硫醇酸盐,并进一步进行化学反应转化为三氟甲基磺酰亚胺官能团。
最后,对所得产物进行纯化、晶体收集等工艺步骤,从而得到目标化合物n-甲基-n-丙基吡咯二(三氟甲基磺酰)亚胺。
2.3 物理化学性质分析对于n-甲基-n-丙基吡咯二(三氟甲基磺酰)亚胺的物理化学性质,尚未有详细数据报告。
啶虫脒中间体N-(6-氯-3-吡啶甲基)甲胺合成工艺优化

啶虫脒中间体N-(6-氯-3-吡啶甲基)甲胺合成工艺优化啶虫脒中间体N-(6-氯-3-吡啶甲基)甲胺是一种重要的有机合成中间体,广泛应用于医药、农药和染料等领域。
合成工艺的优化对于降低成本、提高产率和提高产品质量具有重要意义。
本文将重点探讨啶虫脒中间体N-(6-氯-3-吡啶甲基)甲胺的合成工艺优化方法,以期为相关领域的研究提供参考。
一、啶虫脒中间体N-(6-氯-3-吡啶甲基)甲胺的合成工艺啶虫脒中间体N-(6-氯-3-吡啶甲基)甲胺的合成通常采用简洁高效的方法,其合成路线主要包括以下几个步骤:1. 以邻苯二甲酸酐为起始原料,通过酰胺化反应生成邻苯二甲酰胺;2. 邻苯二甲酰胺经过亲核取代反应,生成啶虫脒中间体;3. 啶虫脒中间体经过亲核取代反应,生成啶虫脒中间体N-(6-氯-3-吡啶甲基)甲胺。
二、合成工艺存在的问题当前啶虫脒中间体N-(6-氯-3-吡啶甲基)甲胺的合成工艺存在一些问题:1. 原料利用率低,反应产物难以分离纯化;2. 合成步骤多,反应条件苛刻,导致产率低,成本高;3. 反应中产生大量废弃物,环境污染严重。
四、优化方法的实施1. 原料选择和反应条件的优化可以通过改进合成方法,选择更合适的原料和催化剂,优化反应条件,提高反应的选择性和产率。
可以尝试不同的溶剂、温度、反应时间等参数,寻找最佳的反应条件。
2. 合成路线的简化可以通过改进合成路线,简化合成步骤,减少中间体生成的废弃物。
可以将多步反应合并为一步,或者利用催化剂促进反应,提高反应的效率和选择性。
3. 新合成方法的开发可以通过开发新的合成方法,寻找更加高效、环保的合成途径。
可以尝试使用微波辐射、超声波处理、离子液体等新技术,提高反应效率和产物纯度,减少废弃物排放。
【江苏省自然科学基金】_微波合成_期刊发文热词逐年推荐_20140819
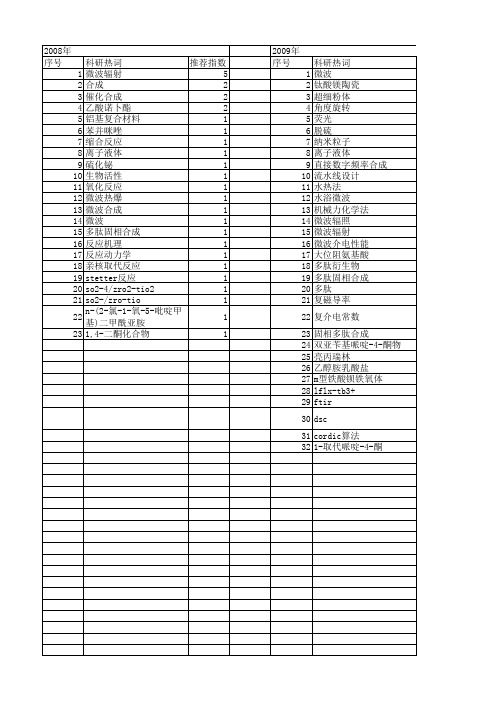
2012年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23
科研热词 微波辐射 谐波抑制 红色荧光粉 溶胶-凝胶法 槽线 晶体结构 微波水热 引发剂 开放实验 带通响应 吸水树脂 吸收 功分器 保水性 交联剂 二茂铁取代吡啶 sol--gel method red phosphor mn2+ microwave radiation mg2sio4: mn2+ mg2sio4: limnpo4
推荐指数 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2014年 序号 1 2 3 4 5 6 7 8 9 10
科研热词 高性能 量子点 酯化 离子液体 柠檬酸三丁酯 微波水相合成 微波 多齿配体 增塑性能 催化剂
推荐指数 1 1 1 1 1 1 1 1 1 1
2008年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23
科研热词 推荐指数 微波辐射 5 合成 2 催化合成 2 乙酸诺卜酯 2 铝基复合材料 1 苯并咪唑 1 缩合反应 1 离子液体 1 硫化铋 1 生物活性 1 氧化反应 1 微波热爆 1 微波合成 1 微波 1 多肽固相合成 1 反应机理 1 反应动力学 1 亲核取代反应 1 stetter反应 1 so2-4/zro2-tio2 1 so2-/zro-tio 1 n-(2-氯-1-氧-5-吡啶甲基)二甲酰亚胺 1 1,4-二酮化合物 1
科研热词 溶胶-凝胶燃烧法 高分子吸附燃烧法 香豆素 镁掺杂 锰锌铁氧体 锂锌铁氧体 锂-锌铁氧体 脱铜 电磁性能 水热合成 氟曲马唑 桂皮酸 无铅压电陶瓷 无机非金属材料 微波辐射 微波电磁特性 微波电磁性能 微波水热合成 微波合成 微波反应 固体酸催化剂 卤代反应 pechmann反应 nδ -保护鸟基酸 n-烷基化反应 mg2+掺杂 edta莫2na
微波作用下合成2-甲基苯并咪唑
输} 最大功率 9 0 A A AR 6 】 _ { 0 W: V T 3 0红外光谱仪 ( B 压片 ) K r ;
WR .B 数 字 熔 点 仪 ( S1 上海 精 密 科 学 仪 器 有 限 公 司 ) 。 试 剂 : 邻 苯 二 胺 、 冰 乙 酸 、 多 聚 磷 酸 、 氨 水 、活 性 炭 、
无 水 乙醇 均 为 分 析 纯 试 剂 。 1 . 实 验 方 法 2 ・
杂环化合物 ,具有很强的生物活性和抗 蚀性,在 高性 能复合
材料、金 属防腐蚀 、医药 、染料 等方面有着广泛 的用途 I。 “
此,2 甲綦苯 并咪哗及 其衍 生物 的合成及应用研 究从未 间 .
断 , 至今 仍 十 分活 跃 。 J
应时 间。近年来微 波促进 的有机化 学反应 具有 加热 时问 短 、产率高、对 环境 友好 等优点而受到人们 的关注 ,其中同 相微波反应以其安全 、反应 装置简 单而倍受青 。
A bsr t - e h be z m i z e wa yn h ie by t e c in ofO ph nyln dim i ih a e i cd i h e e c t ac :2 m t yl n i da ol s s t esz d he r a to - e e e a ne w t c tc a i n t e pr s n e of
中 图分 类 号 : 06 62 2. 3 文 献 标 识 码 :A 文 章 编 号 : 10 - 152 0 )50 3 -2 0 99 1(0 80 -0 90
M ir wa eEn a c dS n h sso - e h l n i d z l c o v h n e y t e i f M t yBe zmi a oe 2
微波催化药物合成分析研究进展
微波催化药物合成研究进展huazi 发表于 2007-5-31 19:46:00关键词:微波药物合成化学;微波催化;微波氚标记法;微波组合化学;催化方法组合学摘要综述了微波辐照技术在药物合成方面的应用和研究进展,以及微波在药物氚标记、组合化学上的应用,并初步展示了微波化学的发展前景.微波化学作为化学领域中一门新兴的边缘学科,在即将来临的21世纪中将方兴未艾、蓬勃发展.从1986年Gedye RN及其合作者发现微波照射可以促进有机反应以来,化学家们对微波的催化机制及其应用研究正趋于成熟与完善。
其催化机制在于微波的能级恰好与极性分子的转动能级相匹配,这就使得微波能可以被极性分子迅速吸收,从而与平动能发生自由交换,使反应活化能降低,进而使反应活性大为提高.现已有敞开式、密闭式、回流式、管道流动式四种不同类型的微波催化反应装置已进入实验室,并逐步进入药厂、化工厂和其他有关企业.微波药物合成化学是一门颇具特色的药物化学分支.微波有机合成化学与微波药物合成化学没有本质的区别,只是后者对象限制在药物和生物活性分子及其中间体等范围内,当然会有些特殊的研究方法,如微波组合化学及微波氚标记方法等.本文对此领域近几年的研究进展作一综述.1 微波催化在药物合成中的应用众所周知,一些传统的药物合成方法有的反应复杂、难度大、费时费力,还有的反应进行得很慢甚至难以发生,选用微波催化方法则可大大优化反应条件,加快反应速度,提高反应选择性和反应收率,使过去难以发生或速度很慢的反应得以高速完成,同时还能大大简化后处理过程.这方面研究越来越多,下面按有机药物化学反应主要类型分类叙述.1.1 酰化反应Dayal B〔1〕等利用微波炉由胆汁酸与牛黄酸合成胆汁酸共轭物,整个过程只用了10 min,而传统的方法则需30~40 h,且产率低.在庚醛与苯甲醛的缩合反应中,Ayoubi SA等〔2〕发现,用微波技术仅用1 min就可得到82%的主产物和18%的自缩合副产物,且反应装置简单,后处理过程容易操作.醇的酰化反应是药物合成的重要反应,也是微波催化研究得最多、最成熟的反应类型之一〔3〕,这方面的例子很多.例如:6,11-二氢-11-氰基二苯并〔b,e〕氧杂(艹>/(卓>,经多聚磷酸甲酯( PPEC H3>水解后,可以得到三环类高效抗胆碱能药物的重要中间体.传统的加热需较长时间,而在微波照射下,几分钟内就可顺利完成反应,不但缩短了反应时间,而且优化了反应条件〔4〕.二苯羟乙酸酯也是合成药物的重要中间体.传统方法需要对二苯羟乙酸与低碳脂肪醇回流4 h,方可得到一定产率的酯.胡文祥〔5〕等用微波照射技术,仅用了10 min就完成了反应.尼泊金酯类防腐剂由于毒性低、无刺激性及适用于较宽pH范围等特点,广泛应用于食品、化妆品、医药工业.但其传统生产工艺需反应3 h,且后处理过程较麻烦,而微波照射则可避免这些问题〔6〕.此外,氰乙酸酯类化合物的合成,通常的加热酯化法需8~10 h,改用微波照射后,可缩短到20~30 m in〔7〕.被保护的果糖和取代羟乙酸活化酯在正庚烷中进行酯交换反应,采用微波催化改进后〔8〕,10 min 即得到了50%~90%的新型抗胆碱能化合物,而传统方法则需要6 h也难以完成.邻苯二甲酰亚胺己过氧酸是一种优良的漂白剂,它在消毒及卫生保健方面有许多独特的优点,但其合成(N-酰化反应>需在160℃下,加压160 kPa,反应5 h.胡文祥等〔9〕用微波催化,伴以少量水引发,仅用了5 min就得到了60%的产率.1.2 消除反应Bose AK〔2〕研究发现利用微波技术,可以很容易地将6,6-二溴青霉烷酸转化为主产物cis-6-溴青霉烷酸.不饱和吡喃糖苷的合成为大量天然产物的合成及Diels-Alder反应提供了重要中间体.传统方法需加热4 h,产率为44%,而用微波改进后反应仅需14 min,产率为88%.Jones和Chapman〔2〕将微波技术应用于含羧基的吲哚进行脱羧反应中,反应几乎定量完成.该法很容易得到2-取代的吲哚,它是一种极有用的药物中间体.在药物的合成中常常会遇到官能团的保护与脱保护问题,微波可用于加速这类反应.Abenhaim D等〔2〕将该技术应用于三甲基乙酰的脱保护反应中.1.3 重排反应Abramovitch研究小组对Fischer成环过程中发生的〔3.3〕-σ-重排反应使用了微波技术,结果得到了非常高的产率,反应几乎定量完成.Ipaktschi〔2〕等对σ-重排反应进行了微波催化,发现仅用5 min就得到了95%的高产率.粘土用来催化有机反应,已有不少报道.Villemin等〔2〕采用这种方法并以微波辅助进行了Fischer 吲哚的合成,用5 min得到了85%的产率.1.4 立体选择性反应Banik〔2〕研究小组利用微波技术,以甘露糖醇二丙酮化合物为原料,仅用数分钟即得到了具有光学活性的抗菌素类的重要中间体β-内酰胺,而且两步产率都很高,分别为75%和90%.Villemin D〔10〕利用三氧化二铝-氟化钾载体催化与微波照射结合使用,在苯基异口恶唑啉-5-酮与噻吩甲醛反应中,仅用15 min便得到了92%的E式构型产物.硫脲衍生物是一类具有多种生物活性的化合物,刘福安等〔11〕采用微波常压反应装置较好地完成了L-焦谷氨酰-4-苯甲酰基硫脲的全合成.1.5 成环反应Petit A〔2〕等在由吡咯与苯甲醛反应合成具有人体生化意义的四苯基卟啉的实验中,采用微波干反应技术,在10 min内完成,产率为9.5%.虽产率没有明显提高,但简化了产物的分离与提纯过程.胡文祥等〔12〕采用微波湿反应技术也同样取得了成功,且速度和产率均有所提高,加热5 min就得到了40%的产率.而传统的加热回流需4 h,且产率低于10%.由于这一反应由8个分子碰撞在一起形成目标产物,负熵效应大,超声催化反应效果并不理想.三氮唑化合物与4-二甲氨基苯甲醛在微波照射下3 min,即可制得产率为90%的取代噻二唑化合物.而传统方法则需9 h,收率为77%〔13〕.Fallis等〔2〕在长叶烯的关键合成步骤中,采用微波辅助进行了分子内Diels-Alder反应,反应2 h得到了92%的产率.Linders和Kokje及其合作者在蒂巴因衍生物与甲乙烯基酮的环加成过程中应用了微波技术,在24 h内得到了24%的产率,还简化了后处理过程〔2〕,这是合成某些高效镇痛药的途径之一.含二茂铁取代基的丙烯醛与酯生成杂环的反应中,Puciovia〔2〕等使用了微波技术,结果产率分别达到85%和35%.Bram G〔2〕应用微波技术合成重要的工业原料蒽醌,使其产率较传统方法(50%>大为提高.取代吡啶并色满酮是药物合成的重要中间体,它一般由取代苯氧烟酸分子内缩合生成,但传统的方法反应时间长,且后处理麻烦.经改进后,仅用微波催化5 min就完成了反应,产率可达94%〔14〕.1.6 差向异构化反应Takano〔2〕等在一个因环反转而引发的外消旋反应中发现,使用微波照射仅需20 min就可完成这个反应,而在传统的加热条件下则很难进行.1.7 烃化反应在三氯化铝催化下的苯和甲苯的Friedel-Crafts甲锗烷基化反应中,使用微波技术可使反应时间由传统方法的24 h缩短为2 h,产率由20%提高到了25%〔2〕.Herradon等在一缩醛的苯甲酰化反应中采用微波技术,经30 min产率可达70%,而传统加热则需数小时〔2〕.芳香亚甲基丙二酸二乙酯是一类重要的合成中间体,它通过关环反应可以制备具有抗菌生理活性的喹啉衍生物.通常它的制备需长时间的加热回流,由黄宪等〔13〕采用微波技术仅用9 min就高产率地完成了反应,产物的收率在81%~90%之间.将微波技术与相转移催化技术结合运用,可以成功地合成α-氨基酸,反应只需1~2 min,且不需溶剂,产率高〔14〕.磺酰基乙酸酯的二烷基化反应可用于前列腺素类活性化合物和萜类化合物的合成,普通加热条件需1~6 h,经微波改进后只需2 min〔15〕.1.8 金属有机反应在二茂铁肟的制备中,Puciova与Toma〔2〕发现使用微波催化可以得到热力学稳定的产物,他们在2 0 s的时间内就得到了97%的产率.此外,采用微波反应装置,可以在不到1 min的时间内合成出高产率的铑、铱的二烯类络合物,而传统加热则需几个小时〔16〕.而且采用这种新技术可以直接由RhCl3*XH2O与C6H5合成阳离子〔Rh(η-CH5>2〕+.1.9 还原反应Gordon EM〔2〕等在苯甲醛的催化氢化生成苯甲醇的过程中,应用了微波技术,结果发现仅用7 min 就完成了反应,而传统回流方法则需3 h.Bose〔2〕及其合作者对钯-炭或Raney镍催化下的β-内酰胺的氧化,使用了微波技术,使反应得以高速完成,产率在80%~90%之间.1.10 糖类化合物的某些反应在半乳糖1,4-内酯的合成过程中,一般的方法只能得到22%~38%的产率,而选用微波催化来进行反应,则可得到60%~66%的产率,反应时间仅需10 min〔2〕.Straathof等人〔2〕将微波技术运用到淀粉制备1,6-脱水葡萄糖的反应中,很有推广应用价值.Nakanishi等〔2〕用微波催化对低聚糖进行了甲醇解,发现适当的保护可以导致产物的异构变换.三乙酰基-D-葡萄糖同硝基苯酚在微波照射下,仅需1 min即可得到2,3-位不饱和糖苷的产物,产率为72%,而传统的方法需7 h,产率为75%.微波催化使其速度提高了180倍〔2〕.长期以来,由于人们只发现微波对需要加热的反应十分有效,使得更多的人相信微波的热机制,然而Pagnotta〔2〕等却发现一个例外,α-D-葡萄糖苷的变旋光反应在微波的照射下同样能有很快的速率,而且溶剂的不同还会导致两者的比例发生变化,使旋光度发生改变.同时,作者成功地用焓效应阐明了电磁波和机械波的热效应,为熵效应阐明了它们的非热效应.1.11 其它反应由于微波催化的快速性,美国华盛顿大学Welch M等利用微波炉生产了半衰期短的放射性标记药物,取得了反应时间短、产率高、杂质少的良好效果.此外微波还在药物的结晶、提取、制剂和中、西药的干燥及药物样品的溶解、制备等过程中有许多重要应用.它还可以促进蛋白质的水解及污水中汞的萃取等.2 微波组合化学组合化学是近年来发展起来的一种有机合成与生物评价技术,在新药研究中占有重要地位,其基本方法是在高聚物支撑材料上进行大规模多种化合物的合成,以产生大型化合物库,并实施高通量的快速筛选.组合化学技术可大大简化新药筛选的过程.但是由于组合化学要求不同组分的反应能力要尽量相同,而非肽类化合物的合成往往是不能满足这一条件的,这又限制了它的推广应用.胡文祥和恽榴红教授曾提出微波组合化学概念,合理地运用微波化学与组合化学的优点,可望弥补上述缺陷,合成了一系列重要药物中间体〔17,18〕.这种新颖而又富有创造性的药物合成技术,可以实现小分子药物的组合合成,在组合盘内一次即可完成多种实验条件或正交设计和均匀设计的实验,具有简便、快速、高效、易于实现自动化等特点.将两反应物用量(摩尔数>及催化剂种类等三种因素按5个水平设置(3因素5水平>,全面实验需125(53>次,正交设计需作实验25(52>次,而均匀设计需5次.若运用微波组合化学方法,一次完成正交设计25次和均匀设计5次实验,两者所得结果经统计分析处理基本相同.对于多因素、多水平的实验,合理组合采用均匀设计和微波(或超声波>组合化学方法,往往一次就能得到较好的结果,这是令人欢欣鼓舞的,必将大大提高工作效率、节省经费、产生巨大的经济和社会效益.除了微波技术、红外技术和超声波技术可用于组合化学外,其它物理和化学及生物催化方法也可用于组合化学,这必将对新药研究过程中先导化合物的发现和优化两个环节产生重大的影响;同时对于开发超导体和其它新材料、发展有机合成和药物合成化学及分子生物学反应等方面还将产生深远的影响.3 微波氚标记微波氚标记方法在药物分子与受体结合机理研究中有着重要的作用.微波氚标记方法是应用微波能在低氚气压力条件下,使氚活化产生自由原子(基>或等离子体,从而发生H-T交换反应,最终获得氚标记化合物的方法.往往标记分子中所有的氢原子都可以被取代,但机率各不相同,被称为全标记(非均匀全标记>.其实验技术可分为普通微波氚标记和流气式微波全标记.其典型反应机理如下:3H∶3H3H*+3H*3H+R∶HR*+3H∶HR*+3H2R∶3H+3H*它的特点是反应时间短、标记效率高、方法简便、耗氚量少,且所得的产品保持原有的生物活性.已有许多不同类型的反应应用微波氚标记法.其放射比度为26.7 GBq/mmol,放化纯度大于98%〔19〕.其放射性比度大于37 GBq/mmol,放化纯度大于95%〔20〕.微波氚标记化合物是在膜上进行的H-T置换,李德有等〔21〕在研究中发现膜越薄反应效果越好,并实现了许多新药的氚标记反应.4 催化方法组合学本世纪80年代初期胡文祥曾提出:化学、生物和物理三大类催化方法合理相互组合运用,可以克服单一方法的不足之处,充分发挥有关方法的长处.随后又同恽榴红教授合作通过实验和理论探索,建立了微波催化与化学催化、超声波催化与化学催化、超声波催化与酶促合成等相结合的方法,提出了“微波组合化学”、“超声组合化学”及“催化方法组合学”等概念.例如在二取代羟乙酸与甲醇或乙醇发生酯化的反应中,用浓硫酸作为化学催化剂,常规回流搅拌4 h方可使反应完成,倘若在微波的反应器中回流3~5 min即可达到同样收率.研究发现,脂肪酶在50℃以下超声波作用1 h,酶的活力仍然保持完好状态,这就为建立酶(或微生物>促-超声波催化联用方法提供了依据.例如在用二苯羟乙酸活化酯与单糖或双糖进行选择性酶促酯化反应时,要达到同样产率,超声波只需0.5~1 h,而常规搅拌反应则需6 d.磁场与酶促、磁场与化学催化(包括相转移催化>、磁场与超声或微波、电场与超声、光与超声催化等相结合的方法,以及红外、微波与其它方法的组合运用等将会有广泛的应用前景,可大大提高科研效率,节省经费.显然这些催化方法的合理运用或组合运用可以取长补短,从而达到更有效地催化有机、药物及生物化学反应的目的.随着对微波技术进行广泛的横向研究(在不影响通讯的情况下>,必将会为人们提供更多的技术手段,合理地组合运用微波、红外、磁场、超声波等物理催化手段及新的化学催化方法和生物(酵母、脂肪酶、酯酶、蛋白酶及我们首次提出的“糖酶”〔21〕等>催化方法〔22~25〕,将极大地改变现有化学合成反应(尤其是药物合成>的现状,并在即将来临的21世纪中得到更加广泛的应用.1通讯联系人北京9702信箱15号2山西大学化学系,太原0300063军事医学科学院六所,北京100850参考文献[1]Dayl B,Rapole KR,Salen G,et al.Microwave-iduced rapid synthesis of bile acid co njugates.Synlett,1995,8:861~862[2]Caddick S.Microwave assisted organic reactions.Tetrahedron,1995,51(38>:10403~1 0432[3]陆摸文,胡文祥,恽榴红.有机微波化学研究进展.有机化学,1995,15(6>:561~566[4]高守海,恽榴红.微波条件下的6,11-二氢-11-氰基二苯〔b,e〕氧杂(艹>/(卓>-11-羧酸甲酯的合成.现代应用药学,1995,12(5>:22~23[5]张连锋,胡文祥,恽榴红.二苯羟乙酸醇酯的微波合成.第一届全国微波化学学术讨论会论文集,长春:中国电子学会微波分会,1996.52~53[6]陈新容,洪品杰,戴树姗.尼泊金酯类的微波合成.化学通报,1993,(5>:38~39[7]汪家钰,李辉.氰乙酸酯类微波合成法.全国第六届有机合成化学学术讨论会论文摘要集,上海:中国化学会,1995.18[8]胡文祥,张连锋,恽榴红.二苯羟乙酸葡萄糖酯的微波合成.第一届全国微波化学学术讨论会论文集,长春:中国电子学会微波分会,1996.48~49[9]胡文祥,张连锋,恽榴红,等.邻苯二甲酰亚胺己过氧酸的合成及其漂白性能的研究.军事医学科学院院刊,1999,23(2>:81~83[10]Villemin D,Martin B,Garrigues B.Potassium fluoride on alumna:dry condensation of 3-phenylisoxazol-5-one with aldehydes under microwave irradiation.Synth Commun,1993,23 (16>:2251~2257[11]刘福安,李耀先,郭乐.微波常压合成光学活性的L-焦谷氨酰-4-苯甲酰基硫脲.全国第六届有机合成化学学术讨论会论文摘要集,上海:中国化学会,1995.104[12]Lu MW,Hu WX,Yun LH.The rapid synthesis of tetraphenyl porphyrin with microwav e irradiation.Proceedings of First National Conference on Microwave Chemistry,1996.54~55[13]徐才丁,陈国英,黄宪.微波条件下芳香甲叉丙二酸二乙酯类化合物的制备.全国第六届有机合成化学学术讨论会论文摘要集,上海:中国化学会,1995.24[14]邓润华,宓爱巧,蒋耀忠.微波快速烷基化合成α-氨基酸.应用化学,1993:10(5>:10 8~109[15]王玉良,王宁,蒋耀忠,等.微波促进的苯磺酰基乙酸乙酯的二烷基化反应.第一届全国微波化学学术讨论会论文集,长春:中国电了学会微波分会,1996.44[16]Rbaghurst D,Mingos DMP,Watson MJ.Application of microwave dielectric loss heat ing effects for the rapid and convenient synthesis of organometallic anometal lic Chem,1989,368:43~45[17]胡文祥.广义组合化学.化学通报,(in press>[18]Li WZ,Yun LH,Ding ZK,et al.Microwave promoted nucleophilic substitution reacti on of chloride with amines and their application for generation of arylamine livrary with molecular diversity.In:Wu YD,Yan YJ,eds.Proceedings of Symposium on Frontiers of Chemisty in Conjunction with the Second Conference for Worldwide Chinese Young Chemists.Hong Kong:T he Hone Kong University of Science and Technology,1997[19]陈兰福,李德有.微波氚标记法与化合物结构的关系.中国药物化学杂志,1993,3(1>:6~9[20]李德有,陈兰福,张作恩,等.微波氚标记化合物的研究.核技术,1991,14(8>:71~73[21]胡文祥,恽榴红,曹晔.糖酶的分子设计及其三维构效关系与分子医学研究.科学(Scienti fic American>,1998,(6>:54~55[22]胡文祥,恽榴红.超声波技术在有机药物化学中的应用.中国药物化学杂志,1993,3(1>:76~78[23]胡文祥.有机化学反应选择性经验规律.化学通报,1995,(5>:35~38,50[24]陆摸文,胡文祥.有机磁合成化学研究进展.有机化学,1997,17(4>:289~294[25]Hu WX,Wang JY,Yun LH,et al.Some applications of physical and biological cataly sis in organic or medicinal chemistry.In:Wu YD,Yan YJ,eds.Invited Lecture and Proceedings of Symposium on Frontiers of Chemistry in Conjunction with the Second Conference for World wide Chinese Young Chemists.Hong Kong:The Hong Kong University of Science and Technology,1 997.45~46。
无溶剂条件下微波辐射合成2_氨基噻唑衍生物
2005年第25卷有机化学V ol. 25, 2005第7期, 826~829 Chinese Journal of Organic Chemistry No. 7, 826~829* E-mail: fengchao@; Tel.: 8627-83692749.Received October 15, 2004; revised December 9, 2004; accepted January 24, 2005.No. 7 成冲云等:无溶剂条件下微波辐射合成2-氨基噻唑衍生物827图1 目标化合物的合成路线Figure 1The synthetic rout of target compounds司, 噻吩乙酮来自Avoco公司, 4-甲基苯乙酮自制; 其余均为市售试剂.1.2 2-氨基-4,5,6,7-四氢苯并噻唑(1)的合成将硫脲7.6 g (0.1 mol)、碘12.7 g (0.05 mol)和环己酮5.2 mL (0.05 mol)混合, 搅拌下在195 W微波辐射反应40 s后接着130 W反应5 min. 反应完毕加热水200 mL,趁热过滤, 滤液用Na2CO3处理, 得黄色固体, 冷却减压过滤, 滤饼用蒸馏水洗涤两次, 真空干燥后得6.4 g 淡黄色针状晶体1, 产率88%. m.p. 86~87 (℃文献值[4] 87~88 );℃1H NMR (CDCl3, 300 MHz) δ: 1.80 (s, 4H), 2.55 (s, 4H), 4.89 (d, J=32 Hz, 2H); IR (KBr) ν: 3373, 3283, 3169, 3087, 2933, 2844, 2741, 1637, 1584, 1524, 1442, 1367, 1311, 1277, 1239, 1181, 1113, 1062, 1018, 892, 725, 695, 650, 630, 537 cm-1.1.3 2-氨基-4-苯基噻唑(2)的合成将硫脲7.6 g (0.1 mol)、碘12.7 g (0.05 mol)和苯乙酮5.2 mL (0.05 mol)混合, 搅拌下在130 W微波辐射反应2 min后接着65 W反应10 min. 反应完毕加乙醚50 mL洗涤, 滤除乙醚, 残留物加热水200 mL, 趁热过滤,滤液用氨水调至中性, 得白色絮状固体, 冷却过滤,滤饼用蒸馏水洗涤两次, 真空干燥得5.7 g微黄色针状晶体2, 产率67%. m.p. 149~150 (℃文献值[8] 146~148 );℃1H NMR (CDCl3, 300 MHz) δ: 7.78 (d, J=8 Hz, 2H), 7.47 (t, J=27 Hz, 2H), 7.28 (t, J=15 Hz, 1H), 6.73 (s, 1H), 5.11 (s, 2H); IR (KBr)ν: 3435, 3254, 3155, 3114, 3068, 1599, 1516, 1482, 1441, 1338, 1319, 1202, 1040, 769, 716, 667, 578 cm-1.1.4 2-氨基-4-[4-甲氧基-苯基]噻唑(3)的合成将硫脲2.4 g (32 mmol)、碘3.9 g (16 mmol)和对甲氧基苯乙酮2.4 g (16 mmol)混合, 搅拌下在65 W微波辐射反应11 min 40 s. 反应完毕加乙醚30 mL洗涤,除去乙醚, 残留物加热水200 mL, 趁热过滤,滤液用氨水调至中性, 冷却过滤,滤饼用蒸馏水洗涤两次, 真空干燥得2.1 g白色粉末3, 产率64%. m.p. 206~208 (℃文献值[4] 204~205 );℃ 1H NMR (CDCl3, 300 MHz) δ: 7.70 (d, J=9 Hz, 2H), 7.26 (s, 1H), 6.91 (d, J=9 Hz, 1H), 6.59 (s, 1H), 4.98 (s, 2H), 3.85 (d, J=13 Hz, 3H); IR (KBr) ν: 3441, 3119, 1626, 1538, 1523, 1494, 1452, 1417, 1327, 1291, 1246, 1179, 1037, 836, 738, 700, 602 cm-1.1.5 化合物4~9的合成参考1.4合成化合物4~9, 微波辐射反应条件和产率见表1.表1微波辐射合成化合物3~9的反应条件及产率aTable 1 The reaction condition and yield of compounds 3~9 Compd.R1R2t/min 产率/%3 p-CH3OC6H4 H11.6 644 p-ClC6H4 H15445 p-CH3C6H4 H20 126 p-H2NC6H4 H 5 217 p-O2NC6H4 H 5 268 2-Thieyl H20379 α-Naphthyl H20 17a微波辐射功率均为65 W (10%).2-氨基-4-[4-氯-苯基]噻唑(4): m.p. 169~170 (℃文献值[4] 163~164 );℃1H NMR (CDCl3, 300 MHz) δ: 7.70 (d, J=8 Hz, 2H), 7.34 (d, J=24 Hz, 2H), 6.71 (s, 1H),5.12 (s, 2H); IR (KBr) ν: 3441, 3114, 2345, 1635, 1536, 1478, 1403, 1341, 1089, 1040, 1011, 823, 730, 574, 486cm-1.2-氨基-4-[4-甲基-苯基]噻唑(5): m.p. 125~126(℃文献值[4] 124~125 );℃1H NMR (CDCl3, 300 MHz) δ: 7.66 (d, J=8 Hz, 2H), 7.21 (d, J=9 Hz, 2H), 6.67 (s,1H), 5.03 (s, 2H), 2.36 (s, 3H); IR (KBr) ν: 3455, 3118, 1638, 1539, 1522, 1490, 1401, 1333, 1113, 1037, 824, 730,694 cm-1.2-氨基-4-[4-氨基-苯基]噻唑(6): m.p. 168~170(℃文献值[4] 174~175 );℃1H NMR (CDCl3, 300 MHz) δ: 7.55 (b, 2H), 6.68 (t, J=19 Hz, 1H), 6.54 (s, 1H), 6.51 (s, 1H), 4.65 (b, 2H), 4.05 (b, 2H); IR (KBr) ν: 3370, 1608, 1509, 1402, 1277, 1181, 833, 755 cm-1.2-氨基-4-[4-硝基-苯基]噻唑(7): m.p. 283~285(℃文献值[4] 285~286 );℃ 1H NMR (CDCl3, 300 MHz) δ: 8.24 (d, J=9 Hz, 2H), 7.94 (d, J=8 Hz, 2H), 6.97 (s,1H), 5.02 (s, 2H); IR (KBr) ν: 3401, 3154, 1694, 1642, 1595, 1539, 1505, 1404, 1322, 1261, 1206, 1110, 1039, 854, 843, 748, 720, 619 cm-1.2-氨基-4-噻吩基噻唑(8): m.p. 127~130 (℃文献值[4] 131~132 ℃); 1H NMR (CDCl3, 300 MHz) δ: 7.33 (d, J=3 Hz, 1H), 7.25 (t, J=9 Hz, 1H), 7.03 (t, J=8 Hz,1H), 6.62 (s, 1H), 5.02 (s, 2H); IR (KBr) ν: 3424, 3116, 2341, 1627, 1548, 1522, 1401, 1364, 1115, 800, 703 cm-1.828有机化学V ol. 25, 20052-氨基-4-萘基噻唑(9): m.p. 153~156 ,℃1H NMR (CDCl3, 300 MHz) δ: 8.33 (t, J=9 Hz 1H), 7.86 (t, J=8 Hz, 2H), 7.63 (d, J=7 Hz, 1H), 7.48 (t, J=8 Hz, 2H), 7.26 (s, 1H), 6.65 (s, 1H), 5.22 (d, J=16 Hz, 2H); IR (KBr) ν: 3430, 3078, 1628, 1528, 1392, 1345, 1021, 810, 781, 722, 646 cm-1.2 结果与讨论在普通加热条件下,酮、硫脲和碘反应需数十小时以上, 在微波辐射条件下, 利用硫脲和酮反应合成2-氨基噻唑衍生物的文献未见报道. 本文利用微波反应合成了9种化合物, 其性状与熔点与文献报道一致. 并利用IR和1H NMR对化合物结构进行了确证.2.1 最佳反应条件的筛选为了寻找微波辐射反应的最佳条件, 在预试验的基础上, 本文对微波辐射功率、辐射时间和投料比进行研究. 以环己酮为例(表2), 应用正交设计方法, 以产率为考核指标, 设计考察了它们的影响.表2 正交设计的因素与水平的选择(L34)aTable 2 The factor and level of orthogonal test (L34)因素 A/WB/minC D水平1 130 10 1∶2 1∶1水平2 195 151.2∶2 1.2∶1水平3 65 201.4∶2 1.4∶1a A: 辐射功率, B: 反应时间, C: 环己酮和硫脲投料比, D: 环己酮和碘投料比.利用《正交设计助手oea》软件将实验数据处理(表3). 实验表明反应最优水平组合为A1B2C2D1.由表3可看出四因素中影响最大的是酮/碘投料比;表明碘在环化反应中起主导作用, 既可催化引发反应又参与了反应过程, 是反应原料之一. 依据表3最佳反应条件, 经多次验证, 表明微波辐射法比普通加热法反应时间缩短48倍, 产率与文献值[4]相当.2.2 微波辐射功率和时间的影响提高微波辐射功率、延长辐射反应时间, 有利于促表3 正交设计处理直观分析表aTable 3 Results and calculation of orthogonal testFactornA/W B/min C DYield/%1 13010 0.5 1 692 13015 0.6 1.2 553 13020 0.7 1.4 514 19510 0.6 1.4 605 19515 0.7 1 606 19520 0.5 1.2 267 6510 0.7 1.2 378 6515 0.5 1.4 619 6520 0.6 1 53I 58.355.3 52 60.7II 48.758.7 56 39.3III 50.343.3 49.357.3极差9.615.4 6.721.4a A, B, C, D同表2.进环合作用; 然而功率过高反而导致产率降低. 实验过程中发现, 功率高时, 反应体系易干燥结块黏附于瓶壁,使反应物不能充分均匀接触, 导致反应进行不完全, 副反应增多, 后处理困难, 产率大幅度降低. 微波辐射功率较低时, 达不到环合条件, 即使延长辐射时间也不能达到理想产率甚至得不到目标化合物. 因此, 本文采用双功率微波辐射法. 即先以适宜的高功率反应一段时间,目的在于诱发反应进行; 接着低功率长时间辐射以保证环合反应充分进行.以化合物1,2的合成为例(如表4所示), 实验证明双功率微波合成法既能诱发反应进行又避免反应过度,使产率显著提高.2.3 微波辐射合成2-氨基噻唑衍生物反应机理的初步探讨碘存在下酮与硫脲反应生成氨基噻唑衍生物的机理未见文献探讨. 实验结果(表3)显示碘/酮投料比是该反应的重要影响因素, 表明碘除起催化作用外, 同时也参与了反应. 同时双功率实验结果(表4)表明高功率引发有利于促进碘分子进攻酮的α碳原子, 但辐射时间太表4 单、双功率微波辐射合成反应比较Table 4 A comparison of single-time and double-time microwave irradiation of compounds 1 and 2单功率反应双功率反应P/W t/min 产率/% P1/W t1/min P2/W t2/min 产率/%1 130 15 63 1950.6 130 5 882 130 6 58 130 2 65 10 67No. 7成冲云等:无溶剂条件下微波辐射合成2-氨基噻唑衍生物829长会导致碘升华和反应体系炭化而阻碍进一步环合, 所以还需在低功率下使环合反应充分进行. 参照氯乙醛和硫脲反应制备2-氨基噻唑的反应机理[9], 结合实验结果分析, 作者认为该反应可能机理是: 碘分子首先与酮的α碳作用生成不稳定的中间物α-碘代酮, 再与硫脲反应,所得产物再经环化、脱水等步骤得到终产物, 假设历程如图2. 另外以2-戊酮、丙酮、环戊酮等为原料进行微波辐射反应, 均未得到目标产物, 可能因为原料不易生成α-碘代酮(如烷基酮)或者生成的α-碘代酮不稳定(环张力较大), 反应不能继续进行, 从侧面证实反应生成了α-碘代酮中间体的假设.关于微波辐射加速有机合成反应的原因, 目前尚无定论[10]. 本文采用微波辐射法反应, 体系温度远低于普通加热法, 初步判断微波非热效应可能对加速此类反应起决定作用. 然而微波致热效应也有一定作用; 一般所需温度较高的常规反应, 利用微波辐射法反应时需功率也较高.总之, 利用微波辐射法合成2-氨基噻唑衍生物具有反应时间短、无需溶剂、减少污染、产品易分离和后处理简单等优点. 特别是利用双功率微波辐射催化有机合成反应可大大提高反应产率和纯度.图2 假定的环合反应机理Figure 2 The ratiocinative mechanism of cyclization reactionReferences1 Zhang, A.; Xiong, W. N.; Hilbert, J. E.; DeWita, E. K.;Bidlack, J. M.; Neumeyer, J. L. J . Med . Chem . 2004, 47, 1886.2 Schneider, C. S.; Mierau, J. J . Med . Chem . 1987, 30, 494.3 Pratt, J.; Jae, H.-S.; Rosenberg, S.; Spina, K.; Winn, M.;Buchner, S.; Novosad, E.; KerKman, D.; Shiosaki, K.; Opgenorth, T.; DeBernardis, J. Bioorg . Med . Chem . Lett . 1994, 4, 169.4 King, L. C.; Hlavacek, R. J. J . Am . Chem . Soc . 1950, 72,3732.5 Yuan, K.-J.; Xia, P. Organic Heterocyclic Chemistry ,Peoples Medical Publishing House, Beijing, 1984, p. 95 (in Chinese).(袁开基, 夏鹏, 有机杂环化学, 人民卫生出版社, 北京, 1984, p. 95.)6 (a) Kodomari, M.; Aoyama, T.; Suzuki, Y . Tetrahedron Lett . 2002, 43, 1717.(b) Flygare, J. A.; Kearney, P. C.; Fernandez, M. J . Org . Chem . 1998, 63, 196.(c) Dane, G .; Juan, F. Tetrahedron Lett . 1999, 40, 423. 7 Varma, R. S. Green Chem . 1999, 1, 43.8 Liu, H.-L.; Li, Z.-C.; Anthonsen, T. Molecules 2000, 5,1055.9 Roberts, R. M.; Rodewald, L. B.; Wingrove, A. S. AnIntroduction to Moderny. Experimental Organic Chemistry , Translated by: Cao, X.-G .; Hu, C.-Q., Shanghai Scientific and Technical Publishers, Shanghai, 1981, pp. 208~209 (in Chinese).(Roberts R. M., Rodewald L. B., Wingrove A. S, 近代实验有机化学导论, 曹显国, 胡昌奇译, 上海科学技术出版社, 上海, 1981, pp. 208~209.)10 Wang, J.; Jiang, F.-C. Chin . J . Org . Chem . 2002, 22, 212 (inChinese).(王静, 姜凤超, 有机化学, 2002, 22, 212.)(Y0410151 QIN, X. Q.)No. 7Chinese Journal of Organic ChemistryIIIA New Synthetic Route of Disulfide Containing Aniline CompoundsDENG, Shi-Ren; HU, Gao-Qiang; YAN,Yong; GUO, Jian-Ping; HUANG, Wei-Guo; ZHOU, Yun-Hong; LI, Zao-Ying *Chin. J. Org. Chem. 2005, 25(7), 815Compound 1 was synthesized via a novel route by some cheap reagents in a relativelymild condition. At the same time, another new analogue 2 was prepared following the similar method. Thioacetalization Reaction of Odorlessα-Oxoketene Dithioacetals as 1,3-Propanedithiol EquivalentLIN, Chun; YU, Hai-Feng; LIU, Qun *; HOU, Dong-YanChin. J. Org. Chem. 2005, 25(7), 819Thioacetalization reaction of the selected aldehydes/ketones with 1a /1b was studied. Quantum Chemical Study on Asymmetric Allylation of BenzaldehydeCHEN, Wan-Suo *; CHEN, Zhi-Rong Chin. J. Org. Chem. 2005, 25(7), 822The quantum chemical method was employed to study the modified asymmetric allylation of benzaldehyde controlled by diisopropyl D -(-)-tartrate auxiliary. All the structures were optimized completely at the B3LYP/6-31G(d,p) level. The (R )-secondary alcohol could be achieved mainly through a six-membered ring chair-like transition state structure. From the relative reaction rate theory the main product predicted was in agreement with the experiment.Solvent Free Synthesis of 2-Aminothia-zole Derivatives under Microwave IrradiationCHENG, Chong-Yun; JIANG, Feng-Chao * Chin. J. Org. Chem. 2005, 25(7), 826Nine 2-aminothiazole derivatives were obtained under microwave irradiation condition by the reaction of thiourea, iodine and ketone in the absence of solvent. The reaction conditions were optimized by orthogonal design. The mechanism of the cyclization reaction under microwave irradiation was also suggested.Synthesis of Hydrogenated Quinolinesby Michael Addition of 1,3-Cyclohexane- dione with β,β-DicyanostyreneWANG, Jin-Jun *; XIE, Lei; KANG, Ming- Qin; ZHANG, Min; LI, Fu-Guo; CUI, Bing-CunChin. J. Org. Chem. 2005, 25(7), 830The hydrogenated quinolines were synthesized by Michael addition of1,3-cyclohexanedione with β,β-dicyanostyrene which was converted into 1,8-naphthridine derivative by the condensation with 1,3-cyclohexane-dione.Hydrogenated benzo[c ]acridin-5-one was obtained using one pot method by co-refluxing of aromatic aldehyde, α-naphthyl- amine and 1,3-cyclohexanedione. Synthesis of Cyclic Dienol Ether and Its PropertiesHUANG, Yan; LIN, Yong-Cheng * Chin. J. Org. Chem. 2005, 25(7), 835。
N-{1-[取代吡啶(噻唑)甲基]-5-甲基-1H-1,2,3-三唑-4-甲酰基}-N′-(芳氧乙酰)肼的合成与生物活性
CHI S 0URN P I HE S R NE E J AL OFAP LED C MIT Y
Vo . 125 No. 1 1
NO . 0 8 V20
Ⅳ {.取代吡啶 ( .1[ 噻唑 ) 甲基 ]5甲基. 123三唑4・ 一一 1 ,,. 日一 甲酰基 } ( . .芳氧乙酰 ) 的合成 与生物活性 Ⅳ 肼
中图分类 号 :6 6 02
文献标识码 : A
文章编号 : 0 - 1 (0 8 1.2 6 5 1 00 8 20 ) 116 - 0 5 0
昆虫 生长调 节剂 (G s是一 类通 过干 扰 、 IR ) 破坏 昆虫 正 常生 长发 育来 杀灭 害虫 的杀 虫 剂 , 因其 独特
的作用方式和高度的安全性, 已成为害虫综合防治的重要方法[ 。 1 昆虫生长调节剂通过干扰几丁质的 ] 生物合成 , 使昆虫无法蜕皮或不完全致死性蜕皮 | ] 从化学结构分析 , 2。 主要有苯甲酰脲和双酰肼 , 代表 性的商品化品种有抑食肼 、 虫酰肼 、 环虫酰肼 、 除虫脲和氟虫脲等 。 ] 吡啶与噻唑类化合物不仅具有杀 菌、 杀虫杀螨 、 除草和抗病毒等多种生物活性 , 而且对哺乳动物的毒性低而引起广泛研究兴趣r 。 5 本 ]
文将芳 氧 乙酰肼 和含 吡啶 ( 噻唑 ) 123三 唑 的双 杂环进行 结构拼 接 , 计合 成 了一 系列 含双杂 环 的 与 ,,. 设
双酰肼化合物( ) 合成路线见 Shm 。 4, ce e1
He t
VC 1
!
Ht 。
v
N —
C 3 C2 2H H OH O 2 C C Cs
5mm l 氧 乙酰 肼 和 25mm l 酸钠 , 加入 T F和水 各 1 , o芳 . o碳 再 H 0mL 加热 搅拌 回流 ,L T C检 测下 反应 1 0~
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
关键词 N (一 .一 5吡 啶 甲 基 ) 甲酰 亚 胺 ;氧 化 反 应 ;亲 核取 代 反 应 ;微 波 辐 射 ;生 物 活 性 - 氯 1氧一一 2 二
S nh s f - 一 lr一一x 一一yii meh 1 i ro ymi y te i o ( Ch o 1o y5p r n s N 2 o d e ty d ab n l d )c i e
g v e e e N-2 c lr — — x 一 一 y iie ty) iab n l d s va c n e t n lmeh d a d mi a e sv n n w ( 一h o o lo y 5 p rdn meh 1dc o yi e i o v ni a t o n — r mi o
(C lg cec, ajn g iutrl nvri , ajn 1 0 5 ol e fSi e N ni A r l a i st N nig2 0 9 ) e o n g c u U e y (C l g Maeil c n e n n ier g N nigU ies A rn uis n As o a tsNajn 10 6 ol e f t a i c dE gn ei , ajn nvri o eo a t d t n ui , nig2 0 1 ) e o r Se a n y t f ca r c
Ab t a t T e n ce p i c s b t u i n o o a s m at o i a b n l d a 3 t 一 h o o s r c h u l o h l u si t f p ts i i t o u s l f dc r o yi s mi e 3  ̄ g wi 2 c l r 一 h
ng rcdrses u f ao n ihyed vrh o vninltr ga a i te ea r. h inpoeue,ayp r ct nadhg i s e ecnet asrn tmbe mprt eT e i i i l o t o ii nt u
sr cu e ft e e s n h t a g t o o n s we e c n i e y e e n a n l s s T I GC— S H t t r so s y t e i t e mp u d r o fr d b lme t la ay e ,F -R, u h c r c m M , NM R a d “ n C NM R s e t . e p e i n r i l g c l e t s o d t a e a n c mp u d a ee c l n p cr T r l ah mi a y b o o i a ss h we t r i o o n s v x e l t t h ct h e
i g r s r e un e o m a e s r s e s d s c d a t g s a h tr a ton t e nv r m e t l - n e ou c d rn r lpr s u e po s s e u h a v n a e ss or e ci i ,e ion m n a l be y
Der a ie nd ir wa e lr a in a d i t s u erM c o v v v radit n o
Bi lg c l t i s a c oo ia i t Re e r h Ac v y
L Z a . ig , 0。 h o Pn 。 Z HANG, a . n Xi Ya o YANG, n Ho g , 。
1 o y一 c o o t l y i i r p r d by o d to f t e n to e 一 h o o 5 c or m ehypy i i e - x 5一hl r mehy p rd ne p e a e xi a i n o h ir g n of 2 c l r 一 一 hl o t l rd n
摘要 以二 甲酰亚胺钾 3  ̄3 2氯一一 甲基 吡啶的 N原子氧化后得到 的2氯一一 5氯 甲基 吡啶发生亲核取代反应, a g与 一 5氯 一 1氧一一 用传统和微波两种 方法合成 了 7 未见文献报到 的化合物 N (一 1氧一一 啶甲基 ) 甲酰亚胺类化合物 4  ̄4 .对 比 种 - 氯一一 5吡 2 二 a g 两种合成 方法,在常压 下,微波辐射 作为反应热源 具有用 时少 、环境友好 、易纯化和 产率高 的特 点.这些 目标化 合物 4  ̄4 a g的结构经元素分析,R GC MS MR, CNMR确证.初步的生物活性测 定结果表明, - 一 1氧一一 I , — ,H N ” N ( 氯一一 5吡啶 甲 2 基) 甲酰 亚胺类 部分化合物具有 良好 的杀 虫活性 . 二
维普资讯
20 0 8年第 2 8卷 第 1 8  ̄9 期, 9 3
有 机 化 学
Ch n s o r a f r a i e s y i e eJ u n l g n cCh mi t o O r
V I2 . 0 8 o. 8 2 0
NO . 9 ̄ 9 1 8 3
研 究论 文
微波辐射合 成 N (一 1氧一一 - 氯一. 5吡啶 甲基) 甲酰亚胺类 化合物和 2 二
生物活性研 究
吕兆萍 张晓燕 杨 红牦
ቤተ መጻሕፍቲ ባይዱ(南 京 农 业 大 学 理 学 院
南京 209 ) 10 5
(南 京 航 空 航 天 大 学材 料 科 学 与 技 术 学 院 南 京 2 0 1) 10 6
