元素结合规律与赋存状态4
元素的结合规律与赋存方式

(4) 有利的矿物晶体构造
矿物的晶体构造愈复杂、松弛(偏离最紧密堆积愈远), 其中发生类质同象的可能性愈大。 例:沸石类矿物海绵状晶格中:
2K+ Ba2+ , 2K+ Ca2+ , 2Na+ Ca2+
25
(5) 代换的能量角度
KAlSi3O8(491.4KJ/mo l)
NaAlSi3O8 (247.8KJ/mol)
8
2 亲氧性元素(亲石元素)
只有能与氧以离子键性结合的金属; 亲氧元素:K、Na、Ca、Mg、Nb、Ta、Zr、Hf、 REE等; 易熔于硅酸盐熔体,主要集中在岩石圈。
9
3 亲硫性元素(亲铜元素)
只有能与硫结合形成高度共价键性质的金属; 亲硫元素:Cu、Pb、Zn、Au、Ag等; 易熔于硫化铁熔体。主要集中于硫化物—素
(1) 化学键性——首要条件
Cu+(0.96Å) 和 Na+(0.98Å) Hg2+(1.12Å) 和 Ca2+ (1.06Å)
电价相同,半径相似
但在硅酸盐造岩矿物中很少有Cu+、Hg 2+的存在; 在硫化物(Cu、Hg)矿物中也不易发现Na+、 Ca2+ 为什么?
CaAl2Si2O8 (256.2KJ/mol)
KCl晶格中K被Rb置换
16
1)类质同象和固溶体
(1) 概念
类质同象:某些物质晶体中
的部分构造位置随机地被介质 中地其他质点(原子、离子、 配离子、分子)所占据,结果 只引起晶格常数的微小变化, 晶体的构造类型、化学键类型 等保持不变,这一现象称类质 同象。
类质同象混入物 固溶体
17
5第二章元素的结合规律与赋存形式1.

第二章 元素的结合规律与赋存形 式Part1
9
2.现象:
造岩矿物种类——氧化物和含氧盐类比较
多;矿床的矿石矿物,如Pb、Zn、Cu、Fe等 重金属形成硫化物组合。 一些元素倾向于与氧结合形成氧化物或含 氧盐,而另一些元素则首先与硫化合形成硫 化物。 这就形成了地质学熟知的以造岩元素为主 体的含氧盐矿物类组合和以重金属元素为代 表的硫化物矿物类组合
2018/12/10
第二章 元素的结合规律与赋存形 式Part1
3
2.1
自然体系及自然作用产物
地球化学体系的特征 自然过程产物的特征 自然界元素结合的基本规律
2.1.1 2.1.2 2.1.3
2018/12/10
第二章 元素的结合规律与赋存形 式Part1
4
2.1.1
地球化学体系的特征
1、自然作用体系温度、压力等条件的变化 幅度与人为制备的条件相比是有限的。 2、自然作用体系是多组分的复杂体系。 3、自然作用体系是开放体系。 4、自然作用体系为自发进行的不可逆过程。
2018/12/10
第二章 元素的结合规律与赋存形 式Part1
5
2.1.2
自然过程产物的特征
1.自然稳定相(Minerals)和各种
流体相的总数有限, 2.元素成组分类自然组合, 3.自然产物的稳定相一般都是不纯 4.在地壳物理化学条件下,相似的物质
组成和类似的作用过程会使自然作用产物 的类型重复出现
亲 铁 元 素
亲 铜 元 素
亲 气 元 素
① 亲石元素 ;② 亲铜元素 ; ③亲铁元素 ;④ 亲气元 素 ;⑤ 亲生物元素
2018/12/10
第二章 元素的结合规律与赋存形 式Part1
煤中微量元素的赋存状态

煤中微量元素的赋存状态煤中微量元素是一类具有重要环境和生物学意义的组分。
在这些微量元素的赋存状态上,存在着关键的化学、物理和生物学影响,这种影响可能会影响煤的质量、热值、可燃性和毒性。
为了提高煤资源的经济价值,必须准确地测定煤中微量元素的赋存状态,以便合理地利用煤资源,保护环境并实现煤的可持续利用。
煤是一种自然的有机质材料,它的组成有很多种元素,其中微量元素包括碳(C),氢(H),氧(O),硫(S),氮(N),氟(F),磷(P),硒(Se),锰(Mn),铁(Fe),锌(Zn)和铜(Cu)等。
这些微量元素在煤体中的赋存状态有三种:元素,元素的混合物或元素的有机化合物,形成了多层次、复杂的赋存状态。
元素赋存状态是指元素自身在煤体中的存在形式,它主要有晶体和液体两种形式,这两种形式的元素具有不同的耐受性和迁移性,会影响煤的性质。
晶体元素,如铁、锰和锌,除了处于原子状态外,很容易形成氧化物,水解物或沉淀物,对其他元素有较大的分解、改变和稳定作用;液体元素,如氢、氧和氮,它们在煤体中一般少有极大的变化,但它们在煤体中具有迁移性,会影响煤体中其他元素的形成和运动。
元素混合物赋存状态是指元素形成包裹体,其中宿主支撑了元素的主要活性,从而形成特定的化学和物理组合。
这种混合物的存在,可以赋予煤体一定的比表面积和活性,体现出煤的性质,如热值、着火温度、煤气峰值等。
例如,燃烧过程中释放氮气,归因于煤体中FeN和SiN混合物;另外,锰、铁、锌和硫的混合物也能够影响煤的热值。
元素有机化合物的赋存状态指的是元素被有机物所包裹,形成特定的有机化合物,这些有机物可能是有机磷酸盐、羧酸盐、酰胺类化合物、含氮有机物等。
它们的存在会影响煤的可燃性和毒性,在煤的燃烧过程中,这些有机化合物也会形成有害的物质,如硫氧化物、氮氧化物等,从而对环境造成污染。
综上所述,煤中微量元素的赋存状态对煤的质量、热值、可燃性和毒性具有重要影响。
因此,为了更加合理地利用煤资源,保护环境并实现煤的可持续性利用,必须准确地测定煤中微量元素的赋存状态,以期提高煤资源的经济价值。
元素结合规律与赋存状态2

静电引力吸引。由于电子云球
形对称,离子键无方向性和饱
和性,配位数较大-极性键。
▪ 离子键结合晶体为离子晶体,
硬度中等、比重和熔点高,极
性分子溶剂中易溶解。
Na和Cl形成氯化钠化学键。钠原子外电子层1个电子转移到1个氯原 子的外电子层,钠变为阳离子,氯变为阴离子。
带负电荷的离子(获得电子)称为阴离子 Negatively charged ions (gain of electron) are called anions.
岩石-Rock
一种天然产出的矿物或类矿物组成 的固结混合物
A naturally occurring consolidated mixture of minerals or mineral-like substances
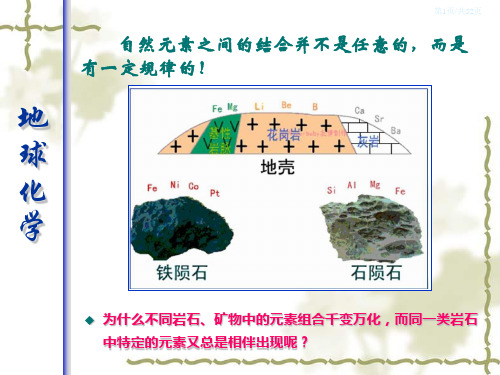
第2章 元素结合规律与赋存状态
2.3 元素结合的微观控制因素
自然体系中元素结合规律受体系中元素种类和相 对丰度控制,但是元素的结合归根到底是一种化 学行为,任何条件下元素的结合都与原子内部结 构(原子电子层结构)有关。如果生成结晶化合物, 元素结合还与晶体结构有关。
控制元素结合的微观因素包括原子(离子)半经、 配位数、原子和离子极化、最紧密堆积等。还受 体系性质和热力学规律影响,受体系化学组成、 温度、压力、氧化还原电位等宏观因素影响。
矿物物理和化学性质最重要的因素。硬度、解理、 熔点、电导性和热导性、热膨胀系数等直接与键 力大小有关。
▪ 平均键力越强,晶体硬度越大、熔点越高、热膨
胀系数越小。
两种原子模型-模型中的粒 子大小不成比例.电子很小. 质量为质子质量1/1837。 核与电子层壳之间的空间 比图示大的多
电子轨道模型-玻尔模型 由质子和中子组成的原子 核(核直经仅占原子直经的 1/1万)和核外高速旋转电 子构成
煤中微量元素

赋存于 矿物中
被有机 质束缚
溶于孔 隙水中
主要指氯及其 他易溶元素
二、微量元素在煤中的赋存状态
1、煤中矿物
煤中矿物是微量元素最主要的载体,其矿物特征如下: 第一、煤中矿物种类繁多。主要是少见和偶见的矿物种类很多。 常见的有粘土矿物(高岭石、伊利石、绢云母、蒙脱石);黄铁矿和白 铁矿;石英;方解石和菱铁矿、白云石等;褐铁矿和铝土矿。 以上常见的矿物占煤中矿物含量的绝大部分,其中又以粘土类矿物为主。 第二、煤中矿物产状复杂。 分散的晶体颗粒、球粒、结核、透镜体、条带等,充填在煤的割理和其它 裂隙中。 第三、煤中矿物具有多种成因和多期生成的特点。 多种来源:植物成因的;陆源碎屑成因的;火山成因的矿物;化学成因的。 多期形成:同生的(特别是粘土矿物、煤中多数黄铁矿);后生的(方解石等)。
其中,在1018个样品中属于一级的样品数占78.68%;属于二级的样品数占9.82%; 属于三级和四级的样品数共占11.5%。
三、煤中砷
1. 煤中砷的丰度
地区 全国 华北 华南 全国 全国 全国 省(市、 w(As) 自治区) 10-6 黑龙江 吉林 0.61~5.01 2.15~119.0 C-N C-P P T J-K E-N 中国煤中砷的含量w(As),10-6 成煤时代 样品数 范围 算术平均值 3193 249 590 93 892 16 0.4~10 0.4~10 0.5~25 1.0~10 0.5~10 2.0~15 5 3 10 3 2 11 省(市、 w(As) 自治区) 10-6 贵州 2.49~6.2 0.32~31.7 资料来源
结合以上文献,依据大量数据资料,推理出47种元素在我国大多数煤中含量平均 值范围段: 元素含量平均值范围段 元 素
地球化学复习重点

绪论:1. 地球化学:地球化学是研究地球及其子系统(含部分宇宙)的化学组成、化学作用和化学演化的科学.2. 地球化学研究的基本问题:①元素(同位素)在地球及各子系统中的组成②元素的共生组合和存在形式③研究元素的迁移④研究元素(同位素)的行为⑤元素的地球化学演化3. 地球化学的研究思路:"见微而知著"。
通过观察原子、研究元素(同位素),以求认识地球和地质作用地球化学现象。
4. 简述地球化学的研究方法:A. 野外工作方法:①宏观地质调研②运用地球化学思维观察、认识地质现象③在地质地球化学观察的基础上,根据目标任务采集各种地球化学样品B.室内研究方法:④量的测定,应用精密灵敏的分析测试方法,以取得元素在各种地质体中的含量值⑤质的研究,也就是元素结合形态和赋存状态的研究⑥动的研究,地球化学作用过程物理化学条件的测定和计算。
包括测定和计算两大类。
⑦模拟地球化学过程,进行模拟实验。
⑧测试数据的多元统计处理和计算。
第一章:基本概念1. 地球化学体系:我们把所要研究的对象看作是一个地球化学体系,每个地球化学体系都有一定的时间连续,具有一定的空间,都处于特定的物理化学状态(T、P 等)2. 丰度:一般指的是元素在这个体系中的相对含量(平均含量)。
3. 分布:元素的分布指的是元素在一个化学体系中(太阳、陨石、地球、地壳、某地区)整体的总的含量特征。
4. 分配:元素的分配指的是元素在各地球化学体系内各个区域、各个区段中的含量。
5. 研究元素丰度的意义:①元素丰度是每一个地球化学体系的基本数据以在同一体系中或不同体系中用元素的含量值来进行比较,通过纵向(时间)、横向(空间)上的比较,了解元素基本特征和动态情况,从而建立起元素集中、分散、迁移等系列的地球化学概念。
是研究地球、研究矿产的重要手段之一。
②研究元素丰度是研究地球化学基础理论问题的重要素材之一。
宇宙天体是怎样起源的?地球又是如何形成的?地壳中主要元素为什么与地幔中的主要元素不一样?生命是怎么产生和演化的?这些研究都离不开地球化学体系中元素丰度分布特征和分布规律。
第二章 元素的结合规律与赋存形式(R)
② 吸附相杂质:不参加主矿物晶格,在矿
物表面、裂隙面等呈吸附状态; ③ 超显微非结构混入物:(<0.001mm)
它不占主矿物晶格位置,但又不能形成可以 进行矿物学 研究的颗粒(其成分和性质不清, 下图);
地 球 化 学
第5页/共52页
一、自然界元素结合的类型及特点
元素赋存形式的研究方法: 矿物学观察及X射线衍射法 电子探针 萃取法(偏提取法)
第6页/共52页
元素结合规律可从两个不同侧面来衡量:
地
从能量的侧面:衡量元素结合的能量参数:
球
电负性(X)、电离势(I)、电子亲和能(Y)、晶
化 格能(U); 从空间几何形式的侧面:半径(原子、离子)、配
第9页/共52页
(一)亲铁性
地
元素在自然界以金属状态产出的一种倾向。
球
铁具有这种倾向,在自然界中,特别是O,S丰度低
化 的情况下,一些元素往往以自然金属状态存在,常常与
学 铁共生,称之为亲铁元素。 基本特征:不易与其他元素结合,因为它们的价电
子不易丢失(具有较高电离能)。
代表元素:铂族、Cu、Ag、Au、Fe、Co、Ni等。
FeSiO3+MnS→MnSiO3+FeS (25℃时:Gr=-11.56 KJ<0,反应向右进行)
第16页/共52页
(三)自然界元素亲和性的特点
地 1. 双重性和过渡性:
球
自然界元素的亲和性不是绝对的,存在着双重性和
过渡性。
化
学
地 球 化 学
2. 不同价态元素亲和性
第17页/共52页
地球化学课件

2) 原子(离子)结合时的几何关系
化学键性相同时,是否发生类质同象取决于 原子 (离子)结合时的几何关系-半径,配位数等。同价类质 同象发育程度主要取决于离子半径差,差值增大, 类质同象臵换范围减小; r1和r2分别代表较大离子和较小离子的半径,当: (r1-r2)/r2<10~15%, 形成完全类质同象,端元组分 间无限混溶; (r1-r2)/r2=10到20~40%, 高温下完全类质同象,低 温时形成不完全类质同象,固溶体发生分解; (r1-r2)/r2>25~40%, 高温下只能形成不完全类质同 象,低温下不能形成类质同象;
1.戈尔德斯密特类质同象法则 戈尔德斯密特(1937)在研究岩浆结晶过程中元素 在矿物间分配的基础上,总结出元素发生类质同 象臵换的规律; 1)小离子优先法则:两种离子电价相同,半径相似, 小半径离子优先进入矿物晶格,集中于早结晶矿 物中,大半径离子集中于晚结晶矿物中。 Mg2+、Fe2+、Mn2+和 Ca2+离子半径分别为0.078nm, 0.083nm,0.091nm,0.099nm,因此Mg2+、Fe2+ 集中在早期结晶橄榄石等矿物中, Mn2+和Ca2+集 中在晚期晶出的辉石,角闪石, 斜长石和黑云母 等矿物中;
同样Ca2+和Hg2+,二者半径相近 (rCa2+=1.05A, rHg2+=1.12A),电荷也相同, 但因二者电负性相差较大(Ca1.0,Hg1.9), 也不能相互臵换。硅酸盐造岩矿物中不易 发现Cu和Hg等元素,反之赋存Cu和Hg等元 素的硫化物中也不易发现Na、Ca等元素;
键性接近是类质同象置换的首要条件。
当两种元素数量差异很大时一种元素以分散量进入另一元素晶格主导和伴生元素地球化学参数相近伴生元素隐藏在主导元素晶格中称为内潜同晶内潜同晶置换可以使许多地球化学行为相同或相地球化学行为相同或相近的元素依次进入晶格形成内潜同晶链近的元素
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
晶体场--带负电荷配位体对中心离子产生的静电场.
将一个过渡金属离子放到正八面体配位晶体中,据最小能量原理,
原子中电子充填先从能量最低的1s开始,s轨道最多充填2个电子, 电子云呈球形对称。p电子层有3个自旋成对p轨道: px, py,pz,电子云
呈哑铃形,分别和x,y,z轴方向相一致。
d电子轨道 几何形态
正八面体场中配位体处于直 角坐标三个垂直轴方向。阳 离子的d电子有5个轨道: dx2-dy2, dz2, dyz, dxy, dxz.电 子云呈花瓣状。 dx2-dy2,dz2延伸方向与x,y,z轴 一致。dyz,dxy,dxz沿二轴间 坐标平分线延伸。 沿轴延伸的dx2-dy2, dz2电子 云瓣指向配位体,造成dx2dy2,dz2轨道电子斥力>沿轴对 角线延伸的dyz, dxy, dxz轨道
1. d-电子层未充满元素,包括3d,4d,5d未充满元素: 第一过渡系列:Sc,Ti,V,Cr,Mn,Fe,Co,Ni,Cu 第二过渡系列:Y,Zr,Nb,Mo,Ru,Rh,Pd,Ag 第三过渡系列:Hf,Ta,W,Re,Os,Ir,Pt,Au 2. 镧系或4f电子未充满元素,15个稀土元素 3. 锕系或5f电子未充满元素 约占地壳元素一半(包括惰性元素), 金属元素大
Geochemistry: Applications of Quantum Mechanics in the Earth and Mineral Sciences. Oxford University Press.1992
李高山,李英堂,量子矿物学,地质出版社,
1994。
2.5 过渡元素的结合规律- 晶体场理论和配位场理论
第2章元素结合规律与赋存状态
参考书:
Burns R G. Mineralogical Applications of
Crystal Field Theory. Cambridge University Press.1993.
Tossell J A and Vaughan D J. Theoretical
(2) 五重简并:在一个孤立的过渡金属离子中,五 个d轨道能级相同,电子云呈球形对称,电子在五 个d轨道上分布概率相同--五重简并。中心离子处 于晶体场中时,五个d轨道有明显方向性,在晶体 场作用下发生分裂,使d轨道简并度降低。
(3) 晶体场分裂:当过渡金属离子处在晶体结构中 时,由于晶体场非球形对称特征,使d轨道能级产 生差异,称为晶体场分裂。
一组是能量低的dxy,dxz和dyz轨道t2g(dε)轨道
符号表示对称类型,e为二重简并, t 为 三 重 简 并 , g 为 中 心 对 称 。 eg 和 t2g轨道的能量差为晶体场分裂能,
用△表示。
晶体场分裂能
5个能量相等的d轨道, 在八面体场作用下分
裂为两组:一组能量
高 : dx2-dy2,dz2, 为 eg(dγ)轨道;另一组能 量 低 : dxy,dxz,dyz, 为 t2g(dε)轨道。 e-二重简并, t-三重简 并, g-中心对称。 eg轨 道 和 t2g 能 量 差 为 晶
部分--晶体场和配位场理论的意义。
图2.21 过渡族元素 及其用途
过渡金属离子的电子层结构:
过渡金属离子的共同特征是具有未充满的d电子轨 道层,第一过渡系列元素的基本电子构型:
(1s)2(2s)2(2p)6(3s)2(3p)6(3d)1-10(4s)1-2
2.4.1 晶体场理论基本要点
1929年,贝特将群论和量子力学用于静电理论发展而成。 1959年威廉士首先用晶体场理论解释地质现象,此后凡涉 及过渡元素地球化学行为均用此解释,取得了较好效果。
将一个孤立的过渡金属离子放到正八面体配位的 晶体中时,根据量子力学和最小能量原理,原子 中电子充填首先从能量最低的1s开始,s轨道最多 充填2个电子,电子云呈球形对称(图2.22)。
p轨道可以有3个自旋成对的p轨道:px,py,pz轨道, 电子云呈哑铃形,分别和x,y,z轴一致(图2.22)。
图2.22 晶体场中s,p,d轨道状态的y2极坐标图
由元素的地球化学亲和性的讨论已知元素间通过 化学键相结合,化学键的性质和强弱决定了元素 结合的牢固程度和结合后表现的性质。但是对于 过渡性元素的地球化学性质,还须辅之以晶体场 理论和配位场理论才能得到较好解释。
过渡元素-凡d,f电子层未充满的元素(包括氧化状 态未充满元素Cu,Ag,Au)均为过渡元素。三类:
体场分裂能.用△表示
图2.25 八面体配位中过渡金属离子d轨道的分裂示意图 In an octahedral crystal field, the energy of the d orbitals projected between the coordinates and the ligands (the t2g orbitals) are lowered relative to the energy
图2.24 正八面体配位时电子云排布(b和c), b:八面体6个顶点的实心球为配位体,使dx2-dy2(c图空 心椭球)轨道电子的排斥力>沿坐标轴对角线方向延伸的
dxy(斜线椭球), dxz, dyz轨道的排斥力。
晶体场分裂能:
5个能量相等的d轨道,在八面体场 作用下,分裂为两组:
一 组 是 能 量 高 的 dx2-dy2,dz2 轨 道 -eg(dγ)轨道
处在八面体场中的一个过渡金属元素在其d 轨道能级上会发生两个变化:
1. 由于阴离子场的整体排斥力会使平均能 量增大;
2. 能级发生分裂
1. 正八面体配位d轨道分裂和晶体场分裂能
(1) 非过渡型离子电子轨道在空间迭合呈球形对称 分布,过渡型离子因d层电子未充满不呈球形对称。 假设处于晶体场中的中心离子和配位体之间的作用 是纯静电作用,两者间不存在轨道重叠。
