有机化学 第九章
合集下载
有机化学 第9章 醛、酮、醌

对于脂肪醛、酮来说,α-H的活泼性表现在可以H+的 形式解离,并转移到羰基的氧上,形成所谓烯醇式异构体。
O CH3-C-CH3
酮式
OH CH3-C=CH2
烯醇式
碱和酸都可以促使烯醇化,原因如下: 碱促进烯醇化的理由:碱可以夺取α-H,而产生碳负离子
O B: + H-CH2-C-CH3
O 碳负离子 -CH2-C-CH3
3、氧化
醛和酮最主要的区别是对氧化剂的敏感性。因为醛中羰 基的碳上连有氢,所以醛很容易被氧化为相应的羧酸。而酮 则不易被氧化。因此用此性质可区别醛酮,常用弱的氧化剂 如托伦试剂(硝酸银的氨溶液),Ag+即可将醛氧化为羧酸, 本身被还原为金属银Ag。P:164页
OH-
RCHO + Ag+ 托伦试剂
Ag + RCOO- 银镜反应
由于生成复杂的氧化产物,酮氧化一般没有合成意义。 但环己酮氧化是工业上生产己二酸的方法。
O KCrO4 + H2SO4 HOOCCH2CH2CH2CH2COOH
环己酮
己二酸
4、烃基上的反应
(1)α-H的活性 与羰基相邻的碳(α-C)上的氢叫α-H,由于羰基中氧
原子的电负性较强,使得α-C上电子密度有所降低,从而 使α-H与分子中其它碳原子上的氢相比,酸性有所增强, 即具有一定的活性。
6、酮还有一种命名法:根据羰基所连的两个烃基而命名, 简单在前,复杂在后,最后加一酮字。如:
O C-CH3
苯乙酮 甲基苯基酮
O CH3-C-CH2CH3
丁酮 甲基乙基酮
物理性质
醛、酮分子间不能形成氢键,没有缔 合作用,但由于极性较强, 因此沸点比相 应(或分子量相近的)醇低,比相应的烷 烃和醚高。
O CH3-C-CH3
酮式
OH CH3-C=CH2
烯醇式
碱和酸都可以促使烯醇化,原因如下: 碱促进烯醇化的理由:碱可以夺取α-H,而产生碳负离子
O B: + H-CH2-C-CH3
O 碳负离子 -CH2-C-CH3
3、氧化
醛和酮最主要的区别是对氧化剂的敏感性。因为醛中羰 基的碳上连有氢,所以醛很容易被氧化为相应的羧酸。而酮 则不易被氧化。因此用此性质可区别醛酮,常用弱的氧化剂 如托伦试剂(硝酸银的氨溶液),Ag+即可将醛氧化为羧酸, 本身被还原为金属银Ag。P:164页
OH-
RCHO + Ag+ 托伦试剂
Ag + RCOO- 银镜反应
由于生成复杂的氧化产物,酮氧化一般没有合成意义。 但环己酮氧化是工业上生产己二酸的方法。
O KCrO4 + H2SO4 HOOCCH2CH2CH2CH2COOH
环己酮
己二酸
4、烃基上的反应
(1)α-H的活性 与羰基相邻的碳(α-C)上的氢叫α-H,由于羰基中氧
原子的电负性较强,使得α-C上电子密度有所降低,从而 使α-H与分子中其它碳原子上的氢相比,酸性有所增强, 即具有一定的活性。
6、酮还有一种命名法:根据羰基所连的两个烃基而命名, 简单在前,复杂在后,最后加一酮字。如:
O C-CH3
苯乙酮 甲基苯基酮
O CH3-C-CH2CH3
丁酮 甲基乙基酮
物理性质
醛、酮分子间不能形成氢键,没有缔 合作用,但由于极性较强, 因此沸点比相 应(或分子量相近的)醇低,比相应的烷 烃和醚高。
大学有机化学第九章卤代烃
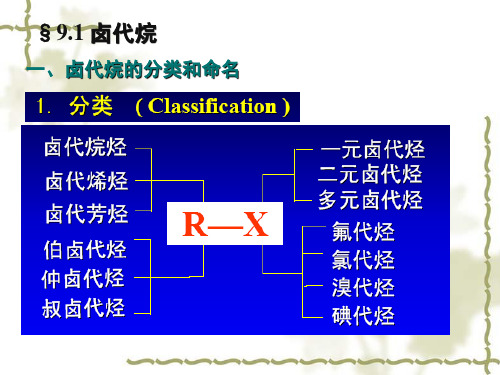
❖ 2应、速S度N2与历卤程代在烃动和力碱学有上关一。般为二级反应,其反
❖ 3、反应的进攻试剂(HO-)从离去基团的反面 进攻反应底物,产物的构型翻转(瓦尔登转化)
❖ 4、反应过程中是通过一个过渡态而转化为产 物,没有碳正离子中间体生成,不发生重排, 无重排产物。
2. 单分子亲核取代反应(SN1):
C2H5
4-乙基-6-氯-2-己烯
二. 卤代烃的物理性质
❖ 常温常压下:CH3Cl,C2H5Cl及CH3Br Gas ❖ 其它常见RX Liquid
❖ >C15
Solid
❖ RX:分子极性小,不溶于水,易溶于许多有机化
合物(做溶剂)。如:氯仿(CHCl3)
❖ 卤代烷:X数增加,可燃性降低。CCl4为灭火剂
CH3
CH3 C Cl + NaOH
CH3
CH3 C CH2 +NaCl + H2O
CH3
CH2 CH2 Cl ,
Cl
x 几乎不反应
❖ C、由于多数RX由相应的醇制备,因此用此
法制备醇在合成上意义不大。但少数醇可以 用此法。例如:
CH3 Cl2 hv
CH3CH=CH2
Cl2 hv
CH2Cl H2O/NaOH 加加
加热才沉淀
7、与炔钠的反应 (亲核试剂:RC≡C-)
RC≡CH NaNH2 RC≡CNa
液NH3
10 R’X
RC≡CR’
注意:NaNH2是强碱,不能使用叔(30)卤烷,否则 将主要得到烯烃。乙烯型卤代物,卤苯型化合物在
该条件下反应几乎不发生。
二、亲核取代反应历程及立体化学
δR δX + Nu 反应物 亲核试剂
按②:
❖ 3、反应的进攻试剂(HO-)从离去基团的反面 进攻反应底物,产物的构型翻转(瓦尔登转化)
❖ 4、反应过程中是通过一个过渡态而转化为产 物,没有碳正离子中间体生成,不发生重排, 无重排产物。
2. 单分子亲核取代反应(SN1):
C2H5
4-乙基-6-氯-2-己烯
二. 卤代烃的物理性质
❖ 常温常压下:CH3Cl,C2H5Cl及CH3Br Gas ❖ 其它常见RX Liquid
❖ >C15
Solid
❖ RX:分子极性小,不溶于水,易溶于许多有机化
合物(做溶剂)。如:氯仿(CHCl3)
❖ 卤代烷:X数增加,可燃性降低。CCl4为灭火剂
CH3
CH3 C Cl + NaOH
CH3
CH3 C CH2 +NaCl + H2O
CH3
CH2 CH2 Cl ,
Cl
x 几乎不反应
❖ C、由于多数RX由相应的醇制备,因此用此
法制备醇在合成上意义不大。但少数醇可以 用此法。例如:
CH3 Cl2 hv
CH3CH=CH2
Cl2 hv
CH2Cl H2O/NaOH 加加
加热才沉淀
7、与炔钠的反应 (亲核试剂:RC≡C-)
RC≡CH NaNH2 RC≡CNa
液NH3
10 R’X
RC≡CR’
注意:NaNH2是强碱,不能使用叔(30)卤烷,否则 将主要得到烯烃。乙烯型卤代物,卤苯型化合物在
该条件下反应几乎不发生。
二、亲核取代反应历程及立体化学
δR δX + Nu 反应物 亲核试剂
按②:
有机化学-第九章

甲醇(球棒模型) CH3OH 甲醇(球棒模型)
乙醇(比例模型) C2H5OH 乙醇(比例模型)
9.1 醇的结构和分类
由于氧原子的强吸电子作用,使醇羟基上的氢有一定的酸 酸 性,而氧原子上的未共用电子对则有一定的碱性和亲核性 碱性和亲核性 。 受羟基的影响,醇的α-碳和该碳上的氢(α-H)容易发 生氧化或脱氢反应 氧化或脱氢反应,而β-碳上的氢则可参与分子内的脱 氧化或脱氢反应 分子内的脱 水反应。 水反应
醇一般有如下酸性强弱次序: CH3OH > 1o ROH > 2o ROH > 3o ROH
9.2 醇的化学性质
醇的酸性虽然很弱,但也足以使Grignard试剂发生分解。 Grignard试剂 Grignard试剂
9.2 醇的化学性质
醇羟基中的氢可被活泼的金属单质置换,放出氢气并生成 醇金属。
9.2 醇的化学性质
9.2 醇的化学性质
醇氧化与脱氢反应
一、醇的氧化
1.伯醇的氧化 1.伯醇的氧化 由于羟基的影响,醇的α-氢原子比较活泼,容易被氧 化。伯醇被氧化剂(如K2Cr2O7、KMnO4、浓HNO3等)氧化时, 先是生成醛,然后进一步被氧化,生成羧酸。
9.2 醇的化学性质
采用一种称为 PCC 的氧化剂,用于氧化伯醇制取醛是比 较好的氧化方法之一。PCC(pyridinium chlorochromate) PCC( chlorochromate) PCC 在盐酸溶液中的络合盐,又称Sarrett试 Sarrett试 是吡啶和 CrO3 在盐酸溶液中的络合盐 Sarrett 剂,是橙红色晶体,它溶于 CH2Cl2,在室温下便可将伯醇 氧化为醛。
9.3 酚的结构分类以及化学性质
酚羟基上的反应
《有机化学》第九章

(一)酸水液提取法
第九章
水溶液直接提取法不利于那些碱性较弱不能直接溶解于水的生
物碱提取,因此可采用偏酸性的水溶液,使生物碱与酸作用生成盐
进行生. 物碱提取。具有碱性的生物碱在植物体中多以盐的形式存在, 而弱碱性或中性生物碱则以不稳定的盐或游离碱的形式存在,故常
用0.5%~2%的乙酸、盐酸等为溶剂。
29 第二节 生物碱
二 、 生物碱的提取方法
(二)醇类溶剂提取法
游离生物碱及其盐一般都能溶于甲醇和乙醇,因此用它 们作为生物碱的提取溶剂,应用较为普遍。甲醇的极性比乙 醇的极性大,对生物碱的溶解性比乙醇好,甲醇的沸点也比 乙醇低,但对视神经的毒性很大,所以除实验室有时将甲醇 作为生物碱提取溶剂外,多数用乙醇作为溶剂,有时也用稀 乙醇(60%~80%)作溶剂。通常采用醇提—酸水—碱化— 亲脂性溶剂萃取的方法反复进行。
N
-
N
CH3
33 第二节 生物碱
三 、 重要的生物碱
(三) 麻黄碱
第九章
麻黄碱俗称麻黄素,分子中有两个手性碳(用*标记),麻黄碱的分子结构式如下:
糠醛是重要的化工原料,可用 于制造酚醛树脂、农药、医药(如 呋喃妥因、呋喃唑酮)等。
O2N- O
O -CH=N-N-C = O
CH2-CH2
- -
-
呋喃唑酮(痢特灵)
19 第一节 杂环化合物的分类和命名
四、 重要的杂环化合物及其衍生物
(二) 吡咯衍生物——叶绿素、血红素和维生素B12
第九章
20 第一节 杂环化合物的分类和命名
1
第九章 杂环化合物、生物碱
【知识目标】 理解杂环化合物的分子结构、分类。 掌握五元单杂环、六元单杂环化合物的化学性质。 掌握杂环化合物的分类和命名方法。 了解几种重要的生物碱(麻黄素、烟碱、小檗碱、鸦片制剂)。 【技能目标】 掌握常见杂环化合物、生物碱的鉴别方法。
第九章
水溶液直接提取法不利于那些碱性较弱不能直接溶解于水的生
物碱提取,因此可采用偏酸性的水溶液,使生物碱与酸作用生成盐
进行生. 物碱提取。具有碱性的生物碱在植物体中多以盐的形式存在, 而弱碱性或中性生物碱则以不稳定的盐或游离碱的形式存在,故常
用0.5%~2%的乙酸、盐酸等为溶剂。
29 第二节 生物碱
二 、 生物碱的提取方法
(二)醇类溶剂提取法
游离生物碱及其盐一般都能溶于甲醇和乙醇,因此用它 们作为生物碱的提取溶剂,应用较为普遍。甲醇的极性比乙 醇的极性大,对生物碱的溶解性比乙醇好,甲醇的沸点也比 乙醇低,但对视神经的毒性很大,所以除实验室有时将甲醇 作为生物碱提取溶剂外,多数用乙醇作为溶剂,有时也用稀 乙醇(60%~80%)作溶剂。通常采用醇提—酸水—碱化— 亲脂性溶剂萃取的方法反复进行。
N
-
N
CH3
33 第二节 生物碱
三 、 重要的生物碱
(三) 麻黄碱
第九章
麻黄碱俗称麻黄素,分子中有两个手性碳(用*标记),麻黄碱的分子结构式如下:
糠醛是重要的化工原料,可用 于制造酚醛树脂、农药、医药(如 呋喃妥因、呋喃唑酮)等。
O2N- O
O -CH=N-N-C = O
CH2-CH2
- -
-
呋喃唑酮(痢特灵)
19 第一节 杂环化合物的分类和命名
四、 重要的杂环化合物及其衍生物
(二) 吡咯衍生物——叶绿素、血红素和维生素B12
第九章
20 第一节 杂环化合物的分类和命名
1
第九章 杂环化合物、生物碱
【知识目标】 理解杂环化合物的分子结构、分类。 掌握五元单杂环、六元单杂环化合物的化学性质。 掌握杂环化合物的分类和命名方法。 了解几种重要的生物碱(麻黄素、烟碱、小檗碱、鸦片制剂)。 【技能目标】 掌握常见杂环化合物、生物碱的鉴别方法。
有机化学

+ I (CH3CH2)4N
碘化四乙铵
(CH3CH2)3N OH CH3
氢氧化甲基三乙铵
+
练习题
NHCH3
[ (CH3)2N(C 2H5)2] I
+
N-甲基苯胺
NH2
碘化二甲基二乙基铵
CH3CHCHCH2CH3 CH3
3-甲基-2-氨基戊烷
二.胺的物理性质(自学)
三.胺的化学性质 胺的分子结构
●●
4.与亚硝酸反应 脂肪族伯胺
R NH2 NaNO2 HCl
0-5℃醇、烯、卤代烃
N2
放出的氮气是定量的,可用于氨基的定量分析 。
芳香族伯胺
Ar NH2
0
NaNO2 HCl
。 5C
[Ar
N N]Cl
H2O
NaCl
芳香胺重氮盐 低温稳定,室温分解成酚和氮气
仲胺与亚硝酸反应
R2NH NaNO2 HCl R2N N O (黄色油状)
重氮化反应应用
可以制备一些不能用直接方法制备的化合物
NO2 浓HNO3 浓 H2SO4 N2+ClNaNO2 HCl
0 5。 C
NH2 Fe HCl
NH2 Br2 H2O Br Br Br
Br Br
Br
H3PO2
Br Br
Br
(2)偶联反应
重氮盐与芳香叔胺类或酚类化合物在弱碱性、中性或弱 酸性溶液中发生反应,生成偶氮化合物,称为偶联(偶合) 反应。
CH3 N CH2CH3
N
CH2CH3
Cl
N-甲基-N-乙基环戊胺 H2NCH2CH2 CH2 CH2 NH2 1,4-丁二胺(腐胺)
N-甲基-N-乙基-4-氯苯胺 CH3CH2NHCH2CH2CH3 乙、丙胺
有机化学

CH3CH—CHCH3 + HBr CH3 OH (CH3)2CCH2CH3 Br 64%(重排产物)
有机化学 第九章 醇、酚、醚
我们知道,仲醇与HBr反应是SN1机理:
有机化学
第九章 醇、酚、醚
CH3 C OH CH3
HCl
?
当羟基所在的碳原子上连有环烷基时,重排生成扩环产物。例如:
有机化学
第九章 醇、酚、醚
有机化学
第九章 醇、酚、醚
有机化学
第九章 醇、酚、醚
(二)弱碱性
氧盐
有机化学
第九章 醇、酚、醚
二、羟基的取代反应(C-O键断裂)
醇可以与多种卤化试剂作用,羟基被卤原子取代而中成卤 代烃。 (一)与氢卤酸的反应
R— OH + H— X
(1)反应机理
RX +
H2O
醇与氢卤酸反应涉及C—O键断裂。卤素(X–)取代羟基 ((OH),属于亲核取代(SN),不结构的醇采取不同的机理 (SN1或SN2)。
有机化学
第九章 醇、酚、醚
(三)频哪醇的脱水及频哪醇重排
通常将两个羟基都连在叔碳原子的歧α-二醇称频哪醇(pinaco1)。 在A12O3作用下频哪醇发生分子内脱除两分子水的反应生成共轭二 烯烃:
第三节
醇的化学性质
羟基是醇的官能团,醇的化学性质主要由羟基决 定,大部分反应都涉及O—H键断裂或C—O键断裂。
R CH2 — O — H
在化学习醇的化学性质时,要注意断键的部位,这 对了解它们的反应机理、活性及有关规律是很重要的。
有机化学
第九章 醇、酚、醚
一、酸性和碱性
(一)弱酸性 (羟基中氢的反应,O—H键断裂)
有机化学
有机化学 第九章 醇、酚、醚
我们知道,仲醇与HBr反应是SN1机理:
有机化学
第九章 醇、酚、醚
CH3 C OH CH3
HCl
?
当羟基所在的碳原子上连有环烷基时,重排生成扩环产物。例如:
有机化学
第九章 醇、酚、醚
有机化学
第九章 醇、酚、醚
有机化学
第九章 醇、酚、醚
(二)弱碱性
氧盐
有机化学
第九章 醇、酚、醚
二、羟基的取代反应(C-O键断裂)
醇可以与多种卤化试剂作用,羟基被卤原子取代而中成卤 代烃。 (一)与氢卤酸的反应
R— OH + H— X
(1)反应机理
RX +
H2O
醇与氢卤酸反应涉及C—O键断裂。卤素(X–)取代羟基 ((OH),属于亲核取代(SN),不结构的醇采取不同的机理 (SN1或SN2)。
有机化学
第九章 醇、酚、醚
(三)频哪醇的脱水及频哪醇重排
通常将两个羟基都连在叔碳原子的歧α-二醇称频哪醇(pinaco1)。 在A12O3作用下频哪醇发生分子内脱除两分子水的反应生成共轭二 烯烃:
第三节
醇的化学性质
羟基是醇的官能团,醇的化学性质主要由羟基决 定,大部分反应都涉及O—H键断裂或C—O键断裂。
R CH2 — O — H
在化学习醇的化学性质时,要注意断键的部位,这 对了解它们的反应机理、活性及有关规律是很重要的。
有机化学
第九章 醇、酚、醚
一、酸性和碱性
(一)弱酸性 (羟基中氢的反应,O—H键断裂)
有机化学
有机化学精品教学课件:第九章醚

有机化学精品教学课件: 第九章醚
• 醚的简介 • 醚的合成 • 醚的用途 • 醚的衍生物 • 醚的安全性
01
醚的简介
醚的定义
01
02
03
醚的定义
醚是一类由醇和酚的分子 间脱水形成的化合物,其 结构通式为R-O-R',其中 R和R'是烃基。
醚的形成
醚可以通过醇或酚分子间 脱水反应生成,反应过程 中需要酸催化。
03
醚的用途
作为溶剂
醚类化合物由于其低极性和良好的溶解能力,常被用作溶剂,如石油醚、乙醚等。
在化学实验中,醚类化合物常被用作反应溶剂,有助于提高反应速率和选择性。
醚类溶剂在涂料、油漆、油墨等工业领域也有广泛应用,能够提高产品的性能和稳 定性。
在医药中的应用
醚类化合物在药物合成中具有重 要作用,许多药物分子中都含有
醇分子内脱水
总结词
醇分子内脱水是制备醚的一种方法,通过醇分子内的脱水反应生成醚。
详细描述
醇分子内脱水是一种制备醚的方法,通过醇分子内的脱水反应生成醚。在酸性催化剂的作用下,醇分 子内脱水反应可以发生,生成相应的醚类化合物。该方法具有操作简便、条件温和的优点,适用于制 备结构简单的醚类化合物。
酚烷基化反应
硝基醚
硝基醚是指醚的烃基部分被硝 基取代的一类化合物。
硝基醚具有较高的稳定性,在 酸性或碱性条件下不易发生水 解反应。
硝基醚在有机合成中常作为中 间体,用于合成其他有机化合 物。
氨基醚
氨基醚是指醚的烃基部分被氨基 取代的一类化合物。
氨基醚具有较低的毒性和较好的 生物相容性,因此在药物设计和
生物医学工程中有广泛应用。
醚的命名
醚可以根据其组成醇或酚 的名称进行命名,例如甲 醚、乙醚等。
• 醚的简介 • 醚的合成 • 醚的用途 • 醚的衍生物 • 醚的安全性
01
醚的简介
醚的定义
01
02
03
醚的定义
醚是一类由醇和酚的分子 间脱水形成的化合物,其 结构通式为R-O-R',其中 R和R'是烃基。
醚的形成
醚可以通过醇或酚分子间 脱水反应生成,反应过程 中需要酸催化。
03
醚的用途
作为溶剂
醚类化合物由于其低极性和良好的溶解能力,常被用作溶剂,如石油醚、乙醚等。
在化学实验中,醚类化合物常被用作反应溶剂,有助于提高反应速率和选择性。
醚类溶剂在涂料、油漆、油墨等工业领域也有广泛应用,能够提高产品的性能和稳 定性。
在医药中的应用
醚类化合物在药物合成中具有重 要作用,许多药物分子中都含有
醇分子内脱水
总结词
醇分子内脱水是制备醚的一种方法,通过醇分子内的脱水反应生成醚。
详细描述
醇分子内脱水是一种制备醚的方法,通过醇分子内的脱水反应生成醚。在酸性催化剂的作用下,醇分 子内脱水反应可以发生,生成相应的醚类化合物。该方法具有操作简便、条件温和的优点,适用于制 备结构简单的醚类化合物。
酚烷基化反应
硝基醚
硝基醚是指醚的烃基部分被硝 基取代的一类化合物。
硝基醚具有较高的稳定性,在 酸性或碱性条件下不易发生水 解反应。
硝基醚在有机合成中常作为中 间体,用于合成其他有机化合 物。
氨基醚
氨基醚是指醚的烃基部分被氨基 取代的一类化合物。
氨基醚具有较低的毒性和较好的 生物相容性,因此在药物设计和
生物医学工程中有广泛应用。
醚的命名
醚可以根据其组成醇或酚 的名称进行命名,例如甲 醚、乙醚等。
有机化学-第九章

有机化学 第九章 醇和酚
30
醇和酚的化学性质
1. 共性 (羟基官能团的作用)(9.6) 2. 醇的个性(9.7) 3. 酚的个性(9.8)
::
碱性
α
R
RCOH
H α H 的反应
酸性 羟基被取代
有机化学 第九章 醇和酚
O H
31
1. 共性
1) 弱酸性 2) 醚的生成 3) 酯的生成 4) 氧化反应 5) 酚类和烯醇化合物的显色反应
NH2
有机化学 第九章 醇和酚
17
3. 其他制备方法
(1) 卤代烷的水解 (9.3.3)
CH2Cl Na2CO3 , H2O
95℃
(2) 重氮盐的水解 (9.3.3)
CH2OH (74%)
原理见7.5, 7.12
NH2
NaNO2, H2SO4
NO2
0~5℃
N2+
H3+O,△
NO2
OH NO2
有机化学 第九章 醇和酚 原理见15.3
有机化学 第九章 醇和酚
32
1) 弱酸性 相对酸性:
表9.1 一些弱酸的pKa 值
酸
pKa
C6H5OH CH3OH
H2O CH3CH2OH (CH3)3COH
HC CH H2 NH3 CH3CH3
9.89
15.5 15.74 15.9 18.0 25 35 38 50
ArOH > ROH > RC CH > 有机化学 第九章 醇和酚
CH3
(4) 发酵法
乙醇的制备:
淀粉 淀粉酶 麦芽糖 麦芽糖酶 葡萄糖
酒化酶 酒精
有机化学 第九章 醇和酚
