高等有机化学课件1-第一章 取代基效应
合集下载
第一章取代基效应.

二、 场效应 (Field effect)
通过空间传递的电子效应 -场效应。 邻氯代苯丙炔酸:3-(2-chlorophenyl)propynoic acid
O C C C δ Clδ O H Cl C C C O H O
pKa: 酸性:
大 弱
小 强
场效应是依赖分子的几何构型的。
酸性:
H H Cl Cl COOH Cl Cl H H COOH
<
Cl Cl H O C O
H H
H C C HOOC
COOH
H C C
COOH
H
H
COOH
pKa1
3.03
H C C HOOC H H COO H
1.92
COO C C COOH -
pKa2
H C C H C O
4.54
OH C O H O H H C C C O O O C O
6.59
H
三、 共轭效应与共振论
H H
H C
H
H >H C
H
在叔碳正离子中 C-H键与空的p轨 道具有9个超共轭 效应的可能,其结果: 正电荷分散在3个碳原子上。
各 种 效 应 在 芳 烃 亲 电 取 代 反 应 中 的 表 现
O NR2 Activating EDG NH2 OH OR
Strongly Activating ortho/para directing Moderately Activiting
CH3COOH ClCH2COOH Cl2CHCOOH Cl3CCOOH pKa 4.76 2.86 1.29 0.65
取代基效应是贯穿有机化学始终的核心根 本问题,是有机化学的筋脉之一。 官能团性质+取代基效应=活的有机化学
高等有机化学第一章取代基效应自ppt课件(2024)

2024/1/28
22
06
研究方法与实验技术
2024/1/28
23
红外光谱法
红外光谱原理
01
利用物质对红外光的吸收特性进行分子结构和化学键
分析。
红外光谱仪的构造与工作原理
02 光源、干涉仪、样品室、检测器等部分的组成和工作
原理。
红外光谱在取代基效应研究中的应用
03
通过比较不同取代基对红外光谱的影响,推断取代基
2024/1/28
取代基对溶剂效应的影响
不同取代基在溶剂中的溶解度不同,可影响溶剂效应,从而改变反应机理。
14
04
取代基效应理论解释
2024/1/28
15
诱导效应
定义
由于取代基的电负性差异,通过化学键的传 递,导致分子中电子云密度分布发生变化的 现象。
2024/1/28
规律
吸电子基团使电子云偏向自己,增加分子极性;供 电子基团使电子云偏离自己,减小分子极性。
定义
在某些分子中,由于σ键电子与相邻空p轨道或π轨 道的相互作用,导致分子性质发生变化的现象。
规律
超共轭效应通常使分子更稳定,键角发生变化,键 能增加。
影响因素
参与超共轭的原子类型、σ键与空轨道的能级差等。
18
05
常见取代基效应实例分析
2024/1/28
19
甲基取代效应
甲基的诱导效应
甲基作为一个供电子基团,通过共轭效应向相邻的碳原子提供电子,使得相邻碳原子的
取代基的引入会使分子的对称性降低,分子间 作用力减弱,从而导致熔点、沸点降低。例如 ,氯苯的熔点、沸点均低于苯。
取代基的极性也会对熔点、沸点产生影响。极 性取代基会增加分子间作用力,使熔点、沸点 升高。例如,硝基苯的熔点、沸点均高于苯。
天津大学有机化学第一章 取代基效应 Substitution

空间效应的作用:
1. 化合物(构象)的稳定性
HH CH3
H CH3 H
2. 化合物的酸碱性
O C OH
C CH3
CH3 CH3
pKa1 < pKa2
O C OH
当t-Butyl 在邻位时, 把羧基挤出了与苯环所在 平面,羧基的 -C效应消失。
3. 对反应活性的影响
伯卤代烷的乙醇解的相对速度是与中心碳原子 连接的烷基大小相关的:
σ-π 超共轭体系 σ- p 超共轭体系
四. 场效应 ( )
五. 空间效应 ( )
1. 对化合物稳定性的影响 2. 对化合物酸性的影响 3. 对反应活性的影响 4. 张力:F-张力,B-张力,角张力
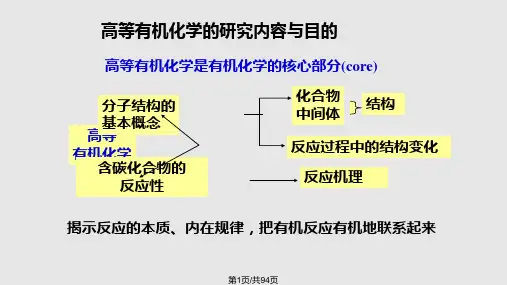
高等有机化学的研究内容与目的
高等有机化学是有机化学的核心部分(core)
高等 有机化学
分子结构的 基本概念
含碳化合物的 反应性
化合物 中间体
结构
反应过程中的结构变化 反应机理
揭示反应的本质、内在规律,把有机反应有机地 联系起来。
第一章 取代基效应
(Substituent Effects)
H
H
H C Br + OH
H C OH + Br
H
H
反应的本质: 旧键的断裂,新键的生成 共价键的极性取决于取代基的效应
第一章 取代基效应 (Substituent Effects) ( )
取代基效应 ( ) 电子效应 ( )
一. 诱导效应 ( )
结构特征 ( ) 传递方式 传递强度 相对强度
二. 共轭体系 ( )
1. 共轭体系与共轭效应 2.结构特征 ( ) 3. 传递方式 ( )
4. 相对强度
第1章取代基效应

马氏加成
反马氏加成
Cl3C←CH=CH2 CH3C→CH=CH2 三氯甲基强烈的-I效应的结果。
N N
more active
-N+R3的-I效 应,间位定 位,致钝
2、 对反应机理的影响(路径)
在一些反应中,由于诱导效应等因素可能改变 其反应机理。 如溴代烷的水解反应,伯溴代烷如CH3-Br主要 按 SN2历程进行,而叔溴代烷如(CH3)3C-Br则主 要遵从SN1历程进行。
(3)由核磁共振化学位移粗略比较
X-CH3中甲基的δ值: X δ -NO2 4.28 -F 4.26 -OH 3.47 -Cl 3.05 -Br 2.68 -SH 2.44 C6H5 2.30 X -N(CH3)2 -I -COCH3 -COOH -CN -CH3 H δ 2.20 2.16 2.10 2.07 2.00 0.90 0.23
H H O Cl Cl Cl O H
1. 2 共轭效应
1. 2. 1电子离域与共轭效应 在1,3-丁二烯CH2=CH—CH=CH2 中的键长不是 简单的单键和双键的键长,存在着平均化的 趋势。
0.154
C
nm
C C C C
0.137 nm 0.147 nm
C
more stable C C C
0.134 nm
OR2 >
+
NR3
+
+I效应:
NR >
-
O
-
同主族 -I效应: -F > -C l > -Br > I -I
- OR > -SR > SeR
O R2 >
+ +
;
高等有机化学 取代基效应自PPT课件
第11页/共94页
4、诱导效应强弱
诱导效应的相对强度:取决于取代基的中心原子 的电
负性 (Electronegativeties)
比氢原子相对电负性愈大,则-I效应愈强, 比氢原子相对电负性愈小,则+I效应愈强。
第12页/共94页
(1)与碳原子直接相连的原子
➢同周期的元素自左到右电负性增大,-I 增强:
第16页/共94页
例如:以乙酸为参考酸,具有X—CH2COOH通式, 由
于取代X基诱导效应pk的a 方向和X 强度不同,其pk酸a 性强弱不
同一NO2
1.68
一+N(CH3)3 1.83
一I —OH
3.12 3.83
一CN
2.46 —H
4.76
—F
2.66 —CH
4.88
—C1
2.86 一C(CH3)3 5.05
高等有机化学的研究内容与目的
高等有机化学是有机化学的核心部分(core)
分子结构的 基本概念 高等 有机化学 含碳化合物的
反应性
化合物 中间体
结构
反应过程中的结构变化
反应机理
揭示反应的本质、内在规律,把有机反应有机地联系起来
第1页/共94页
目录
第一章 取代基效应 第二章 有机反应活性中间体 第三章 饱和碳原子上的亲核取代反应 第四章 芳环上的取代反应 第五章 碳碳重键的加成反应 第六章 碳杂重键的加成反应 第七章 消除反应
但卤代烷的亲核取代反应活性却恰恰相反,实际其相 对活
性为: R—I>R—Br>R—C1 > C—F
原因:是动态诱导效应的影响。因为在同族元素中, 随原
子序数的增大电负性降低,其电子云受到核的约束也 第35页/共94页
4、诱导效应强弱
诱导效应的相对强度:取决于取代基的中心原子 的电
负性 (Electronegativeties)
比氢原子相对电负性愈大,则-I效应愈强, 比氢原子相对电负性愈小,则+I效应愈强。
第12页/共94页
(1)与碳原子直接相连的原子
➢同周期的元素自左到右电负性增大,-I 增强:
第16页/共94页
例如:以乙酸为参考酸,具有X—CH2COOH通式, 由
于取代X基诱导效应pk的a 方向和X 强度不同,其pk酸a 性强弱不
同一NO2
1.68
一+N(CH3)3 1.83
一I —OH
3.12 3.83
一CN
2.46 —H
4.76
—F
2.66 —CH
4.88
—C1
2.86 一C(CH3)3 5.05
高等有机化学的研究内容与目的
高等有机化学是有机化学的核心部分(core)
分子结构的 基本概念 高等 有机化学 含碳化合物的
反应性
化合物 中间体
结构
反应过程中的结构变化
反应机理
揭示反应的本质、内在规律,把有机反应有机地联系起来
第1页/共94页
目录
第一章 取代基效应 第二章 有机反应活性中间体 第三章 饱和碳原子上的亲核取代反应 第四章 芳环上的取代反应 第五章 碳碳重键的加成反应 第六章 碳杂重键的加成反应 第七章 消除反应
但卤代烷的亲核取代反应活性却恰恰相反,实际其相 对活
性为: R—I>R—Br>R—C1 > C—F
原因:是动态诱导效应的影响。因为在同族元素中, 随原
子序数的增大电负性降低,其电子云受到核的约束也 第35页/共94页
1取代基效应精讲
SN1
F-张力:两者在相互接近过程中,基团位阻导致相 R' 互排斥作用 Face strainR CH3
R R N B R' R'
N
CH3
I-张力:来自于分子内部的牵制力,导致反应过程受 阻,Internal strain
60°
109 °28′
R X R
60°
120 °
2.1 取代基效应
Substituent Effects
有机化学反应的本质 旧键的断裂,新键的生成。
H HCH 共价键:电子对的共用 原子间由于 H covalent bond
H H C H
H 成键电子的 原子轨道重 叠而形成的 本质是通过电子将原子核联系在一起的力。 化学键 H H
H C Br + OH H
pKa
4.82
CH3COOH
2.84
ClCH2COOH
4.06
Cl2CHCOOH Cl3COOH
4.52
pKa
4.76
2.86
1.29
0.65
加和性 B:电子是定域的 电子就在两个原子之间
3. 诱导效应的相对强度
中心原子电负性的大小
中心原子在元素周期表中的位置
规则 -I periodic table of elements
O N O
CH3 NO2
pKa
8.24
7.16
O C OH
× √
O C OH CH3 C CH3 CH3 pKa1 >
CH3
pKa2
当甲基在邻位时,把硝基 挤出了与苯环所在平面, 硝基的 -C效应消失。
2. 反应活性的解释
构象翻转
R EtOH + H C Br H
高等有机化学亲核取代-PPT课件
1) 异面进攻反应(Nu-从离去基团L的背面进攻反应中心)
N u
-
C
δ δ N u C L … …
N u C +L
-
2) 构型翻转 (产物的构型与底物的构型相反——瓦尔登Walden转化)。
三、分子内亲核取代反应
从立体化学角度看,分子内亲核取代反应的立体化学特征是 中心碳原子的构型保持不变,即反应物和产物的构型相同。
§1 亲核取代反应机理
一、SN1 机理
+ N u R L
+ L N u R
ν =k1 R L
反应分两步进行 第一步 正碳离子的生成:是决定反应速率的一步。
RL
慢
δ
RL
δ
L + R +
第二步 亲核试剂进攻正碳离子:
+ N R + u -快
RN u
溴代叔丁烷的水解
第一步:
CH 2 CH 3 δ δ 慢 CH C Br C Br CH … 3 … 3 CH CH 3 3 CH 3 + B r C CH 3 CH 3
6. 卤离子互换反应
卤素相同、烃基结构不同的卤代烷,其活性 顺序为:1°>2°>3°。
醇的亲核取代反应
1.与氢卤酸反应
R O H + H X R X + H O 2
由于醇羟基不是好的离去基团,其亲核取代反应一般要在 酸性催化下进行,羟基质子化后以水的形式易于离去。
反应速度与氢卤酸的亲反应活性有关 HX的反应活性:HI>HBr>HCl
S 1 , 有 重 排 N
S 2 , 一 般 不 重 排 N
2、与卤化磷和亚硫酰氯反应
3 R O H+ P X ( P+X ) 3 2 3 R X+ P ( O H ) 3 X =B r、 I(制 ) 备 溴 代 或 碘 代 烃 R O H+ P C l5 R O H+ S O C l2 R C l +P O C l3 + H C l R C l +S O C l 2 +H 此 反 应 产 物 纯 净 制 氯 代 烃
N u
-
C
δ δ N u C L … …
N u C +L
-
2) 构型翻转 (产物的构型与底物的构型相反——瓦尔登Walden转化)。
三、分子内亲核取代反应
从立体化学角度看,分子内亲核取代反应的立体化学特征是 中心碳原子的构型保持不变,即反应物和产物的构型相同。
§1 亲核取代反应机理
一、SN1 机理
+ N u R L
+ L N u R
ν =k1 R L
反应分两步进行 第一步 正碳离子的生成:是决定反应速率的一步。
RL
慢
δ
RL
δ
L + R +
第二步 亲核试剂进攻正碳离子:
+ N R + u -快
RN u
溴代叔丁烷的水解
第一步:
CH 2 CH 3 δ δ 慢 CH C Br C Br CH … 3 … 3 CH CH 3 3 CH 3 + B r C CH 3 CH 3
6. 卤离子互换反应
卤素相同、烃基结构不同的卤代烷,其活性 顺序为:1°>2°>3°。
醇的亲核取代反应
1.与氢卤酸反应
R O H + H X R X + H O 2
由于醇羟基不是好的离去基团,其亲核取代反应一般要在 酸性催化下进行,羟基质子化后以水的形式易于离去。
反应速度与氢卤酸的亲反应活性有关 HX的反应活性:HI>HBr>HCl
S 1 , 有 重 排 N
S 2 , 一 般 不 重 排 N
2、与卤化磷和亚硫酰氯反应
3 R O H+ P X ( P+X ) 3 2 3 R X+ P ( O H ) 3 X =B r、 I(制 ) 备 溴 代 或 碘 代 烃 R O H+ P C l5 R O H+ S O C l2 R C l +P O C l3 + H C l R C l +S O C l 2 +H 此 反 应 产 物 纯 净 制 氯 代 烃
高等有机化学教案1取代基效应
改变物理性质
通过引入特定的取代基,可以改变 有机分子的物理性质,如溶解度、 熔点、沸点等,从而满足不同的应 用需求。
02 取代基对分子构型影响
取代基对键长、键角影响
取代基电负性
取代基的电负性会影响相邻碳原子的电子云密度,从而改变键 长和键角。例如,电负性较大的取代基(如-F)会使相邻碳原 子的电子云密度降低,键长变短,键角变小。
应速率。具有共轭效应的取代基可以与反应中间体形成共轭体系,从而
稳定中间体并促进反应的进行。
04 取代基对光谱性质影响
取代基对紫外-可见光谱影响
取代基的电子效应
取代基通过诱导效应、共轭效应等改变分子的电子云分布,从而影响紫外-可见光谱的吸 收波长和强度。
取代基的空间效应
取代基的空间位阻和构象变化也会影响紫外-可见光谱的吸收,例如邻位取代基可能导致 分子内氢键的形成,进而影响光谱性质。
取代基对立体化学的影响
探讨取代基如何通过空间位阻和电子效应来影响反应的立体选择性, 如顺反异构化、区域选择性等。
实验注意事项及改进建议
实验安全注意事项
强调实验过程中应注意的安全事项,如避免使用过量试剂、注意加 热温度和时间控制等。
实验操作规范
提醒学生注意实验操作规范,如准确称量、充分搅拌、正确使用仪 器等。
01取代基的ຫໍສະໝຸດ 子效应在周环反应中,取代基的电子效应可以影响反应中间体的稳定性和反应
速率。给电子取代基可以稳定负离子中间体,有利于周环反应的进行。
02
取代基的空间效应
取代基的空间大小也会影响周环反应的进行。大的取代基可能会阻碍反
应中间体的生成或转化,导致反应速率降低。
03
取代基的共轭效应
在周环反应中,取代基可以通过共轭效应影响反应中间体的稳定性和反
通过引入特定的取代基,可以改变 有机分子的物理性质,如溶解度、 熔点、沸点等,从而满足不同的应 用需求。
02 取代基对分子构型影响
取代基对键长、键角影响
取代基电负性
取代基的电负性会影响相邻碳原子的电子云密度,从而改变键 长和键角。例如,电负性较大的取代基(如-F)会使相邻碳原 子的电子云密度降低,键长变短,键角变小。
应速率。具有共轭效应的取代基可以与反应中间体形成共轭体系,从而
稳定中间体并促进反应的进行。
04 取代基对光谱性质影响
取代基对紫外-可见光谱影响
取代基的电子效应
取代基通过诱导效应、共轭效应等改变分子的电子云分布,从而影响紫外-可见光谱的吸 收波长和强度。
取代基的空间效应
取代基的空间位阻和构象变化也会影响紫外-可见光谱的吸收,例如邻位取代基可能导致 分子内氢键的形成,进而影响光谱性质。
取代基对立体化学的影响
探讨取代基如何通过空间位阻和电子效应来影响反应的立体选择性, 如顺反异构化、区域选择性等。
实验注意事项及改进建议
实验安全注意事项
强调实验过程中应注意的安全事项,如避免使用过量试剂、注意加 热温度和时间控制等。
实验操作规范
提醒学生注意实验操作规范,如准确称量、充分搅拌、正确使用仪 器等。
01取代基的ຫໍສະໝຸດ 子效应在周环反应中,取代基的电子效应可以影响反应中间体的稳定性和反应
速率。给电子取代基可以稳定负离子中间体,有利于周环反应的进行。
02
取代基的空间效应
取代基的空间大小也会影响周环反应的进行。大的取代基可能会阻碍反
应中间体的生成或转化,导致反应速率降低。
03
取代基的共轭效应
在周环反应中,取代基可以通过共轭效应影响反应中间体的稳定性和反
《高等有机第一章》课件
烯烃的化学性质
烯烃可以发生加成反应、氧化反应和聚合反 应等。
炔烃的结构与性质
炔烃的稳定性
炔烃的稳定性比烯烃差,因为它们具有不饱 和的三键。
炔烃的通式
CnH2n-2,其中n表示碳原子数。
炔烃的化学性质
炔烃可以发生加成反应、氧化反应和聚合反 应等。
芳香烃的结构与性质
1 2
芳香烃的通式
CnH2n-6,其中n表示碳原子数。
中间体的结构。
常见有机合成反应类型
烷基化反应
酰化反应
氧化反应
还原反应
通过碳-碳键将一个烷基 基团连接到有机化合物
上。
将酰基基团连接到有机 化合物上,通常用于制
备羧酸衍生物。
通过添加氧原子或氧基 团来改变有机化合物的
官能团。
通过去除氧原子或氧基 团来改变有机化合物的
官能团。
06
有机化合物的应用
有机化合物在工业上的应用
有机化合物的结构与性质
烷烃的结构与性质
烷烃的通式
CnH2n+2,其中n表示碳原子数。
烷烃的稳定性
随着碳原子数的增加,烷烃的稳定性逐渐增加 。
烷烃的化学性质
烷烃的化学性质比较稳定,但在一定条件下可以发生取代反应和裂解反应。
烯烃的结构与性质
烯烃的通式
CnH2n,其中n表示碳原子数。
烯烃的稳定性
烯烃的稳定性比烷烃差,因为它们具有不饱 和的双键。
芳香烃的稳定性
芳香烃具有稳定的苯环结构,因此其稳定性较高 。
3
芳香烃的化学性质
芳香烃可以发生取代反应、加成反应和氧化反应 等。
05
有机化合物的合成与反应机理
有机合成简介
有机合成是有机化学中的重要分支, 主要研究如何通过一系列化学反应将 简单的原料转化为复杂的有机化合物 。
高等有机化学课件
3. 对反应活性的影响 伯卤代烷的乙醇解的相对速度是与中心碳原子 连接的烷基大小相关的:
R EtOH + H C Br H
R 相对速度 1.0 0.28 0.03 4.2× 10
-5
H3CCH3CH2(CH3)2CH(Isopropyl)
R EtO C H + HBr H SN2 反应
乙氧基从背后进攻
四. 场效应
五. 空间效应 ( )
1. 对化合物稳定性的影响 2. 对化合物酸性的影响 3. 对反应活性的影响 4. 张力:F-张力,B-张力,角张力
第一章 取代基效应 (Substituent Effects)
H H C Br + OH H H H H C OH + Br
反应的本质: 旧键的断裂,新键的生成 共价键的极性取决于取代基的效应
C2H5 CH3 N Ph O
不同取代开链叔胺分子不具有旋光活性:
R R' R" N
R N R' R"
两种对映体因快速翻转 相互转化,导致消旋。
手性中心 - 其它杂原子:
O
S
CH2Ph
H2C CHCH2 CH3
[α] D = +16.8°
P
[α]27 = +92.4° D
三. 含两个(或多个)手性中心的分子
空间传递
空间效应 (位阻效应) 物理的相互作用
电子效应 (Electronic effect):
由于取代基的作用而导致的共有电子对 沿共价键转移的结果。
O O2N CH2 C O H > CH3
O C O H
一. 诱导效应 (Inductive effect)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Inductive effects are those that occur through the sigma system due to electronegativity effects. These too can be either electron donating (e.g. -Me) where sigma electrons are pushed toward
the functional group or electron withdrawing (e.g. CF3, +NR3) where sigma electrons are drawn away from the functional group.
R R
G G
C
δ
δ
C
δ
δ
Cl Cl Cl
δ
C C C
pKa: 大 酸性: 弱 场效应是依赖分子的几何构型的。
小 强
酸性:
H H Cl Cl COOH Cl Cl H H COOH
<
Cl Cl H O C O
H H
H C C HOOC
COOH
H C C
COOH
H
H
COOH
pKa1
3.03
H C C HOOC H H COO H
1.92
COO C C COOH
化学则是辅线,二者相辅相成、缺一不 可。
高等有机化学的研究内容:
化合物及中间体的结构 分子结构 高等 有机化学
反应 反应过程中的结构变化
机理
目的: 揭示有机反应的本质和内在规律, 把各类反应有机地联系起来。
第一章 取代基效应 Substituent Effects
一.诱导效应 二.场效应 三.共轭相应 四.超共轭效应
官能团之间的相互转化。即“What”的问题。
但是没有告诉我们为什么会发生这样的转
化?这种转化是易是难?即“Why”的问题。
目的: 高等有机化学告诉我们结构、 取代基等对官能团或中间体性质的影响规 律,帮我们正确判断反应能否发生、朝哪 个方向发生,并能以此解释和指导自己的
实验。 如果把有机化学看成主线,高等有机
H2C CH CH O
OH
δ δ δ
苯酚分子中氧原子上的孤对电子与 苯环上的π电子形成 p- π共轭。 结果: 使羟基邻、对位的碳原子 带有部分的负电荷。
3、共轭效应的强度:取决于取代基中的中心 原子的电负性与半径。
① -C效应 :一般表现在π-π共轭体系:
电负性大,半径小,-C 强
CH2=CH-CH=O >CH2=CH-CH=NR >CH2=CH-CH=CH2 同元素,带正电荷的,-C效应较强
σ轨道与π轨道的重叠, σ电子的离域
+I:
CH3 H3C C CH3
Me3C>Me2CH>Et>Me
CH3 H C CH3 CH3 H C H H H C H
μ: 0.70D
0.65D
0.58D
0.38D
R Br2 FeBr3
R
Br
R:
CH3
Me3C Me2CH 110 180
CH3 H C CH3
the group or electron withdrawing (e.g. -C=O) where π electrons are drawn away from the group.
1.1、π - π 共轭体系
O C C C C C C C C C C C N C C C C C H
C1
C2
·Electrons in σ bonds have a fixed location and so they are
O
-
OO
-
OO
-
O
C
O
C
O
C
O
Lewis Diagrams
2/3 O
Resonance Hybrid 2/3-O
C O 2/3-
书写原则:
1. 原子排列顺序不能改变 2. 符合Lewis结构式书写规则 3. 未成对电子必须相同
取代基效应
诱导效应 电子效应 共轭效应 超共轭效应 场效应空间传递电子效应
物理相互作用 空间效应(位阻效应)
取代基通过对分子电子云 电子效应 (Electronic effect): 分布产生影响从而改变母 体分子的性质
O
O H
Acidity: O2N
CH2 C O
>
CH3 C O
H
一、 诱导效应 Inductive effect
C3
C4
1.2、p -π共轭体系
O Cl CH CH2 R C OH
CH3 CH CH CH2
CH3
C3 H
C2
C1+
H
H
2.1、共轭效应特点: 共轭效应受距离的影响较小
δ δ δ δ
Y
CH
CH CH CH2
2.2、结构特征:
☻共轭体系中所有原子共平面
C C C Y
(I)
C C X
(II)
Y为吸电基-吸电子共轭效应 (-C), X为供电基-供电子共轭效应 (+C)。
pKa2
H C C H C O
4.54
OH C O H O H H C C C O O O C O
6.59
H
三、 共轭效应与共振论
Resonance effects (conjugation effects) Resonance effects are those that occur through the π system and can be represented by resonance structures. These can be either electron donating (e.g. -OCH3) where π electrons are pushed toward
超共轭效应的作用:
CH2CH3
H H C CH CH2 + ND3 H
Br2 hυ
CHCH3 Br
H H C CH CH2 + ND2H D
使分子的偶极距增加: H
H μ :
CH3 C O 2.27 H C CH O H 2.73
使正碳离子和自由基稳定性增加:
H H H H H C H H HC > C C > H HC C H H HH C H HC H
Et Me H 290 340 1
H H C CH3 H H C H
H3C C CH3
H H C CH CH2 H
当C-H键与双键直接相连时, C-H键的强度减弱,H原子的 活性增加。
H H C CH O H
羰基化合物的α-H原子酸性较强
H
C H H
C C H
C-H键上的σ电子发生 离域,形成σ-π共轭。σ 电子已经不再定域在原来的 H C、H 两原子之间,而是离域 H 在C3-C2之间,使H原子容易 作为质子离去,这种共轭强 度远弱于π-π和p-π共轭。
COOR COOH Moderately Deactiviting COR CHO COCl CF3 CN SO3H Strongly Deactivating N+R3 NO2
meta directing
五. 空间效应 (Steric effect)
也称为位阻效应,由取代基引起的一种空 间张力或阻力的效应。
δ
C
δ
特征: ⅰ沿分子链传递(σ-键) ⅱ由电负性差异引起 强度:取决于取代基的电负性与距离。电负性差 值越大,强度越高;距离越大,强度越弱。
C
Z C H 标准 +I
C Z -I
Electronegativity
H 2.1 Li 1.0 Na 0.9 K 0.8 Be 1.5 Mg 1.2 Ca 1.0 B 2.0 C 2.5 N 3.0 O 3.5 F 4.0
C NR2
>
C N R
② +C效应: p - π共轭体系
同周期:电负性越大,+C 效应越小
+C: C
C NR2 > C C OH > C C F
同族元素:半径接近,+C 显著。 +C: C C F > C C Cl > C C Br > C C I
☺共轭效应与诱导效应在一个分子中往往是并存的,
有时两种作用的方向是相反的.
1. 空间效应对构象的影响 ※环状化合物的稳定构象
H
H CH3
H
CH3 H
与3,5-位直立氢发生相互作用
CH3COOH pKa: 4.76 ClCH2COOH 2.86 O2NCH2COOH 1.68
二、 场效应 (Field effect)
通过空间传递的电子效应 -场效应。
邻氯代苯丙炔酸:3-(2-chlorophenyl)propynoic acid
O C C C δ Clδ O H Cl C C C O H O
带负电荷的取代基的 + I 强
4. 相同原子:带正电荷的取代基的 -I 强
-I:
-NR3 > -NO2 > -NR2
取代基诱导效应的结果:
对反应活性的影响
CH3 CH2O, HCl ZnCl2 CF3 CH2O, HCl ZnCl2
对反应方向的影响:
Cl3C C CH2 H HCl
对化合物酸性的影响:
五.空间效应
取代基效应:分子中的原子或原子团对 所研究的官能团所产生的影响
CH3COOH ClCH2COOH Cl2CHCOOH Cl3CCOOH pKa 4.76 2.86 1.29 0.65
the functional group or electron withdrawing (e.g. CF3, +NR3) where sigma electrons are drawn away from the functional group.
R R
G G
C
δ
δ
C
δ
δ
Cl Cl Cl
δ
C C C
pKa: 大 酸性: 弱 场效应是依赖分子的几何构型的。
小 强
酸性:
H H Cl Cl COOH Cl Cl H H COOH
<
Cl Cl H O C O
H H
H C C HOOC
COOH
H C C
COOH
H
H
COOH
pKa1
3.03
H C C HOOC H H COO H
1.92
COO C C COOH
化学则是辅线,二者相辅相成、缺一不 可。
高等有机化学的研究内容:
化合物及中间体的结构 分子结构 高等 有机化学
反应 反应过程中的结构变化
机理
目的: 揭示有机反应的本质和内在规律, 把各类反应有机地联系起来。
第一章 取代基效应 Substituent Effects
一.诱导效应 二.场效应 三.共轭相应 四.超共轭效应
官能团之间的相互转化。即“What”的问题。
但是没有告诉我们为什么会发生这样的转
化?这种转化是易是难?即“Why”的问题。
目的: 高等有机化学告诉我们结构、 取代基等对官能团或中间体性质的影响规 律,帮我们正确判断反应能否发生、朝哪 个方向发生,并能以此解释和指导自己的
实验。 如果把有机化学看成主线,高等有机
H2C CH CH O
OH
δ δ δ
苯酚分子中氧原子上的孤对电子与 苯环上的π电子形成 p- π共轭。 结果: 使羟基邻、对位的碳原子 带有部分的负电荷。
3、共轭效应的强度:取决于取代基中的中心 原子的电负性与半径。
① -C效应 :一般表现在π-π共轭体系:
电负性大,半径小,-C 强
CH2=CH-CH=O >CH2=CH-CH=NR >CH2=CH-CH=CH2 同元素,带正电荷的,-C效应较强
σ轨道与π轨道的重叠, σ电子的离域
+I:
CH3 H3C C CH3
Me3C>Me2CH>Et>Me
CH3 H C CH3 CH3 H C H H H C H
μ: 0.70D
0.65D
0.58D
0.38D
R Br2 FeBr3
R
Br
R:
CH3
Me3C Me2CH 110 180
CH3 H C CH3
the group or electron withdrawing (e.g. -C=O) where π electrons are drawn away from the group.
1.1、π - π 共轭体系
O C C C C C C C C C C C N C C C C C H
C1
C2
·Electrons in σ bonds have a fixed location and so they are
O
-
OO
-
OO
-
O
C
O
C
O
C
O
Lewis Diagrams
2/3 O
Resonance Hybrid 2/3-O
C O 2/3-
书写原则:
1. 原子排列顺序不能改变 2. 符合Lewis结构式书写规则 3. 未成对电子必须相同
取代基效应
诱导效应 电子效应 共轭效应 超共轭效应 场效应空间传递电子效应
物理相互作用 空间效应(位阻效应)
取代基通过对分子电子云 电子效应 (Electronic effect): 分布产生影响从而改变母 体分子的性质
O
O H
Acidity: O2N
CH2 C O
>
CH3 C O
H
一、 诱导效应 Inductive effect
C3
C4
1.2、p -π共轭体系
O Cl CH CH2 R C OH
CH3 CH CH CH2
CH3
C3 H
C2
C1+
H
H
2.1、共轭效应特点: 共轭效应受距离的影响较小
δ δ δ δ
Y
CH
CH CH CH2
2.2、结构特征:
☻共轭体系中所有原子共平面
C C C Y
(I)
C C X
(II)
Y为吸电基-吸电子共轭效应 (-C), X为供电基-供电子共轭效应 (+C)。
pKa2
H C C H C O
4.54
OH C O H O H H C C C O O O C O
6.59
H
三、 共轭效应与共振论
Resonance effects (conjugation effects) Resonance effects are those that occur through the π system and can be represented by resonance structures. These can be either electron donating (e.g. -OCH3) where π electrons are pushed toward
超共轭效应的作用:
CH2CH3
H H C CH CH2 + ND3 H
Br2 hυ
CHCH3 Br
H H C CH CH2 + ND2H D
使分子的偶极距增加: H
H μ :
CH3 C O 2.27 H C CH O H 2.73
使正碳离子和自由基稳定性增加:
H H H H H C H H HC > C C > H HC C H H HH C H HC H
Et Me H 290 340 1
H H C CH3 H H C H
H3C C CH3
H H C CH CH2 H
当C-H键与双键直接相连时, C-H键的强度减弱,H原子的 活性增加。
H H C CH O H
羰基化合物的α-H原子酸性较强
H
C H H
C C H
C-H键上的σ电子发生 离域,形成σ-π共轭。σ 电子已经不再定域在原来的 H C、H 两原子之间,而是离域 H 在C3-C2之间,使H原子容易 作为质子离去,这种共轭强 度远弱于π-π和p-π共轭。
COOR COOH Moderately Deactiviting COR CHO COCl CF3 CN SO3H Strongly Deactivating N+R3 NO2
meta directing
五. 空间效应 (Steric effect)
也称为位阻效应,由取代基引起的一种空 间张力或阻力的效应。
δ
C
δ
特征: ⅰ沿分子链传递(σ-键) ⅱ由电负性差异引起 强度:取决于取代基的电负性与距离。电负性差 值越大,强度越高;距离越大,强度越弱。
C
Z C H 标准 +I
C Z -I
Electronegativity
H 2.1 Li 1.0 Na 0.9 K 0.8 Be 1.5 Mg 1.2 Ca 1.0 B 2.0 C 2.5 N 3.0 O 3.5 F 4.0
C NR2
>
C N R
② +C效应: p - π共轭体系
同周期:电负性越大,+C 效应越小
+C: C
C NR2 > C C OH > C C F
同族元素:半径接近,+C 显著。 +C: C C F > C C Cl > C C Br > C C I
☺共轭效应与诱导效应在一个分子中往往是并存的,
有时两种作用的方向是相反的.
1. 空间效应对构象的影响 ※环状化合物的稳定构象
H
H CH3
H
CH3 H
与3,5-位直立氢发生相互作用
CH3COOH pKa: 4.76 ClCH2COOH 2.86 O2NCH2COOH 1.68
二、 场效应 (Field effect)
通过空间传递的电子效应 -场效应。
邻氯代苯丙炔酸:3-(2-chlorophenyl)propynoic acid
O C C C δ Clδ O H Cl C C C O H O
带负电荷的取代基的 + I 强
4. 相同原子:带正电荷的取代基的 -I 强
-I:
-NR3 > -NO2 > -NR2
取代基诱导效应的结果:
对反应活性的影响
CH3 CH2O, HCl ZnCl2 CF3 CH2O, HCl ZnCl2
对反应方向的影响:
Cl3C C CH2 H HCl
对化合物酸性的影响:
五.空间效应
取代基效应:分子中的原子或原子团对 所研究的官能团所产生的影响
CH3COOH ClCH2COOH Cl2CHCOOH Cl3CCOOH pKa 4.76 2.86 1.29 0.65
