第二章第三节第3课时 氧化剂和还原剂
课件5:1.3.2 氧化剂和还原剂

钢铁的锈蚀
食物的腐败
我们应该深入学习化学反应的规律,趋利避害使之更好的服务于社会。
课堂练习
1.根据反应 2H2S+O2 === 2S↓+2H2O, 4NaI+O2+2H2O === 2I2+4NaOH, Na2S+I2 === 2NaI+S↓, 判断氧化性强弱顺序是( D )
A.O2>S>I2 C.I2>S>O2
(4)2HgO === 2Hg+O2↑
氧化剂、还原剂:HgO 氧化产物:O2;还原产物:Hg
构建氧化还原反应概念模型: 化合价降低,得电子,被还原(发生还原反应)
氧化剂 + 还原剂 === 还原产物 + 氧化产物 (氧化性)(还原性)
化合价升高,失电子,被氧化(发生氧化反应)
口诀:
元素被氧化,物质发生氧化反应,得到氧化产物 升失氧化——还原剂,
Hg Ag
属 K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ (H+) Cu2+ (Fe3+) Hg2+ Ag+
氧化性逐渐增强
金属单质的还原性越强,对应阳离子的氧化性越弱。
2. 根据氧化还原反应原理判断 氧化剂+还原剂===氧化产物+还原产物 氧化性: 氧化剂 > 氧化产物 还原性: 还原剂 > 还原产物
B.I-、Fe2+、Br-
C.Br-、I-、Fe2+
D.Fe2+、I-、Br-
点拨:标化合价,明确变价元素,找出还原剂和还原产物,比较还原性
人教版高中化学必修一课件第二章第三节氧化剂还原剂.pptx

元素处于最低价态-- 只能失电子
只有还原性,只能做还原剂。
元素处于中间价态-既有氧化性又有还原性, 既能做氧化剂又能做还原剂。
2.在下列反应中:
①2Na+2H2O===2NaOH+H2↑ ②2F2+2H2O===4HF+O2 ③Cl2+H2O===HCl+HClO ④C+H2O=高=温=CO+H2 ⑤CaO+H2O===Ca(OH)2 ⑥2H2O=电=解=2H2↑+O2↑ 试从氧化还原的角度,回答下列问题: (1)水只作氧化剂的是_①__④_____。
合价降低的总数=还原剂化合价升高的总数。
2、强弱规律
氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物
3、先后规律 同一氧化剂与多种还原剂混合,还原剂强的先被 氧化 同一还原剂与多种氧化剂混合,氧化性强的先被还
原
如:氯气通入FeBr2溶液
在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加
氧化还原反应
第2课时氧化剂和还原剂
总结
还原剂
具有 还原性
发生 氧化反 应
生成 氧化产 物
化合价升高,失电子,被氧化
氧化剂 具有 氧化性 发生 还原反 生成还原
氧化性和还原性
氧化性:氧化剂所表现出得电子的性质 还原性:还原剂所表现出失电子的性质
氧化剂、还原剂与元素化合价之 间的关系
(C )
A.ClO3->BrO3->Cl2>Fe3+>I2 B.BrO3->Cl2>ClO3->I2>Fe3+ C.BrO3->ClO3->Cl2>Fe3+>I2 D.BrO3->ClO3->Fe3+>Cl2>I2
氧化还原反应的基本规律
1、守恒规律 还原剂失电子总数=氧化剂得电子总数=氧化剂化
氧化剂和还原剂PPT教学课件

2020/12/10
5
氧化剂: _____电子,化合价 _____, 发生_____反应,表现____性,生成 _____产物;
还原剂: _____电子,化合价 _____, 发生_____反应,表现____性,生成 _____产物;
2020/12/10
2.从化合价的角度分析H2SO4,SO2,H2S 在氧化还原反应中可以表现什么性质?
2020/12/10
8Байду номын сангаас
常见的氧化剂: 常见的还原剂:
课本P59 第二题
2020/12/10
9
PPT教学课件
谢谢观看
Thank You For Watching
10
化合价升高,发生氧化反应
还原剂 + 氧化剂 = 氧化产物 + 还原产物
化合价降低,发生还原反应
化合价升高
Fe 失 电 子
Fe2+ ;
还原剂 氧化反应
Cu2+
化合价降低 得电子
氧化产物 Cu
2020/12/10
氧化剂 还原反应 还原产物 4
判断下列反应中的氧化剂,还原剂,氧化产 物和还原产物.
C. 2H2O = 2H2 + O2
2020/12/10
2
2.在以上氧化还原反应中,哪些元素的化合价升 高了,哪些元素的化合价降低了,指出含有这些 元素的具体物质。
氧化剂:所含某种元素化合价降低的反应 物,氧化剂具有氧化性;
还原剂:所含某种元素化合价升高的反应 物,还原剂具有还原性。
2020/12/10
3
如:Fe + Cu2+ = Fe2+ + Cu
《第三节-氧化剂与还原剂》PPT课件

一、化学反应与元素化合价的变化 1.氧化还原反应的概念 反应中有元素化合价升降的化学反应叫做氧 化还原反应。
氧化还原反应的特征和判断依据
特别注意:氧化还原反应的实质是电子的转移
√× × √ √ ×
【迁移·应用】
判断下列反应是否为氧化还原反应。从四种基本反应 类型的角度分析属于哪种基本反应类型。
2FeCl3+Cu==2FeCl2+CuCl2 结论: Fe3+具有氧化性 氧化性比较:Fe3+ > Cu2+ > Fe2+
探究三、 Fe2+的氧化性和还原性
实验1:往FeCl2溶液中加入锌粉 Zn+ FeCl2==ZnCl2+Fe(溶液有浅绿色变为无色) 实验2:往FeCl2溶液中先加硫氰酸钾溶液再滴加氯水 2FeCl2+ Cl2== 2FeCl3(溶液由浅绿色变为红色) 结论:Fe2+ 既有氧化性又有还原性
还原剂具有还原性
失去电子的难易程度
化合价升高
特别提醒:得失电子的难易程度与得失电子多 少没有关系
3.从化合价高低认识氧化性和还原性
【想一想】判断下列物质具有氧化性还是还原性。
还原性
既具有氧化性 又具有还原性
氧化性
-2 0 +4
+4
+4
H22S S
SO2 H2SO3 Na2SO3
+6 HH22SSOO44((浓浓))
△ 3. CuO + H2 ==== Cu + H2 O
△ 4. Fe2O3 + 3CO ==== 2Fe + 3CO2
氧化剂和还原剂ppt课件

还原剂: 具有还原性,失去电子,化合价升高
中间价态的化合物,在氧化还原
C.Br-、I-、Fe2+
D.Fe2+、I-、Br-
课堂探究
物质的氧化性或还原性强弱的比较
(3) 根据元素周期表比较: 同一周期,从左往右,氧化性逐渐增强,还原性逐渐减弱; 同一主族,从上往下,还原性逐渐增强,氧化性逐渐减弱。
(4) 根据反应条件比较: 2KMnO4+16HCl(浓) === 2MnCl2+2KCl+5Cl2↑+8H2O
C. 氧化性:Co2O3>Cl2>HIO3 D. 还原性:CoCl2>HCl>I2
解析: 反应Ⅰ中Cl元素的化合价部分升高,则HCl为还原剂,A错误;反应Ⅱ中Cl元素的化合价
降低,则Cl2发生还原反应,B错误;由氧化剂的氧化性强于氧化产物的氧化性可知,反应Ⅰ中氧 化性:Co2O3>Cl2,反应Ⅱ中氧化性:Cl2>HIO3,则氧化性:Co2O3>Cl2>HIO3,C正确;由还 原剂的还原性强于还原产物的还原性可知,反应Ⅰ中还原性:HCl>CoCl2,反应Ⅱ中还原性:I2 >HCl,故还原性:I2>HCl>CoCl2,D错误。
Fe2O3 + 3CO
高温
0
+4 -2
2Fe + 3CO2↑
化合价降低
氧
还
化
原
剂
剂
还氧 原化 产产 物物
氧化剂 + 还原剂 = 还原产物 + 氧化产物
最新鲁科版高中化学必修第一册第2章第3节第3课时 氧化还原反应的应用

解析 (1)H2O2在Fe2(SO4)3做催化剂的条件下分解生成H2O和O2,在此反应中 H2O2既做氧化剂也做还原剂,所以用双线桥表示电子转移的方向和数目为:
(2)I-被氧化生成I2的离子方程式为H2O2+2I-+2H+==I2+2H2O。
方法点拨研究物质氧化性或还原性的思路 (1)根据物质中所含元素化合价升高或降低的可能性,预测物质可能具有还 原性或氧化性。若所含元素化合价有升高趋势,说明该物质具有还原性。 反之,若所含元素化合价有降低趋势,说明该物质具有氧化性。 (2)如果预测某物质具有氧化性,就需要寻找具有还原性的另一物质,通过 实验检验两者能否发生氧化还原反应,以验证预测。相应地,如果预测某物 质具有还原性,就需要寻找具有氧化性的另一物质,通过实验验证预测。
易错警示(1)实验室制取Cl2时必须用浓盐酸,稀盐酸与MnO2不反应。随着 反应的进行,浓盐酸将逐渐变稀,一定程度时,该反应会自动停止,HCl不可 能消耗尽。
(2)因氧化性强弱不同,MnO2氧化浓盐酸需要加热, KMnO4氧化浓盐酸不需 要加热。
变式训练2(2020河北唐山一中高一期中)无水FeCl3呈棕红色,固体FeCl3极 易潮解,100 ℃左右时升华。某学习小组利用如图装置(某些夹持仪器略去) 制备并收集无水FeCl3固体。请回答:
(3)分离MnO2和KCl的固体混合物,由于MnO2不溶于水,而KCl能溶于水,所 以可向固体混合物中加入适量的水搅拌,使KCl充分溶解,然后过滤,分离出 MnO2固体和KCl溶液,将固体洗涤、干燥,可得纯净的MnO2;将洗涤液与滤 液合并,然后将该溶液蒸发,可得到高温下饱和KCl溶液,根据KCl的溶解度 受温度的影响变化较大的特点,然后冷却结晶,即可得到KCl固体。
化学鲁科版1第2章第3节氧化剂和还原剂第3课时教案

化学鲁科版1第2章第3节氧化剂和还原剂第3课时教案教学目标1.课标要求(1)把握铁及其化合物的氧化性或还原性。
(2)通过实验探究,使学生学会用“用已知物质的性质验证未知物性质”的科学方法。
(3)通过性质实验探究,进一步巩固氧化还原反应的知识。
2.三维目标(1)知识与技能①把握铁及其化合物的氧化性或还原性。
②通过探究实验进一步深化明白得氧化还原反应的相关知识。
(2)过程与方法通过“铁及其化合物的氧化性和还原性”实验探究活动,使学生学会用氧化还原反应原理推测和验证未知物性质的科学方法。
(3)情感态度与价值观①体会氧化还原反应的普遍存在,并能举例说明生活、生产中常见的氧化还原反应。
②通过了解铁与人体健康的内容,应用化学知识使生活更健康。
③通过“铁及其化合物的氧化性和还原性”实验探究活动,培养学生严谨认确实科学态度和精神。
教学分析1.教材分析探究铁及其化合物的氧化性和还原性这一主题设置在氧化还原反应知识之后,是氧化还原反应知识的延伸和应用。
而铁及其化合物的相关性质是高中时期比较重要的元素知识,该主题的进行使学生在分析铁及其化合物的氧化性和还原性、把握铁及其化合物的相互转化关系的同时,能够进一步巩固氧化还原反应的知识。
2.学情分析金属铁及其化合物是学生专门熟悉的物质,他们在日常生活中、在往常的实验课程中常常接触到含铁元素的物质。
通过对前面氧化还原反应知识的学习,学生差不多明白了铁具有还原性,而且能够依照化合物所含元素价态的高低简单判定该化合物的氧化还原性质。
如此,教师比较容易找到适当的教学切入口,同时关于铁及其化合物的氧化还原性质的探究,学生们也差不多具有了一定的理论基础。
教学重点、难点1.重点①把握铁及其化合物的相互转化关系,进一步巩固氧化还原反应的知识。
②实验探究方案的设计。
③用氧化还原反应原理推测和验证物质性质的科学方法。
2.难点①铁及其化合物的相互转化关系。
②用氧化还原反应原理推测和验证物质性质的科学方法。
第三节 氧化剂和还原剂(第三课时)
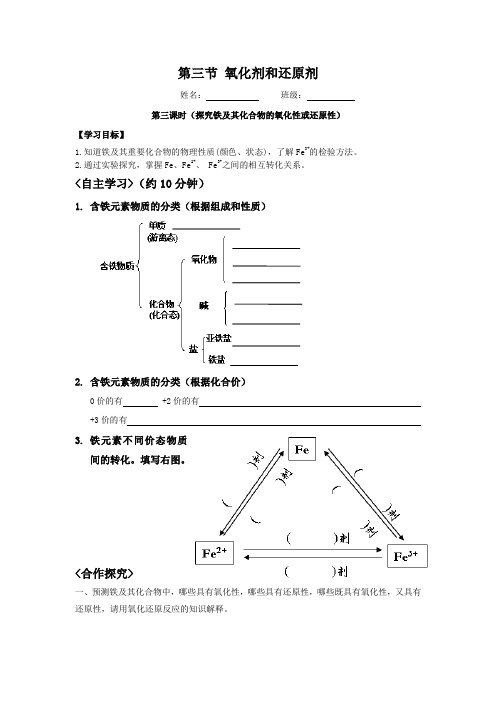
第三节氧化剂和还原剂姓名:班级:第三课时(探究铁及其化合物的氧化性或还原性)【学习目标】1.知道铁及其重要化合物的物理性质(颜色、状态),了解Fe3+的检验方法。
2.通过实验探究,掌握Fe、Fe2+、 Fe3+之间的相互转化关系。
<自主学习>(约10分钟)1.含铁元素物质的分类(根据组成和性质)2.含铁元素物质的分类(根据化合价)0价的有 +2价的有+3价的有3.铁元素不同价态物质间的转化。
填写右图。
<合作探究>一、预测铁及其化合物中,哪些具有氧化性,哪些具有还原性,哪些既具有氧化性,又具有还原性,请用氧化还原反应的知识解释。
二、以金属铁、氯化亚铁、氯化铁为例进行探究。
【实验前准备】1、金属铁、氯化亚铁、氯化铁三种样品的颜色特征是什么?2、FeCl3如何检验?FeCl2能否与KSCN溶液反应,有何现象?3、如何证明物质具有氧化性或还原性?【活动•探究】1. 提出预测与假设(金属铁、氯化亚铁、氯化铁的氧化性与还原性金属铁—性、氯化亚铁—、氯化铁—性。
2. 设计实验方案实验试剂:铁粉、稀硫酸、FeCl3溶液、FeCl2溶液、氯水、稀硝酸、KSCN溶液、锌片、铜片。
请用上述试剂,设计实验方案:探究Fe、FeCl2、FeCl3的氧化性或还原性。
写出相应离子反应方程式:【迁移应用】① 人们利用FeCl 3溶液腐蚀铜箔制造印刷线路板。
请说出其中的道理,分析所发生的化学反应。
② 在FeSO 4溶液里加铁钉或铁粉来防止溶液里的Fe 2+被氧化。
请说出其中的道理,分析所发生的化学反应。
③ 除杂:(1)FeCl 3(FeCl 2)(2)FeCl 2(FeCl 3) 【小结】强氧化剂:;弱氧化剂:;强还原剂:;弱还原剂:;<达标测评>1. 下列物质与铁反应后的生成物,能与KSCN 溶液作用生成红色溶液的是( ) A. 盐酸 B. 氯气 C. CuSO 4溶液 D. 稀硫酸2. 所含铁元素既有氧化性又有还原性的物质是( )强强A. FeB. FeCl2C. FeCl3D. Fe2O33. 要除去FeCl2溶液中少量的氯化铁,可行的办法是( )A. 滴入KSCN溶液B. 通入氯气C. 加入铜粉D. 加入铁粉4. 下列关于铁的叙述正确的是()A. 铁能被磁铁吸引,但纯铁易锈蚀B. 在人体的血红蛋白中含有铁元素C. 铁能在空气中剧烈燃烧D. 不能通过化合反应制得FeCl2和Fe(OH)3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.判断下列反应中的氧化剂、还原剂
① 2Na + Cl2 === 2NaCl 还原剂 氧化剂
② CuSO4 + Fe ==== FeSO4 + Cu 氧化剂 还原剂
③ 2H2O ====
电解
2H2 + O2↑
既是氧化剂又是还原剂 △ ④MnO2 +4HCl(浓)====MnCl2 +2H2O +Cl2↑ 氧化剂 还原剂
纵观全局
得电子, 化合价降低, 被还原, 发43; H2 ====
还原剂
△
还原产物
Cu + H2O
氧化产物
失电子, 化合价升高, 被氧化, 发生氧化反应
常见氧化剂和还原剂
氧化剂 单质 氧化物 化 合 物 盐 含氧酸 无氧酸 O2、Cl2、Br2 还原剂 Na、Fe、H2、C CO、SO2 FeSO4、Na2SO3 H2SO3
再复习回顾一下吧
化合价降低,得电子,被还原
+1 -2 0 +2 -2 △ 0 CuO + H2 ==== Cu + H2O
化合价升高,失电子,被氧化
物质所含元素化合价升高的反应是氧化反应 物质所含元素化合价降低的反应是还原反应 失去电子的反应就是氧化反应 得到电子的反应就是还原反应
双线桥分析氧化还原反应
下列反应中,哪些是氧化剂?哪些是还原剂? Cu + Cl2 ==== CuCl2
还原剂
点燃
氧化剂
Zn +
还原剂
H2SO4 ==== ZnSO4 + H2↑
氧化剂
CaCO3 + 2HCl ==== CaCl2 + H2O + CO2↑
非氧化还原反应
Cl2
+
H2O==== HCl + HClO
既是氧化剂又是还原剂
氧化性:物质得电子性质,氧化剂具有氧化性。 且物质得电子 越容易氧化性越强
还原性:物质失电子性质,还原剂具有还原性。 且物质失电 子越容易还原性越强
常见的氧化剂和还原剂 ①常见的氧化剂 a. 某些非金属单质,如:O2、Cl2、Br2等; b. 某些含氧酸:浓硫酸、HNO3、HClO等; c. 含高价金属的盐:KMnO4、 FeCl3等。 ②常见的还原剂 a.活泼金属单质:Al、Zn、Fe等; b.某些非金属单质:C、H2等; c.含低价元素的化合物:CO、H2S、Fe2+等。
氧化剂和还原剂的动画演示
还是咱哥俩好啊!
氧化剂:是得到电子(或电子对偏向)的物质,在反应时所含元素 的化合价降低的反应物。 还原剂:是失去电子(或电子对偏离)的物质,在反应时所含元 素的化合价升高的反应物。
氧化还原反应基本概念 1.反应物中: 氧化剂:得到电子化合价降低的物质。 得e-的反应物 → 所含元素化合价降低→发生还原反应 还原剂:失去电子化合价升高的物质。 失e-的反应物 → 所含元素化合价升高→发生氧化反应 2.氧化性和还原性:
(强还原性)
3.根据金属活动性顺序表
在金属活动性顺序表中,金属的位置越靠前,其还原性就越强;金属
的位置越靠后,其阳离子的氧化性就越强。
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb(H)Cu Hg
Ag
Pt
Au
还原性逐渐增强
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ H+ Cu2+ Ag+
氧化性逐渐增强
)
4.苹果汁是人们喜欢的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空
气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现 象发生,说明维生素C具有( B )
A. 氧化性
C. 碱性
B. 还原性
D. 酸性
5.已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+====Fe3++Ce3+
2.在Fe2+、Fe3+、S、I-、H+中只有氧化性的是 Fe
3+
H
+
,只有还原性的是_______,既有氧化性又 I-
有还原性的是
Fe
2+
S
。
3.实现下列变化,一定要加入其它物质作氧化剂的是( C A.CaCO3 → CO2 B.NaCl → NaNO3 C.Zn → ZnCl2 D.CuO → CuSO4
定具有强氧化性,如Na+。同理元素的化合价处于最低价态时,具有 还原性,但不一定具有强还原性,如F-。
2. 根据氧化还原反应方程式 在同一氧化还原反应中 氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物 得ne氧化剂 (强氧化性) + 还原剂 ==== 还原产物 (弱还原性) 失ne+ 氧化产物 (弱氧化性)
特别提示
氧化性、还原性的强弱取决于物质得失电子的难易程度而与得 失电子数目的多少无关。
1.根据元素的化合价
物质中元素处于最高价态,该元素只有氧化性;物质中元素处于最低 价态,该元素只有还原性;物质中元素处于中间价态,该元素既有氧 化性又有还原性。
需要注意的是:元素的化合价处于最高价态时,具有氧化性,但不一
MnO2、CO2
FeCl3、KMnO4 HClO、HNO3、浓硫酸 HCl
H2S、HCl
氧化还原反应的存在
钢铁的冶炼
拓展应用
氧化性、还原性强弱的判断
氧化性:物质得电子的能力(物质越容易得电子,即得电子能力
越强,氧化性就越强) 还原性:物质失电子的能力(物质越容易失电子,即失电子能力
越强,还原性就越强)
第2课时 氧化剂和还原剂
1.掌握氧化剂和还原剂的概念 2.理解氧化剂和还原剂的判断
3.了解氧化性和还原性大小的比较
复习回顾
1.下列化学反应中,哪些属于氧化还原反应?
√
点燃 Cu + Cl2 ==== CuCl2
√ Zn + H2SO4 ==== ZnSO4 + H2↑ × CaCO3+ 2HCl ====CaCl2+H2O+CO2↑ √ Cl + H O==== HCl + HClO 2 2
得到1 × 2e-,化合价降低,被还原
氧化剂
+2 0 △ 0 +1 CuO + H2 ==== Cu + H2O
还原剂
失去2 × e-,化合价升高,被氧化
方法:
1、找出反应前后化合价发生变化的元素并标出化合价; 2、从反应物中被氧化(或被还原)的元素指向产物中对应的 价态变化的元素 3、用e- 表示电子,注明电子得失数 4、查得失电子数是否相等
