脾淋巴细胞分离
两种方法分离小鼠脾原始T淋巴细胞效果比较

实验四脾淋巴细胞分离及流式检测 邵

1 2 3
9
10
可重复滤过
超净台下操作全过程 4
5
8 6
7
实验步骤
(二)制备单个核细胞悬液:
塑料漏皿
1. 将脾脏置于盛有5mLPBS缓冲液的平皿中,然后再置于尼龙指套 中。用针芯轻轻碾磨使单个核细胞通过尼龙指套悬浮于平皿中;
2. 吸取平皿中细胞悬液(再次用尼龙指套过滤)置于刻度离心管中, 加PBS缓冲液(可冲洗培养皿)至10mL,以1500rpm离心5min。 弃去上清,弹散细胞沉淀,加ACK2ml,轻轻吹打混匀并放置34min,以破坏红细胞。然后加PBS缓冲液至10ml,以1500rpm离 心5min;
实验步骤
(一)取小鼠脾脏(3人1组) • 小鼠颈椎脱位处死
用拇指和食指往下按住鼠头,另一只手抓住鼠尾,用力稍 向后上方一拉,使之颈椎脱臼,造成脊髓与脑髓断离
• 取其后右侧卧位,消毒左侧背腹交界 处皮肤,剪取脾脏并尽量将去除脂肪 及筋膜组织。
取脾脏
1
2
3
4
5
6
7
8
9
可重复滤过
10
(四)计算细胞活力
1. 50μl细胞悬液+ 50μl的0.2% 苔盼兰溶液并混匀;
2. 取一滴显微镜下观察:
如果细胞被染成蓝色,旋转显 微镜微调节钮,细胞无反光, 则为死细胞;而细胞不被染色, 晶莹透亮,旋转显微镜调节钮, 细胞明显反光而且有立体感, 为活细胞;
3. 计算细胞活力:计数100个 细胞中活细胞的百分率,一般 活力应在95%以上。
实验步骤
(三)计算细胞浓度
1.将上述细胞悬液做一定倍数的稀释;(建议5倍稀释) 2.混匀稀释后,取1滴加至细胞计数板中,计数细胞计数板中4大方格细胞总数; 3.计算细胞总数:
淋巴细胞增殖实验报告

淋巴细胞增殖实验报告一、实验目的本实验旨在通过体外培养淋巴细胞,观察不同刺激条件下淋巴细胞增殖的情况,探讨淋巴细胞增殖与免疫应答的关系,为进一步研究免疫调节机制提供实验依据。
二、实验材料1. 实验动物:昆明种小鼠,体重20-25g,雌雄不限。
2. 试剂:RPMI-1640培养基、胎牛血清、淋巴细胞分离液、植物血凝素(PHA)、刀豆素A(ConA)、胰蛋白酶、二甲基亚砜(DMSO)、ELISA试剂盒等。
3. 仪器:超净工作台、CO2培养箱、倒置显微镜、酶标仪、流式细胞仪等。
三、实验方法1. 淋巴细胞分离:取小鼠颈椎脱臼处死,无菌操作下取出脾脏,加入胰蛋白酶消化,离心洗涤,再用淋巴细胞分离液分离淋巴细胞。
2. 淋巴细胞培养:将分离得到的淋巴细胞用RPMI-1640培养基重悬,调整细胞密度为1×10^6个/mL,加入PHA或ConA作为刺激剂,分别设置无刺激组、PHA刺激组、ConA刺激组等。
3. 细胞增殖观察:将培养的淋巴细胞置于CO2培养箱中培养,分别在24h、48h、72h、96h和120h取样,用倒置显微镜观察细胞形态变化,并计算细胞数量。
4. ELISA检测:取培养上清液,按照ELISA试剂盒说明书检测细胞因子(如IL-2、IFN-γ等)含量。
5. 流式细胞术检测:取培养的淋巴细胞,用荧光标记的抗体检测T细胞亚群(如CD4+、CD8+等)和细胞周期分布。
四、实验结果1. 细胞形态观察:随着培养时间的延长,淋巴细胞在PHA或ConA刺激下逐渐转变为淋巴母细胞,细胞体积增大,核仁明显,细胞浆内出现空泡。
2. 细胞增殖:在PHA或ConA刺激下,淋巴细胞数量显著增加,且呈时间依赖性。
3. 细胞因子检测:ELISA结果显示,在PHA或ConA刺激下,培养上清液中IL-2、IFN-γ等细胞因子含量显著升高。
4. 流式细胞术检测:流式细胞术结果显示,在PHA或ConA刺激下,T细胞亚群CD4+和CD8+的比例发生改变,且细胞周期分布发生变化。
小鼠脾脏单个核细胞分离
-
特异性 敏感性
优点
缺点
细胞生物 低 学方法 免疫学方 高 法
分子生物 高 学方法
高
可确定活 性
易操作, 可大量检 测 既可定量 又可定位
繁琐费时 不能确定是 否有活性
不能反映浓 度和活性
较高
高
小鼠脾单个核细胞的分离—密度梯度离心法
原理 根据物理学中颗粒沉降原理,不同密度的物质颗 粒在其沉降运动中可因其比重的差别而处于不同 的分布位置。利用此原理可设计一定密度的液体 界面,将各种不同密度的细胞通过离心沉降而达 到使其彼此分离的目的。已知小鼠淋巴细胞和单 核细胞的密度大约在1.088之间,而红细胞与粒细 胞 的 密 度 均 大 于 1.088 。 因 此 , 若 用 密 度 为 1.088±0.001 的分离液则可通过密度梯度离心方 法,在分离液界面上收集单个核细胞。
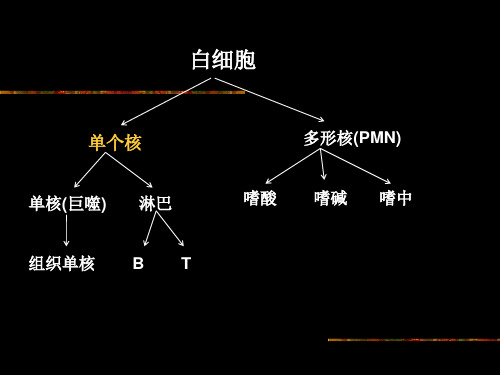
T:表达CD2(SRBC受体) B:不表达CD2
免疫细胞功能检测
淋巴细胞转化试验
细胞毒试验
细胞因子检测 溶血空斑实验
T
PHA, ConA,PWM
或Ag
形态学观察Lc 与淋巴母细胞 的比值
3H-TdR掺入法测cpm值
细胞因子检测
细胞生物学方法: CK细胞敏感株
密度梯度离心法
聚蔗糖—泛影葡胺 Ficoll-Hypaque: 1.088±0.001
LC, M :1.088 RBC, 粒细胞:>1.092
在1ml小鼠脾脏细胞悬液混匀,然后用滴管沿盛有 2ml淋巴 细胞分离液的试管壁轻轻铺于分离液面上。 将该试管置水平式离心机中离心(1800rpm)15分钟。 用滴管小心地直接插入白色絮状的细胞层(含单个核细 胞),吸出界面层细胞,移入另一试管内。 在该细胞收集管内加入生理盐水,用滴管轻轻上下冲洗混 匀,然后在离心(1000rpm)10分钟,弃去上清液,将沉 淀细胞充分摇匀,再用生理盐水离心洗涤1次。 用0.3ml生理盐水(约6滴)将沉淀细胞稀释,摇匀。 取细胞悬液一滴加入等量白细胞稀释液于另一试管中充分 混匀,用计数板在显微镜下计数,计算单个核细胞浓度 (个/ml)。 检查细胞活力:取细胞悬液一滴加入等量锥兰溶液于另一 试管中充分混匀,用载玻片在显微镜下计数100~200个单 个核细胞中着色的死细胞数
脾脏分离淋巴细胞

从小鼠脾脏中分离淋巴细胞
方法一:
1用注射器内芯或者研棒研磨过100目筛网,Hank’s液冲洗,收集分离的脾细胞悬液。
2另取无菌试管,先加入淋巴细胞分离液,然后将试管倾斜,略放平,吸取刚刚制备的细胞悬液缓慢的加入试管中,一般分离液和细胞悬液的体积比为1:2,要轻要慢,不要冲破了淋巴细胞分离液和细胞悬液的界面。
室温水平离心2000转/分钟,30分钟。
3离心后取出试管,可以看到不同的分层,一般上面是非细胞成分和细胞碎片,接下来是单个核细胞,再往下是红细胞等。
吸走上层非细胞层弃之,吸出单个核层在另外无菌试管中,因为淋巴细胞分离液对细胞有毒性作用,加入PBS离心洗两遍(1000转/分钟,10分钟)。
4倾倒上清,用RPMI-1640重悬细胞。
方法二:
用注射器内芯或者研棒研磨过100目筛网,Hank’s液冲洗,收集分离的脾细胞悬液,2000r/min离心3min,弃上清。
加红细胞裂解液8mL,混匀脾细胞,静置5-6min,待红细胞完全破碎,2000r/min离心3min,弃上清去除红细胞,Hank’s液洗1-2遍,用RPMI-1640(含10%胎牛血清)重悬细胞。
达科为小鼠脾脏淋巴细胞分离解决方案 - 生物在线

相关产品
1. 预包被 ELISPOT 试剂盒
货 号 名 称 规 格
DKW22-1000-048 DKW22-1000-096 DKW22-1000-500 DKW22-2000-048 DKW22-2000-096 DKW22-2000-500 DKWHBV-1001-048 HBV C-γ IFN ELISPOT kit DKWHBV-1001-096 DKWTB-1002-048 TB- γ IFN ELISPOT kit DKWTB-1002-096 Mouse IFN-γ precoated ELISPOT kit Human IFN-γ precoated ELISPOT kit
2. 3.
平皿的口径不能太大,否则尼龙网不能产生有效的弹 力。 镊子在一边夹住尼龙网,防止尼龙网在研磨过程中滑 动。
参考文献:
1. 2. 3. 4. 5. 6. 7. 8. 殷玉俊,等.[J]江苏大学学报医学版,2008,18(1):15-18 泰淑红,等.[J]免疫学杂志,2008,24(1):34-37 Juntao Zou, et,al.[J]Journal of the Neurological Sciences,2008,5:003-007 朱 鹏,等.[J]中华微生物学和免疫学杂志,2007,27(11):1046-1049 朱 鹏,等.[J]世界华人消化杂志,2007,15(31):3289-3294 刘 义,等.[J]生殖与避孕,2007,27(11):691-694 张 慧,等.[J]江苏大学学报医学版,2007,13(2):97-101 王晓莲,等.[J]实用老年医学,2007,21(4):240-242
3/4
达科为生物技术有限公司
EZ-SepTM 系列说明书
小鼠淋巴细胞分离

小鼠全脾分离及淋巴细胞的获取实验步骤:1.杀鼠:将小鼠颈椎脱臼处死,70%酒精喷涂表面,无菌条件下剖开小鼠腹腔2.分离全脾:取脾,横切约1mm厚放入固定液,作为组化样本,其余组织放入1ml 5% FCS 1640.3.脾淋巴细胞的分离:1)脾脏处理:将脾脏置于200目滤网上,用5mL注射器内芯轻轻研磨,不断向组织上滴加2ml 5% FCS 1640,直至组织内绝大部分细胞被分离,1ml注射器抽吸滤过,将细胞收集于5ml离心管中。
.2)500g,3min,弃上清。
3)红细胞裂解:加入1ml 红细胞裂解液,轻轻吹打混匀,室温裂解2分钟至红细胞完全破碎。
4)500g,5min,弃上清。
5)洗涤1次:加入1ml 5% FCS 1640,重悬沉淀,500g,3分钟,弃上清。
加入1mL 10% FCS1640重悬,取出15μL计数;6)台盼蓝染色细胞计数:1:20稀释细胞悬液,与0.4%台盼蓝染液9:1混合,计数;计算终浓度为1×107/mL所需加入10% FCS 1640的量。
7)加入适量10% FCS 1640调整细胞浓度至1×107/mL,置于4ºC备用。
小鼠淋巴结分离及淋巴细胞的获取实验步骤:1.杀鼠:将小鼠颈椎脱臼处死,70%酒精喷涂表面,无菌条件下剖开小鼠腹腔2.分离淋巴结:取腋下,腹股沟,肠系膜淋巴结,其中腋下淋巴结置固定液中送组化,其余淋巴结放入1ml 5% FCS 1640.3.淋巴结淋巴细胞的分离:1)淋巴结处理:将淋巴结漂浮于3ml 5% FCS 1640(玻璃平皿)中,用无菌大镊子紧捏淋巴结,并用5mL注射器内芯轻轻研磨,绝大部分淋巴细胞游离置培养基中,1ml注射器抽吸滤过,将细胞收集于5ml离心管中。
.2)500g,3min,弃上清。
3)洗涤:加入1ml 5% FCS 1640,重悬沉淀,500g,3分钟,弃上清。
加入1mL 10% FCS1640重悬,取出15μL计数;4)台盼蓝染色细胞计数:1:20稀释细胞悬液,与0.4%台盼蓝染液9:1混合,计数;计算终浓度为1×107/mL所需加入10% FCS 1640 的量。
小鼠淋巴细胞的分离培养

小鼠淋巴细胞的分离培养
一、血液中淋巴细胞的分离:
1在1.5ML离心管中加入淋巴细胞分离液0.7ML;
2眼部采集小鼠的抗凝血,抗凝剂20%.。
3轻轻将血液加入淋巴细胞分离液的表面,立即以2000—2500转/分离心10MIN。
4小心吸取上层细胞,转移至另一1.5ML离心管中,再用HANK’S 悬浮至1.5ML,再离心,去上清,再悬浮,等待分型用。
二、鼠脾脏中淋巴细胞的分离:
1无菌采集鼠的脾脏,且灭菌注射器的弯针头轻轻扎取,尽可能使单个细胞分离,再分别用4层灭菌纱布过滤2次。
2将滤液小心加入淋巴细胞分离液中。
离心。
3 吸取上层淋巴细胞,HANK‘S液洗涤2次(尽可能去除淋巴
细胞分离液)。
4加入1640培养液进行培养。
、
*淋巴细胞分离液不低于全部液体的50%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小鼠脾脏单个核细胞的分离
一、实验目的
1. 熟悉细胞分离的基本原理
2. 掌握小鼠脾脏单个核细胞的分离的方法
3. 掌握流式细胞术检测细胞表面标志的方法
二、实验原理
1.台盼蓝染色:正常的活细胞,胞膜结构完整,能够排斥台盼蓝,使之不能够进入胞内。
丧失活性或细胞膜不完整的细胞,胞膜的通透性增加,可被台盼蓝染成蓝色。
通常认为细胞膜完整性丧失,即可认为细胞已经死亡。
2.脾是人和脊椎动物最大的淋巴器官。
人的脾脏位于左季肋区的后外侧部,呈卵圆形,脾是血循环中重要的滤过器,能清除血液中的异物、病菌以及衰老死亡的细胞,特别是红细胞和血小板。
三、实验材料
小鼠
手术器械(剪刀、镊子)、酒精喷壶、杀鼠板
平皿,尼龙膜指套、研磨棒、
吸管、试管、EP管、移液器和tips
PBS缓冲液、红细胞裂解液(ACK)
细胞计数板
0.2%台盼蓝染液
8.显微镜
四、实验步骤
(一)取小鼠脾脏
1.小鼠颈椎脱位处死——用拇指和食指往下按住鼠头,另一只手抓住鼠尾,用力稍向后上方一拉,使之颈椎脱臼,造成脊髓与脑髓断离。
2.取其后右侧卧位,消毒左侧背腹交界处皮肤,剪取脾脏并尽量将去除脂肪及筋膜组织。
(二)制备单个核细胞悬液:
1.将脾脏置于盛有5mLPBS缓冲液的平皿中,然后再置于尼龙指套中。
用针芯轻轻碾磨使
单个核细胞通过尼龙指套悬浮于平皿中;
2.吸取平皿中细胞悬液(再次用尼龙指套过滤)置于刻度离心管中,加PBS缓冲液(可
冲洗培养皿)至10mL,以1500rpm离心5min。
弃去上清,弹散细胞沉淀,加
ACK2ml,轻轻吹打混匀并放置3-4min,以破坏红细胞。
然后加PBS缓冲液至10ml,以1500rpm离心5min;
3.弃去上清,弹散细胞沉淀,加PBS缓冲液至2ml,吹打混匀即为小鼠脾脏单个核细胞
悬液。
(放置冰上)
4.取100uL至EP管中,进行计数和活力测定(建议5倍稀释)
5.以1500rpm离心5min,根据计数结果稀释到合适的浓度
a)注:减少操作的时间,并放置冰上或低温离心机里以保证细胞活力
(三)计算细胞浓度
1.将上述细胞悬液做一定倍数的稀释;(建议5倍稀释)。
2.混匀稀释后,取1滴加至细胞计数板中,计数细胞计数板中4大方格细胞总数;
3.细胞计数:细胞浓度(个/mL)=平均每个大方格中细胞数(4个大方格细胞总数/4)
×104×稀释倍数。
每个脾脏的总细胞数:细胞浓度(个/mL) ×10mL
注:镜下偶见有两个以上细胞组成的细胞团,应按单个细胞计算,若细胞团10%以上,说明分散不好,需重新制备细胞悬液。
(四)计算细胞活力
1. 50μl细胞悬液+ 50μl的0.2%苔盼兰溶液并混匀;
2. 取一滴显微镜下观察:
如果细胞被染成蓝色,旋转显微镜微调节钮,细胞无反光,则为死细胞;而细胞不被染色,晶莹透亮,旋转显微镜调节钮,细胞明显反光而且有立体感,为活细胞;
3. 计算细胞活力:计数100个细胞中活细胞的百分率,一般活力应在95%以上。
注意事项:
1.通常分离细胞是为了下一步实验。
有些实验如需要对细胞作进一步培养,则在分离细胞时一定要严格无菌操作。
2.在用ACK破坏红细胞时,不要时间过长,以免破坏其他细胞。
五、实验数据处理和分析
从EP管中取出悬好的单个核细胞10μl后,加入40μlPBS,再加入50μl台盼蓝染料,然后吸取一滴于细胞计数板上,此时稀释倍数为10倍,然后于镜下计数得4个大方格的活细胞+死细胞个数为——
293+1、305+5、309+3、353+3
计算得本次取出的单个核细胞浓度为3.15*107个/ml。
活细胞百分率为:99.06%。
由于后面流式所需脾脏细胞个数为1x106-5x106,所以本小组吸取了已提取细胞液160μl,约5x106个细胞进行离心,用以流式分选。
六、经验总结与思考
个人认为在处死小鼠时新手不熟练使用颈椎脱位法太过于残忍,有很多同学把尾巴扯断,希望老师以后教学时能换一种处死方式如腹腔注射等。
由于脾脏紧靠肋弓,所以取脾脏时侧卧位要比直接开腹腔更方便寻找脾脏,也不容易导致失手将脾脏剪断的现象发生。
在血红细胞表面上有红细胞专属的表面抗原,当裂解液中含可以攻击特定红细胞表面抗原的酶的时候只会造成红细胞的变形,生物通道扩大,膨胀,裂解,或者引起红细胞的变性,而不会攻击其他细胞。
另外红细胞有自己的电负性,渗透脆性(通常是一些非酶细胞裂解液的突破点) ,悬浮稳定性,红细胞裂解液就是利用这些特性裂解红细胞。
本次实验中第一次裂解离心后发现细胞沉底中仍有红细胞存在,因此又重复裂解了一次,直到沉淀红色不明显才停止。
经过思考我认为短时多次的重复要优于少次长时的裂解,因为红细胞裂解液不能完全保证不损伤白细胞,所以太长时间的裂解也会影响提取所得白细胞的数量。
