酯化反应
酯化反应条件

酯化反应条件酯化反应是一种重要的有机合成反应,通过酸催化或酶催化作用,将醇和酸酐反应生成酯。
酯化反应可以应用在许多领域,包括食品、药物、化妆品和涂料等。
本文将介绍酯化反应的条件及其影响因素。
1. 酯化反应的催化剂酯化反应常用的催化剂包括酸、碱和酶,每种催化剂都有其独特的应用。
以下是常用催化剂的介绍:1.1 酸催化剂酸催化剂是酯化反应中最常用的催化剂之一。
常用的酸催化剂包括硫酸、磷酸和三氟甲磺酸等。
酸催化剂可以促进醇和酸酐之间的酯化反应,加快反应速率。
酸催化剂常用于不对空气敏感的酯化反应。
1.2 碱催化剂碱催化剂在酯化反应中也有一定应用。
碱催化剂常用的是碳酸盐和碱金属等。
与酸催化剂相比,碱催化剂对空气和水较为敏感。
碱催化剂通常可用于无需高反应速率的酯化反应。
1.3 酶催化剂酶是一种生物催化剂,具有高效催化的特性。
在某些情况下,酶可以替代传统的酸碱催化剂,实现对环境的友好性。
酶催化剂可以在较温和的条件下进行酯化反应,提高产率和选择性。
2. 酯化反应的反应物酯化反应的反应物主要包括醇和酸酐。
醇可以是一元醇、二元醇或多元醇,而酸酐则通常是由无机酸或有机酸与酸酐形成。
3. 酯化反应的反应条件酯化反应的条件是影响反应速率和产物选择性的重要因素。
以下是酯化反应的常见条件:3.1 温度温度是酯化反应中的重要参数之一。
较低的温度倾向于得到较少的产物,而较高的温度则有助于提高反应速率。
在实际应用中,应根据反应物的性质和反应速率的要求选择适当的温度。
3.2 反应物比例酯化反应的反应物比例在一定程度上影响产物的选择性。
通常来说,过量的醇有助于增加酯的产率,但过量的酸酐会导致副反应的发生。
因此,在设计酯化反应时,应根据所需产物的比例选择适当的反应物比例。
3.3 反应时间反应时间是指反应达到平衡所需的时间。
在实际应用中,反应时间需要根据不同的反应物、催化剂和反应条件进行调整。
太短的反应时间可能导致不完全的反应,而太长的反应时间则会增加生产成本。
酯化反应机理催化剂酯化方法

酯化反应机理催化剂酯化方法酯化反应是一种常见的有机合成反应,它是通过醇与酸反应生成酯的过程。
酯化反应在工业上具有广泛的应用,例如生产香料、塑料、溶剂、涂料等。
本文将介绍酯化反应的机理、常见的催化剂以及酯化反应的方法。
酯化反应通常是使用醇和酸发生酸催化反应来生成酯。
在酸性条件下,酸会负责催化酸酯交换反应。
其机理主要分为四个步骤:1.酸催化:酸作为催化剂使酯化反应加速进行。
酸可以与醇或酸形成氢键,使得醇中的-OH基和酸中的-COOH基增加亲电性,促进了反应的进行。
2.亲核进攻:醇中的氧原子攻击酸中的羰基碳原子,形成一个酰氧离子。
这是反应的决速步骤。
3.水解:酰氧离子失去一个负电荷,并与酸中的-OH基结合,生成产物酯。
4.生成酸与醇:剩余的酸与醇进行酸酯交换反应,生成酮和水。
酯化反应催化剂:为了提高酯化反应的速度和产率,常常使用催化剂来加速反应。
常见的催化剂包括:1.酸催化酯化催化剂:例如硫酸、磷酸和苯甲酸等。
酸具有高度的亲电性,可以促进亲核取代反应。
2.酶催化酯化催化剂:例如酯酶,可以在温和的条件下促进酯化反应的进行。
酶作为生物催化剂,具有高效和特异性。
3.有机催化剂:例如有机酸,可以作为替代传统无机酸的催化剂使用,并且具备环境友好性。
酯化反应方法:酯化反应可以通过多种方法进行,根据反应条件的不同可以分为以下几种方法:1.酸催化酯化反应:将酸和醇加热反应,酸催化酯化反应是一种常见的酯化反应方法,常用的酸包括硫酸、盐酸、磷酸等。
2.酯交换反应:通过醇的交换来进行酯化反应,常用的催化剂包括金属醇盐、酯化酶等。
3.酰氯法:将酸与氯化物反应生成酰氯,然后将酰氯与醇反应生成酯。
酰氯法具有反应速度快、操作简单等特点,常用于大规模工业生产。
4.酸酐法:将酸酐与醇反应生成酯。
酸酐反应具有较高的选择性和反应速度,常用于特定的酯化反应。
总结:酯化反应是一种重要的有机合成反应,其机理是通过酸催化,亲核进攻,水解和生成酸与醇等步骤完成的。
酯化反应
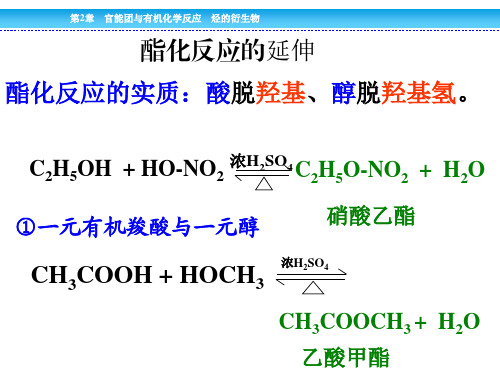
②多元羧酸与一元醇
COOH
COOH + 2CH3CH2OH
浓H2SO4
COOCH2CH3 COOCH2CH3 + 2H2O
乙二酸二乙酯
③一元羧酸与多元醇分子间脱水形成酯
2
浓H2SO4
CH3COOCH2 + CH3COOCH2
2H2O
二乙酸乙二酯
第2章 官能团与有机化学反应 烃的衍生物
④多元羧酸与多元醇之间的脱水反应
4.为什么导管不插入饱和Na2CO3溶液中? 有无其它防倒吸的方法? 防止受热不匀发生倒吸
几种可防倒吸的装置: 第2章 官能团与有机化学反应 烃的衍生物
第2章 官能团与有机化学反应 烃的衍生物
巩固练习 第2章 官能团与有机化学反应 烃的衍生物
1、下列物质中最易电离出H+的是( A )
A.CH3COOH B.C2H5OH
第2章 官能团与有机化学反应 烃的衍生物
某一元醇10g与乙酸反应生成乙酸某酯11.17g,反应
回收该醇1.8g,则该醇的相对分子质量接近于( C )
A、88
B、102
C、116
D、196
一元醇 + CH3COOH → 乙酸某酯 + H2O
Mr(醇) 60
Mr(醇)+42 18
10g-1.8g
11.17g
A 1种 B 2种 CC3 种 D 4种 生成物中水的相对分子质量为 20 。
第2章 官能团与有机化学反应 烃的衍生物
下列反应均可发生,请写出生成的
有机物,并判定是否是酯化反应:
浓硫酸
A. C2H5OH +HOOCH
B. CH2OHCHOHCH2OH +HO-NO2 浓硫酸
第七章 酯化反应

第七章酯化反应7.1 涵义狭义:醇或酚和含氧酸(有机或无机)作用生成酯和水的过程。
广义:凡是能大生成酯类的反应。
有时叫成酯反应。
成酯反应方法大约有六十二种,其中有十四种是常见的。
⑴R'OH + RCOOH RCOOR' + H2O⑵R'OH + (RCO)2O RCOOR' + RCOOH⑶R'OH + RCOCl RCOOR' + HCl⑷R''OH + RCOOR' RCOOR'' + R'OH⑸R''COOR''' + RCOOR' RCOOR''' + R''COOR'⑹R'OH + RCN + H2RCOOR' + NH3⑺R'OH + RCONH2RCOOR' + NH3⑻ROH + CH2=C=O CH3COOR⑼CH=CH + RCOOH RCOOCH=CH2⑽CH3O CH33COO CH3⑾RCH2CHO + HOOCCH2COOR' RCH=CHCOOR'⑿CH3COC Cl3 + R'OH CH3COOR⒀RCOOR' + NaX⒁RCOOR' + R''COOH R''COOR' + RCOOH以下我们主要分析第一个反应,2,3,4略为介绍,其它则不谈。
7.2 羧酸法酯化⑴特点不论是什么酸和醇的反应都有三个特点。
①可逆反应;②需要催化剂;③要加热椐研究,等摩尔的乙酸和乙醇反应,要达到平衡,在室温,需16年;150~170℃要24小时;150~170℃,加酸只要2~3小时。
⑵平衡转化率的控制CH3COOH + CH3 CH2OH CH3COO CH2 CH3 + H2O 起始浓度1mol 1mol 0 0 平衡浓度1-x 1-x x x 实测平衡浓度0.335 0.335 0.665 0.665 平衡常数K = [酯][水]/[酸][醇] = 0.6652/0.3352 = 3.94若起始浓度为 1 2 0 0 平衡浓度1-x 2-x x x 平衡常数K不变∴K = 3.94 = x2/(1-x)(2-x) = x2/( x2-3x+2)求得x = 0.845若按1:3投料,则转化率x = 99.6%因此控制转化率的方法是:①增加醇的投料量②及时蒸出水或酯经实践证明,工业生产的投料比是1:1.5(乙醇回收率问题,成本)不同的酯类采取的方法是不同的,对于低沸点酯类则蒸出酯;中沸点的酯类蒸出酯、水、醇三元混合物;高沸点的酯类蒸出水,但往往要加入带水剂(如苯或甲苯)⑶酯化反应的影响因素①醇结构的影响Ⅰ 根据实验有,反应速度 V 伯醇>V 仲醇>V 叔醇 其原因是:A. 存在空间位阻效应。
酯化反应机理

酯化反应机理酯化反应是有机化学中常见的一种重要反应类型,也是合成酯类的常用方法之一。
本文将介绍酯化反应的机理和相关实例,希望能对读者有所帮助。
一、酯化反应的定义和原理酯化反应是一种酸催化下醇与酸酐之间发生的酯键形成反应。
在酸催化条件下,酸酐与醇反应生成酯和水。
酯化反应的形成机制主要有酸催化机制和醇缺失机制。
酸催化机制:在强酸存在的条件下,酸催化剂(如硫酸)将酸酐中的羧基质子化,形成硫酸酯中间体。
此时,醇与硫酸酯中的氧原子形成氢键,发生亲核加成,产生酯和硫酸作为副产物。
醇缺失机制:在无水条件下,由于酸酐和醇中含有水分,酸酐中的羧基经过质子化形成羧阳离子,与醇中的氧原子形成亲核加成,反应生成酯和水。
二、酯化反应的机理例如,醋酸与乙醇反应生成乙酸乙酯的酯化反应可以作为酯化反应的机理示例。
1. 酸催化机制首先,乙酸醋酸中的羧基会受到硫酸催化剂的质子化作用,生成乙酸阳离子。
然后,乙醇中的氧原子通过质子化,生成亲核剂。
此时,醇中的氧原子与乙酸中的羰基碳原子形成键融合,生成中间体。
接下来,乙酸醋酸中的硫酸作为副产物失去一个质子,并与水生成硫酸乙酯。
最后,中间体中的氧碳键断裂,生成乙酸乙酯和水。
总的反应方程式可以表示为:CH3COOH + CH3CH2OH →CH3COOCH2CH3 + H2O2. 醇缺失机制首先,乙酸醋酸中的羧基会受到质子化作用,生成乙酸阳离子。
然后,乙醇中的氧原子形成亲核剂。
醇中的氧原子与乙酸中的羰基碳原子形成键融合,生成中间体。
最后,中间体中的氧碳键断裂,生成乙酸乙酯和水。
总的反应方程式可以表示为:CH3COOH + CH3CH2OH →CH3COOCH2CH3 + H2O三、酯化反应的应用酯化反应在化学和生物化学中具有广泛的应用,例如:1.合成香精和香料:酯类化合物是香精和香料的主要成分之一,酯化反应可以合成各种具有芳香性的酯类化合物,为香精和香料的合成提供了重要的方法。
2.合成药物:许多药物的制造过程中都需要酯化反应。
酯化反应知识点

酯化反应知识点整理
今天咱们来摆一摆酯化反应那些事儿。
酯化反应,说白了就是醇跟羧酸或者含氧的无机酸凑一块儿,生成酯还有水的一种反应。
这反应啊,分三种情况:羧酸跟醇反应、无机含氧酸跟醇反应,还有无机强酸跟醇的反应。
要说这羧酸跟醇的反应,那可是个可逆反应,慢得很,所以嘛,一般都要加点浓硫酸进去当当催化剂,让它快点。
这反应的过程,就像是羧酸分子中的羟基跟醇分子中羟基的氢原子手拉手成了水,剩下的部分就互相搭个伴儿成了酯。
有个口诀叫“酸脱羟基醇脱氢”,说的就是这个理儿。
无机强酸跟醇的反应,那就快多了,跟羧酸跟醇的反应比起来,简直就是闪电战。
像浓硫酸跟乙醇,常温下就能反应生成硫酸氢乙酯。
酯化反应在化学工业里头用处可大了,尤其是在有机合成和药物合成方面。
你比如说,乙醇和醋酸反应生成的乙酸乙酯,那可是制造染料和医药的好东西。
还有啊,有些菜肴烹调的时候,加了醋和酒,也会发生部分酯化反应,生成芳香酯,让菜肴的味道更巴适。
酯化反应的时候,温度、催化剂、溶剂这些条件都很重要。
加热嘛,能加快反应速度,让反应更彻底。
催化剂呢,就像是个推手,能帮忙把反应往前推一推。
常用的催化剂有酸性催化剂和碱性催化剂,像硫酸、磷酸这些就是酸性催化剂,氢氧化钠、碳酸钠这些就是碱性催化剂。
总的来说,酯化反应是个挺重要的有机反应,了解它的基本知识,对咱们了解有机化学和化学工业的发展,那可是大有裨益啊。
酯化名词解释

酯化是一种化学反应,是指酸与醇之间发生酯键的形成过程。
在酯化反应中,酸分子中的羧基(-COOH)与醇分子中的羟基(-OH)发生酯化反应,生成一个酯分子和一分子水。
酯化反应可以是酸催化的,也可以是酶催化的。
酯化反应常用于有机合成中,可以合成各种酯化合物。
酯化反应的应用广泛,例如在食品工业中用于合成食品香精、在制药工业中用于合成药物、在化妆品工业中用于合成香水等。
此外,酯化反应还可以用于制备酯类溶剂,因为酯具有较低的沸点和较好的溶解性,适用于许多溶剂应用场合。
酯化反应的现象

酯化反应的现象酯化反应,顾名思义,就是指通过化学反应形成酯的过程。
在这个反应中,酯与水反应,形成醇和羧酸。
这个过程通常会利用一种酯化剂来促进反应。
酯是一种常见的有机化合物,很多人都不知道它们是什么。
它们通常由一个羧酸和一个醇反应而成。
酯分子通常含有一个羧酸端(COOH)和一个醇端(OH)。
酯化反应通常是由酸催化剂加速的。
这种反应可以用来生成许多有用的物质,如食品香料、合成材料和香水等。
酯化反应的过程是一个亲核加成-消除反应。
酯化剂一般是一种强酸,它的作用是促进酯化反应。
酯与水反应生成醇和羧酸。
当酸催化剂加入到反应体系中时,它可以极大地加速反应速率。
这是因为酸催化剂可以弱化酯中的羰基亲电性,让求核试剂更容易进攻该亲电性中心。
酯化反应是一种可逆反应,意味着当酯生成的速率等于酯与水反应的速率时,反应就会停止。
在酯化反应达到平衡后,如果反应物之一的浓度发生变化,反应就会重新开始。
这种动态平衡的性质对于实际应用非常重要。
酯化反应在生物化学和工业化学中都具有重要的应用价值。
例如,在微生物合成中,酯化反应主要用于合成生物大分子和脂肪酸等。
此外,酯化反应还被广泛应用于生产营养补充剂、食品添加剂和香料等。
总之,酯化反应是一种非常有用的化学反应,具有广泛的应用价值。
它是产生有机化合物的一种重要方法,这些化合物在生命科学、食品工业、化学工业等领域都具有广泛的应用。
我们需要不断探索酯化反应的机理与工艺,以推动各个行业发展,促进我们生活品质的提升。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
RCOORˊ + H 2O RCOORˊ+ RCOOH RCOORˊ + HCl
RCOO R″ + RˊOH R ″COORˊ + RCOOH RCOOR ‴ + R″COORˊ
• 用途: • 工业上酯化是将羧酸与醇在催化剂存在 下进行的反应生产羧酸酯;羧酸酯最重 要的用途是溶剂及增塑剂, • 其他的用途还包括有树脂、涂料、合成 润滑油、香料、化妆品、表面活性剂、 医药等。 • 本章着重学习羧 酸与醇的反应
• 即,三种方式: • 1、酯醇交换法,即醇解法或醇交换法
O R C OR
/
R OH
//
R
COOR
//
R OH
/
2、酯酸交换法,即酸解法或酸交换法
O R C OR
/
O R
//
O OH R C OH R
//
O C OR
/
C
3、酯酯交换法,即醇酸互换
O R C OR
/
O R
//
O OR
// /
O OR
// /
C
R
C
R
//
C
OR
/
5、腈的醇解 • 在硫酸或氯化氢作用下.腈与醇共热可直接成 为酯:
RCN R OH
/
H2O
RCOOR
/
NH3
•本法的优点在于腈可直接转变为酯,不必先制成 羧酸。
• 例如,工业上大量生成的甲基丙烯酸甲酯就是 应用此法。 • 合成过程分为二步:
(CH3)2C(OH)CN H2SO4 CH2 C CH3 CONH2 H2SO4
(2)羧酸的结构
• 酯化反应活性:
•空间位阻
• 甲酸 ≻ 直链羧酸 ≻ 有侧链羧酸 ≻ 芳香族羧酸。
• (见表5-2 异丁醇与各种羧酸的酯化反应影响的结果 )
• 如:以苯甲酸为例,当邻位有取代基时,酯化
反应速度减慢;当两个邻位均有取代基时,酯
化更难,而且形成的酯不易皂化。
• 表5-2 异丁醇与各种羧酸的酯化反应转化率、平衡常数(等摩尔混合,155℃)
③ 对甲苯磺酸
• 具有浓硫酸的一切优点,而且无氧化性,碳化作用较 弱,但价格较高。常用于反应温度较高及浓硫酸不能 使用的场合,如长碳链脂肪酸和芳香酸的酯化。 • (4)酸性阳离子交换树脂 • 特点:操作简便、反应条件温和、催化剂可再生和易 于分离、副反应少、产率高、可连续化生产等。如果 加入适量酸钙,可加快反应速度并提高收率。
• ② 干燥氯化氢或盐酸 • 优点:酸性强、催化效果好、无氧化性和易于 分离等。 • 缺点:设备腐蚀严重、操作较复杂、反应时间 过长时易发生醇羟基氯代副反应等。 • 应用:一般用于某些以浓硫酸作为催化剂时发 生脱水等副反应的含羟基化合物的酯化,也用 于氨基酸的酯化。
干燥HCl H2NCH2COOH C2H5OH HCl H2NCH2COOC2H5 H 2O
• ② 无水酸式盐:AlCl3、FeCl3、KHSO4、CH3COONa等;
• ③ 氧化物:Al2O3、SiO2、ZnO、TiO2、钛酸四丁酯 [Ti(OC4H9)4]等; • ④ 强酸性阳离子交换树脂; • ⑤ 分子筛。
• 选择催化剂应考虑: • ① 醇和酸的种类和结构 • ② 酯化温度 • ③ 设备耐腐情况 • ④ 成本
•Rˊ可以是脂肪族或芳香烃基; •RCOZ为酰化剂,其中的Z可以代表OH,X, OR″, OCOR″,NHR″等。
• • • • • • • • • • •
即,主要有以下几种: ① 羧酸与醇或酚作用: RˊOH + RCOOH ② 酸酐与醇或酚作用: RˊOH +(RCO)2O ③ 酰氯与醇或酚作用: RˊOH + RCOCl ④ 酯交换: R″OH + RCOORˊ R″COOH + RCOORˊ R″COOR‴ + RCOORˊ
61.69 44.36 41.18 33.25 29.03 21.50 8.28 3.45 48.82 40.26 11.55 8.62 6.64
64.23 67.38 68.70 69.52 69.51 73.73 72.65 74.15 73.87 72.02 74.61 72.57 76.52
返回
• (3)酯的水解反应机理: • 酯的水解是羧酸与醇进行酯化反应的逆反应。 • 工业上最重要的酯类水解是由油脂与苛性钠共 热生产肥皂,此碱性水解又称皂化。 • 特点: • ① 酯的水解反应也是一个可逆平衡反应; • ② 可在酸或碱催化下进行; • ③ 反应过程中,进攻的亲核试剂化 率/% 平衡常数K
1h后①
平衡极限
1 2 3 4 5 6 7 8 9 10 11 12 13
HCOOH CH3COOH C2H5COOH C3H7COOH (CH3)2CHCOOH CH3)(C2H5)CHCOOH (CH3)3CCOOH (CH3)2(C2H5)CCOOH (C6H5)CH2COOH (C6H5)C2H4COOH (C6H5)CH=CHCOOH C6H5COOH p-(CH3)C6H4COOH
第五章 酯化技术
5.1概述 5.2 酯化反应的基本原 理(主要介绍以醇为 原料的酯化、以酯为 原料的酯化、水解和 皂化) 5.3 酯化方法(主要介 绍以醇为原料的酯化、 酯化技术) 5.4 应用实例。
5.1 概 述
• 定义: • 酯化反应通常是指醇或酚与含氧的酸(包括有 机和无机酸)作用生成酯和水的反应。 • 由于它是在醇或酚羟基的氧原子上引入酰基的 过程,故又称为O-酰化反应。 • 其通式为: • RˊOH + RCOZ RCOORˊ + HZ
3.22 4.27 4.82 5.20 5.20 7.88 7. 06 8.23 7.99 7.60 8.63 7.00 10.62
•① 1h后的转化率可表示相对酯化速度。
(3) 催 化 剂
• 作用:可降低反应活化能,加快反应的速度。 • 种类: • ① 酸:H2SO4、HCl(或氯化氢)、H3PO4、F3CCOOH、 C6H5SO3H、р-(CH3)C6H4SO3H等;
• ⑤ 催化剂来源
• ⑥ 是否易于分离等。
几种常用催化剂的性能:
• ① 浓硫酸 • 优点:酸性强、催化剂效果好、性质稳定、吸 水性强及价格低廉等,是应用最为广泛的催化 剂。 • 缺点:氧化性,易使反应物发生磺化、碳化或 聚合等副反应,对设备腐蚀严重,后处理麻烦, 产品色泽较深等。 • 注意:不饱和酸、羟基酸、甲酸、草酸和丙酮 酸等的酯化,不宜用硫酸催化,因为它能引起 加成、脱水或脱羧等副反应。
极
限
69.59 66.57 66.85 67.30 59.41 60.75 60.52 59.28 58.66 62.03 50.12 6.59 2.53 0.83 8.64 9.46
5.24 3.96 4.07 4.24 2.18 2.39 2.35 2.12 2.01 2.67 1.01 0.0049 0.00067 0.0089 0.0192
• RCOORˊ + H2O
H+ / OH¯
RˊOH + RCOOH
(二)主要影响因素
• 1 反应物的结构 • (1)醇或酚结构的影响 • 酯化反应活性: • 甲醇 ≻ 伯醇 ≻ 仲醇 ≻ 叔醇 ≻ 酚。
• (见表5-14醇或酚的结构对酯化反应影响的结果 ) •空间位阻
•通常,叔醇和酚的酯化要 选用活泼的酸酐或酰化剂。
COOH (CH3CO)2O OH OCCH3 O COOH CH3COOH
③ 二元酸酐与醇共热反应, 即,能如按下式首先生成单烷基酯:
苯酐
辛醇
•工业上大规模生产的各种型号的增塑剂邻苯二丁酯 (DBP)及二辛酯(DOP)就是以苯酐和过量醇在 硫酸催化下进行酯化而得的。
3、酰氯法
• 特点:① 酰氯的酯化能力比相应的酸酐强, 用它作酯化剂,酯化反应极易进行;对于一些 空间位阻较大的叔醇,也能顺利完成酯化反应。 • ② 是一个不可逆反应。 • 酰氯和醇反应生成酯: • 通式:RCOCl + RˊOH → RCOORˊ + HCl • 缺点:反应中释放出氯化氢 ,易产生多种副 反应(如氯化、脱水和异构化等)
• 常采用吡啶、三乙胺、等有机碱或碳酸钠无机 弱碱中和HCl。 • 另外,为了防止酰氯分解,一般均采用分批加 碱以及低温反应的方法。 • 如,
R COCl N N COR Cl ROH
/
RCOOR
/
N H
Cl
4、酯交换法 • 定义:酯交换,是指在反应过程中原料酯与另 一种参加反应的反应剂间发生了烷氧基或烷基 的交换,从而生成新的酯的反应。 • 应用场合:当用酸对醇进行直接酯化不易取得 良好效果时,常常要用酯交换法。 • 反应方式: • 酯交换除原料酯外,参与反应的另一反应剂可 能是醇、酸或另一种酯。
• 缺点:耐高温性能较差,使用温度低于120℃,因此 限制了它们的应用范围。
CH3COOH 树脂 CH3(CH2)3OH CaSO4 SO3H ; 室温 CH3COOC4H9 (100%) H2O
5.3 酯化方法
• 1、羧 酸 法 • ⑴ 特点:羧酸与醇作用生成酯的反应(羧酸法)是双 分子的平衡可逆反应,虽经加热和催化剂的作用可加 快反应速度,但不能提高平衡转化率。 • ⑵ 酯化转化率: • 为提高酯的收率,制取更多的酯类产物,可采用两种 方法: • 其一是原料配比中,对于便宜原料可以采用过量,以 提高酯的平衡转化率; • 其二是通过不断蒸发反应生成的酯和水.破坏反应的 平衡,使酯化进行完全,这种方法比前者更为有效。
2、羧酸酐法
• 特点: ① 羧酸酐是比羧酸更强的酰化剂 • ② 反应在少量酸或碱的催化下进行。常用的催 化剂有浓硫酸、对甲苯磺酸、高氯酸、氯化锌、 无水乙酸钠、吡啶以及二甲基苯胺等。 • ③ 醇的结构对酸酐法合成酯的影响,酯化速度 顺序为:伯醇>仲醇>叔醇。 • 应用: • ①适用于较难反应的酚类化合物及空间阻碍较大 的醇的直接酯化:
