第六章 配合物的结构与性质
配位化合物的结构和性质

2
3
sp
sp2
直线形
平面三角形
[Ag(NH3)2]+
[CuCl3]2-
4
sp3
d3s dsp2
四面体
四面体 平面正方形 三角双锥形 四方锥形
[Ni(NH3)4]2+
MnO4[Ni(CN)4]2Fe(CO)5 [TiF5]2-
5
dsp3 d4s
6
d2sp3
八面体
[Fe(CN)6]3-
6.2 价键理论
(3) 平行正方形场
在平行正方形配合物中,四个配体沿x,y轴正负方向与
中心离子接近。 在平行正方形配合物中,dx2-y2轨道的电子云极大值方向 指向配体,因此能级最高,高于Es能级;dxy 轨其也在xy平面上,所以
也要受到较大的排斥故能级也高于Es能级;dz2 轨道的能级 较低,低于Es能级;dyz和dxz轨道受到的排斥作用相同,是 简并的,能级最低。这样,在平面正方形场中,能级分裂为 四组。
由于△值通常从光谱确定,故称这个顺序为光谱化学序列。
分裂能和成对能
b) 当配体固定时,分裂能随中心离子的不同而不同,其
大小次序为:
Pt 4 Ir 3 Pd 4 Rh3 Mo3 Ru3 Co3 Cr 3 Fe 3 V 2 Co2 Ni 2 Mn2
中正负离子的静电作用;
中心离子在配体的静电作用下,使原来简并的d轨道分 裂成能级不同的几组轨道;
d电子在分裂的d轨道上重新排布,优先占据能量较低
的轨道,往往使体系的总能量有所降低,形成强场低自 旋、弱场高自旋的配合物。
二、d轨道在晶体场中的分裂
d原子轨道的角度分布图
配合物的结构和性质

构型畸变 Jahn-Teller畸变 畸变
38
例: [Cu(NH3)6
2+,d 9,八面体场 ] 八面体场
两种 简并态
Z轴多一个电子 拉长八面体 拉长八面体
XY平面多一个电子 XY平面多一个电子 平面
压扁八面体 压扁八面体
39
Notes: (1) 基态 无简并态 理想构型 基态,无简并态 无简并态,理想构型 (2)高能轨道上出现简并 高 (3)低能轨道上出现简并 低
电子组态: 电子组态:
(t2g)4 (eg)2
顺磁性
28
例2:[Co(NH3)6]3+ , Co3+:3d6
∆o=23000 cm-1 P= 21000 cm-1
强场低自旋
电子组态: (t2g)6
抗磁性
29
②四面体配合物 例: [CoCl4]2-
∆t 较小,高自旋态 较小,
,Co2+ : 3d7 (e)4(t2)3
3.5
配合物的结构和性质
1
3.5.1 简介
单核配合物 单核配合物 配 合 物 (中心)原子或离子 中心) 如:Cu(NH3)6Cl2 双核配合物 双核配合物 如:Mn2(CO)10 (周围)若干离子或分子 周围)
2
(4,8) net (45.6)2(410.614.84)
3
(4,6) net (44.62)2(44.610.8)
M L
作用较弱 作用较弱
21
d 轨道在平面正方形场的分裂 轨道在平面正方形场 平面正方形场的分裂
22
6Dq 1.78Dq
-2.67Dq 正四面 体场 球形场
-4Dq 正八面 体场 平面正 方形场
《结构化学第六章》
产生磁性的原因: 物质具有不同的磁性,首先是源于物质内部的电子组
态,即电子在原子轨道和分子轨道上的排布情况;其次是 源于化学成分、晶体结构、晶粒组织和内应力等因素,这 些因素引起磁矩排列的情况不同。
.
物质的磁结构分类:
.
6.6.2 顺磁共振
顺磁共振是研究具有未成对电子的物质,如配合物、 自由基和含有奇数电子的分子等顺次性物质结构的一种重 要方法,它又称为电子顺磁共振(EPR)或电子自旋共振 (ESR)。 原理:
.
三种成键方式(自由基反应):
6.5.3 簇合物的催化性能(自学)
.
6.6 物质的磁性和磁共振
磁性是普遍存在的一种物质属性,任何一种物质材料 都有磁性,只不过表现形式和程度有所不同。物质的磁性 常用磁化率х或磁矩μ表示。磁化率是在外磁场H中物质 磁化强度M和磁场强度H的比值:
M/H
Χ是一个无量纲的量。
因子是为了使δ得到一个便于表达的数值。
对于扫频仪器,δ可以如下表达成
Δ是i 无量v纲 v参的,1由0于6 乘10v6因i v子参v,参所以1单0位6为ppm。
.
影响化学位移的因素: (1)核外电子分布 (2)抗磁各向异性效应 (3)溶剂效应和氢键的影响
.
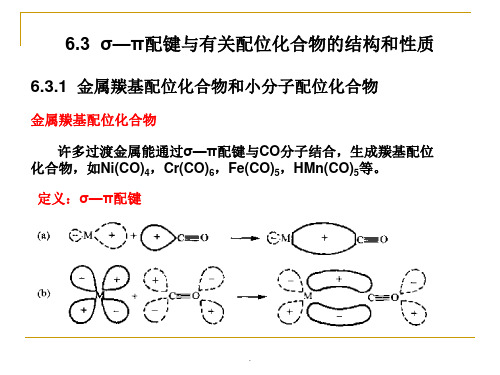
3.磷、砷、锑、铋的三价化合物,如PF3、PCl3、AsCl3、 SbCl3、PR3等也可作为配位体形成σ—π配键。P、As等原子除 有一孤对电子可以作为电子对的供给者,与M形成σ键外,它还 有空的d轨道可和M形成反馈π键,使配位化合物稳定存在,例如 Pd(PF3)4、HCo(PF3)4、Ni(PF3)4、(R3P)4Mo(CO)2等。
.
6.3.2 不饱和烃配位化合物
以不饱和烃为配位体,通过σ—π配键与过渡金属形成的 配位化合物,在石油化工中占有重要地位。
高二化学配合物结构和性质PPT学习教案

(1)画出这两种固体分子的几何构型图
NH
Cl
Cl-P3 t-Cl
Cl-Pt-NH3
NH
NH
①淡3 黄色
②黄3 绿色
(2)淡黄色固体在水中的溶解度小而黄绿色固体溶解度大
的
①中结构原对称,分子无极性因;②的分子有极性是
_,__据__相__似__相__溶__规__则__可__知__,__前__者__溶__解__度__小__而__后__者__大。
(Cu2+的半径小于Zn2+的半径)
答案:B
第28页/共30页
思考题:
向CoCl2溶液中滴加氨水,使生成的Co(OH)2沉 淀溶解生成[Co(NH3)6]2+。此时向溶液中通入空气 ,得到的产物中有一种其组成可用CoCl3·5NH3表 示。把分离出的CoCl3·5NH3溶于水后立即加硝酸 银溶液,则析出AgCl沉淀。经测定,每1mol CoCl3·5NH3只生成2mol AgCl。请写出表示此配合 物结构的化学式(钴的配位数为6):
高二化学配合物结构和性质
会计学
1
一、什么叫配合物
由提供孤电子对的配体与接受孤电 子对的中心原子以配位键结合形成的化 合物称为配合物。
请思考NH4Cl是否是配合物?
第1页/共30页
配合物的组成
[Cu(NH3)4] SO4
中心离子 配位体 配位数 外界离子
内界
外界
配合物
NH3中的N为配位原子
第2页/共30页
第12页/共30页
[Ag(NH3)2]+的成键情况和空间结构 Ag+空的5s轨道和5p轨道形成sp杂化轨 道,接受2个NH3分子提供的孤电子对, 形成直线形的[Ag(NH3)2]+。
第6章-鞣制化学与鞣法(4)精选全文

A
98 100 6
100
P
294
4K2Cr2O7+12H2SO4+C6H12O68Cr(OH)SO4+4K2SO4+6CO2+14H2O
0.0
100.0
酸度和碱度的关系是 酸度+碱度=1
酸度(%)= 酸度(%)=
铬配合物中酸根的总价数 ×100%
铬配合物中铬的总价数 铬配合物中OH基的总价数
×100% 铬配合物中铬的总价数
注:上述只适合于阳铬配合物和不带电荷的中性铬配 合物,而不适合于阴铬配合物.
铬鞣液的酸度和碱度在概念上与铬配合物在 酸度和碱度是一致的,但两者仍有区别。铬 鞣液酸度和碱度的表达式如下。
4K2Cr2O7+12H2SO4+C6H12O6 8Cr(OH)SO4+4K2SO4+6CO2+14H2O
(1)糖用量的计算
如红矾钾用量为100份,则糖的用量为
x
糖=
180 100 4 294
=15.3
即糖的用量为红矾钾用量的15.3%。这是理论值,实际 用量为红矾钾用量的25%~30%。
渗透与结合的均匀性 好 差 一般 一般 一般 一般
填充性 一般 好 差 较好 差 差
颜色 兰色 白色 白色 白色 黄色 浅黄色
铬鞣革的性能
铬盐与蛋白质纤维结合牢固,耐水洗、不易 脱鞣。
铬鞣革柔软、强度高、耐贮存、耐湿热稳定 性好。
革强度大,物理机械性能优良。 化学稳定性良好,对微生物和酸的抵抗力也
单核铬配合物[Cr(H2O)6]Cl3在水溶液中的酸、 碱度的关系。
表6-1 CrCl3·6H2O的酸度和碱度关系
铬配合物
配合物的结构和性质

配合物的结构和性质【学习目标】了解配合物的结构和性质【知识要点】1.配离子的空间构型配位数杂化轨道类型空间构型例子2 sp [Ag(NH3)2]+3 sp2[CO3]2-、[NO3]-4 sp3[Zn(NH3)4]2+4 (dsP2) [Ni(CN)4]2A+6 (d2sp3) [A1F6]2-2.顺、反异构体化学组成相同的配合物可以有不同的结构,这就是配合物的异构现象。
主要是指化学组成相同,仅仅由于配体围绕中心离子的位置不同而产生的结构、性质不同的几何体。
最常见的有顺式、反式两种异构体。
(1)存在于含有两种或两种以上配位体的配合物(某些有机物中也存在)。
(2)顺式——指相同配体彼此位于邻位。
反式——指相同配体彼此处于对位。
(3)在配位数为、或的配合物中,不存在顺、反异构体。
因上述构型中配位位置都是彼此相邻的。
(4)顺、反异构体性质同。
3.配合物的稳定性配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。
当作为中心原子的金属离子相同时,配合物的稳定性与有关。
如CO与血红素中的Fe2+形成的配位键比O2与Fe2+形成的强。
(1)配位原子的电负性__________________________________________________(2)配位体的碱性____________________________________________________(3)螯合效应_________________________________________________________4.配合物的命名(1)配合物内界命名。
一般按如下顺序:配体个数(用一、二、三……表示)一配体名称(不同配体名称之间以中圆点“·”隔开)一“合”字一中心原子名称一中心原子的化合价(在括号中用罗马数注明)。
如:[PtCl4]四氯合铂(Ⅱ)(2)自右向左阴离子名称在前,阳离子名称在后。
若阴离子部分是简单离子则称“某化某”,若阴离子为复杂离子则称“某酸某”。
第六章--配合物的结构和性质

• VBT的基本要点: 的基本要点: 的基本要点
和配体L之间 (A)配合物的中心离子 和配体 之间,是由中心离子提供 )配合物的中心离子M和配体 之间, 与配位数相图的空轨道来接受配体提供的孤对电子, 与配位数相图的空轨道来接受配体提供的孤对电子,形成配 位键。 位键。 有空轨道,: 3有孤对电 ,:NH 如:在[Cu(NH3)4]2+中,Cu2+有空轨道,: ( 故可以形成配位键: 子,故可以形成配位键:见P69。 。 (B)为了形成稳定的配合物,中心离子采取杂化轨道与配位 )为了形成稳定的配合物, 原子形成σ配键, 原子形成σ配键,杂化轨道的类型与配位个体的配位键型和 空间构型相对应。 P71表 空间构型相对应。见P71表。
●单核配位化合物:一个配位化合物分子(或离子)中只含有一 单核配位化合物:一个配位化合物分子(或离子) 单核配位化合物 个中心原子。 个中心原子。 ●多核配位化合物:含两个或两个以上中心原子。 多核配位化合物:含两个或两个以上中心原子。 ●金属原子簇化合物:在多核配位化合物中,若M—M之间有键 金属原子簇化合物:在多核配位化合物中, 之间有键 合称为金属原子簇化合物 金属原子簇化合物。 合称为金属原子簇化合物。 ●配位化合物是金属离子最普遍的一种存在形式。 配位化合物是金属离子最普遍的一种存在形式。 ●金属离子和不同的配位体结合后,性质不相同,可以进行溶解、 金属离子和不同的配位体结合后,性质不相同,可以进行溶解、 沉淀、萃取,以达到合成制备、分离提纯、分析化验等目的。 沉淀、萃取,以达到合成制备、分离提纯、分析化验等目的。
内轨型配合物: 内轨型配合物: 为外轨型配合物, 如[FeCN6]3- 为外轨型配合物,见P69。 。 特点: 轨道参与杂化; 特点:(n-1)d轨道参与杂化;配体的孤对电子部分 轨道参与杂化 进入中心离子的( ) 轨道中 轨道中; 进入中心离子的(n-1)d轨道中;配体一般为电负 性小的原子, 性小的原子,如C,P,因电负性小,易给出电子, ,因电负性小,易给出电子, 对中心离子的价层电子结构有强烈的影响。 对中心离子的价层电子结构有强烈的影响。因此内 轨型配位键形成时打乱了中心离子的外层电子排布。 轨型配位键形成时打乱了中心离子的外层电子排布。
(06) 第六章 配合物的结构与性质-2

Cr(CO)6 Mn2(CO)10 Fe(CO)5 Co2(CO)8 Ni(CO)4
例 Mn2(CO)10是典型的双核羰基化合物,
•其中 Mn—Mn 直接成键。每个 Mn与5 个 CO 形成八面体 其中 直接成键。 与 个配位, 构型中的 5 个配位,第六个配位位置通过 Mn—Mn 键相互 提供一个电子, 个价电子。 提供一个电子,使每个 Mn原子周围满足 18 个价电子。 原子周围满足 •为了减少空间阻碍引起的排斥力,羰基基团互相错开。 为了减少空间阻碍引起的排斥力,羰基基团互相错开。 为了减少空间阻碍引起的排斥力
b) Pt2+的充满电子的 d 轨道和 C2H4 的π*轨道叠加成键,由Pt2+提供 d 电子成π配键。 * 以上成键方式的作用: 1. 防止由于形成σ配键使电荷过分集中到金属原子上; 2.促进成键作用。
过渡金属(M)和烯烃 和烯烃( 过渡金属 和烯烃
C
C
) 间形成 配键的情况 间形成σ-π配
★ 除乙烯外,其他的烯烃和炔烃也能和过渡金属形成配位化合物。
Co2(CO)8 的情况和 Mn2(CO)10相似。
CO的等电子体与过渡金属形成的配位化合物: ● CO的等电子体与过渡金属形成的配位化合物:
N2、NO+、CN-等和 CO 是等电子体,由于结构的相似性,它们也可 和过渡金属形成 配位化合物。 例如,在1965年,人们得到了第一个N2分子配位化合物[Ru(NH3)5N2]Cl3 ★ NO与过渡金属形成的配位化合物: NO比CO多一个电子,这个电子处在π* 轨道上,当NO和过渡金属配 位时,由于π* 轨道参与反馈π键的形成,所以每个NO分子有3个电子参 与成键。 当按照18电子结构规则计算时,由NO分子与CO分子可形成下列化 合物: V(CO)5NO , Mn(CO)4NO,Mn(CO)(NO)3, Fe(CO)2(NO)2,[Fe(NO)(CO)3]-, Co(CO)3(NO),Co(NO)3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[6.7] 解释为什么大多数Zn2+的配位化合物都是无色的。 [解]: Zn2+的 3d轨道已充满电子,它通常以sp3杂化轨道形 成配键,无d—d能级跃迁。因此,其配位化合物都是无色的。
[6.10]利用配位场理论考虑下列配位离子的结构及不成对电子数:MnO43- , Pd(CN)42- , NiI42- , Ru(NH3)63+ , MoCl63- , IrCl62- , AuCl4[解]: 离子 d电子数 形状 d电子排布 不成对电子数 MnO43d2 四面体 2 Pd(CN)42d8 正方形 0
Cr
(d)
Cp Mo S+ Mo Cp Mo Cp
每个Mo原子周围的价电子数=6(Mo原子本身的价电 子)+5(Cp提供)+2×2(由CO提供)+2(由金属键提 供)+1(由S原子提供)=18
H
(e)
Re
Байду номын сангаас
Mo Re H
Mo Re H
与4个CO相连的Re原子周围的价电子数为: 7(Re原子本身的)+1(H原子提供的)+2×4(4个CO提供的) +1×2(两个Re—Re键各提供1个)=18 与3个CO相连的Re原子周围的价电子数为: 7个(Re原子本身具有的)+1(由H原子提供)+1(由Re—Re 单键提供)+2(由Re=Re双键提供)+2×3(由3个CO提供)+1 (外来电子)=18
[6.16] 尖晶石的化学组成可表示为AB O ,氧离子紧 2 4 密堆积构成四面体空隙和八面体空隙。当金属离子A 占据四面体空隙时,称为正常尖晶石;而A占据八面 体空隙时,称为反式尖晶石。试从配位场稳定化能计 算结果说明NiAl2O4是何种尖晶石结构。 [解]:若Ni2+ 占据四面体空隙,则其d电子的组态为 (e)4(t2)4。此时配位场稳定化能为: LFSE(Td)=-[4×0.178+4×(-0.267)]△=0.356△ 若Ni2+占据八面体空隙,则其d电子的组态为 (t2g)6(eg*)2。此时配位场稳定化能为: LFSE(Oh)=-[6×(-0.4)+2×0.6] △=1.2△ 显然,LFSE(Oh)>LFSE(Td ),所以Ni2+ 占据八面 体空隙,NiAl2O4采取反式尖晶石结构。
t2 e
配合物因有未成对的d电子而显顺磁性。若呈平面正方形, 则d电子的排布方式为:
dx2 -y 2 dxy dz2 dxz,dyz
配合物因无不成对电子而显反磁性。反之,若Ni2+ 的四配位 化合物显顺磁性,则它呈四面体构型;若显反磁性,则它呈平面 正方形。此推论可推广到其他具有d8组态过渡金属离子的四面体 配位化合物。 NiCl42-为顺磁性离子,因而呈四面体构型。Ni(CN)42-为反 磁性离子,因而呈平面正方形。 [6.17] 某学生测定了三种配合物的d—d跃迁光谱,但是忘记了贴 标签,请帮助他将光谱波数与配合物对应起来。三种配合物是: CoF63- ,Co(NH3)63+ ,Co(CN)63- 。三种光谱波数是:3400cm-1 , 1300cm-1,2300cm-1。 [解]:d—d跃迁光谱的波数与配位场分裂能的大小成正比,而分 裂能大小与配位体的强弱及中心离子的性质有关。因此,光谱波 数与配体强弱及中心离子的性质有关。而在这三种配合物中,中 心离子及其d电子构型都相同,因此光谱波数只决定于各自配体 的强弱。配体强者,光谱波数大;反之,光谱波数小。据此,可 将光谱波数与配合物对应起来: CoF63Co(NH3)63+ Co(CN)631300cm-1 2300cm-1 3400cm-1
Cl
NH3
Cl
NH3
Pt Cl
顺铂
Pt
NH3
NH3
反铂
Cl
(b)用1,2-二氨基环丁烯二酮与铂原子配位,只生成顺式配合 物,其结构式为:
O C C C C O
NH2 Pt NH2
Cl Cl
Pt原子用dsp2杂化轨道分别与Cl原子的p轨道和N原子的sp3 杂化轨道叠加形成4个σ键。Pt原子、Cl原子和N原子处在一个 平面上。该平面与C,O原子所在的平面交成一定角度。
V
V
(短横另一端接配位体CO) 每个V原子周围的价电子数=5(V原子本身的电子)+ +1(由金属键摊到的)+2×6(6个配体提供的)=18。
(b)
CO Cp Ni CO Ni Cp
每个Ni原子周围的价电子数=10+2+1+5=18 (c)
Cp Cr Cp
每个Cr原子周围的价电子数=6+2×2+3+5=18
[6.14] 写出下列分子的结构式,使其符合18电子规则: (a)V2(CO)12 (b)Ni2(CO) 2(C5H5)2(羰基成桥) (c)Cr2(CO)4(C5H5)2 (d)[Cp3MO3(CO)6(μ3-S)]+ (e)[H3Re3(CO)10]2-(有2个Re—Re单键,1个Re=Re双键) [解]:(a)
NiI42Ru(NH3)63+
d8
d5
四面体
八面体
2
1
MoCl63IrCl62AuCl4-
d3
d5 d8
八面体
八面体 正方形
3
1 0
一个配位离子究竟采取何种几何构型,主要决定于它在能 量上和几何上是否有利。对于六配位的离子,比较容易判断, 只是有时需要考虑是否会发生Jahn-Teller效应.但对于四配位 的离子,因素复杂些,判断起来费点脑筋。本题中的MnO43-离子, 从配位场稳定化能来看,采取正方形 ( LFSE= -1.028△0)比 采取四面体构型 ( LFSE= -0.534△0)有利,但由于Mn(V)半径 较小(47pm),若采取正方形构型,则配体之间的排斥力较大, 不稳定;若采取四面体构型,则配体之间的排斥力减小,离子 较稳定[此时Mn(V)的半径也略有增大]。在NiI42-配离子中,尽 管Ni2+属d8构型,但由于它的半径仍较小,而I-的半径较大 (~216pm)且电负性也较大,因而采取正方形构型时配体之 间的斥力太大,而采取四面体构型可使斥力减小,因而稳定。 同是d8构型的Pd2+和Au3+,它们分属第二和第三长周期,半径 较大,周围有较大的空间,此时配位场稳定化能是决定配位离 子几何构型的主导因素。由于采取正方形构型比采取四面体构 型可获得较大的配位场稳定化能,因而它们的四配位离子[如 Pd(CN)42-和AuCl4- ]一般采取平面四方形,呈反磁性。
[6.20] 二氯二氨合铂有两种几何异构体,一种是顺式,一种 是反式,简称顺铂和反铂。顺铂是一种常用的抗癌药,而反铂 没有抗癌作用。 (a) 写出顺铂和反铂的结构式。 (b) 若用1,2-二氨基环丁烯二酮代替两个NH3与铂配位,则生 成什么结构的化合物?有无顺反异构体?分析化合物中原子的 成键情况。 (c) 若把1,2-二氨基环丁烯二酮上的双键加氢然后再代替两个 NH3与铂配位,则生成什么化合物?写出其结构式。该化合物 中有无σ—π配键形成? [解]:(a)
(c)
Cl Pt O NH2 H O H NH2
Cl NH2
O
H H Pt
Cl Cl
O
NH2
该化合物无σ—π配键。
第六章 配合物的结构和性质
第六章 配合物的结构和性质
[6.3] 判断下列配位离子是高自旋型还是低自旋型,画出d电 子排布方式,说明配位离子的磁性,计算LFSE(用△0表示)。 (a) Mn(H2O)62+ (b) Fe(CN)64- (c) FeF63[解]:兹将各项结果列于下表: 配位离子 Mn(H2O)62+ Fe(CN)64FeF63-
d电子构型为d1,d2,d4(LS),d5(LS),d6 (HS)和d7(HS)时,配 合物发生小畸变;d电子构型为d4(HS) ,d7(LS)和d9时,配合 物发生大畸变。
根据上述分析,CuCl64- (c)和Cr(H2O)62+ (e)会发生较大的 变形; Ti(H2O)63+ (d)会发生较小的变形; CuCl42- (b)若为四面 体,则会发生变形。
[6.23] 根据磁性测定结果知,NiCl42-为顺磁性而Ni(CN) 42- 为 反磁性,试推测它们的几何构型。 [解]:Ni2+为(3d)8组态,半径小,其四配位化合物既可呈四面体 构型,也可呈平面正方形构型,决定因素是配体间排斥作用的 大小。若Ni2+的四配位化合物呈四面体构型,则d电子的排布方 式为:
[6.11] 解释为什么Co(C5H5) 2极易被氧化为Co(C5H5) 2+ 。 [解]:按分子轨道理论近似处理, Co原子的9个价层轨 道(3d,4s,4p)和C5H5的10个π分子轨道(每个C5H5环提供5 个)组合成为Co(C5H5) 2的19个分子轨道。基态时19个电子 (10个来自两个C5H5 ,9个来自Co原子)填充在能级较低的 前10个分子轨道上,其中能级最高的4个分子轨道及d电子的 a* 排布情况如下: 1g
a1g e2g
处在高能级轨道a1g*上的电子易失去,所以Co(C5H5) 2易被氧 化成为Co(C5H5) 2+ 。
[6.12] 用Jahn-Teller效应说明下列配位离子中哪些会发生变形。 (a) N i(H2O)62+ (b) CuCl42(c)CuCl64(d)Ti(H2O)63+ (e)Cr(H2O)62+ (f) MnCl64[解]: Jahn-Teller效应的大意是:在对称的非线型配合物中, 若出现简并态,则该配合物是不稳定的。此时它必然会发 生变形,使其中一个轨道能级降低,消除简并,获得额外 的稳定化能。对过渡金属配合物来说,产生Jahn-Teller效 应的根源是中心原子d电子分布的不对称性。 对于六配位的配合物,d电子的构型为d0 , d5(HS)和d10 时,其电子分布是球对称的,最稳定的几何构型是正八面 体。d电子的构型为d3 ,d6(LS) 和d8时,其分布是八面体 对称,配合物也呈正八面体构型。 若d电子分布不对称,则配合物将发生畸变,产生长键 和短键之别。若d电子分布的不对称性涉及到能级较高eg* 的轨道,则畸变程度大;若d电子分布的不对称性只涉及 到能级较低的t2g轨道,则畸变程度较小。具体情况是:
