无机化学 第三章 氧族元素
《氧族元素》课件

硫单质
总结词
化学性质不活泼,常温下稳定,加热 易燃烧
详细描述
硫单质包括硫磺和硫化物,它们在常 温下比较稳定,加热时易燃烧,发出 蓝紫色火焰。硫单质在自然界中广泛 存在,是重要的化工原料,可用于生 产硫酸、染料、橡胶等。
硒单质
总结词
化学性质与硫相似,有毒性
详细描述
硒单质包括硒粉、硒化物等,其化学性质与硫相似,在常温下比较稳定,加热时易燃烧。硒单质有毒性,对人和 动物有害,但也是一种重要的微量元素,对生物体具有保护作用。
麻醉剂
氧族元素中的一些化合物具有麻醉 作用,如氧化亚氮、氟代烃等,可 用于手术麻醉和牙科治疗。
在环保领域的应用
大气污染治理
氧族元素中的一些化合物可用于 大气污染治理,如二氧化硫、三 氧化硫等可用于脱硫脱硝处理, 减少燃煤烟气中的硫化物和氮氧
化物含量。
水处理
氧族元素中的一些化合物可用于 水处理,如臭氧、二氧化氯等可 用于消毒和杀菌,三氯化铁等可 用于混凝沉淀,去除水中的悬浮
催化剂பைடு நூலகம்
氧族元素在工业催化领域也有广泛应 用,如二氧化硫、三氧化硫等可用于 石油裂化催化剂,三氧化二砷可用于 合成氨催化剂等。
在农业上的应用
01
02
03
肥料
氧族元素中的磷是植物生 长必需的元素之一,磷肥 的施用能够提高农作物的 产量和品质。
杀虫剂
氧族元素中的硫和硒等具 有杀虫作用,可用于防治 农作物病虫害,如硫磺粉 、亚砷酸等。
硫化物合成
硫化物性质
具有不同的化学性质,如离子型硫化物、共 价型硫化物和配位型硫化物等。
可以通过热分解、硫化还原反应等方法合成 。
02
01
硫化物应用
第三章 氧族元素

B
3 HXeO6 2e HXeO4 4OH
0.9V 1.24V 2.07V
O3 H 2O 2e O2 2OH
A
H 4 XeO4 H 2e HXeO4 2 H 2O 3.0V
O3 2 H 2e O2 H 2O
4、H2O2的制备
实验室:Na2O2 +H2SO4+10H2O = Na2SO4· 10H2O↓+H2O2
实际不用,市售方便,价廉,常见30%溶液
工业: 19世纪 :BaO2+H2SO4 = BaSO4↓+H2O2 BaO2+CO2+H2O= BaCO3+H2O2 1908年,电解水解法
水解反应 (NH4)2S2O4 +2H2SO4 = NH4HSO4 +H2S2O8 H2S2O8 + H2O = H2SO5 +H2SO4 H2SO5 + H2O = H2SO4 + H2O2
3)测定(碘量法) O3能迅速氧化I-成I2 ,因此可用碘量法测定O3含量。 标准Na2S2O3 O3 + 2I- + H2O = O2 + 2OH- + I2 溶液滴定 4)用途 ①杀菌,净化水和空气。 ②处理电镀液含氰废水 O3 + CN- = OCN- + O2 2OCN- + 3O3 +H2O = 2CO2 + N2 + 3O2 + 2OH5O3 + 2CN- +H2O = 5O2 + 2CO2 + N2 + 2OH③臭氧和烯烃反应,可以确定双键位置。 CH3CH2CH=CH2 O3 CH3CH2CHO + HCHO CH3CH=CHCH3 2CH3CHO ④漂白,脱臭,火箭助燃剂,真空检漏等 3、生成和制备 从能量的观点来看,只要给氧以足够的能量(光、电、热) 即可转变成臭氧。在雷雨天,由于大气中放电而生成臭氧。 在电动机和复印机旁边也经常可以闻到臭氧的特殊腥味。
无机化学练习氧族元素的性质与反应

无机化学练习氧族元素的性质与反应氧族元素是周期表中的第16族元素,包括氧、硫、硒、碲和钋。
它们在自然界中广泛存在,具有一系列独特的性质和反应。
本文将重点介绍氧族元素的性质和反应,包括物理性质、化学性质以及常见的反应类型。
一、物理性质1. 氧族元素的原子结构氧族元素的原子结构包括原子核、质子、中子和电子。
它们的原子数分别为8、16、32、34和84。
它们的原子量依次增加,呈现出一定的趋势。
2. 外层电子结构氧族元素拥有6个外层电子,包含了2个s电子和4个p电子。
这使得它们能够参与不同种类的化学反应。
二、化学性质1. 氧族元素的氧化性氧族元素都具有较强的氧化性,能够与其他元素形成化合物。
其中,氧是最常见的元素之一,能够与大多数元素反应,形成氧化物。
2. 氧族元素的还原性虽然氧族元素具有一定的氧化性,但它们在某些条件下也可以发生还原反应。
例如,对于氧化物,可以通过加热或与一些还原剂反应来进行还原。
3. 氧族元素的电负性氧族元素的电负性逐渐减弱,由氧最高,钋最低。
这意味着氧族元素与其他元素形成化合物时,元素间的电子密度存在差异,从而影响了化合物的性质。
三、氧族元素的反应1. 与氢气的反应氧族元素与氢气可以反应,形成相应的氢化物。
其中,氧化氢是最常见的氢化物。
氧化氢在化学和生物体系中起着重要的作用,具有酸性。
2. 与金属的反应氧族元素可以与许多金属发生反应,形成金属氧化物。
这些金属氧化物在日常生活中广泛应用,如氧化铁、氧化铜等。
3. 与非金属的反应氧族元素与非金属元素也可以发生反应,形成相应的化合物。
例如,氧和硫可以反应生成二氧化硫,硒和氧可以反应生成二氧化硒。
4. 与水的反应氧族元素与水可以发生反应。
其中,氧与水反应生成氢氧化物,硫与水反应生成亚硫酸,硒和水反应生成亚硒酸。
5. 其他反应类型氧族元素还可以与氮、碳、氯等元素形成多种化合物。
例如,五氧化二磷、四硫化三碳、四氯化硒等。
结论氧族元素具有独特的物理性质和化学性质,可以通过与其他元素的反应形成各种化合物。
无机化学:氧族元素

碳酸汞、氧化汞等 12
1. 氧( O2)
VB:
O 2s2 2px1 2py2 2pz1
|
|
O 2s2 2px1 2py2 2pz1 即O=O 应为“反磁性”。
MO:
(
1s
)
2
(
1s
)
2
(
2
s
)
2
(
2s
)
2
(
2
px
)2
2 2
py pz
2 2
(2) 不稳定性
K2 10-25
2H 2O2 2H 2O O2 ,Δ r Hm -196kJ mol -1
22
(3)氧化还原性
酸性条件: O2 0.682V H2O2 1.77V H2O
碱性条件:HO
2
H 2O
3e
3OH
,
E 0.87V
H 2O2 2Fe 2 2H 2Fe 3 2H 2O
H 2O2 PbS(s, 黑) PbSO 4 (s,白) 4H 2O
5H 2O 2
2MnO
4
6H
2Mn
2
5O 2
8H
2O
3H 2O2
2Cr(OH)
4
2OH -
2CrO
24
8H 2O
可见:H2O2氧化性强,还原性弱;
是不造成二次污染的杀菌剂。
24
性质:(1) 不稳定性
2O3 3O2
(2) 氧化性
Δr H m 286 kJ mol -1
无机化学——氧族元素

无机化学——氧族元素无机化学,氧族元素氧族元素是周期表中第16族元素,包括氧、硫、硒、碲和钋。
这些元素的电子构型都是 ns2 np4,因此它们在化学性质上有些相似。
本文将重点讨论氧族元素的性质和应用。
首先,氧族元素的化学性质主要受到它们的电子构型的影响。
由于氧族元素的 np4 外层电子非常稳定,因此它们都倾向于接受两个电子,形成-2 价的阴离子。
这使得氧族元素在化合物中通常呈现-2 价,例如氧化物(O2-)、硫化物(S2-)等。
然而,这并不意味着氧族元素只能形成-2 价,它们还可以形成其他价态,如+4、+6等。
氧族元素参与的化学反应主要包括氧化反应和还原反应。
它们在氧化反应中往往是氧化剂,能够接受电子使其他物质发生氧化。
例如,氧气(O2)是最常见的氧化剂,可以与其他物质反应生成氧化产物。
氧化剂的强弱顺序为:O2>S>Se>Te>Po。
在还原反应中,氧族元素的化合物可以接受电子,发生还原。
例如,硫酸(H2SO4)可以被还原成二氧化硫(SO2)。
氧族元素在生物和环境中起着非常重要的作用。
氧是地球上最常见的元素之一,占据大气中的21%。
它是细胞呼吸和许多生物代谢反应的关键组分,在维持生命中起着至关重要的作用。
此外,氧还参与水的形成和氧化燃烧等重要过程。
硫是地球上第10常见的元素,在自然界中以硫化物和硫酸盐的形式广泛存在。
硫化物在地下矿床中存在,如铅、锌和铜的硫化物,通过提取和加工可以得到对应的金属。
硫酸是一种重要的化学品,在工业生产中广泛应用,如肥料、造纸、皮革制品等。
硒在生物体内有重要的生理作用,是人体中一种必需的微量元素。
它参与抗氧化作用和免疫反应,对维持机体正常生理功能起着重要的作用。
然而,长期摄入过多的硒会导致中毒,因此硒的摄入量需要控制在适当的范围内。
碲是一种具有金属和非金属特性的半金属元素。
它在半导体工业中有重要应用,用于制造太阳能电池和热敏电阻等器件。
此外,碲还具有光电效应和光敏化学反应的特性,在一些领域具有潜在的应用前景。
无机化学-第三章-氧族元素
2、硫的化学性质
1)与许多金属 直接化合
2Al3S Al2S3 HgS HgS
2)与氢、氧、碳、 卤素(碘除外)、 磷等直接作用
S3F2(过量) SF6 SCl2 ΔSCl2
SO2 SO2
3)与氧化性酸作用
S + 6HNO3(浓) H2SO4 + 6NO2+2H2O
4)与碱的作用
3S + 6NaOH 2Na2S + Na2SO3 + 3H2O
(二)、三氧化硫、硫酸及其盐
1、SO3 无色,易挥发固体 固体有三种结构复杂的变体
性质:强氧化性 10SO3 + 4P = 10SO2 + P4O10 SO3 + 2KI = K2SO3 + I2
溶于浓硫酸得发烟硫酸(H2SO4·xSO3)
SO3中的大π键 S:
3p4 3s2
2O: 2 s2
pz 2p4
3CuS+ 8HNO3→3S+2NO+3Cu(NO3)2+4H2O 3HgS+2HNO3+12HCl →3S+2NO+3H2[HgCl4]+4H2O
HgS + Na2S = Na2[HgS2]
3)多硫化物
碱金属(包括NH4+)硫化物水溶液能溶解单质硫生成多硫化物。
Na2S+(x-1)S = Na2Sx (Sx)2-随着硫链的变长颜色:黄→橙→红
二、硫化氢和硫化物
1)硫化氢
结构:H2S结构与H2O相似(键角谁大?) 性质:弱酸性 ( Ka1=8.9×10-8 Ka2=7.1×10-19) 强还原性:
0.3002V
EA
SO24
0.1576V H SO
无机化学课件--氧族
Se
Te
Po
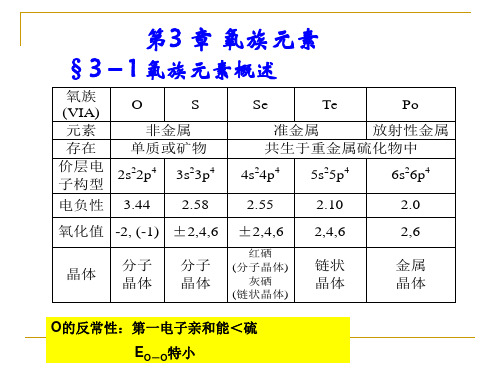
准金属 放射性金属 共生于重金属硫化物中 4s24p4 2.55 ±2,4,6
红硒 (分子晶体) 灰硒 (链状晶体)
5s25p4 2.10 2,4,6 链状 晶体
6s26p4 2.0 2,6 金属 晶体
依次↑ 依次 依次↑ 依次
分子 晶体
分子 晶体
单质Se H2R 化学活性: 化学活性: 稳 定 性: 酸 性: 熔 沸 点: 小 大 弱 最高 小
Cl + O 3 ClO + O 2 →
ClO + O Cl + O 2 →
O 3 + O 2O 2 →
2)氮氧化物和某些自由基等 ) 保护: 年签定蒙特利尔议定书, 保护:1987年签定蒙特利尔议定书,禁止使用 年签定蒙特利尔议定书 禁止使用CFC和其它 和其它 卤代烃,减少大气污染。 卤代烃,减少大气污染。
单质Te H2O H2S H2Se H2Te 大 小 强 大
13.2 氧及其化合物
1. 氧( O2)
O 1s 2 2s 2 2p 2 2p1 2p1 x y z
2 * 2 2 4 * 2
分子轨道电子排布式: 分子轨道电子排布式:
(σ 1s ) (σ
2
* 2 1s
) (σ 2s ) (σ
2s
) (σ 2 p ) (π 2 p ) (π
2O 3
稳定性
3O 2
= − 285 .4 kJ • mol -1 ∆rHm
O3 ﹤ O2
4) 氧化性
O3 > O2
O 3 + 2H + + 2e −
O 3 + 2H 2 O + 2e −
氧族元素及其化合物
2Ag+2O3 →Ag2O2+2O2
氧族元素及其化合物
臭氧能迅速且定量地把I-氧化成I2,常利用该反应来测定O3的 含量,称之为碘量法。
臭氧具有强氧化性和不易导致二次污染的优点,因此常用作消毒杀 菌剂、空气净化剂和漂白剂等。在废气净化领域,可以利用臭氧氧化废 气中二氧化硫,并制得硫酸以回收利用;在废水处理领域,臭氧可氧化 废水中的有机物,通常与传统水处理技术进行组合,以满足废水深度净 化的要求。
在实验室里,可以将过氧化钠加到冷的稀硫酸或稀盐酸中来制备 H2O2:
Na2O2+H2SO4+10H2O →Na2SO4·10H2O+H2O2 工业上制备过氧化氢,目前主要有电解法和蒽醌法两种方法。
氧族元素及其化合物
三、 硫及其重要化合物 1. 单质硫
单质硫有几种同素异形体,最常见的是正交硫和单斜硫。当 加热到368.6 K时,正交硫不经熔化就转变成单斜硫,当把它冷 却时,就发生相反的转变过程,所以368.6 K是正交硫与单斜硫 之间的平衡转变点:
无机化学
氧族元素及其化合物
一、 氧族元素的通性
周期表第ⅥA族包括氧(O)、硫(S)、硒 (Se)、碲(Te)、钋(Po)五种元素,通称 为氧族元素。其中硒和碲是稀有元素,钋是放射 性元素,最重要的是氧和硫两种元素。有关氧族 元素的一些性质见表8-14。
氧族元素及其化合物
氧族元素及其化合物
氧族元素和卤素相似,随原子序数的增加,原子半径和离子半径增 大,而电负性和电离能则降低。由氧向钋过渡,元素的非金属性逐渐减 弱,金属性逐渐增强,氧和硫是典型的非金属,硒和碲是两性的准金属, 钋是金属。氧族元素的非金属活泼性弱于相应的卤族元素。
无机化学《氧族元素》教案
无机化学《氧族元素》教案教学要求]1. 掌握臭氧、过氧化氢的结构和性质。
2. 掌握硫化氢的特性及硫化物的水溶性。
3. 了解掌握硫的氧化物、含氧酸及其盐的结构、一般性质及用途。
[ 教学重点]1. 氧的单质及双氧水的结构、制备和性质2. 硫的单质及重要化合物的结构、制备和性质[ 教学难点]1. 氧的单质及双氧水的结构、制备和性质2. 硫的单质及重要化合物的结构和性质[ 教学时数]6 学时[ 教学内容]1. 氧族元素的通性2. 氧及其化合物3. 硫及其化合物15-1 氧族元素的通性一、氧族元素的存在氧族元素有氧、硫、硒、碲和钋五种元素。
氧是地球上含量最多,分布最广的元素。
约占地壳总质量的46.6% 。
它遍及岩石层、水层和大气层。
在岩石层中,氧主要以氧化物和含氧酸盐的形式存在。
在海水中,氧占海水质量的89% 。
在大气层中,氧以单质状态存在,约占大气质量的23% 。
硫在地壳中的含量为0.045% ,是一种分布较广的元素。
它在自然界中以两种形态出现棗单质硫和化合态硫。
天然的硫化合物包括金属硫化物、硫酸盐和有机硫化合物三大类。
最重要的硫化物矿是黄铁矿FeS2,它是制造硫酸的重要原料。
其次是黄铜矿CuFeS2、方铅矿PbS 、闪锌矿ZnS 等。
硫酸盐矿以石膏CaSO 4· 2H 2 O 和Na2SO 4 · 10H 2 O 为最丰富。
有机硫化合物除了存在于煤和石油等沉积物中外,还广泛地存在于生物体的蛋白质、氨基酸中。
单质硫主要存在于火山附近。
二、氧族元素的基本性质氧族元素的一些基本性质性质氧硫硒碲原子序数原子量价电子构型常见氧化态815.992s 2 2p 4-2,-1,01632.063s 2 3p 4-2,0,+2,+4,+63478.964s24p 4-2,0,+2,+4,+652127.605s 2 5p 4-2,0,+2,+4,+6共价半径/pmM 2 - 离子半径/pm第一电离能/(kJ/mol)第一电子亲合能/(kJ/mol) 第二电子亲合能/(kJ/mol) 单键解离能/(kJ/mol)电负性(Pauling 标度) 661401314141-7801423.441041841000200-5902262.58117198941195-4201722.55137221869190-2951262.10三、氧族元素的电极电势氧的电势图:2.07 0.68 1.77φ A θ / V O 3 ——— O 2——— H 2 O 2 ——— H 2 O1.24 –0.08 0.87φ B θ / V O 3 ——— O 2 ——— HO 2 -——— OH –硫的电势图:2.05 0.20 0.40 0.50 0.14φ A θ / V S 2 O 82 -——— SO 4 2 -——— H 2 SO 3 ——— S 2 O 3 2 - ——— S ——— H 2 S-0.92 -0.58 -0.74 -0476φ B θ / V SO 4 2 - ——— SO 3 2 - ——— S 2 O 3 2 -——— S ——— S 2 -15-2 氧及其化合物一、单质氧自然界中的氧含有三种同位素,即16 O 、17 O 和18 O ,在普通氧中,16 O 的含量占99.76% ,17 O 占0.04% ,18 O 占0.2% 。
无机化学:氧族元素
2、臭氧的分子结构 (1) 价键理论
★ 价键理论
结构:
∏34
中心O: sp2杂化 边O: sp2杂化
键角:117o μ=1.8×10-30 C•m 唯一极性单质
大键
分子中多个原子间有相互平行的p轨道,彼此连贯重叠形 成的π键也称为多原子π键或大π键。
形成大π键的条件:
1、这些原子都在同一平面上; 2、这些原子有相互平行的p轨道; 3、p轨道上的电子总数小于p轨道数的2倍。 是3个或3个以上原子形成的π键
CH3CH2CO + HCHO 2CH3CHO
(3) 臭氧与大气污染
臭氧层最重要的意义在于吸收阳光中强烈的紫外线辐射, 保护地球上的生命。
大气中的还原性气体污染物,如SO2、CO、H2S、NO、 NO2等同大气高层中的O3发生反应,导致O3浓度的降低。 如:
NO2 + O3 NO3 NO + O3
3、臭氧的性质 (1) 不稳定性
臭氧在常温下就可分解: 2 O3 = 3 O2 ΔrHmӨ=- 285.4 kJ·mol-1
若无催化剂或紫外线照射时,它分解得很慢。
(2) 强氧化性
臭氧能氧化一些只具弱还原性的单质或化合物,并且有 时可把某些元素氧化到高价状态。如 2 Ag + 2 O3 = Ag2O2 + 2 O2 PbS + 4 O3 = PbSO4 + 4 O2 O3 + XeO3 + 2 H2O = H4XeO6 + O2
A =
在碱性条件下,H2O2是中等的氧化剂。
过氧化氢在水溶液中,不论是氧化剂,还是还原剂,都在 反应体系中不引入任何杂质:
d.从上面的电位图来看,H2O2不稳定,易歧化。 (i) 在OH-介质中比在H+介质中分解快; (ii) 若有重金属离子Fe2+、Mn2+、Cu2+、Cr3+ 等存在,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5s25p4 2.10 2,4,6 链状 晶体
6s26p4 2.0 2,6 金属 晶体
O的反常性:第一电子亲和能<硫
EO-O特小
§3-2 氧及其化合物
氧的元素电势图
一、 氧( O2)Biblioteka O O顺磁性
有两个三电子Π 键,键能相当于一个正常的 键,因此 O2分子总键能相当于O=O双键的键能496kJ/mol。
Fe 2 S3 FeS
-
3
2
H2S X2 S 2X 2H (X = Cl, Br, I)
5H2S 2MnO-4 6H 2Mn2 5S 8H2O
H2S+Ag →H2 ?
2)金属硫化物 颜色:(大多数为黑色,少数需要特殊记忆)
SnS 棕,SnS2 黄,As2S3 黄,As2S5 黄, Sb2S3橙, Sb2S5橙,MnS 肉,ZnS 白, CdS 黄。
性质:强氧化性
10SO3 + 4P = 10SO2 + P4O10
SO3 + 2KI = K2SO3 + I2 溶于浓硫酸得发烟硫酸(H2SO4· xSO3)
SO3中的大π键
sp2
4
S:
3p 3s
2
pz 3p
激发
3s
2O:
2p
4
pz
1O:
2p
2
pz
2s
2s 2
O
S O
SO3
O
6 4
2、H2SO4
O3的性质: 1、不稳定性
2、氧化性 O 3 2H 2e O 3 H 2 O 2e
2O 3
3O 2
Δ rHm
= - 285 . 4 kJ • mol -1
O 2 H 2 O EA = 2.075V O 2 2OH EB = 1.247V
O3 2I 2H I 2 O2 H 2 O
Cl+ O3 → ClO + O2 ClO + O → Cl + O2 总反应:O + O3 → 2 O2
据估计每产生一个Cl几个月内便可使约10万 个臭氧分子消失
O3 +hv(λ =220~320nm) → O + O2
O2 +hv(λ<240nm) → O + O
氧的成键特征 1、O原子为结构基础 2、O2 为结构基础 3、O3 为结构基础
P 177,题11?
3CuS+ 8HNO3→3S+2NO+3Cu(NO3)2+4H2O 3HgS+2HNO3+12HCl →3S+2NO+3H2[HgCl4]+4H2O HgS + Na2S = Na2[HgS2]
3)多硫化物
碱金属(包括NH4+)硫化物水溶液能溶解单质硫生成多硫化物。
Na2S+(x-1)S = Na2Sx
§3-3 硫及其化合物
存在:主要以硫化物形式存在于自然界中。
最重要的硫化物矿是黄铁矿FeS2,它是制造硫酸 的重要原料。其次是、方铅矿PbS、闪锌矿ZnS等。
黄铁矿FeS2
黄铜矿CuFeS2
一、单质硫 S8 1、结构: S:sp3杂化
形成环状S8分子。
ES-S(226)>1/2ES=S(429KJ· mol-1) EO-O(142)<1/2EO=O(496KJ· mol-1)
这个反应被用来测定O3的含量:
PbS + 2O3 = PbSO4 + O2
2Ag + 2O3 = Ag2O2 + 2O2 过氧化银
臭氧层破坏
自1985年英国科学家首先在南极发现臭氧洞以来,这些年的 科学观察表明南极上空的臭氧洞还在不断扩大 ,另据世界各地 的地面站和人造卫星观察显示,全球除了热带地区外的大部分 区域,平流层的臭氧都有稀释化倾向。臭氧的大量减少将会使 到达地表的有害紫外线 UV-B ( 280~ 320nm )大量增加 , 而这种 紫外线会损害生物体中的 DNA ,增加皮肤癌、白内障的患病几 率,还会对农作物及海洋生物造成严重影响。因此大气平流层 臭氧耗损已成为当今人们最关注全球性问题之一。 经Crutzen、 Molina和 Rowland及其他科学家研究证实, 促使平流层臭氧耗损的主要物质是能产生 Cl 和 ClO 的氯氟烃 (CFCs)、产生Br 和BrO 的哈龙类化合物(Halons ),此外超 音速飞机等排放出的 NOx也会造成臭氧的减少,这些物质中尤 以 CFCs 影 响 最 大 。
H2 O2 HO2-+H+ Ka1=1.55×10-12
H2O2+NaOH → Na2O2+H2O
3)氧化还原性 (氧化能力>还原能力)
H2O2在酸性溶液中是一种强氧化剂
作还原剂 Cl2+H2O2 → 2HCl+O2
2MnO4-+5H2O2+6H+ →2Mn2++5O2+8H2O
4)链转移反应(可检验Cr(Ⅵ)与H2O2)
CuSO4· 5H2O-胆矾或蓝矾,FeSO4· 7H2O-绿矾, ZnSO4· 7H2O-皓矾 d、热稳定性(碱金属碱土金属、MnSO4受热不分解)
CuSO4
FeSO4 Fe2O3+SO3+SO2
(三)、硫代硫酸钠
硫代硫酸盐:Na2S2O35H2O,海波,大苏打。 硫代硫酸(H2S2O3):极不稳定,未能得纯品 制备:
1. 在沸腾的温度下使亚硫酸钠Na2S2O3溶液与S粉反应:
Na2SO3 + S = Na2S2O3
2. 将Na2S和Na2CO3配成2:1的溶液,然后通入SO2气体: 如何写?
2Na2S + Na2CO3 + 4SO2 = 3 Na2S2O3 + CO2
第3 章 氧族元素 §3-1 氧族元素概述
氧族 O S (VIA) 元素 非金属 存在 单质或矿物 价层电 2s22p4 3s23p4 子构型 电负性 3.44 2.58 氧化值 -2, (-1) ±2,4,6 晶体 分子 晶体 分子 晶体 Se Te Po 准金属 放射性金属 共生于重金属硫化物中 4s24p4 2.55 ±2,4,6
H 2SO 3 2H2S 3S 3H2 O
H 2SO 3 I 2 H 2 O H 2SO 4 2HI (Cl2 , Br2 ) 2H2SO 3 O 2 2H2SO 4
(二)、三氧化硫、硫酸及其盐 1、SO3 无色,易挥发固体
固体有三种结构复杂的变体
2)H2SO3及盐:
•二元中强酸(只存在水溶液中)
H 2SO 3
HSO
3 H HSO 3 H SO 2 3
Ka1 = 1.7× 10-2
Ka2 = 6.0× 10-8
24 24 23
• 氧化性<还原性 盐还原性更强
EA (SO /H 2SO 3 ) = 0.1576V
EB (SO /SO ) = -0.9362V
0.3002V
EA SO
24
0.1576V
H 2SO3
0.4497V
S 0.3478V
0.144V
H 2S
•与空气(O2)反应
2H 2 S 3O2 完全 2H 2 O 2SO 2 2H 2 S O 2 不完全 2H 2 O S
•与中等强度氧化剂作用
H2S 2Fe S 2Fe 2H
O O || O | Cr | O O
乙醚
鉴定: Cr2O72- + 2H2O2 + 2H+ == 5H2O + 2CrO5 水相: 2CrO5+ 7H2O 2+ 6H+ == 7O2+ 10H2O + 2Cr3+(蓝绿)
Cr2O72- + H2O2 + H+ == Cr3++ H2O + O2
Cr3+ + H2O2 + OH- →CrO42- + H2O
(Sx)2-随着硫链的变长颜色:黄→橙→红
2-
性质:
S
2- X
- 遇酸不稳定: S 2 2H x
[H 2S x ]
H 2S(g) (x -1)S
2- 3
2- 弱氧化性: SnS S 2
SnS
还原性:
3FeS2 8O2
Fe3 O 4 6SO2
三、硫的含氧化合物 (一)、二氧化硫、亚硫酸及其盐
3、硫酸盐 a、溶解性
b、易成复盐
一类的组成通式是: M(Ⅰ)2SO4· M(Ⅱ)SO4· 6H2O (NH4)2SO4· FeSO4· 6H2O-摩尔盐 另一类组成的通式是: M(Ⅰ)2SO4 · M(Ⅲ) 2(SO4)3· 24H2O K2SO4· Al2(SO4)3· 24H2O -明 矾
c、大多含结晶水
S 3F2 (过量) SF6 Δ SCl S Cl 2 2 S O2 SO 2
H2SO4 + 6NO2+2H2O S + 6HNO3(浓)
3S + 6NaOH 2Na2S + Na2SO3 + 3H2O
二、硫化氢和硫化物
1)硫化氢
结构:H2S结构与H2O相似(键角谁大?) 性质:弱酸性 ( Ka1=8.9×10-8 Ka2=7.1×10-19) 强还原性:
S(单斜硫) S(斜方硫,菱形硫)
制备:从黄铁矿提取硫:
96 0 C
3FeS2 + 12C + 8O2 → Fe3O4 + 12CO + 6S
