大学有机化学醛和酮56页PPT
合集下载
第十一章醛和酮--精品PPT课件

NaBH4还原的特点: ①选择性强(只还原醛、酮、酰卤中的羰基,不还原其它基团。
②稳定(不受水、醇的影响,可在水或醇中使用)。
3. Meerwein-Ponndorf-Verley还原法
R
OH Al(OPr-i)3
R
O
O+
OH +
(H)R'
(H)R'
(二)还原为烃 1.吉尔聂尔-沃尔夫-黄鸣龙还原法
§11-1 结构、分类、同分异构和命名
一、结构
CO sp2 杂化
π键 σ键 CO
121.8。 H 116.5。 C O
H
近平面三角形结构
CO 电负性 C < O
π CO
π 电子云偏向氧原子
δδ CO 极性双键
二、分类
CH3CH2CH2CHO 脂肪醛
CHO
脂环醛
CHO
芳香醛
CH3CH=CHCHO 不饱和醛
R CH2 H(R') ① Kishner-Wolff-Huang Minlon 法 ② 硫代缩醛-脱硫加氢 ③ Clemmensen 法
(一)还原成醇
1.催化氢化
H
+
H2
O H + H2
O
Ni 压力
Ni
OH
H O
2. 用还原剂(金属氢化物)还原
(1)LiAlH4还原
CH3CH=CHCH2CHO
① LiAlH 4 干乙醚
O CH3 C CH2I
O
I2 快
CH3 C CHI2
O
I2 快
CH3 C CI3
O
OH-
CH3 C O- + CHI3
大学有机化学重点知识总结第十一章 醛、酮
—制备增加2个C原子的伯醇:
+
H2C CH2
-+
RM gBr
O -
(C2H5)2O
R C H 2 C H 2 O M g B r
H 3O + H O C H 2C H 2R
精选可编辑ppt
42
33.
CH3 ( NBS )
CH2Br
Mg
(
干醚
CH2MgBr )
① O / 干醚
(
② H3O+
CH2CH2CH2OH )
R C O R '+H 2 O H +
R CO +2 R 'O H
(R '')HO R '
(R '')H
精选可编辑ppt
33
H +
O O C H 3
( )+ ( )
O
CH2CH2CH2CH CH3OH
HO
O
O
O
C OCH3 H
O O
C OCH3
H OC H2CH 2OH
精选可编辑ppt
34
(3)活性:醛>酮 酮一般用原甲酸三乙酯形成缩酮
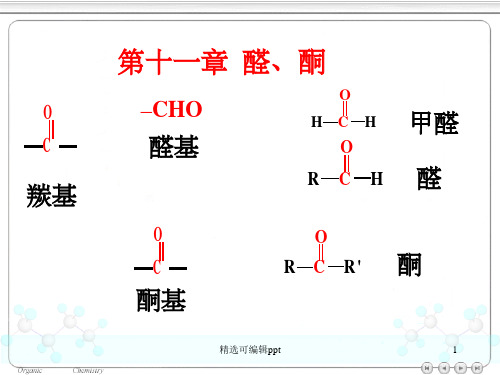
O C
羰基
第十一章 醛、酮
–CHO
醛基
O HCH
O
RCH
甲醛 醛
O
C
酮基
O
R C R' 酮
精选可编辑ppt
1
烃基
脂肪族醛和酮 芳香族醛和酮
醛和酮
饱和醛和酮
的分类 烃基是否饱和 不饱和醛和酮
一元醛和酮
羰基个数 二元醛和酮
多元醛和酮
醛和酮幻灯片.pptx

R
R C O + NH2 OH 羟胺 OH
[R C NH OH] -H2O R C N OH
R
R
肟
R R C O + NH2 NH2
肼
R C N NH2
R
腙
第28页/共81页
R R C O + NH2 NHC6H5
苯肼
R C N NHC6H5
R
苯腙
R R C O + NH2 NHCONH2
氨基脲
R C N NHCONH2
3-甲基丁醛 3-methylbutanal
CH3CH2CCH2CH3 O
3-戊酮 3-pentanone
第6页/共81页
CH3CHCHO
CHO
2-苯基丙醛 2-phenylpropanal
COOH
对甲酰基苯甲酸 4-formylbenzoic acid
CH3CHCH2CHO OH
3-羟基丁醛 3-hydroxylbutanal
CHO
第41页/共81页
❖用金属氢化物加氢:LiAlH4或NaBH4,可以把羰基还原为醇羟基,反 应机理是提供负氢离子对羰基进行亲核加成。
-
O
-
OAlH3
OH
H AlH3
C
C
H2O
C
H
H
LiAlH4
CH3CH CHCH2CHO orNaBH4 CH3CH CHCH2CH2OH
第42页/共81页
❖Meerwein-Ponndorf-Verley还原法:在异丙醇铝的存在下,以异丙醇 为还原剂,反应中只还原醛或酮的羰基,而不影响分子中的其他基团。
CH CHO CH2O HOCH2 CH2OH
有机化学 醛和酮PPT课件

CHO
RCH CH2
CO + H2
[Co(CO)4]2
+ RCH2CH2CHO
R CH CH3
此反应又称氢的甲酰化反应,反应相当于氢的甲酰基(-CHO)按反马氏规
则加成到双键上,得到以直链为主的产物。如:
+ H2C CH2 CO
H2 [Co(CO)4]2
120℃,10~20MPa
CH3CH2CHO
有机化学
CN
R OH
+ H+
C
(R')H
CN
应用:
氧负离子中间体
合成羟基腈,增长碳链。
有机化学
23
第23页/共73页
(2)与饱和NaHSO3的加成
R C
H3C(H)
O NaHSO3
R ONa
C
H3C(H)
SO3H
稀酸或稀碱
羟基磺酸钠
R
OH
C
H3C(H)
SO3Na
特点:
——鉴别醛、部分酮
①反应可逆;
② 只 有 醛 、 脂 肪 族 甲 基 酮 和—少 于—8 个分C 的离环 酮、才提可 以纯反羰应 。基化合物
本章主要内容
一、醛酮的结构、分类和命名 二、醛酮的制法 三、醛酮的物理性质 四、醛酮的化学性质 五、重要的醛酮
有机化学
1
第1页/共73页
一、醛酮的结构、分类和命名
1、醛酮的结构 羰基的结构
CO
羰基中的O原子没有发生杂 化,其2个2s电子与成键无关。
羰基的碳氧双键是由一个
键和一个键组成的。
2p
羰基是平面三角形。
饱和醛酮 不饱和醛酮 O
CHO
醛和酮PPT演示课件

(2)羰基化合物是极性化合物。
13
(二)醛、酮的物理性质
1、状:常温下,甲醛是气体,低、中级醛、酮是液体, 高级醛、酮是固体。
2、味:低级醛有强烈的刺激气味,低级酮有特殊气味, 中级醛、酮有果香味。
3、沸点:醛、酮的沸点比分子量相近的烷烃和醚高,而 比分子量相近的醇低。
4、溶解性:低级脂肪醛、酮易溶于水,其他醛、酮的 水溶性随分子量的增加而减弱,高级醛、酮和 芳香族醛、酮不溶于水。醛、酮能溶于乙醇、 乙醚等有机溶剂。
且垂直于σ键所在的平面。
12
问题:
碳氧双键和碳碳双键都是由一个σ键和一个π键 组成,它们在极性方面会有区别吗?
由于氧原子的电负性较碳原子大,羰基中π键的电 子云偏向于氧原子方面,使得羰基发生极化,羰基碳原 子就带有部分正电荷,而氧原子则带有部分负电荷。
羰基极化的情形:
δ+
δ—
CO
结论: (1)碳氧双键是一个极性不饱和键。
R—C—H + HCN O
H2O/HOH
α—羟基腈
α—羟基酸
18
(2)与亚硫酸氢钠的加成
醛、脂肪族甲基酮 、低级环酮 + 过量NaHSO3饱和 溶液作用,生成α—羟基磺酸钠。
R—C—H + HSO3Na O
R—CH—SO3Na
OH
α—羟基磺酸钠
α—羟基磺酸钠不溶于饱和NaHSO3溶液而呈白色结晶析出。
CH2 + N2
但该还原法是在碱性条件下进行的,所以当分 子中含有对碱敏感的基团时,不能使用这种还原法。
36
5、 歧化反应——Cannizzaro反应
不含α-H 的醛在浓碱作用下,一分子醛被氧化成羧酸, 一分子醛被还原成醇,该反应称为Cannizzaro反应。
13
(二)醛、酮的物理性质
1、状:常温下,甲醛是气体,低、中级醛、酮是液体, 高级醛、酮是固体。
2、味:低级醛有强烈的刺激气味,低级酮有特殊气味, 中级醛、酮有果香味。
3、沸点:醛、酮的沸点比分子量相近的烷烃和醚高,而 比分子量相近的醇低。
4、溶解性:低级脂肪醛、酮易溶于水,其他醛、酮的 水溶性随分子量的增加而减弱,高级醛、酮和 芳香族醛、酮不溶于水。醛、酮能溶于乙醇、 乙醚等有机溶剂。
且垂直于σ键所在的平面。
12
问题:
碳氧双键和碳碳双键都是由一个σ键和一个π键 组成,它们在极性方面会有区别吗?
由于氧原子的电负性较碳原子大,羰基中π键的电 子云偏向于氧原子方面,使得羰基发生极化,羰基碳原 子就带有部分正电荷,而氧原子则带有部分负电荷。
羰基极化的情形:
δ+
δ—
CO
结论: (1)碳氧双键是一个极性不饱和键。
R—C—H + HCN O
H2O/HOH
α—羟基腈
α—羟基酸
18
(2)与亚硫酸氢钠的加成
醛、脂肪族甲基酮 、低级环酮 + 过量NaHSO3饱和 溶液作用,生成α—羟基磺酸钠。
R—C—H + HSO3Na O
R—CH—SO3Na
OH
α—羟基磺酸钠
α—羟基磺酸钠不溶于饱和NaHSO3溶液而呈白色结晶析出。
CH2 + N2
但该还原法是在碱性条件下进行的,所以当分 子中含有对碱敏感的基团时,不能使用这种还原法。
36
5、 歧化反应——Cannizzaro反应
不含α-H 的醛在浓碱作用下,一分子醛被氧化成羧酸, 一分子醛被还原成醇,该反应称为Cannizzaro反应。
《醛和酮的》PPT课件

通式
此方法用于制备醇
1o醇 2o醇
甲醛
醛 3o醇
酮
精选ppt
39
与有机金属锂试剂的反应
O
O H
+ (C H 3 )2 C H C C H (C H 3 )2 (C H 3 )2 C H L i H 3 O +(C H 3 )2 C H C C H (C H 3 )2
H O O H
例二:
转化
O
COC2H5 O
CH2OH
O
II: 还原C=O生成CH2
精选ppt
33
(3) 与氢氰酸加成 RHC O HCN
R OH
C H
CN
α -氰醇
(α -羟基腈)
H2O H+
H
R C COOH OH
α -羟基酸
A: 反应在酸性条件下难以进行,在碱性条件下易进行
B: α-羟基腈多官能团中间体
26
(1) 水合反应
H 3C C O + H 2O
H
H 3C O H C
H O H
平衡偏向左边
机理:
精选ppt
27
(2)与醇的缩合
A. 反应通式:
半缩醛羟基
R H C=O
HOR/
干HCl
R OH H C OR/
R/OH,H+
R OR/ H C OR/
+
H2O
半缩醛
缩酮
(不稳定)
I:
II: 反应为平衡反应,除水可使平衡向右移动
(2)乙烯催化氧化 ➢乙酸、乙酸乙酯的原料
精选ppt
15
3、丙酮
➢无色液体 ➢工业制备
❖丙烯水化 ❖异丙苯制苯酚的付产物 ❖丙烯催化氧化
有机化学第十章醛酮PPT课件

注意事项
在醇氧化制备醛的过程中,应控制反应条件,如温度、浓度、催化剂 等,以避免过度氧化或其它副反应的发生。
通过醇的氧化制备酮
总结词
醇氧化是制备酮的一种常用方法,常用的氧化剂有高锰酸 钾、硝酸、铬酸等。
详细描述
醇氧化制备酮的反应机理是醇分子中的羟基被氧化成羰基, 同时生成氢离子,常用的氧化剂可以将醇氧化成相应的酮, 同时生成水或其它相应的产物。
醛酮还可以用于合成生物活性分子,如激素、维生素等,对生命过程具有重要影响。
05 醛酮的制备方法
通过醇的氧化制备醛
总结词
醇氧化是制备醛的一种常用方法,常用的氧化剂有高锰酸钾、硝酸、 铬酸等。
详细描述
醇氧化制备醛的反应机理是醇分子中的羟基被氧化成羰基,常用的 氧化剂可以将醇氧化成相应的醛,同时生成水或其它相应的产物。
亲核加成反应
与氢氰酸加成
酮在氢氰酸的作用下,可以发生亲核加成反应, 生成相应的羟基腈。
与水加成
酮在水的作用下,可以发生亲核加成反应,生成 相应的醇。
与醇加成
酮在醇的作用下,可以发生亲核加成反应,生成 相应的酯。
亲电加成反应
与溴加成
01
酮在溴的作用下,可以发生亲电加成反应,生成相应的溴代酮。
与硫酸加成
02 醛的化学性质
还原反应
还原成醇
还原成醇和烃的混合物
在催化剂存在下,醛基可被还原成醇, 如用氢化铝锂(LiAlH4)作为还原剂。
在某些条件下,醛基可被还原成醇和 烃的混合物,如用氢气作为还原剂。
还原成烃
在酸性条件下,醛基可被还原成烃, 如用硫酸铜和亚硫酸氢钠作为还原剂。
氧化反应
氧化成酸
在强氧化剂存在下,醛基可被氧化成羧基,如用高锰酸钾 (KMnO4)作为氧化剂。
在醇氧化制备醛的过程中,应控制反应条件,如温度、浓度、催化剂 等,以避免过度氧化或其它副反应的发生。
通过醇的氧化制备酮
总结词
醇氧化是制备酮的一种常用方法,常用的氧化剂有高锰酸 钾、硝酸、铬酸等。
详细描述
醇氧化制备酮的反应机理是醇分子中的羟基被氧化成羰基, 同时生成氢离子,常用的氧化剂可以将醇氧化成相应的酮, 同时生成水或其它相应的产物。
醛酮还可以用于合成生物活性分子,如激素、维生素等,对生命过程具有重要影响。
05 醛酮的制备方法
通过醇的氧化制备醛
总结词
醇氧化是制备醛的一种常用方法,常用的氧化剂有高锰酸钾、硝酸、 铬酸等。
详细描述
醇氧化制备醛的反应机理是醇分子中的羟基被氧化成羰基,常用的 氧化剂可以将醇氧化成相应的醛,同时生成水或其它相应的产物。
亲核加成反应
与氢氰酸加成
酮在氢氰酸的作用下,可以发生亲核加成反应, 生成相应的羟基腈。
与水加成
酮在水的作用下,可以发生亲核加成反应,生成 相应的醇。
与醇加成
酮在醇的作用下,可以发生亲核加成反应,生成 相应的酯。
亲电加成反应
与溴加成
01
酮在溴的作用下,可以发生亲电加成反应,生成相应的溴代酮。
与硫酸加成
02 醛的化学性质
还原反应
还原成醇
还原成醇和烃的混合物
在催化剂存在下,醛基可被还原成醇, 如用氢化铝锂(LiAlH4)作为还原剂。
在某些条件下,醛基可被还原成醇和 烃的混合物,如用氢气作为还原剂。
还原成烃
在酸性条件下,醛基可被还原成烃, 如用硫酸铜和亚硫酸氢钠作为还原剂。
氧化反应
氧化成酸
在强氧化剂存在下,醛基可被氧化成羧基,如用高锰酸钾 (KMnO4)作为氧化剂。
醛和酮—醛和酮(药学有机化学课件)

+ COCH3
Br2
COCH2Br + HBr
卤仿反应
卤仿反应:如果醛、酮α-碳上有三个氢,三个氢被卤素原子
取代,使得碳碳键极性增大,发生碳碳键的断裂,生成三卤
甲烷和羧酸盐的反应。
O
O
CH3C-R(H)+ 3X2
NaOH
OH CX3-C-R(H)
O
CHX3 + R(H)-C-O
O
O
CH3 C CH3 I2 + NaOH CI3 C CH3 NaOH CH3COONa + CHI3
有机化学/ 醛和酮
醛的特征反应
醛基上氢原子由于受羰基 的影响变得比较活泼,因此醛 具有不同于酮的特殊的反应。 醛能被弱氧化剂——托伦试剂、 斐林试剂氧化为羧酸。
一、托伦反应
托伦(Tollens)试剂是AgNO3与氨水生成的一种无色的 银氨配合物溶液,其中Ag+ 起着氧化剂作用,当它与醛共热时, 醛被氧化为羧酸,而它则被还原为金属银,附着在试管内壁上, 形成光亮的银镜,因此该反应也称为银镜反应。
或浓H2SO4
H
或浓H2SO4 H
半缩醛
缩醛
➢ 半缩醛不稳定,很难分离。 ➢ 缩醛具有双醚的结构,对碱、氧化剂、还原剂稳定,可
以分离出来。
➢ 缩醛在稀酸中易水解转变为原来的醛,合成中可利用此 反应来保护醛基。
一、加成反应
与醇加成 分子内也能形成半缩醛、缩醛。
CH O
干 HCl
OH
H OH O
环状半缩醛(稳定) 在糖类化合物中多见
O
C5 H3C4 H2C3 C2 HC1 H3
CH3 2-甲基-3-戊酮
C H3
