北大有机化学课件10-醛和酮
合集下载
2024版年度《北京大学有机化学》ppt课件

2024/2/2
31
THANKS
感谢观看
2024/2/2
32
14
酚
酚的分类与命名
根据羟基所连苯环的不同,酚可 分为一元酚和多元酚等。
2024/2/2
酚的物理性质
多数酚为无色或淡黄色晶体,具有 特殊气味,微溶于水,易溶于有机 溶剂。
酚的化学性质
酚分子中的羟基和苯环相互影响, 使得酚具有一些特殊的化学性质, 如酸性、氧化反应等。
15
醚
醚的分类与命名
根据醚键两端所连基团的不同,醚可分为单醚、混醚等。
实例与应用
乙炔是常见的炔烃之一,广泛应用于 焊接、切割、照明等领域。
10
芳香烃
定义与通式
结构特点
芳香烃是由苯环或稠环结构组成的烃类化合 物。
芳香烃分子中含有苯环或稠环结构,具有特 殊的稳定性和芳香性。
性质与反应
实例与应用
芳香烃的化学性质较为特殊,可以发生取代、 加成、氧化等多种反应,但反应条件较为苛 刻。
机溶剂。
卤代烃的化学性质
03
卤代烃中的卤素原子较为活泼,可发生取代反应、消除反应等。
13
醇
醇的分类与命名
根据羟基所连碳原子的不 同,醇可分为伯醇、仲醇、 叔醇等。
2024/2/2
醇的物理性质
多数醇为无色液体,具有 特殊气味,可溶于水,也 可溶于有机溶剂。
醇的化学性质
醇分子中的羟基具有亲核 性,可发生氧化反应、酯 化反应等。
遵守实验室规章制度,尊重实验数据,不抄袭、不造假,保持诚信 和实事求是的科学精神。
29
实验操作规范与安全注意事项
1
实验前准备
熟悉实验步骤和操作规程,检查实验仪器和试剂 是否齐全、完好,做好个人防护措施。
大学有机化学重点知识总结第十一章 醛、酮
—制备增加2个C原子的伯醇:
+
H2C CH2
-+
RM gBr
O -
(C2H5)2O
R C H 2 C H 2 O M g B r
H 3O + H O C H 2C H 2R
精选可编辑ppt
42
33.
CH3 ( NBS )
CH2Br
Mg
(
干醚
CH2MgBr )
① O / 干醚
(
② H3O+
CH2CH2CH2OH )
R C O R '+H 2 O H +
R CO +2 R 'O H
(R '')HO R '
(R '')H
精选可编辑ppt
33
H +
O O C H 3
( )+ ( )
O
CH2CH2CH2CH CH3OH
HO
O
O
O
C OCH3 H
O O
C OCH3
H OC H2CH 2OH
精选可编辑ppt
34
(3)活性:醛>酮 酮一般用原甲酸三乙酯形成缩酮
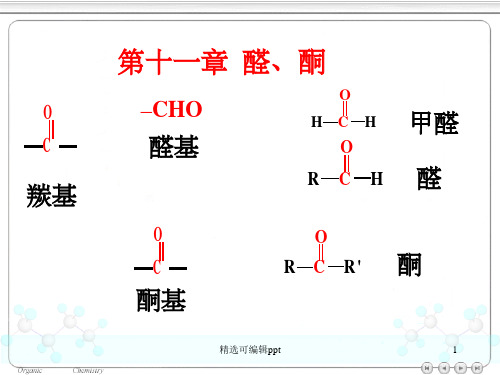
O C
羰基
第十一章 醛、酮
–CHO
醛基
O HCH
O
RCH
甲醛 醛
O
C
酮基
O
R C R' 酮
精选可编辑ppt
1
烃基
脂肪族醛和酮 芳香族醛和酮
醛和酮
饱和醛和酮
的分类 烃基是否饱和 不饱和醛和酮
一元醛和酮
羰基个数 二元醛和酮
多元醛和酮
大学有机化学第11章__醛和酮

甲基乙烯基酮
O C CH3
苯乙酮
(乙酰苯)
共九十一页
2)系统(xìtǒng)命名 法
O
5
CH3
CH3CH2-C-CH2-CH-CH2CH3
CH3-CH-CH2CH2CHO
HO-CH-CH3
6
4-甲基戊醛
5-乙基-6-羟基 3-庚酮
- (qiǎngjī)
共九十一页
C H 3
C H O
C H 2 C H 2 C H C H O O H C C H 2 C H C H 2 C H O
共九十一页
加成-消除(xiāochú)历程
R’
R—C=O + H2N—G
H+
R’ R-C — N—G
H+ -H2O
R’ R-C=N—G
OH H
(N-取代(qǔdài)亚胺)
这种加成-消除实际上可以看成由分子间脱去一分子水:
R’
R—C=O + H2 N—G
R’ R-C=N—G + H2O
共九十一页
加成-缩合产物(chǎnwù)的结构及名称:
加成-缩合产物的结构(jiégòu)及名称:
R’ R—C=O +
R’
H2N—R H2N—OH
R—C = N-R Schiff base R’
R—C = N-OH 肟(oxime)
H2N—NH2 H2N—NH-
O
R’
R—C=N-NH2 腙(hydrazone) R’
R-C=N-NH-C6H5 苯腙
H2N—NH-C-NH2
R’
R-C=N-NH-CO-NH2 缩氨脲
共九十一页
6) 与格氏试剂加成
O C CH3
苯乙酮
(乙酰苯)
共九十一页
2)系统(xìtǒng)命名 法
O
5
CH3
CH3CH2-C-CH2-CH-CH2CH3
CH3-CH-CH2CH2CHO
HO-CH-CH3
6
4-甲基戊醛
5-乙基-6-羟基 3-庚酮
- (qiǎngjī)
共九十一页
C H 3
C H O
C H 2 C H 2 C H C H O O H C C H 2 C H C H 2 C H O
共九十一页
加成-消除(xiāochú)历程
R’
R—C=O + H2N—G
H+
R’ R-C — N—G
H+ -H2O
R’ R-C=N—G
OH H
(N-取代(qǔdài)亚胺)
这种加成-消除实际上可以看成由分子间脱去一分子水:
R’
R—C=O + H2 N—G
R’ R-C=N—G + H2O
共九十一页
加成-缩合产物(chǎnwù)的结构及名称:
加成-缩合产物的结构(jiégòu)及名称:
R’ R—C=O +
R’
H2N—R H2N—OH
R—C = N-R Schiff base R’
R—C = N-OH 肟(oxime)
H2N—NH2 H2N—NH-
O
R’
R—C=N-NH2 腙(hydrazone) R’
R-C=N-NH-C6H5 苯腙
H2N—NH-C-NH2
R’
R-C=N-NH-CO-NH2 缩氨脲
共九十一页
6) 与格氏试剂加成
有机化学第十章醛和酮详解演示文稿

H(R)
2. H2O
ONa R C SO3H
H(R)
NaHSO3
HCN / NaOH OH
R C CN H(R)
第二十三页,共74页。
1. 醛酮羰基上的亲核加成反应(2)
分析:分子型亲核试剂的特点及与醛酮的加成
•特点分析
H Nu
水、醇、胺
•预测:直接与羰基加成
H OH H OR H NHR H NR2
▪ 醛酮与胺类化合物的加成——生成亚胺和烯胺
▪
第二十二页,共74页。
一. 醛酮的性质(II)
复习:醛酮与负离子型亲核试剂的加成
OH
R C CCR
OH RC R
H(R)
(R)H 1. M C C R
OH
1. RMgX 2. H2O
2. H2O
RC H
1. LiAlH4
H(R)
O
or NaBH4
C
R
第六页,共74页。
CrO3 Pyridine
Sarrett 试剂
RCH O
CrO3 Pyridine
Sarrett 试剂
CrO3 / H2SO4 Jones 试剂 O
Al[OC(CH3)3]3 / CH3CCH3
Oppenauer 氧化
O R C R'
• 氧化烯烃
R1
C R2
R3 C
H
(1) O3 (2) Zn / H2O
R''
1o醇 2o醇 3o醇
2.2 醛酮与炔化物的加成
O
M C C R(H)
H2O
C
M = Na, K, MgX等
OH C C C R(H)
有机化学--醛和酮

羰基等吸电子基团活化-氢的能力有以下次序: CHO COPh COR CN COX CO2R CO2H
问题:薄荷酮、孟烷酮和异孟烷酮是三个具有光学活性的天然化合物:
O
O
O
(-)-薄荷酮
孟烷酮
异孟烷酮
试对以下现象提出合理的解释:
(1)在乙醇钠的乙醇溶液中放置一段时间,光学纯的 薄荷酮([]D = -32o)会变成消旋的薄荷酮([]D = 0)。
(2)用90%的硫酸处理,孟烷酮转变为孟烷酮和异孟 烷酮的混合物。
2、-卤化反应
O
X2
R CH3
O R CH2X
(X = Cl, Br或I)
酸催化过程:
O
H+
C R CH3
O+H
-H-
C
R CH2
H
+
OH
XX
OH X-
C
C
R CH2
R CH2 X
O
C
+ HX
R CH2 X
O
Br2 AcOH, H2O, 70oC
醛和酮
➢ 醛酮的命名,结构、物理性质 ➢ 醛酮的制备 ➢ 醛酮的反应
O C RH
醛
O C R R'
酮
O C R OH
羧酸
O C R OR'
酯
O C R NH2
酰胺
羰基 Carbonyl group 醛 Aldehydes 酮 Ketones
O C RX
酰卤
亲核加成 氢化还原
R (H)R'
C O
4-氧代戊醛
O
(R)-Carvone (R)-香芹酮
薄荷味
大学化学(有机物医学)第十章醛和酮.pptx(授课讲义)

H
C H
σ键
O
H
116.6°
sp2
C O
H H
C
δ
+
O
δ
-
H
平面分子
121.7°
甲醛的结构
三、醛和酮的物理性质
1. 沸点
正戊烷 乙醚 丁醛 丁酮 Mw 72 72 34.6 72 76 72 80 丁醇 丙酸 74 118 74 141
bp/℃ 36
羧酸 醇 醛、酮 烷烃、醚
氢键
极性
2. 溶解性
甲醛、乙醛、丙酮易溶于水 6个碳以上醛、酮不溶于水
3. 气味
用作香精、化妆品、食品 等,如 O
茉莉酮
福尔马林(40%的甲醛水溶液)
四、醛和酮的化学性质
醛、酮分子中含有活泼的羰基,可以 发生多种化学反应。
氧化反应 还原反应
亲核加成
OdC C +
d
R (H)
H
α-C及α-H的反应
(一)亲核加成反应
—C=O 与烯键 —C=C— 在结构上有相似之处,能发生 一系列加成反应。但烯烃的加成属于亲电加成;羰基的加 成属于亲核加成。亲核加成是醛酮最为特征的反应。
OH
HCN
R C R'(H) CN -氰醇(-羟基腈)
NaCN + H2SO4
毒性、危险性问题
反应物要求:醛、脂肪族甲基酮和8个碳以下的环酮
1
下列各化合物可否与HCN加成?
A. CH3(CH 2) 2CH O
B.
O
C. C6H 5CH O
O
D. CH3
C CH2C6H5
E. C6H 5COCH 3
实验 醛、酮与2,4-二硝基苯肼的反应
有机化学第10章 醛和酮

Witting反应是在醛酮基碳所在处形成碳碳双键的一个重要方法,产物中 没有双键位置不同的异构体。反应条件温和,产率也较好,但产物双键 的构型较难控制。 Witting也因该工作而与Brown H C共享了1979年的诺 贝尔化学奖。 另一种类型的磷叶立德试剂是霍纳(Horner L)提出的:用亚磷酸 酯为原料来代替三苯基膦与溴代乙酸酯得到的试剂磷酸酯,后者在强碱 作用下形成Horner试剂。
另一种类型的磷叶立德试剂是霍纳(Horner L)提出的:用亚磷酸 酯为原料来代替三苯基膦与溴代乙酸酯得到的试剂磷酸酯,后者在强碱 作用下形成Horner试剂。
补充: 醛、酮与炔化钠的加成
R-CC-Na+ NaNH2 (-NH3) R-CCH +
C=O
NH3(液) 或乙醚
C C ONa CR H O 2
• 醛和脂肪族甲基酮(或七元环以下的环酮)与之反应,生成
• -羟基磺酸钠
白色
过量
在酸碱下可逆反应,分离提纯
-羟基磺酸钠与等摩尔的NaCN作用,则磺酸基可被氰基取代, 生成 -羟基腈,避免用有毒的氰化氢,产率也比较高。
3、与醇的加成
*1 反应情况介绍 ① 与醛反应 CH3CH=O + CH3CH2OH
(hydrazine)
C 6H 5 H C O + H2NNH O2 N NO2
(hydrazone)
C 6H 5 H C NNH O 2N NO2 + H 2O
2,4–二硝基苯肼
O O + H2NNHCNH2
2,4–二硝基苯腙
O NNHCNH2 + H2O
氨基脲
(semicarbazine)
缩氨基脲 (半卡巴腙)
大学有机化学教程第八章醛和酮详解演示文稿

应可用来鉴别醛和甲基酮。
第25页,共68页。
a、反应机理
δ-O
δ+C R
H(CH3)+ SO3H
R C
CH3(H)
O SO3H
互变重排
R
OH
C
CH3(H) SO3
R
OH
Na
C
CH3(H) SO3Na (白)
羰基的碳原子是和硫原子结合的,HSO3-的亲核性
与CN-相近,二者反应机理也相似。
第26页,共68页。
b、反应范围
醛,脂肪族甲基酮以及C8以下的环酮均可与饱和NaHSO3溶液 反应。非甲基酮和芳香酮难发生此反应。
不 同 的 羰 基 化 合 物 与 1molNaHSO3 反 应 1hr 后 生成加成产物的百分数为:
CH3CHO (89%)
CH3COCH3 CH3CH2COCH3
(56%)
(36%)
O CH3CH2COCH2CH3 PhCOCH3
O CH3CCH2CH3
O CH3CCH3
二甲酮(丙酮)
甲基乙基甲酮
(甲乙酮)(丁酮)
O CH3CCH(CH3)2
甲异丙酮(异戊酮)
第6页,共68页。
(2)系统命名法
(a)选主链。选取包含羰基在内的最长碳链为主链,
并根据主链碳原子数命名为“某醛”或“某酮”。
(b)编号。从离羰基最近的一端开始编号。醛的羰
第4页,共68页。
2、醛酮的命名
(1) 普通命名法
醛与醇的习惯命名相似,相应的碳原子数的烃 基后面加一个“醛”字即可。
CH3CH2CHO
丙醛
CH2=CHCHO
丙烯醛
O CH3CH2CH2C H
第25页,共68页。
a、反应机理
δ-O
δ+C R
H(CH3)+ SO3H
R C
CH3(H)
O SO3H
互变重排
R
OH
C
CH3(H) SO3
R
OH
Na
C
CH3(H) SO3Na (白)
羰基的碳原子是和硫原子结合的,HSO3-的亲核性
与CN-相近,二者反应机理也相似。
第26页,共68页。
b、反应范围
醛,脂肪族甲基酮以及C8以下的环酮均可与饱和NaHSO3溶液 反应。非甲基酮和芳香酮难发生此反应。
不 同 的 羰 基 化 合 物 与 1molNaHSO3 反 应 1hr 后 生成加成产物的百分数为:
CH3CHO (89%)
CH3COCH3 CH3CH2COCH3
(56%)
(36%)
O CH3CH2COCH2CH3 PhCOCH3
O CH3CCH2CH3
O CH3CCH3
二甲酮(丙酮)
甲基乙基甲酮
(甲乙酮)(丁酮)
O CH3CCH(CH3)2
甲异丙酮(异戊酮)
第6页,共68页。
(2)系统命名法
(a)选主链。选取包含羰基在内的最长碳链为主链,
并根据主链碳原子数命名为“某醛”或“某酮”。
(b)编号。从离羰基最近的一端开始编号。醛的羰
第4页,共68页。
2、醛酮的命名
(1) 普通命名法
醛与醇的习惯命名相似,相应的碳原子数的烃 基后面加一个“醛”字即可。
CH3CH2CHO
丙醛
CH2=CHCHO
丙烯醛
O CH3CH2CH2C H
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
与羟基或氨基的氢原子以氢键缔合,倾向于以重叠 式为优势构象形式存在。
第三节 醛酮的物理性质
由于羰基的偶极矩,增加了分子间的吸引 力,因此,醛酮的沸点比相应相对分子质量的 烷烃高,但比醇低。醛酮的氧原子可以与水形 成氢键,因此低级醛酮能与水混溶。脂肪族 醛酮相对密度小于1,芳香族醛酮相对密度大 于1。
炔烃
1 氧化 3 傅氏酰基化
芳烃
2 卤化-水解 4 加特曼-科赫反应
醇
1 氧化 2 频哪醇重排
醛 酮 氧化
取代
羧酸
羧酸衍生物
还原
乙醛和丙酮的工业制备
二 用羧酸、羧酸衍生物制备
1 由酰 卤制备
O RCCl
还原
H2/Pd-BaSO4硫-喹啉(罗森孟法)
LiAlH(OBu-t)3
RCHO
RCHO + HCl
四 异丙苯氧化重排-重要的工业制法
+ CH3CH=CH2 AlCl3
O2 CH(CH3)2
自动氧化
C(CH3)2
H+
O OH
C(CH3)2 -H2O O O+ H2
C(CH3)2 O+
重排
+ O C(CH3)2
+ O
C(CH3)2 H2O
亲核加成
+OH2 -H+
O C(CH3)2
OH O CH(CH3)2 C-O键断裂
甲基乙基甲酮 (甲乙酮)
二 系统命名法(参见第一章)
O CH3CCH2CH2CHO
4-氧代戊醛
OO CH3CCHCCH3
CH2CH=CH2
3-烯丙基-2,4-戊二酮
O
环己酮
O
CHO
2’-氧代环己基甲醛
第二节 醛酮的结构
1 C=O双键是由一个键和一个键组成的。 2 C=O是一个极性基团,具有偶极矩。 3 当羰基的位有羟基或氨基存在时,羰基氧原子可
exit
本章提纲
第一节 醛酮的命名 第二节 醛酮的结构 第三节 醛酮的物理性质 第四节 醛酮的光谱特征 第五节 醛酮的制备 第六节 醛酮的反应
第一节 醛酮的命名 一 普通命名法
醛按氧化后生成的羧酸命名,酮看作是甲酮的衍生物。
CH3CH2CHO 丙醛
CH2=CHCHO 丙烯醛
O CH3CCH2CH3
醛的氧化
C=C–C=O
(1)碳碳双键的亲电加成 (2)碳氧双键的亲核加成 (3),-不饱和醛酮的共轭加成 (4)还原
二 羰基的亲核加成
1 总述 2 羰基与含碳亲核试剂的加成 3 羰基与含氮亲核试剂的加成 4 羰基与含氧亲核试剂的加成 5 羰基与含硫亲核试剂的加成
1 总述 (1)反应机理
碱催化的 反应机理
加成产物 0%
若用烷基 锂代替格 氏试剂, 可以发生 正常的加 成反应。
O (CH3)2CHCCH(CH3)2 + (CH3)2CHLi
[(CH3)2CH]3C-OLi H2O
[(CH3)2CH]3C-OH
*2 醛、酮的极限构象式
O M
S L
R
(1)交叉式
O
M
L
SR
(2) R-S重叠
O L
M
S R
与金属化合物反应
NaCCR
1 R'MgX
O RCC CR'
O 2 H2O RCR'
C6H5CdCl or (C6H5)2Cd
O RCC6H5
R’2CuLi
O
RCR'
O
O
-H+
+ CR
AlCl3 低温
Cl-
CR Cl O
CR
2 由羧酸制备
ArCOOH
H2O
R’Li
O
R’Li
ArC-OLi
OLi Ar-C-OLi
(1)醛、酮与格氏试剂的加成
*1 两个副反应。
= == =
不发生正 常反应的 酮主要发 生“烯醇 化”和 “还原” 两个副反 应。
O
(CH3)3CCC(CH3)3 + C2H5MgBr O
加成产物 80%
(CH3)3CCC(CH3)3 + CH3CH2CH2MgBr
加成产物 30%
O
(CH3)3CCC(CH3)3 + (CH3)2CHMgBr
R
OH Ar-C-OH
R
-H2O
O ArC-R
ArCOOH + R’MgX
ArCOOMgX + R’ H
3 由酰胺和腈制备
ArCN -H2O
O ArCNH2
-C10H7MgBr
NMgBr ArCC10H7-n
H2O
NH ArCC10H7-n
H+
H2O
Cl
HCl
SnCl2
ArC=NH
ArCH=NH
H2O
第四节 醛酮的光谱特征
羰基的红外光谱在1750-1680 cm-1之间有一个非常强 的伸缩振动吸收峰。-CHO中的C-H键在2720 cm-1区域有 一个非常特征的伸缩振动吸收峰。当羰基与双键共轭, 吸收向低波数位移。
其它参见第八章
第五节 醛酮的制备
一 制备概貌
1氧化 2直接醛基化
烯烃
1 水合 2 硼氢化-氧化
O ArCC10H7-n
ArCH=O
OH
PCl5
ArC=NH
三 醛酮制备实例
*1 CH3
CN
SnCl2/HCl
CH3
无水醚
*2
COOH + 2CH3Li
H2O
CH=NH
CH3
H2O
CHOO CCH3OClO
O
*3 R'CCl + RCH=CH2 Lewis酸 R'CH-CH2CR' Na2CO3/H2O R'CH=CHCR'
_
+
O+
(CH3)2C=OH
质子转移
OH + (CH3)2C=O
第六节 醛酮的反应 一 醛酮的结构与反应 二 羰基的亲核加成 三 羰基化合物的还原 四 共轭不饱和醛酮的加成和还原 五 -活泼氢的反应 六 醛酮的氧化
亲核加成 氢化还原
一 醛酮的结构与反应
O
CCH
H
-活泼H的反应 (1)烯醇化 (2) -卤代(卤仿反应) (3)醇醛缩合反应
H+
*4
OH
-H2O
SOCl2
(n-C4H9)2CuLi
KMnO4
O
O
HOC(CH2)4COH
O
O
n-C4H9C(CH2)4CC4H9-n
O
O
*5
O
C2H5OH
OC2H5 SOCl2
OH
O
O
O
O
ClC(CH2)2COC2H5
[(CH3)2CHCH2CH2]2Cd 无水乙醚
O
O
(CH3)2CHCH2CH2C(CH2)2COC2H5
C=O Nu-
Nu H+ C O-
Nu C
OH
酸催化的 反应机理
C=O + H+
Nu C
OH
[
+ C=OH
+ C-OH
]
Nu-
(2)醛、酮的反应活性
R H
C=O > R R'
C=O > Ar
R'
C=O
2 羰基与含碳亲核试剂的加成 (1)与格氏试剂的加成 (2)与HCN的加成 (3)与炔化钠的加成
(3)交叉式
O
L
S
MR
(4) R-M重叠
OS L
M R
(5)交叉式
O
S
M
LR
(6) R-L重叠
R与L、M、S 之间的相互作 用大于羰基氧 与L、M、S 之间的相互作 用。所以,三 个交叉式中 (3)最稳定。 三个重叠式中 (6)最不稳 定。
第三节 醛酮的物理性质
由于羰基的偶极矩,增加了分子间的吸引 力,因此,醛酮的沸点比相应相对分子质量的 烷烃高,但比醇低。醛酮的氧原子可以与水形 成氢键,因此低级醛酮能与水混溶。脂肪族 醛酮相对密度小于1,芳香族醛酮相对密度大 于1。
炔烃
1 氧化 3 傅氏酰基化
芳烃
2 卤化-水解 4 加特曼-科赫反应
醇
1 氧化 2 频哪醇重排
醛 酮 氧化
取代
羧酸
羧酸衍生物
还原
乙醛和丙酮的工业制备
二 用羧酸、羧酸衍生物制备
1 由酰 卤制备
O RCCl
还原
H2/Pd-BaSO4硫-喹啉(罗森孟法)
LiAlH(OBu-t)3
RCHO
RCHO + HCl
四 异丙苯氧化重排-重要的工业制法
+ CH3CH=CH2 AlCl3
O2 CH(CH3)2
自动氧化
C(CH3)2
H+
O OH
C(CH3)2 -H2O O O+ H2
C(CH3)2 O+
重排
+ O C(CH3)2
+ O
C(CH3)2 H2O
亲核加成
+OH2 -H+
O C(CH3)2
OH O CH(CH3)2 C-O键断裂
甲基乙基甲酮 (甲乙酮)
二 系统命名法(参见第一章)
O CH3CCH2CH2CHO
4-氧代戊醛
OO CH3CCHCCH3
CH2CH=CH2
3-烯丙基-2,4-戊二酮
O
环己酮
O
CHO
2’-氧代环己基甲醛
第二节 醛酮的结构
1 C=O双键是由一个键和一个键组成的。 2 C=O是一个极性基团,具有偶极矩。 3 当羰基的位有羟基或氨基存在时,羰基氧原子可
exit
本章提纲
第一节 醛酮的命名 第二节 醛酮的结构 第三节 醛酮的物理性质 第四节 醛酮的光谱特征 第五节 醛酮的制备 第六节 醛酮的反应
第一节 醛酮的命名 一 普通命名法
醛按氧化后生成的羧酸命名,酮看作是甲酮的衍生物。
CH3CH2CHO 丙醛
CH2=CHCHO 丙烯醛
O CH3CCH2CH3
醛的氧化
C=C–C=O
(1)碳碳双键的亲电加成 (2)碳氧双键的亲核加成 (3),-不饱和醛酮的共轭加成 (4)还原
二 羰基的亲核加成
1 总述 2 羰基与含碳亲核试剂的加成 3 羰基与含氮亲核试剂的加成 4 羰基与含氧亲核试剂的加成 5 羰基与含硫亲核试剂的加成
1 总述 (1)反应机理
碱催化的 反应机理
加成产物 0%
若用烷基 锂代替格 氏试剂, 可以发生 正常的加 成反应。
O (CH3)2CHCCH(CH3)2 + (CH3)2CHLi
[(CH3)2CH]3C-OLi H2O
[(CH3)2CH]3C-OH
*2 醛、酮的极限构象式
O M
S L
R
(1)交叉式
O
M
L
SR
(2) R-S重叠
O L
M
S R
与金属化合物反应
NaCCR
1 R'MgX
O RCC CR'
O 2 H2O RCR'
C6H5CdCl or (C6H5)2Cd
O RCC6H5
R’2CuLi
O
RCR'
O
O
-H+
+ CR
AlCl3 低温
Cl-
CR Cl O
CR
2 由羧酸制备
ArCOOH
H2O
R’Li
O
R’Li
ArC-OLi
OLi Ar-C-OLi
(1)醛、酮与格氏试剂的加成
*1 两个副反应。
= == =
不发生正 常反应的 酮主要发 生“烯醇 化”和 “还原” 两个副反 应。
O
(CH3)3CCC(CH3)3 + C2H5MgBr O
加成产物 80%
(CH3)3CCC(CH3)3 + CH3CH2CH2MgBr
加成产物 30%
O
(CH3)3CCC(CH3)3 + (CH3)2CHMgBr
R
OH Ar-C-OH
R
-H2O
O ArC-R
ArCOOH + R’MgX
ArCOOMgX + R’ H
3 由酰胺和腈制备
ArCN -H2O
O ArCNH2
-C10H7MgBr
NMgBr ArCC10H7-n
H2O
NH ArCC10H7-n
H+
H2O
Cl
HCl
SnCl2
ArC=NH
ArCH=NH
H2O
第四节 醛酮的光谱特征
羰基的红外光谱在1750-1680 cm-1之间有一个非常强 的伸缩振动吸收峰。-CHO中的C-H键在2720 cm-1区域有 一个非常特征的伸缩振动吸收峰。当羰基与双键共轭, 吸收向低波数位移。
其它参见第八章
第五节 醛酮的制备
一 制备概貌
1氧化 2直接醛基化
烯烃
1 水合 2 硼氢化-氧化
O ArCC10H7-n
ArCH=O
OH
PCl5
ArC=NH
三 醛酮制备实例
*1 CH3
CN
SnCl2/HCl
CH3
无水醚
*2
COOH + 2CH3Li
H2O
CH=NH
CH3
H2O
CHOO CCH3OClO
O
*3 R'CCl + RCH=CH2 Lewis酸 R'CH-CH2CR' Na2CO3/H2O R'CH=CHCR'
_
+
O+
(CH3)2C=OH
质子转移
OH + (CH3)2C=O
第六节 醛酮的反应 一 醛酮的结构与反应 二 羰基的亲核加成 三 羰基化合物的还原 四 共轭不饱和醛酮的加成和还原 五 -活泼氢的反应 六 醛酮的氧化
亲核加成 氢化还原
一 醛酮的结构与反应
O
CCH
H
-活泼H的反应 (1)烯醇化 (2) -卤代(卤仿反应) (3)醇醛缩合反应
H+
*4
OH
-H2O
SOCl2
(n-C4H9)2CuLi
KMnO4
O
O
HOC(CH2)4COH
O
O
n-C4H9C(CH2)4CC4H9-n
O
O
*5
O
C2H5OH
OC2H5 SOCl2
OH
O
O
O
O
ClC(CH2)2COC2H5
[(CH3)2CHCH2CH2]2Cd 无水乙醚
O
O
(CH3)2CHCH2CH2C(CH2)2COC2H5
C=O Nu-
Nu H+ C O-
Nu C
OH
酸催化的 反应机理
C=O + H+
Nu C
OH
[
+ C=OH
+ C-OH
]
Nu-
(2)醛、酮的反应活性
R H
C=O > R R'
C=O > Ar
R'
C=O
2 羰基与含碳亲核试剂的加成 (1)与格氏试剂的加成 (2)与HCN的加成 (3)与炔化钠的加成
(3)交叉式
O
L
S
MR
(4) R-M重叠
OS L
M R
(5)交叉式
O
S
M
LR
(6) R-L重叠
R与L、M、S 之间的相互作 用大于羰基氧 与L、M、S 之间的相互作 用。所以,三 个交叉式中 (3)最稳定。 三个重叠式中 (6)最不稳 定。
