细胞基因组DNA的提取.ppt
DNA的复制PPT课件
•Molecular Biology Course
(CsCl gradient centrifuge)
N15
DNA
N14
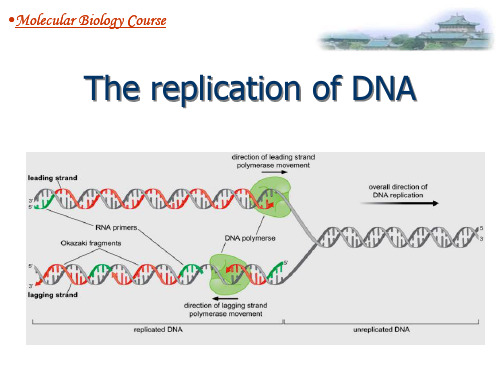
Semi-ConservationReplication
–第三阶段为DNA复制的终止阶段。DNA复制的整个 过程中需要30多种酶及蛋白质分子参加,我们将 在DNA复制的各个阶段着重介绍它们的作用。
•Molecular Biology Course
•Molecular Biology
Course (二)、复制的起始阶段
1、复制的起点 2、复制的方向 3、复制的速度 4、DNA复制起始引发体的形成及所参与的酶和 蛋白质
1、DNA半保留复制的机理 2、DNA的半不连续复制
•Molecular Biology
Course
1、DNA半保留复制的机理
Semi-Conservation Replication
DNA作为遗传物质的基本特点就是在细胞分裂前进行准 确的自我复制,使DNA的量成倍增加,这是细胞分裂的 物质基础。
当用缺乏糖苷酶的大肠杆菌变异株(ung-进行 实验时,尿嘧啶不再被切除。)
此时,新合成的DNA有一半放射性标记出现于岗 崎片断中,另一股直接进入大的片断。由此可 见,当DNA复制时,一条链是连续的,另一条链 是不连续的,因此称为半不连续复制(semidiscontinuous replication) 。
二、复制的起始阶段
•Molecular Biology Course
复制叉( replication fork ):DNA分子中正在进行 复制的分叉部位。它由两条亲代链及在其上新合成的子 链构成。
6动物组织细胞基因组DNA的提取和定量

10.加200ul TE重新溶解沉淀物,然后置于4℃ 或–20℃保存备用。
11.吸取适量样品于GeneQuant上检测浓度和纯度。
【注意事项】
标本必须新鲜,提取前细胞应保持完整。
所用EP管、吸嘴等器物及ddH2O、试剂 等应高压灭菌,操作尽量在4℃以下进行。 混匀试剂、吸取上清等操作时应避免动 作剧烈。 弃异丙醇时动作应轻,切忌甩干,以免 DNA丢失。
动物细胞基因组DNA的 提取及定量
真核细胞基因组DNA的分离纯化
核酸包括DNA、RNA两种分子,在细胞中
都以与蛋白质结合的状态存在。
真核生物的染色体DNA为双链线性分子.
大多数生物体内RNA分子为单链线性分子
分离纯化核酸总的原则:
应保证核酸一级结构的完整性 排除蛋白质、脂类、糖类等其他分子的污染 无其他核酸分子的体积异丙醇,倒转混匀后,可以看见丝 状物,用100ul 吸头挑出,凉干,用200ul TE 重新溶解。
4.加等量的酚·氯仿·异戊醇振荡混匀,
离心12000 rpm,5min。
5.取上层溶液至另一管,加入等体积的氯仿·异戊
醇,振荡混匀,离心12000 rpm,5min。
6. 取上层溶液至另一管,加入1/2体积的7.5mol/L
3. 对于很稀的核酸溶液,可用荧光光度法进行测 定。核酸经凝胶电泳后,在EB(溴化乙锭)中 浸染,核酸分子与溴化乙锭结合后, 能吸收300360nm波长的紫外光,同时诱发出波长为590nm 的红橙色荧光,从而可通过照像机摄影,凝胶成 像系统记录实验结果。此方法灵敏度高,10ng或 更少的DNA即可检出。
一、实验目的
掌握DNA定量的原理 掌握紫外分光光度仪的正确使用。
二、实验原理
植物生物工程实验二植物DNA的提取讲课文档

第三十三页,共41页。
6. 重复第3、第4步。
7. 每支离心管中加入等体积异丙醇(400-500μl)。上下颠倒 几次,4℃静置20分钟(或-20℃,15分钟)。(异丙醇用于 沉淀DNA)
8. 14,000rpm离心20分钟。小心倒出上清夜,避免DNA颗粒丢 失。倒置离心管,空气干燥(1-2分钟)。
第十六页,共41页。
测定结果分析
A:测DNA: 纯的DNA样品OD260/OD280应为1.8,OD260m/OD230应大
于2.0。 1) OD260/OD280大于1.9时,表明有RNA污染。 2) 小于1.6时,表明样品中存在蛋白质或酚污染; 3) OD260/OD230小于2.0时,表明溶液中有残存的盐和小分子杂质,如
第十九页,共41页。
根据OD260定量:
測定260nm吸光值,OD=1.0代表值如下:
a. ds DNA (double stranded DNA) = 50 mg/ml
b. ss DNA (single stranded DNA) = 40 mg/ml c. oligonucleotide = 33 mg/ml
1. 称取100mg新鲜叶片,置于预冷1.5ml离心管中,加入液氮, 研为细粉。加入350μl新鲜2×CTAB缓冲液,再仔细研磨。 (CTAB用于抽提DNA)
2. 用350μl新鲜2×CTAB缓冲液,冲洗研磨棒,加入2μlβ- 巯基乙醇,混匀。65℃水浴45分钟,每15分钟摇动一次。 冷却至室温,静置2分钟。
抽提液
贮存液l 168ul 4032ul
异丙醇;70%乙醇;90%乙醇;10mg/ml EB
不可忽视的细节—血液基因组提取PPT课件

DNA提取原则2:DNA产物纯度
• 严格要求产物纯度
▪ 存档、产物长期保存 ▪ Southern杂交 ▪ 荧光定量PCR ▪ SNP Microarray ▪ CGH (比较基因组杂交)
• 没有严格要求
▪ 常规PCR
内容
DNA提取的原则 基因组提取方法 样本保存和前处理 基因组提取流程 DNA保存及检测方法 试剂选择原则
红细胞裂解充分的现象: 得到的沉淀应为白色沉淀或淡粉色沉淀。有时血液需要进 行两次裂解,注意第二次加入裂解液后需要将沉淀votex 彻底混匀。
核细胞裂解
如果有裂红的步骤,请尽量将上清去除再加入裂解液。 加入裂解液(如:TIANGEN试剂盒中的GB或FG)和蛋白酶K需要彻底混匀。 将沉淀打散混匀后再进行水浴。 水浴时看到溶液变清,没有粘稠物或沉淀时即可进行下步操作,通常水 浴时间10-30min. 若采用有机(酚/氯仿)抽提时应充分混匀,动作要轻柔。离心分离两相 时,应保证一定的转速和时间,且吸取上清时注意不要吸取到中间层及 有机相。
不可忽视的细节
—血液基因组提取
天根生化科技(北京)有限公司
内容
DNA提取的原则 基因组提取方法 样本保存和前处理 基因组提取流程 DNA保存及检测方法 试剂选择原则
DNA提取原则1:DNA片段长度
DNA Length
严格要求片段长度:▪ 构建 ▪ PFGE(脉冲场凝胶电泳)没有严格要求:
▪ PCR ▪ Southern Blots ▪ RFLP
样本保存和前处理-微量血液/干血点/羊水/胸水
保存 微量血液:抗凝血液-20或-70℃保存; 干血点:干燥后室温或4℃保存; 羊水: -20或-70℃保存。 样本前处理 1. 微量血液处理同抗凝血液,不同之处是无需进行红细胞裂解步骤。 2. 干血点加入缓冲液直接进行提取。 3. 羊水/胸水提取时先离心得到沉淀,再进行裂解提取核酸。
实验三-细胞外周血DNA提取

步骤
6. 弃乙醇,敞开Eppendorf管盖,烘干(37℃恒温 箱)后,加1xTE溶液30ul,溶解DNA。(制成的 DNA液置于-20℃冰箱保存备用)
7.用DNA/RNA Calculator检测DNA的含量和纯 度。纯DNA的此比值约为1.8~2.0。纯RNA的比值 约为大于2.0。
步骤
8、限制性内切酶酶切:
实验三、外周血细胞基因组 DNA的提取 (NaI法)
基因组DNA提取原理
Loparev等报道利用NaI提取DNA的方法,从全血制 备白细胞DNA,可用双蒸水溶涨红细胞及白细胞膜, 释放出血红蛋白及细胞核。加NaI破核膜并使DNA 从核蛋白中解离,用氯仿/异戊醇抽提使蛋白质沉淀 完全(异戊醇去泡沫),DNA存在于上层水相中, 以异丙醇沉淀 DNA,离心弃去异丙醇,并重复操作 一次,即可获得白细胞DNA。
9、聚合酶链式反应:
步骤
a、25 ul标准PCR反应体系各成分终浓度如下:
b、标准PCR反应循环参数:
95℃:5 min预变性;94℃ 30s
63℃ 30s、 72℃ 60s, 共30个循环; 72℃ 7min。 c、置于4℃或-20℃保存。
模板DNA50~10ຫໍສະໝຸດ ngTaq DNA聚合酶
0.5~1 uL
PCR反应反复进行三步骤的循环过程: 热变性——退火——引物延伸 1)热变性:基因组DNA在95 ℃下加热5分,双螺旋结构被热变
性解链为两股单链。 2)退火:将反应混合物降温至55~65℃,引物与上述单链DNA
上互补的序列杂交在一起,即退火,形成模板——引物复合。 3)引物延伸:将反应混合物调节至72℃,在DNA聚合酶作用下,
上游引物 (10 uM)
1 uL
真核细胞基因组DNA的提取与鉴定

真核细胞基因组DNA的提取与鉴定一、目的要求掌握真核细胞基因组DNA的提取方法,掌握紫外分光光度法测定DNA含量的方法和DNA电泳方法。
重点实践植物 DNA 的抽提,掌握 CTAB 法快速抽提白三叶草 DNA 。
二、基本原理植物DNA的抽提常采用两种方法:(1)SDS 法:离子去污剂,过程长,纯度高;(2)CTAB 法:该方法简便、快速,DNA产量高(纯度稍次,适用于一般分子生物学操作) 。
CTAB是一种非离子去污剂,植物材料在CTAB的处理下,结合65℃水浴使细胞裂解、蛋白质变性、DNA被释放出来。
CTAB与核酸形成复合物,此复合物在高盐(>0.7mM )浓度下可溶,并稳定存在,但在低盐浓度(0.1-0.5mM NaCl )下CTAB-核酸复合物就因溶解度降低而沉淀,而大部分的蛋白质及多糖等仍溶解于溶液中。
经离心弃上清后,CTAB-核酸复合物再用70-75%酒精浸泡可洗脱掉CTAB。
再经过氯仿/ 异戊醇(24:1) 抽提去除蛋白质、多糖、色素等来纯化DNA,最后经异丙醇或乙醇等DNA沉淀剂将DNA 沉淀分离出来。
现生物试剂公司多依据此原理,经过改造,以吸附膜吸附DNA,除去杂质,从而减少了使用有害药品氯仿抽提的步骤。
琼脂糖凝胶电泳是分离、鉴定和纯化DNA片段的标准方法之一。
琼脂糖是从海藻中提取出来的一种线状高聚物,将其熔化在所需缓冲液中使成清澈、透明的溶液,然后倒入胶模令其固化。
不同浓度的琼脂糖形成的固体基质具有不同的密度(或孔隙度),因此适宜分离不同大小的DNA片段。
在电场中,DNA分子主要因其分子大小不同而被分离。
三、实验步骤(具体见试剂盒操作说明)植物基因组DNA的提取(参考步骤)1.采集适量幼嫩叶片,用液N2 研成粉末,0.4 g 装入1.5ml 离心管中(-20 ℃预冷)。
2.预热 1.5 ×CTAB 到95 ℃,加1ml 到装有叶片粉末的离心管中,混匀(防止冻融)。
细胞基因组dna提取

细胞基因组dna提取一、细胞基因组DNA提取的概念细胞基因组DNA提取是指从生物体内的细胞中提取出其基因组DNA,以便进行分子生物学实验。
DNA提取是许多分子生物学技术和实验的前提,如PCR、限制性酶切、电泳等。
二、细胞基因组DNA提取的原理1. 细胞破碎:将细胞破碎以释放DNA。
可以使用机械方法(如超声波)、化学方法(如溶液中加入洗涤剂)或酶解方法(如加入蛋白酶)等方式进行破碎。
2. DNA分离:将破碎后的混合物离心,使得DNA沉淀到底部。
然后通过去除上层液体和洗涤沉淀来纯化DNA。
3. DNA溶解:将沉淀的DNA溶解在适当的缓冲液中,以便进行后续实验操作。
三、细胞基因组DNA提取的步骤1. 收集样品:收集需要提取DNA的样品,如血液、组织或菌落等。
2. 细胞破碎:使用适当的方法对样品中的细胞进行破碎,释放出DNA。
3. 清洁DNA:通过离心等方法将DNA沉淀到底部,去除上层液体和洗涤沉淀来清洁DNA。
4. 溶解DNA:将沉淀的DNA溶解在适当的缓冲液中,以便进行后续实验操作。
四、细胞基因组DNA提取的影响因素1. 样品来源:不同的样品来源对细胞基因组DNA提取有不同的影响。
如血液、组织或菌落等。
2. 细胞数量:细胞数量越多,提取到的DNA量越多。
3. 细胞类型:不同类型的细胞具有不同的细胞壁和膜结构,需要采用不同的破碎方法。
4. 存储条件:样品在收集后需要妥善存储,避免样品受到污染或降解。
五、细胞基因组DNA提取常用方法1. CTAB法:CTAB法是一种化学法,使用CTAB(十六烷基三甲基溴化铵)来裂解细胞壁和膜,并与核酸结合形成复合物。
该方法适用于高含量多酚类物质的样品。
2. 盐溶法:盐溶法是一种简单易行的方法,使用盐和洗涤剂来裂解细胞壁和膜,并与核酸结合形成复合物。
该方法适用于低含量多酚类物质的样品。
3. 商业化试剂盒:商业化试剂盒是一种快速方便的DNA提取方法,通过购买商业化试剂盒来进行DNA提取。
动物组织细胞基因组DNA提取

动物组织细胞基因组DNA提取一、实验原理真核生物的一切有核细胞(包括培养细胞)都能用来制备基因组DNA。
真核生物的DNA 是以染色体的形式存在于细胞核内,因此,制备DNA的原则是既要将DNA与蛋白质、月旨类和糖类等分离,又要保持DNA分子的完整。
提取DNA的一般过程是将分散好的组织细胞在含SDS(十二烷基硫酸钠)和蛋白酶K的溶液中消化分解蛋白质,再用酚和氯仿/异戊醇抽提分离蛋白质,得到的DNA溶液经乙醇沉淀使DNA从溶液中析出。
蛋白酶K的重要特性是能在SDS和EDTA(乙二胺四乙酸二钠)存在下保持很高的活性。
在匀浆后提取DNA的反应体系中,SDS可破坏细胞膜、核膜,并使组织蛋白与DNA分离,EDTA则抑制细胞中Dnase的活性;而蛋白酶K可将蛋白质降解成小肽或氨基酸,使DNA 分子完整地分离出来。
二、仪器及试剂1. 仪器:恒温水浴锅、台式离心机、紫外分光光度计(GeneQuant)、移液器、玻璃匀浆器、离心管(灭菌)、吸头(灭菌)2. 试剂:(1)细胞裂解缓冲液:Tris(pH8.0)100mmol/LEDTA(pH8.0)500mmol/LNaCL20mmol/LSDS10%胰RNA酶20ug/ml(2)蛋白酶K:称取20mg蛋白酶k溶于1ml灭菌的双蒸水中,C20°C备用。
(3)TE缓冲液(pH8.0):高压灭菌,室温贮存。
(4)酚?氯仿?异戊醇(25:24:1)、(5)异丙醇、冷无水乙醇、70%乙醇、灭菌水。
三、操作步骤1.取新鲜或冰冻动物组织块0.1g(0.5cm3),尽量剪碎。
置于玻璃匀浆器中,加入1ml的细胞裂解缓冲液匀浆至不见组织块,转入1.5ml离心管中,加入蛋白酶K(500ug/ml)20pl,混匀。
在65C恒温水浴锅中水浴30min,也可转入37C水浴12〜24h,间歇振荡离心管数次。
于台式离心机以12000rpm离心5min,取上清液入另一离心管中。
2•加2倍体积异丙醇,倒转混匀后,可以看见丝状物,用100ul吸头挑出,凉干,用200ulTE 重新溶解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
? 离心分离两相时,应保证一定的转速和时间
? 针对不同材料的特点,在提取过程中辅以相 应的去杂质的方法
四、注意事项 ——核酸沉淀、溶解
? 当沉淀时间有限时,用预冷的乙醇或异丙醇沉淀, 沉淀会更充分
? 沉淀时加入1/10体积的NaAc(pH5.2,3M),有利 于充分沉淀
? 材料应适量,过多会影响裂解,导致DNA量 少,纯度低
? 针对不同材料,选择适当的裂解预处理方式:
? 植物材料--液氮研磨 ? 动物组织--匀浆或液氮研磨 ? 组培细胞--蛋白酶K ? 细菌--溶菌酶破壁 ? 酵母--破壁酶或玻璃珠
? 高温温浴时,定时轻柔振荡
四、注意事项 ——核酸分离、纯化
? 采用吸附材料吸附的方式分离DNA时,应提 供相应的缓冲体系
原 因
1. DNA中含有蛋白、 多糖、多酚类杂质
2. DNA在溶解前,有
酒精残留,酒精抑 对
制后续酶解反应
策
3. DNA中残留有金属 离子
1. 重新纯化DNA,去 除蛋白、多糖、多酚 等杂质
2. 重新沉淀DNA,让 酒精充分挥发
3. 增加70%乙醇洗涤 的次数(2-3次)
五、DNA提取常见问题
?问题二: DNA 降解
以上处理时均要同时加入核酸酶抑制剂
? 核酸提取的一般过程 2)破碎抽提核酸除去杂质
1.首先使脱氧核糖核蛋白、核糖体、病毒的核蛋白与 其它成分分离 2.使核酸与蛋白质分离 3.除去脂类 4.多糖的除去
? 核酸提取的一般过程
3)核酸的纯化 根据所需核酸的性质和特点除去其它核酸污
染,并除去提取过程中的系列试剂 (盐、有机溶剂 等)杂质,最后得到均一的核酸样品。
? 除上述DNA,RNA外,还有非细胞形式存在的病毒和 噬菌体,其或只含DNA,或只含有RNA。
一、实验原理
2、核酸制备的一般原则
? 分离纯化核酸总的原则: ①应保证核酸一级结构的完整性; ②排除其它分子的污染。
? 核酸纯化应达到的要求: ①核酸样品中不应存在对酶有抑制作用的有机溶剂和过高 浓度的金属离子; ②其它生物大分子的污染应降低到最低程度; ③排除其它核酸分子的污染。
对于RNA,因分子较小,不易被机械张力拉断, 但抑制RNase活力较难,故在RNA提取中设法抑制 RNase更重要。
? 核酸酶的抑制和抑制剂
DNase抑制
①加入少量金属离子螯合剂,如0.01 mol/L EDTA 或柠檬酸钠,DNase基本可以全部失活。 ②去垢剂、蛋白变性剂及DNase抑制剂也可使 DNase失活。
如:苯酚、氯仿、盐酸胍、DEPC
? 核酸制备中常用的酶
DNase RNase 蛋白酶 K 溶菌酶
? 核酸提取的一般过程 1)破碎细胞(防止核酸酶的作用)
微生物:溶菌酶、SDS裂解。 高等植物:捣碎器破碎、液氮研磨。
酶法:蛋白酶,如胰蛋白酶, 冰冻法:反复冻融或液氮冻后组织捣碎。 动物:液氮处理后用匀浆器破碎。 细胞器DNA:首先纯化细胞器。
细胞基因组DNA的提取
银巍 中山医学院生化教研室
实验一 细胞基因组 DNA的提取
一、实验原理
1、核酸的分类
? DNA 主要存在于细胞核的染色体中。核外也有少量DNA, 如线粒体DNA(mtDNA),叶绿体DNA (cpDNA),质粒DNA。
? RNA 存在于细胞质中,如mRNA, rRNA, tRNA等。
如:SDS、脱氧胆酸钠、4-氨基水杨酸钠、萘-1.5-二磺酸钠、 三异丙基萘磺酸钠
? 核酸制备中常用的蛋白质变性剂
蛋白质变性剂的作用: 1.使蛋白质变性、沉淀,从核酸提取液中分离除去,以防造
成蛋白污染。 2.使蛋白质变性,故可使核糖体解聚释放出核酸。 3.某些蛋白质变性剂也有抑制RNase活性和破裂细胞的作用。
? 沉淀后应用70%的乙醇洗涤,以除去盐离子等 ? 晾干DNA,让乙醇充分挥发(不要过分干燥) ? 若长期储存建议使用TE缓冲液溶解
? TE中的EDTA能螯和Mg2+或Mn2+离子,抑制DNase ? pH值为8.0,可防止DNA发生酸解
五、DNA提取常见问题
?问题一:DNA样品不纯,抑制后续酶解和 Pse抑制 ①操作要带手套。 ②所有器皿要严格消毒, ③试剂处理 ④低温操作
⑤在分离过程中要加入一定的 RNase抑制剂。
? 核酸制备中常用的去垢剂
核酸本身带负电荷,结合带正电荷的蛋白质。用 于核酸提取的去垢剂,一般都是阴离子去垢剂, 去垢剂的作用: 1.溶解膜蛋白及脂肪,使细胞膜破裂; 2.溶解核糖体上面的蛋白质,使其解聚,将核酸 释放出来; 3.对 RNase 、DNase 有一定的抑制作用。
4)核酸样品的保存 核酸保存的主要条件是 温度和介质
温度: 4℃(5℃)最佳和最简单 -70℃是长期保存的良好温度,为一次性保存 -20℃保存
保存介质 : TE缓冲溶液 (最常用 ) 10mmol/L Tris-Cl pH8.0 1mmol/L EDTA pH8.0
实验目的
材料与试剂
实验操作与注意事项
纯化
IV.沉淀或吸附核酸,并去除杂质
V.核酸溶解在适量缓冲液或水中
一、实验原理
4、核酸制备的一般方法和原理
? 核酸酶的抑制和抑制剂 降低温度,改变pH及盐的浓度,都利于对核酸酶
活性的抑制,但均不如利用核酸酶抑制剂更有利,当 然,几个条件并用更好。
对于DNA,抑制DNase活力很容易,但防止机械 张力拉断则更重要。
一、实验原理
3、核酸制备的一般原则
? 核酸制备时应注意的事项: ①尽量简化操作步骤,缩短提取过程。 ②减少化学因素对核酸的降解。 ③减少物理因素对核酸的降解:机械剪切力和高温 ④防止核酸的生物降解。
? 核酸制备的步骤:
I.材料准备
破碎细胞
II.破碎细胞或包膜-内容物释放
提取
III.核酸分离、纯化
,1000rpm,5min离心
四、注意事项 ——材料准备
? 最好使用新鲜材料,低温保 存的样品材料不要反复冻融
? 提取血液基因组DNA时,要 选择有核细胞(白细胞)
? 组培细胞培养时间不能过长, 否则会造成DNA降解
? 含病毒的液体材料DNA含量 较少,提取前先富集
四、注意事项 ——细胞裂解
