有机化学第10章醛酮
有机化学第10章醛、酮及亲核加成反应

醛、酮的分子中都含有羰基(>C=O)
O R
H
醛
-CHO 醛基
O
R
R'
酮
>C=O 酮基
分子中的烃基(R)可以相同也可以不相同。醛、酮分子 中的烃基可以是直链的或是环状的,脂肪的或芳香的。
一、羰基的结构
CO
CO
碳原子SP2杂化轨道与另外三个原子以键结合的,所以这 三个键都处于同一个平面上,键角约为120°。
C6H5CHO
NaHSO3 H2O
C6H5CHSO3Na OH
NaCN H2O
C6H5CHCN OH
三、与氢氰酸的加成
醛及多种活泼的酮(脂肪族甲基酮及少于8个碳原子的脂环 酮)与氰基负离子的碳原子发生加成反应,生成-羟基腈.
R CO
(R')H
+ H+ CN-
R OH C
(R')H CN
反应速度受CN-进攻羰基的影响,加入碱,增 加了CN-的解离,促进反应进行.
H3C O
H3C
Ph3P CH2
O
C CH3
Ph3P CH2CH3
H3C H3C
CH2
CH2CH3 C CH3
第三节 α氢的反应
一、 酸性及互变异构 醛、酮的-亚甲基上的氢受到邻位羰基的活化而 呈一定的酸性,可以通过烯醇式表现出来。
HO
CH3 C C
H+
CH3 1
CH3
(酮式)
O
CH3 C C
CH3
O C H CH2
+ H2O
O
O
C
CH
+ H2O
H CH2 CH3
有机化学 第十章 酮和醛 名词解释

第十章酮和醛1.醛:羰基分别与一个烃基和一个氢相连的化合物。
2.酮:羰基与两个烃基直接相连的化合物。
3.酰基:4.单箭头表示均裂,双箭头表示异裂。
5.脂肪族醛、酮亲核加成反应活性次序:6.增长碳链的反应:酮和醛:与氢氰酸加成、与格式试剂反应、与炔金属化合物反应。
7.羟醛缩合:两分子含有α-氢的醛在酸或碱的催化下(最常用的是稀碱),相互结合形成β-羟基醛的反应。
(反应可逆)8.克莱森-施密特反应:芳香醛与含有α-氢的脂肪醛/酮进行交叉羟醛缩合反应生成α,β-不饱和醛/酮的反应。
9.卤代反应:醛/酮在酸或碱催化下,与卤素反应α-氢被卤代(溶剂:四氯化碳、水、醋酸、酸酐、醇)。
10.制备少一个碳的羧酸:卤仿反应。
11.曼尼希反应:含有α-活泼氢的酮与甲醛及胺反应,可以在酮的α为引入一个氨甲基,这个反应也称为氨甲基化反应。
12.制备α、β-不饱和酮:曼尼希反应、克莱森-施密特反应、羟醛缩合。
13.过氧酸氧化反应:酮在酸催化下与过氧酸作用生成酯的反应。
(过氧酸:过氧乙酸、过氧三氟乙酸、过氧苯甲酸、过氧间氯苯甲酸等)14.康尼扎罗反应:无α-H的醛在浓碱作用下可在两分子间发生反应,一分子醛被还原成醇,另一分子醛被氧化成酸。
(也称歧化反应)15.维悌希反应:醛、酮与磷叶立德反应生成烯烃。
(磷叶立德试剂也称为维悌希试剂)。
16.安息香缩合反应:芳醛在氰基负离子催化下,生成α-羟基酮的反应。
(最简单的芳香α-羟基酮称为安息香)。
17.盖特曼-可赫反应:在催化剂(无水三氯化铝和氯化亚铜)存在下,芳烃与氯化氢和一氧化碳混合气体作用,生成芳醛的反应。
18.在乙醛分子的羰基与甲基这几间插入一个或者多个乙烯基,原来的甲基和醛基间的相互影响依旧存在。
19.迈克尔加成:α,β-不饱和醛/酮和碳负离子发生1,4-共轭加成反应。
20.狄尔斯-阿尔德反应:共轭双烯与含有烯键或炔键的化合物反应生成六元环状化合物的反应。
21.制备乙酰乙酸乙酯:烯酮与乙醇反应。
有机化学第二版第十章醛和酮

第十章 醛酮含有羰基的化合物:O H O CH3CCH3 O C CH3醛和酮:CH 3C羧酸 羧酸:CH3CO OHCOOH COOH COOHOH CH3CHCOOHO羧酸衍生物:CH3COCl (CH3CO) ( )2OCOOC 2H 5NHOβ-二羰基化合物:CH3CCH2COOC 2H5CH2COOC2H5 COOC2H5210 醛和酮教学大纲(醛和酮)醛和酮的结构与物理性质 醛和酮的结构与物理性质; 醛和酮的化学性质:1.与氢氰酸加成; 2.与亚硫酸氢钠加成; 3.与醇亲核加成; 4.与氨的衍生物反应; 5.与Grignard试剂加成; 试剂加成 6.醇醛缩合反应; 7 卤化和卤仿反应; 7. 卤化和卤仿反应 还 原 反 应 —— 催 化 加 氢 、 金 属 氢 化 物 还 原 、 Clemmenson 还 原 、 WolffKishner黄鸣龙还原、Cannizzaro反应;氧化反应)。
羰基 carbonylOR C H R O C R'醛(aldehyde)O R C O R C R' Ar H Ar O C O C R H酮(Ketone K t )Oβ αC H(R)CC脂肪族醛、酮芳香族醛、酮α,β-不饱和醛、酮4命名:O CH3CCH2CH2CHOO O CH3CCHCCH3 CH2CH=CH24-氧代戊醛3-烯丙基-2,4-戊二酮OO CHO环己酮CHO2'-氧代环己基甲醛CHO OH O CHO苯甲醛2-羟基苯甲醛 (水杨醛)呋喃甲醛 (糠醛)5z醛和酮的结构2spCσOδ C+δO键角接近 120 °1 C=O双键是由一个σ键和一个π键组成的。
2 羰基碳原子为 sp2杂化轨道与氧原子的 p 轨道和其它两个原子 形成三个 形成 个σ键 键,一个 个 p轨 轨道与氧原子的 与氧 子 p轨 轨道侧面交盖成 侧面交 成π键 键, 氧原子上另有两对孤对电子处于氧的s轨道和p轨道中。
有机化学第二版-高占先著-第十章课后答案
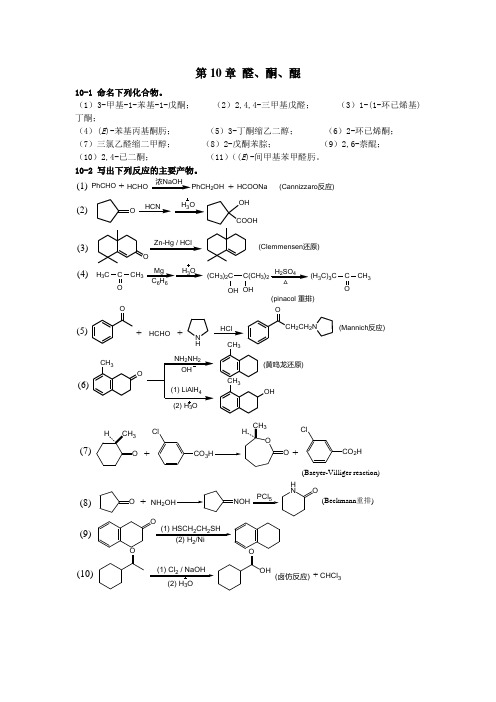
第10章 醛、酮、醌10-1 命名下列化合物。
(1)3-甲基-1-苯基-1-戊酮; (2)2,4,4-三甲基戊醛; (3)1-(1-环已烯基)丁酮;(4)(E )-苯基丙基酮肟; (5)3-丁酮缩乙二醇; (6)2-环已烯酮; (7)三氯乙醛缩二甲醇; (8)2-戊酮苯腙; (9)2,6-萘醌; (10)2,4-已二酮; (11)((E )-间甲基苯甲醛肟。
10-2 写出下列反应的主要产物。
PhCHOHCOONa +浓NaOHHCHO2OH+(Cannizzaro 反应)OZn-Hg / HClHCNH 3OOH COOHO(Clemmensen 还原)H 3CC CH 3O Mg 66H 3OH 2SO 4△(CH 3)2C C(CH 3)2OH OH(H 3C)3CC CH 3O(pinacol 重排)(1)(2)(3)(4)+HCHO(Mannich 反应)+HCl(5)(6)ON HCH 2CH 2NOCH 3OCH3CH 3OH(黄鸣龙还原)CO 3Cl+CO 2HCl+(Baeyer-Villiger reaction)ONH 2+PCl 5H NO(Beckmann 重排)O(1) HSCH 2CH 2SH2O(1) Cl 2 / NaOH 3OHO(卤仿反应)(7)(8)(9)(10)CHCl 3+(Wittig reaction)CH 3MgBr +Ph 3(1) CuCl 3(13)(12)(11)O+O(1,4-加成产物)OCHCH 2CH 3O OOHHONCO(双烯合成反应)10-3 比较下列化合物的亲核加成反应活性。
(2)(1)C OCH 3H 3C C CH 3OH 3CC HOCOCH 3H 3C(3)(4)(3)>(1)>(2)>(4)10-4 将下列化合物按烯醇式的含量多少排列成序。
CH 3COCHCOCH 3CH 3COCH 2CH 3(2)(1)PhC H 2C O(3)(4)3CH 3COCH 2COCH 3C CH 3O(1)>(4)>(3)>(2)10-5 指出下列化合物中,哪些能发生碘仿反应?哪些能与饱和NaHSO 3反应?(2)(1)O(3)(4)(5)ICH 2CHOCH 3CH 2CHOC 6H 5COCH 3CH 3CHOCH 3CH 2CH 2OHCH 3CH 22CH 3CH 3CH 23OH(7)(6)(8)O能与饱和NaHSO 3反应的有(1)、(2)、(5)、(8)[脂肪族甲基酮、大多数醛和8个碳以下的脂肪酮能进行此反应]。
醛 酮

结构,分类和命名醛和酮都是含有羰基官能团的化合物.当羰基与一个羟基和一个氢原子相结合时就是醛,醛基的简写为-CHO.若羰基与两个烃基相结合,就是酮,酮分子中的羰基叫做酮基.醛,酮的通式为:醛: 酮:结构:醛,酮羰基中的碳原子为SP2杂化,而氧原子则是末经杂化的.碳原子的三个SP2杂化轨道相互对称地分布在一个平面上,其中之一与氧原子的2P轨道在键轴方向重叠构成碳氧σ键.碳原子末参加杂化的2P轨道垂直于碳原子三个SP2杂化轨道所在的平面,与氧原子的另一个2P轨道平等重叠,形成π键,即碳氧双键也是由一个σ键和一个π键组成.由于氧原子的电负性比碳原子大,羰基中的π电子云就偏向于氧原子,羰基碳原子带上部分正电荷,而氧原子带上部分负电荷.分类:根据烃基的不同可以分为脂肪醛酮,芳香醛酮.根据羰基的个数可以分为一元醛酮,多元醛酮.命名:普通命名法:醛的命名与醇的习惯命名法相似,称某醛.如:CH3CH2OH CH3CHO乙醇乙醛CH3CH(CH3)CH2OH CH3CH(CH3)CHO异丁醇异丁醛脂肪酮则按酮基所连接的两个烃基而称为某(基)某(基)酮.例如:CH3OCH3 CH3COCH3甲醚二甲酮CH3OCH2CH3 CH3COCH2CH3甲乙醚甲乙酮系统命名法:选择含有羰基的最长碳链作为主链,称为某醛或某酮.由于醛基是一价原子团,必在链端,命名时不必用数字标明其位置.酮基的位置则需用数字标明,写在\"某酮\"之前,并用数字标明侧链所在的位置及个数,写在母体名称之前.例如:CH3CH(CH3)CHO CH3CH2COCH(CH3)CH2CH32-甲基丙醛4-甲基-3-已酮CH3CH═CHCHO CH3CH(CH3)CH═CHCOCH32-丁烯醛5-甲基-3-已烯-2-酮环已基甲醛3-甲基环已酮3-苯丙烯醛1-苯-2-丁酮醛酮命名时习惯上还采用希腊字母α,β,γ等,α碳指与醛基或酮基直接相连的碳原子.例如:CH3CH2CH2CH(CH3)CHO α-甲基戊醛醛和酮的制法醇氧化法伯醇和仲醇氧化可分别得到醛或酮.例如:CH3CH2CH2OH + K2Cr2O7 + H2SO4 CH3CH2CHO实验室中常用的氧化剂是重铬酸钾与稀硫酸或铬酐与吡啶等.因醛比醇更容易氧化,为避免生成的醛进一步氧化成羧酸,应将生成的羧酸尽快与氧化剂分离.酮不易继续氧化,无需立即分离.例如:+ K2Cr2O7 + H2SO4工业上把醇的蒸气通过加热的铜或银等催化剂,发生脱氢生成相应的醛或酮.例如:CH3CH2OH CH3CHO + H2另一种从醇氧化制备酮的方法就是欧芬脑尔氧化法,它是从不饱和醇制备不饱和酮的良好方法.它是把仲醇,叔丁醇铝(或异丙醇铝)与丙酮一起加热回流,仲醇脱去氢,被氧化成相应的酮,而丙酮被还原为异丙醇,并且只氧化羟基成羰基,碳碳双键不受影响.反应通式如下:醛和酮也可由烯烃双键氧化断裂制备,尤其是臭氧化还原后可制得两分子的羰基化合物.例如:CH3CH2CH═C(CH3)CH2CH3 CH3CH2CHO + CH3COCH2CH3炔烃水合法炔烃进行水合时产生不稳定的中间体烯醇,后者重排可得到相应的酮.反应在汞盐和硫酸催化下进行.例如:CH3(CH2)3C≡CH CH3(CH2)3COCH34,直接羰基化法傅-克酰基化反应:在芳烃一章已经讨论过这一反应.例如:+ CH3CH2CH2COCl盖特曼-柯赫合成法:以一氧化碳及干燥氯化氢为原料,在无水三氯化铝及氯化亚铜存在下引入醛基的反应称为盖特曼-柯赫反应.例如:+ CO + HCl物理性质状态:甲醛在室温下为气体,市售的福尔马林是40℅的甲醛水溶液.除甲醛为气体外,12个碳原子以下的脂肪醛,酮均为液体.高级脂肪醛,酮和芳香酮多为固体.水溶性:低级的醛,酮易溶于水.这是由于醛,酮可与水分子形成分子间氢键之故.当分子中烃基的部分增大时,水溶性迅速下降,含6个碳原子以上的醛,酮几乎不溶于水.四,化学性质亲核加成反应醛,酮羰基与碳碳双键一样也是由一个σ键和一个π键组成.由于羰基中氧原子的电负性比碳原子大,π电子云偏向于电负性较大的氧原子,使得氧原子带上部分负电荷,碳原子带上部分正电荷.由于氧原子容纳负电荷的能力较碳原子容纳正电荷的能力大,故发生加成反应时,应是带有一对末共用电子对的亲核试剂(可以是负离子或带有末共有电子对的中性分子)提供一对电子进攻带部分正电荷的羰基碳原子,生成氧负离子.即羰基上的加成反应决定反应速度的一步是由亲核试剂进攻引起的,故羰基的加成反应称为亲核加成反应.与氢氰酸加成醛,脂肪族甲基酮及8个碳以下的环酮能与氢氰酸发生加成反应生成α-氰醇.反应通式为:+ HCN丙酮与氢氰酸作用,无碱存在时,3-4内只有一半反应物作用掉.但如加一滴氢氧化钾,则反应2分钟内即完成.若加入酸,反应速度减慢,加入大量的酸,放置几天也不发生作用.根据以上事实可以推论,在醛,酮与氢氰酸加成反应中,真正起作用的是氰基负离子这一亲核试剂.碱的加入增加了反应体系的氰基负离子浓度,酸的加入则降低了氰基负离子浓度,这是由于弱酸氢氰酸在溶液中存在下面的平衡.HCN CN— + H+醛,酮与亲核试剂的加成反应都是试剂中带负电部分首先向羰基带正电荷碳原子进攻,生成氧负离子,然后试剂中带正电荷部分加到氧负离子上去.在这两步反应中,第一步需共价键异裂,是反应慢的一步,是决定反应速度的一步.可用通式表示如下:+ : Nu—不同结构的醛,酮进行亲核加成反应的难易程度不同,其由易到难的顺序为:HCHO > RCHO > RCOCH3 > RCOR影响醛酮亲核加成反应的速度的因素有两方面,其一是电性因素,烷基是供电子基,与羰基碳原子连接的烷基会使羰基碳原子的正电性下降,对亲核加成不利.其二是立体因素,当烷基与羰基相连,不但降低羰基碳的正电性,而且烷基的空间阻碍作用,也不便于亲核试剂接近羰基,不利于亲核加成反应的进行.2,与亚硫酸氢钠加成醛,甲基酮以及环酮可与亚硫酸氢钠的饱和溶液发生加成反应,生成α-羟基磺酸钠,它不溶于饱和的亚硫酸氢钠溶液中而析出结晶.+ NaHSO3 ↓本加成反应可用来鉴别醛,脂肪族甲基酮和8个碳原子以下的环酮.由于反应为可逆反应,加成物α-羟基磺酸钠遇酸或碱,又可恢复成原来的醛和酮,故可利用这一性质分离和提纯醛酮.3,与醇加成在干燥氯化氢或浓硫酸作用下,一分子醛和一分子醇发生加成反应,生成半缩醛.例如:CH3CH2CHO + CH3OH CH3CH2CH(OH)OCH3半缩醛一般不稳定,它可继续与一分子醇反应,两者之间脱去一分子水,而生成稳定的缩醛.在结构上,缩醛跟醚的结构相似,对碱和氧化剂是稳定的,对稀酸敏感可水解成原来的醛.RCH(OR)2 + H2O RCHO在有机合成中可利用这一性质保护活泼的醛基.例如由对羟基环已基甲醛合成对醛基环已酮时,若不将醛基保护起来,当用高锰酸钾氧化时,醛基也会被氧化成羧酸.+ CH3OH与格氏试剂加成醛,酮与格氏试剂加成,加成产物不必分离,而直接水解可制得相应的醇.格氏试剂与甲醛作用生成伯醇,生成的醇比用作原料的格氏试剂多一个碳原子.HCHO + RMgX RCH2OMgX + H2O RCH2OH格氏试剂与其它醛作用生成仲醇.例如:RCHO + RMgX R2CHOMgX + H2O R2CHOH格氏试剂与酮作用生成叔醇.例如:RCOR + RMgX R3COMgX + H2O R3COH与氨的衍生物加成氨的衍生物可以是伯胺,羟胺,肼,苯肼,2,4-二硝基苯肼以及氨基脲.醛,酮能与氨的衍生物发生加成作用,反应并不停留在加成一步,加成产物相继发生脱水形成含碳氮双键的化合物.反应式如下:+ H2N—R+ H2NOH+ H2NNH2++ H2NNHCONH2上述的氨衍生物可用于检查羰基的存在,又叫羰基试剂.特别是2,4-二硝基苯肼几乎能与所有的醛,酮迅速反应,生成橙黄色或橙红色的结晶,常用来鉴别.6,与魏悌锡试剂加成魏惕锡试剂是由亲核性的三苯基膦(C6H5)3P与卤代烷进行亲核取代反应制得的膦盐,再用强碱例如苯基锂处理除去α-氢而制得.醛,酮与魏悌锡试剂作用脱去一分子氧化三苯基膦生成烯烃,称为魏悌锡反应.反应通式为:+应用魏悌锡反应制备烯烃条件温和,双键位置确定.例如合成亚甲基环已烷,若采用醇脱水的方法难以得到.α-活泼氢的反应醛酮α-碳原子上的氢原子受羰基的影响变得活泼.这是由于羰基的吸电子性使α-碳上的α-H键极性增强,氢原子有变成质子离去的倾向.或者说α-碳原子上的碳氢σ键与羰基中的π键形成σ-π共轭(超共轭效应),也加强了α-碳原子上的氢原子解离成质子的倾向.1,卤代和卤仿反应醛,酮可以和卤素发生卤代反应.在酸的存在下,卤代反应可控制在一卤代产物.+ Br2在碱性催化下,卤代反应不能控制在一卤代产物,而是生成多卤代产物.α-碳原子上连有三个氢原子的醛酮,例如,乙醛和甲基酮,能与卤素的碱性溶液作用,生成三卤代物.三卤代物在碱性溶液中不稳定,立即分解成三卤甲烷和羧酸盐,这就是卤仿反应.常用的卤素是碘,反应产物为碘仿,上述反应就称为碘仿反应.碘仿是淡黄色结晶,容易识别,故碘仿反应常用来鉴别乙醛和甲基酮.次碘酸钠也是氧化剂,可把乙醇及具有CH3CH(OH)—结构的仲醇分别氧化成相应的乙醛或甲基酮,故也可发生碘仿反应.羟醛缩合反应在稀碱的催化下,一分子醛因失去α-氢原子而生成的碳负离子加到另一分子醛的羰基碳原子上,而氢原子则加到氧原子上,生成β-羟基醛,这一反应就是羟醛缩合反应.它是增长碳链的一种方法.例如:CH3CHO + CH3CHO CH3CH(OH)CH2CHO若生成的β-羟基醛仍有α-H时,则受热或在酸作用下脱水生成α,β-不饱和醛.CH3CH(OH)CH2CHO CH3CH═CHCHO酮也能发生醇酮缩合反应,但平衡不利于醇酮的生成.例如丙酮的醇酮缩合需在氢氧化钡的催化下,并采用特殊设备将生成的产物及时分出,使用权平衡向生成产物的方向移动.当两种不同的含α-H的醛(或酮)在稀碱作用下发生醇醛(或酮)缩合反应时,由于交叉缩合的结果会得到4种不同的产物,分离困难,意义不大.若选用一种不含α-H的醛和一种含α-H的醛进行缩合,控制反应条件可和到单一产物.例如:HCHO + (CH3)2CHCHO HOCH2C(CH3)2CHO由芳香醛和脂肪醛酮通过交叉缩合制得α,β-不饱和醛酮,称克莱森-斯密特反应.例如:+ CH3COCH3醇醛缩合反应若在分子内进行则生成环状化合物,是生成环化合物的重要方法.如:(三)氧化与还原反应1,氧化反应醛由于其羰基上连有氢原子,很容易被氧化,不但可被强的氧化剂高锰酸钾等氧化,也可被弱的氧化剂如托伦试剂和斐林试剂所氧化,生成含相同数碳原子的羧酸,而酮却不被氧化.托伦试剂是由氢氧化银和氨水制得的无色溶液.托伦试剂与醛共热,醛被氧化成羧酸而弱氧化剂中的银被还原成金属银析出.若反应试管干净,银可以在试管壁上生成明亮的银境,故又称银境反应. RCHO + *Ag(NH3)2++ RCOONH4 + Ag↓ + NH3 + H2O斐林试剂是由硫酸铜和洒石酸钾钠的氢氧化钠溶液配制而成的深蓝色二价铜络合物,与醛共热则被还原成砖红色的氧化亚铜沉淀.RCHO + Cu2+ + NaOH + H2O RCOONa + Cu2O↓甲醛与斐林试剂作用,有铜析出可生成铜境,故此反应又称铜境反应.HCHO + Cu2+ + NaOH + H2O HCOONa + Cu↓利用托伦试剂可把醛与酮区别开来.但芳醛不与斐林试剂作用,因此,利用斐林试剂可把脂肪醛和芳香醛区别开来.2,还原反应采用不同的还原剂,可将醛酮分子中的羰基还原成羟基,也可以脱氧还原成亚甲基.(1)羰基还原成醇羟基醛酮羰基在催化剂铂,镉,镍等存在下,可催化加氢,将羰基还原成羟基.若分子结构中有碳碳双键也同时被还原.如:CH3CH═CHCHO + H2 CH3CH2CH2CH2OH用金属氢化物如硼氢化钠,氢化锂铝等则只选择性地把羰基还原成羟基,而分子中的碳碳双键不被还原,例如:CH3CH═CHCH2CHO CH3CH═CHCH2CH2OH(2)羰基还原成亚甲基醛,酮与锌汞齐及浓盐酸回流反应,羰基被还原成亚甲基,这一反应称为克莱门森还原.例如:+ HCl(3)康尼查罗反应没有α-氢原子的醛在浓碱作用下发生醛分子之间的氧化还原反应,即一分子醛被还原成醇,另一分子醛被氧化成羧酸,这一反应称为康尼查罗反应,属歧化反应.例如:2HCHO + NaOH(浓) CH3OH + HCOONa如果是两种不含α-H的醛在浓碱条件下作用,若两种醛其中一种是甲醛,由于甲醛是还原性最强的醛,所以总是甲醛被氧化成酸而另一醛被还原成醇.这一特性使得该反应成为一种有用的合成方法. + HCHO + NaOH(浓) + HCOONa+ HCHO + NaOH + HCOONa(四)与品红亚硫酸试剂的显色反应把二氧化硫通入红色的品红水溶液中,至红色刚好消失,所得的溶液称为品红亚硫酸试剂,又称希夫试剂.醛与希夫试剂作用显紫红色,酮则不显色,故可用于区别醛和酮.五,重要的醛和酮1,甲醛又名蚁醛.甲醛在常温下是气体,易溶于水.它有杀菌防腐能力.福尔马林是40℅甲醛水溶液,用作消毒剂和防腐剂.甲醛溶液与氨共同蒸发,生成环六亚甲基四胺,药名为乌洛托品.乌洛托品为白色结晶粉末,易溶于水,在医药上用作利尿剂及尿道消毒剂.2,乙醛是无色,有刺激臭味,易挥发的液体,可溶于水,乙醇,乙醚中.三氯乙醛是乙醛的一个重要衍生物,是由乙醇与氯气作用而得.三氯乙醛由于三个氯原子的吸电子效应,使羰基活性大为提高,可与水形成稳定的水合物,称为水合三氯乙醛,简称水合氯醛.其10℅水溶液在临床上作为长时间作用的催眠药,用于失眠,烦躁不安等.3,苯甲醛为无色液体,微溶于水,易溶于乙醇和乙醚中.苯甲醛易被空气中的氧氧化成白色的苯甲酸固体.4,丙酮为无色易挥发易燃的液体,具有特殊的气味,与极性及非极性液体均能混溶,与水能以任何比例混溶.6,丙烯醛是无色有刺激性的挥发性液体,脂肪过热时所产生的刺激性气味是由于其甘油成分变成丙烯醛之故.。
有机化学-第十章

10.2 醛酮的化学性质
如果利用NaHSO3与羰基化合物加成的可逆性,将 NaCN 与 α-羟基磺酸钠作用,使生成的 HCN 与分解出的羰基化合 物加成生成α-羟基腈,这样也可避免 HCN 的直接使用。 例如:
10.2 醛酮的化学性质
醛、酮与碳负离子的加成
Grignard 试剂,炔钠,Wittig试剂等,都含有碳负离子, 它们与羰基化合物的反应活性很高,有机合成上有广泛的 应用。
10.2 醛酮的化学性质
一、与氨、伯胺的反应
脂肪族醛、酮与氨、伯胺的反应可生成亚胺,也称为席夫 碱(Schiff base):
10.2 醛酮的化学性质
脂肪族醛、酮生成的亚胺中含的C=N双键在反应条件下不 是很稳定的,它易于发生进一步的聚合反应。芳香族的醛、 酮与伯胺反应生成的亚胺则比较稳定。
10.1 醛酮的结构及分类
在醛、酮分子中,羰基碳原子是以sp2 杂化状态与其它三 个原子构成键的,羰基碳原子的P轨道与氧原子上的P轨道 以相互平行的方式侧面重叠形成π键,即羰基是一个平面 构型的; 与羰基碳原子直接相连的其它三个原子处于同一平面内, 相互间的键角约为120度,而π键是垂直于这个平面的。
> > >
>
>
>
>
10.2 醛酮的化学性质
一、与水的加成
甲醛、乙醛、丙酮等小分子羰基化合物在水中的溶解性非 常好,这不仅是它们与水分子之间可以形成氢键,还在于 它们可以与水分子发生加成反应,生成了水合物; 这种水合物只有在水溶液中在一定浓度范围、一定的温度 下才是比较稳定的,游离的羰基水合物(同碳二元醇)是 极不稳定的,它将迅速脱水成为羰基化合物。
有机化学课件第十章醛酮1

2.5 与NaHSO3 加成
O HO S O
O C + NaHSO3
反应可逆
O
HO S O NaHSO3的亲核性
ONa C SO3H
H+(酸处理)
OH C SO3Na
白色结晶物
醛(芳香醛、脂肪醛) 脂肪族甲基酮,八个碳以下的环酮
应用:醛或甲基酮的 分析、纯化
3、醛酮羰基上的亲核加成反应(2)
❖ 分析:分子型亲核试剂的特点及与醛酮的加成
•特点分析
H Nu
水、醇、胺
•预测:直接与羰基加成
H OH H OR H NHR H NR2
✓有活泼 H ✓亲核性不强
羰基亲电 性较弱
亲核能 力不强
O C
NuH
可逆
O C NuH
较易离去
•结论:
分子型亲核 试剂难直接 与羰基加成
3、醛酮羰基上的亲核加成反应(2)
•预测: H+存在下与羰基加
成
H+
O
Jones 试剂
Oppenauer 氧化
二、醛酮的制备
❖氧化烯烃
例:
有合成意 义的反应
二、醛酮的制备
3、芳香酮的合成
芳香酮
三、醛、酮的化学性质
性质分析
羰基氧有弱碱性 可与酸结合
R1
R2
C
α碳有吸电子基
H
α氢有弱酸性
碳与氧相连
O
氢易被氧化
C H(R)
羰基碳有亲电性 可与亲核试剂结合
α氢与碱的反应
OR
OR
半缩醛(酮) 一般不稳定
例1:生成缩醛(酮)
CHO
2 CH3OH HCl
缩醛(酮) 碱性和中性中稳定
有机10

第10章 羰基化合物醛(aldehydes )和酮(ketones )都是分子中含有羰基(碳氧双键)的化合物,因此又统称为羰基化合物。
羰基与一个烃基相连的化合物称为醛,与两个烃基相连的称为酮。
CO R 'CRO HCR (H )O羰基 醛 酮醛可以简写为RCHO ,基团—CHO 为醛的官能团,称为醛基,酮可以简写为RCOR ’, 基团—CO —为酮的官能团,称为酮基。
醛和酮是一类非常重要的化合物,这不仅是因为学多化学产品和药物含有醛、酮结构,更重要的是醛、酮能发生许多化学反应,是进行有机合成的重要原料和中间体。
醌(quinone )类是一类特殊的环状不饱和二酮类化合物。
第一节 醛和酮一、羰基的结构羰基是醛、酮的官能团,它与醛、酮的物理化学性质密切相关。
根据醛、酮分子的结构参数(见表10-1),可以认为羰基碳原子以sp 2杂化状态参与成键,即碳原子以三个sp 2轨道与其它三个原子的轨道重叠形成三个σ键,碳原子上未参加杂化的p 轨道与氧原子上的p 轨道在侧面相互重叠形成一个π键(见图10-1)。
(请在图左边第一幅图中,下半个轨道中着淡灰色,如中间那幅图轨道的颜色)表10-1 醛、酮分子的结构参数醛、酮分子 键长(pm ) 键角() HCHO C =O 120.3 C —H 110.1 ∠HCO 121.7 ∠HCH 116.5 CH 3CHOC =O 120.7 C —C 151.5 C —H 110.4∠CCO 123.9 ∠HCO 118.6 ∠CCH 117.5 CH 3COCH 3C =O 121.4 C —C 152.0∠CCO 121.4 ∠CCC 117.2R δ-R R+图10-1羰基的结构由于氧原子的电负性比碳原子大,所以成键处的电子云就不均匀地分布在碳氧原子之间,氧原子处电子云密度较高,带有部分负电荷,而碳原子处的电子云密度较低,带有部分正电荷。
因此醛、酮具有较高的偶极矩(2.3~2.8D ),例如丙醛的偶极矩为2.5D ,并且在物理性质和化学性质上得到反映。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CO RM g X
C O M g XH 3 O R
C O H+M g X
R
O H
• 加成产物经水解可得到各种类型的醇。
三、与硫亲核试剂的加成
• 醛酮可与亚硫酸氢钠饱和溶液反应,得 到α-羟基磺酸钠,在这个反应中,亚 硫酸氢钠分子中的具有未共用电子对的 硫原子进攻羰基碳原子起亲核加成反应。
H O O N a S O
H
OR'
HCl(g)
R C O + HO R'
R C OH
H
R
OR'
HCl(g)
R C O + HO R'
R C OH
R
半缩醛(酮)一般不稳定,难以分离得到。但具有五 元环或六元的环状半缩醛(酮)较稳定。例如:
O H O C H 2C H 2C H 2CH H C l(g)
OH O H
半缩醛(酮)能与醇继续反应生成缩醛和缩酮。
O H
O H H
O H
H + R CC H R ' R CC H R ' R CC H R '+ H
• 碱可以夺取醛、酮分子中的α-H产生碳负离子或烯醇 负离子。由于负电荷分散在三个原子的共轭体系中, 因而比较稳定。
OH RCC H R '+ O H
O
O
RCC H R ' RCC H R ' + H 2 O
OR'
O R'
R C OH+R'OH H Cl(g) R C OR' +H 2O
H
H
• 对分子量较大的醛,在反应体系中加入苯蒸馏以带出 生成的水,可促进平衡向生成缩醛的方向移动。
• 缩酮的生成较为困难,酮与简单醇的反应产率很低, 但邻位二醇能与酮顺利反应生成环状缩醛。
T s O H O + H O C H 2 C H 2 O HC 6 H 6
CO
CO N a H 2 O CO H
S O 3 H
S O 3N a
• 醛应、脂肪族甲基酮和C6以下的环酮都能与NaHSO3起亲核加成反
C3 H CO+NaHSO3(饱 和 )
H
C3 H OH C
H S3 O Na白 色
乙 醛 亚 硫 酸 氢 钠 加 成 物
• α-羟基磺酸钠为白色固体,因而很容易将其分离。若将分离得到 的固体产物与稀酸或稀碱共热,则又可得到原来的醛酮。
• 说明亲核加成反应的速度与CN-的浓度有关,进攻羰基碳原子的 试剂是CN - ,不是HCN
HCN+OH
快
CN+ H2O
质子转移反应
NC + C O
C O +HC N C N
慢
CO
决速步
CN
快 C O H+O H 质子转移反应 C N
2.与格氏试剂的加成
• 在格氏试剂的分子中,由于Mg的电正性, 使与其相连的碳原子带部分负电荷,极 易与羰基化合物起亲核加成反应。
H HCOH 2 S O 4 K C N H 2 OH OC H 2 C N
• 醛、脂肪族甲基酮和8个碳原子以下的环酮都能与HCN发生反应
HCl
CH3 CH3
CH3 C O HCN CH3 C OH
CN
H2SO4
H2SO4 CH3OH
CH3 CH3 C COOH
OH
2-甲基-2-羟基丙酸
CH3 CH2 C COOH
• 在芳香族醛酮分子中,羰基和芳环共轭,使羰基碳原子上的正电荷 部分分散到芳环上,同时芳环一般有较大体积,空间位阻较大,因 而脂肪族比芳香族容易起加成反应。
• 甲基比任何烃基的体积都小,因而脂肪族甲基酮的亲核加成活性大 于其它的酮
• 醛 > 甲基酮>脂肪酮 > 芳香酮 • 环酮 > 脂肪酮
二、与碳亲核试剂的加成
O
O
O
R C C X 3 R C O H +C X 3 R C O + C H X 3
2-甲基-2-丙烯酸
CH3 CH2 C COOCH3
2-甲基-2-丙烯酸酯
甲基丙烯酸甲酯聚合可得到透明的有机玻璃
• 反应体系的pH值对醛酮与HCN的反应速度有很大的影响。
• 如:丙酮与氢氰酸在无机碱存在下反应,3-4h内只有50%的丙 酮反应,加入少量无机酸,则需几周时间才能建立平衡。但如 果加入少量碱,反应瞬时即可完成。
C N NH C O NH2
缩氨脲
• 脂肪族亚胺和取代亚胺(西佛碱)都不稳定,很容易分解。 但芳香族取代亚胺是稳定的,可以分离出来。
C H O +
N H 2
C H N
• 肟、腙和缩氨脲一般是结晶固体,具有特定的熔点,可以 用于醛酮的鉴定。因此,羟氨、肼、氨基脲称为羰基试剂, 其中2,4-二硝基苯肼最为常用,生成的2,4-二硝基苯腙为黄 色或红棕色晶体,从反应溶液中析出,易于观察。
1.与氢氰酸的加成 • 醛与酮与氢氰酸作用,得到α-羟基腈(氰醇)。
H
H
R'
R'
R C O+H CN
R C OH R C O+H CN
R C OH
CN
CN
• 由于氢氰酸毒性较大且容易挥发,不便于操作,实际工作中一 般先将氰化钠或氰化钾的水溶液与醛酮混合,再滴加硫酸或盐 酸,使生成的HCN立即与醛酮反应。
OH R C C H +OH
X
O R C CHX + X X
OH R C C X + OH
X O R C CX2 + X X
O R C CHX
O R C CHX2 +X
O R C C X 2 + H 2O
O R C CX3 + X
• α-三卤代醛、酮在碱溶液中易发生碳碳键的断裂,生 成相应的卤仿和羧酸盐这个反应就叫氯仿反应。
• 由于氮原子上有未共用电子对,具有亲核性,因而许 多含氮化合物,如氨及氨的衍生物都能与醛酮的羰基
发生亲核加成反应,但加成产物一般不稳定,很容易 失水,生成含有C=N键的化合物,这是一种亲核加 成-消去反应。
CO +H 2 NY
CN H Y OH
CN H Y-H 2 O CNY O H
• 通式
C O H 2 N Y
• 一、 α-H的活性 • 在醛、酮分子中,与羰基相连的碳原子称为α-碳,α-
碳上连有的氢原子称为α-氢。受羰基的影响,会有一 定的酸性。
优势
OH
O H
RCC H R '
RCC H R '
酮式
互变异构 烯醇式
• 酸可以促使醛、酮的烯醇化。这是因为羰基的氧原子 接受质子后增加了羰基的吸电子效应,使α-H更容易 离解。
O
CHO
4-戊酮醛或4-氧代戊醛
3-甲酰基戊二醛
三、醛酮的物理性质
• 甲醛在室温下为气体,其它的均为液体或固体。
• 由于羰基的极性,醛酮均有较大的极性。
H CO
H
2.27D
CH3 CO
H
2.72D
CH3 CO
CH3
2.85D
• 醛酮分子间不能形成氢键,所以沸点比相应的醇低得多,但由 于它们的偶极矩较大,偶极间的静电引力使它们的沸点比分子 量相当的烃或醚高。
C +H 2O
R' O (H )
R C O+H O CH 2CH 2O H
R' (H )
• 因此在有机合成中,常用缩醛(酮)来保护羰基。
O
OO
Br HO OH
Br N aO H
H+ , Benzene
EtO H
OO
O
H 3O +
直 接 消 除 H Br时 会 发 生 Favorskii重 排
五、与氮亲核试剂的加成
Nu +
δδ CO
Nu CO
Nu C O+ E
Nu C OE
决定反应速度的一步是亲核试剂进攻羰基碳的一步,所 以叫做亲核加成反应
• 醛酮加成反应的难易主要取决于羰基碳原子上正电 荷的多少以及所连接的烃基的空间位阻的大小。
• 脂肪族酮有两个给电子烷基,同时酮的两个烷基对亲核试剂进攻羰 基碳原子的空间位阻比醛的一个烷基大,因而醛比酮更易起亲核加 成反应。
O +H 2 O
O
• 硫醇的亲核能力比相应的醇强,因而在室温下酮与硫 醇就能转变为硫代缩酮。
O
H C l(g )
S
H 3 CCC H 3+H S C H 2 C H 2 S H
H 3 C
S+H 2 O C H 3
• 生成原来的醛酮缩醛(酮)对碱稳定,在酸性条件下 可水解生成原来的醛仿反应
• 1. 卤化反应
• 在酸或碱的催化下,醛、酮的α-位易于发生卤 化反应。
O
O
+ Cl2 H2O
Cl + HCl
B r C O C H 3 + B r 2 C H 3 C O O H B r C O C H 2 B r + H B r
• 酸催化的卤化反应是通过烯醇式进行的:
OH
C
O
δ
δ
CO
• 羰基的结构可用共振式表示为:
CO
CO
二、醛、酮的分类
• 按分子中烃基的不同分为:
脂肪族醛酮和芳香族醛酮;
• 按分子中烃基的饱和程度:
饱和醛酮和不饱和醛酮;
• 分子中羰基的数目:
一元醛酮,二元醛酮和多元醛酮。
