第八章配位化合物
配位化合物
8.2 配合物的空间结构和异构现象
1、配合物的空间结构 空间构型
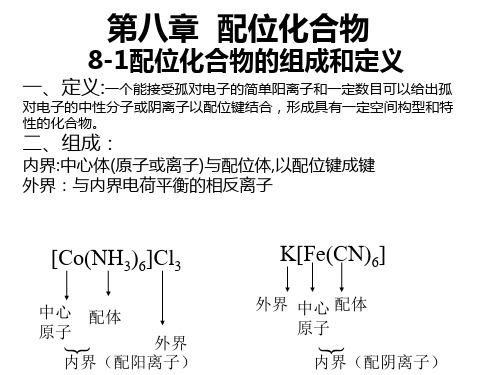
配位数 2 杂化轨道 sp 空间构型 直线型 实例 [Ag(NH3)2]+
3
4
sp2
sp3
平面三角形
平面正方形
[HgI3][Ni(CN)4]-、[PdCl4]2-
四面体
5 dsp3或d3sp d2sp2 6 d2sp3或sp3d2 三角双锥 正方锥形 正八面体
配位数(不一定是配体数)
与中心原子直接以配位键结合的配位原子的数目 称为中心原子的配位数。中心原子的配位数一般可为 2-12,以配位数2,4,6最为常见。 中必原子的配位数与配体的齿数有关,
配体是单齿,那么中心原子的配位数就是配体的数目; 配体是多齿,那么中心原子的配位数则是配体的数目 与其齿数的乘积。 例如: [Co Br(NH3)5] (SO4),
1.62×107=(0.02-x)/4x3
x=6.8×10-4
二、配位解离平衡移动
1. 与弱电解质平衡的竞争
M+ + L+ + OHH+ [ML]
当Ka, Kb越小,配离子越易解离 平衡向生成弱酸、弱碱方向移动 MOH HL
[ Fe(C2O4 )3 ]3
Fe3 3C2O4 2
+ 6H+
→
3. 杂化轨道形式与配合物的空间构型
配 位 数 2 3
空间构型
直线形 平面三角形
杂化轨 道类型 sp sp2
实例
Ag(NH3)2+ , Ag(CN)2– Cu(CN)32 – ,HgI3–
4 4 5
5 6
正四面体 四方形 三角双锥
四方锥 八面体
第八章 配位化合物

系统命名 配合物的命名与一般无机化合物的命名原则相同: 先提阴离子,再提阳离子。 若阴离子为简单离子,称某化某。 若阴离子为复杂离子,称某酸某。 内界的命名次序是: 配位体数—配位体名称—合—中心原子(中心原子 氧化数)
配体的命名顺序:先无机配体,后有机配体。
对于同类配体: (1)先阴离子,后中性分子。 (2)同类配体按配位原子元素符号的英文字母顺序排列。 (3)同类配体中若配位原子相同,则按配体中含原子 数的多少 来排列。原子数少的排前面,原子数多
为了增强成键能力,中心原子采取杂化轨 道与配体成键,配位键具有方向性和饱和性
8.2.2 配离子的形成
1. 外轨型配离子的形成 中心原子全部用外层空轨道(ns,np,nd) 杂化成键形成的配合物称为外轨型配合物. 4d 5s 5p sp杂化 5p 5s .. ..
NH3 NH3
Ag+
4d
[Ag(NH3)2]+
少量BaCl2 少量NaOH 定量乙醇
晶体析出(深蓝)
经分析,深蓝色晶体为[Cu(NH3)4]SO4,在 水中以[Cu(NH3)4]2+和SO42-形式存在,复 杂离子[Cu(NH3)4]2+几乎不能解离出Cu2+, 在结构上4个NH3与1个Cu2+牢固地结合 [Cu(NH3)4]SO4—配位化合物
0.1-x ≈ 0.1
0.1 x 7 Kf 1.62 10 2 x(2 x)
0.1 3 1 3 x 1.2 10 mol L 7 4 1.62 10
Ag+ + 2CN初始: 0 平衡: y 0 2y
[Ag (CN)2 ]0.1 0.1- y mol· -1 L
1. 离解程度 内轨型配离子比外轨型配离子更稳定,
第八章 配位化合物

1.12 10 7
y 2.23 10 -7
8.3.2 配位平衡的移动
Mn+ + x L-
MLx(n-x)
水解 氧化还原 沉淀
酸效应
1. 酸度的影响 2.氧化还原影响
3.沉淀影响
1. 酸度的影响
Fe3+ + 6F+ 6H+ [FeF6]36HF Fe3+ + 6HF
c 6 (F - ) c 6 (F - ) Kf 1
(K a ) 6
总反应为:[FeF6]3- +6H+
K c(Fe 3 ) c 6 (HF) c([FeF6 ]3 ) c 6 (H )
c(Fe 3 ) c 6 (HF) c([FeF6 ]3 ) c 6 (H )
Kf越小,即生成的配合物稳定性越小;Ka越小, 即生成
Kf
c(Ag(NH3 ) 2 ) 0.1 1.12 107 c(Ag )c 2 (NH3 ) x (2x)2
x 1.31 10-3
设在0.2mol· -1NH3存在下,Ag+的浓度为ymol· -1,则: L L
Ag+ + 2NH3 起始浓度/mol· -! L 0 0.2 [Ag(NH3)2]2+ 0.1
可通过对配合物磁矩的测定来确定内、外轨型
m
B
n(n 2)
m为磁矩,SI单位为A· 2; n为分子中未成对电 m 子数;μB为玻尔磁子,是衡量磁矩值的物理常 量,μB= 9.274078×10-24A· 2 。 m 表 磁矩的理论值与未成对电子数的关系 未成对电子数 0 1 2 m/μB 0 1.73 2.83 未成对电子数 3 4 5 m/μB 3.87 4.90 5.92
第八章 配位化合物

A·m2
(3)测定 磁矩可通过磁天平测定。 • 顺磁性:被磁场吸引
• 反磁性:被磁场排斥
• 铁磁性:被磁场强烈吸引 (如 Fe , Co , Ni)
..
..
..
..
N
S
(a)无磁场
N
S
(b)磁场打开
顺磁性的说明
(4)影响因素 未成对电子数越多,磁矩越高,配合物
的磁性越大。
(5)意义
• 根据未成对电子数求磁矩; • 根据磁矩求未成对电子数; • 判断杂化方式、空间构型、配合物类型。
未成对电子数 0 1 2 3 4 5
µ计 / B.M
0 1.73 2.83 3.87 4.90 5.92
例: 测定FeF63-的µ为5.90 B.M,可判断: Fe3+有5个未成对电子;
Ag+
4d
[Ag(NH3)2]+
4d
5s
5p
NH3 NH3
5s
5p
sp杂化
2. 配位数为4的配合物的杂化方式及空间构型
(1)[NiCl4]2-:Ni 3d84s2
sp3杂化
Ni2+
Ni2+ 3d8 外轨型
四面体
3d
[NiCl4]2-
3d
4s
4p
Cl-
Cl- Cl- Cl-
4s
4p
sp3杂化
[NiCl4]2-
NH2-CH2-CH2-H2N
说明:
少数配体虽然有两个配位原子,由于两 个配位原子靠得太近,只能选择其中一 个与中心原子成键,故仍属单齿配体。
硝基NO(2 N是配位原子) 亚硝酸根ONO- (O是配位原子) 硫氰根SCN (S是配位原子) 异硫氰根NCS (N是配位原子)
第八章 配位化合物

NCS−(异硫氰根)
多齿配体:配体中含有两个或两个以上配位原子。
第一节 配位化合物的基本概念
多齿配体 O O 2草酸根( C2O4 ): ‖ ‖ —O—C—C—O— (二齿配体) .. ..
(二齿配体)
乙二胺(en)
:NH2—CH2—CH2—H2N:
(六齿配体) 乙二胺四乙酸(EDTA)
HOOC—CH2
色、稳定性、磁性等性质及其在实践中的应用。
内容提要
第一节 配合物的基本概念 一、配合物的定义 二、配合物的组成 三、配合物的命名 四、配合物的异构现象 五、螯合物和螯合效应 第二节 配合物的价键理论 一、价键理论的基本要点 二、内轨型配合物与外轨型配合物 三、配合物的磁性 第三节 配位平衡
一、配合物的标准稳定常数和标准不稳定常数 二、配位平衡的移动 第四节 配合物的应用 一、生命必需金属元素 二、有毒金属元素的促排
第一节 配位化合物的基本概念
(三)配位数
与中心原子直接结合的配位原子的数目,称 为中心原子的配位数。 中心原子的常见配位数是2、4、6。 对单齿配体:配位数=∑配体数 对多齿配体:配位数=∑配体数×配位原子数(齿数)
[Cu(NH3)4]2+ : 4 单齿配体 [PtCl (NH )]- :3+1=4 3 3
第一节 配位化合物的基本概念
(四)配离子的电荷
配离子的电荷=中心原子和配体所带电荷数的代数和
配离子电荷 中心原子电荷 外界电荷 [Cu(NH3)4]SO4 K2[HgI4]
+2
-2
+2
+2
பைடு நூலகம்-2
+2
H2[PtCl6]
[Ag(NH3)2]OH K4[Fe(CN)6]
第八章_配位化合物

0.10 21 1.0 10 2 y (0.10)
y 1.0 10
20
即Ag+的平衡浓度为1.0×10-20 mol/L。
2、判断配位反应进行的方向
[Ag(NH3)2] ++ 2CN反应向哪个方向进行?
2 [ Ag ( CN ) ][ NH ] 2 3 K [ Ag ( NH 3 ) 2 ][CN ]2
[Cu( NH 3 ) ] 1 2 [Cu ][NH 3 ]
2
2
[Cu( NH 3 ) 2 ] [Cu 2 ][NH 3 ]2
2
3
[Cu( NH 3 ) 3 ] [Cu 2 ][NH 3 ]3
2
2
4
[Cu( NH 3 )4 ] K稳 2 4 [Cu ][ NH 3 ]
[Zn(NH3)4]2+ [Zn(CN)4]2+ 5×108 1.0×1016
中心离子不同,配体相同,配位数相同。
[Zn(NH3)4]2+ [Cu(NH3)4]2+ 5×108 4.8×1012
不同类型配合物稳定性要通过计算 求出溶液中的离子浓度。
CuY2[Cu(en)2]2+ 6.3×1018 4.9×1019
配位离子 [Cu(NH3)4]2+ 配位单元 配合物 配位分子 Fe(SCN)3 配离子与带有异电荷的离子 组成的中性化合物。 [Cu(NH3)4]SO4
Hale Waihona Puke 1.2 配合物的组成中心离子和配位体之 间以配位键结合。
NH3 H3N Cu NH3 NH3
2+ 2 SO4 2
配合物的组成分为内 界和外界两部分。
第八章配位化合物ppt课件
● 配离子与形成体的电荷数
()
3
Ag(S 2O3 ) 2 ,
(2)
Pt Cl 3 (NH 3 )
(3)
K 3 Fe (CN) 6
赤血盐 ,
(2)
K 4 Fe (CN) 6
(3)
(0)
Co Cl 3 (NH 3 )3 , Fe(CO) 5
黄血盐
12
13
←
← ←
← ← ←
(1) 内界与外界
32
8.4.1 价键理论 (valence bond theory)
同一原子内,轨道的杂化和不同原子间轨道的重叠构成了共价键 理论的核心论点之一.这里把第二章的s-p杂化轨道扩大到d轨道上 ,形成s-p-d杂化轨道.
(1) 价键理论的要点
● 形成体(M)有空轨道,配位体(L)有孤对电子,形成配位键
Ag(NH 3 )2 Cl
中配 外 心位 界 离体 子
Ni(CO) 4 CoCl3 (NH3 )3
中配 心位 原体 子
中 心配 离位 子体
配离子
形成体 — 中心离子或原子(central ion or central atom)
(配分子) 配位体 — 中性分子或阴离子
形成体 — 提供空轨道 电子对接受体 Lewis酸 配位体 — 提供孤对电子 电子对给予体 Lewis碱
8
(三)配位数
配合物中,直接与中心离子(或原子)配 位的配位原子的数目称中心离子(或原子)的 配位数。
一般中心离子(或原子)配位数为2、4、 6。中心离子的配位数的多少,主要取决于中 心离子和配体的电荷、体积和电子层结构,以 及配合物形成时温度和反应物的浓度等。
配离子的电荷数等于中心离子和配位体电 荷的代数和。
无机化学:第八章配位化合物

无机化学:第八章配位化合物第八章配位化合物一、配合物的基本概念1、配位化合物的定义及其组成定义:把由一定数目的阴离子或中性分子与阳离子或原子以配位键形成的复杂分子或离子称配合单元。
含有配合单元(配位键)的化合物即配合物。
配合物可看成是一类由简单化合物反应生成的复杂化合物。
配合单元相对稳定,存在于晶体及溶液中,在溶液中不能完全离解为简单组成的部分。
配位键——由配体单方面提供电子对给中心原子(离子)而形成的共价键。
中心离子(或中心原子)——又称“配合物形成体”。
特征:带有空轨道。
组成中心离子的元素种类:◆能充当中心离子的元素几乎遍及元素周期表的各个区域,但常见的是金属离子,尤其是一些过渡金属离子,如[Co(NH3)6]3+、[Fe(CN)6]4—、[HgI4]2—。
◆高氧化态非金属元素原子:如B、Si、P等形成[ BF4]—、[SiF6]2—、PF6—。
◆金属元素电中性原子:如[ Ni(CO)4]、[ Fe(CO)5]、[Cr(CO)6]配合物的组成:配合物由内界和外界组成。
内界为配合物的特征部分(即配位个体),是一个在溶液中相当稳定的整体,在配合物的化学式中以方括号表明。
方括号以外的离子构成配合物的外界。
内外界之间以离子键结合,故在水溶液中易解离出外界离子,而内界即配合单元很难发生离解。
如[Cu (NH3)4] SO4↓↓↓中心原子,配位体,外界在配合物中同中心原子/离子配位的分子如NH3、H2O或阴离子如Cl—、CN—、SCN—称为配位体,简称配体。
配体属于Lewis碱,都含有孤对电子,是电子对的给予体。
中配体无机化学配位化学CO 一氧化碳羰基OH—氢氧根离子羟基NO2—亚硝酸根硝基ONO—亚硝酸根亚硝酸根SCN—硫氰酸根硫氰酸根NCS—硫氰酸根异硫氰酸根Cl—氯离子氯配位体中与中心离子(或原子)直接成键的离子称为配位原子。
配位体所提供的孤对电子即是配位原子所具有的孤对电子。
常见的配位原子有:F、Cl、Br、配位体分类——单齿配体和多齿配体单齿配体:一个配位体只提供1个孤对电子与1个中心离子结合形成1个配位键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
曲靖医学高等专科学校
教案
2011至2012学年秋季学期
系部药学系
教研室(实验室)药学教研室
课程名称医用化学
授课班级护理7、8 助产1、2
授课教师孙晶
职称讲师
使用教材《医用化学》主编于敬海
教案编写日期2011年10月
曲靖医学高等专科学校教务制
教案(首页)
为了解释上述情况,化学家曾提出瑞士著名化学家,苏黎世大学教授。
在科学上崇拜德国,
却表现了几何学的空间概念和丰富的想象力在化学方面的创造性的应用。
普鲁士蓝对治疗经口急慢性铊中毒有一定疗效。
在医疗上铊可置换上的钾后形成不溶性物质
月,清华大学92级化学系物理化学和仪器分析专业
被人投了铊毒,病情严重。
1995年4月底,
治所的陈震阳教授化验确诊后,在协和医院,医用普鲁士蓝被用来救
溶液,Cu(OH)2?
溶液,BaSO4?
,存在于新微粒中;
Cu2+、Zn2+、Ag+、H2O、NH
哪些可以作为中心原子?哪些可以作为配位体?
3、配位数
中心原子形成的配位键的数目叫它的配位数。
螯合物
一、螯合物和螯合剂
螯合物:多齿配体与单个中心离子(或原子)所形成的环状的配合物
螯合效应:由于螯合物的形成而使配合物具有稳定性大大加的作用。
螯合环一般为五元环和六元环。
两个配原子之间一般相隔2~3个其它原子。
形成的螯环的数目越多,
增大。
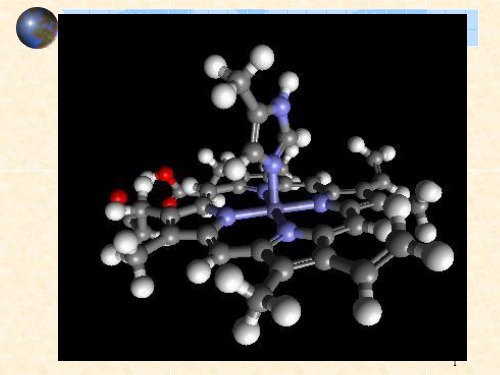
EDTA-Co(III)螯合物的立体结构图
能治疗铊中毒的蓝药水:二、螯合物的应用
人体必须的微量元素Fe、Zn、、I、Co、Se、Mn、Mo等都以配合物形式存在于体内,其中金属离子为中心原子,生物大分子(蛋白质、核酸等)为配体。
有些微量元素是酶的关键成分,大约1/3的酶是。
