保护基团方法大全
各种官能团保护基(全)

• 乙酰基保护基团的水解活性:氯乙酰酯的水解速度是乙酰酯的760倍;
二氯乙酰酯的水解速度是乙酰酯的16000倍;三氯乙酰酯的水解速
度是乙酰酯的1000000倍。
35
碳酸酯类
Boc
36
Cbz
37
二、酚羟基的保护
• 酚羟基易氧化 • 酚羟基(pKa = 10)的酸性强于烷基醇(pKa = 15)
93
➢ 乙酰胺
乙酰氯、卤代乙酸酐、以酸酐、乙酸苯酯等
酸、碱均能脱除保护
94
2.氨基甲酸酯类保护法
• 由氨基与氯代甲酸酯、重氮甲酸酯或各类碳酸酯反应制备
• 脱除方法:催化氢解(Cbz)、酸性水溶液(Boc)、 碱性消除(Fmoc、Teoc、Troc)、金属参与 (Alloc)
95
叔丁氧甲酰基 (Boc)
保护基
4
常用的保护基团
➢ 硅烷类
• TMS、TES、TBDMS、TBDPS,DIPS、DPS、TIPDS • 保护羟基、羧基、氨基(不常用)
• F-脱保护
➢ 缩醛类
• 保护羟基、羰基
➢ 酯类
• 保护羟基、羧基的常用方法
➢ 酰胺类
• 保护氨基
5
常用的脱保护基方法
➢ 酸脱除保护
质子酸、Lewis酸
➢ 碱脱除保护
63
1,1,3,3-四异丙基二硅氧醚
64
四、羰基的保护
• 醛、酮、酸、酯和酰胺
• 具有良好的亲电性
• 反应活性:醛(脂肪醛>芳香醛)>支链酮和环己酮>环戊酮>α,β不 饱和酮或α,α二取代酮>>芳香酮
• 缩醛:O,O-缩醛、S,S-缩醛、O,S-缩醛、O,N-缩醛
第五章保护基团

锂化合物的全部反应。反应完毕,l,3-二噻环己烷化合物可在
高汞离子存在下用酸水解,变为羰基化合物。
43
例3 合成
44
例4 合成
45
例5 合成
46
5.5 羧基常用的保护
形成羧酸酯的形式被保护,
常用甲酯、乙酯、叔丁酯或苄酯。
叔丁酯用酸除去,苄酯用氢解法除去。 还可用酰胺和酰肼来保护羧基 。
甲酯和乙酯可以用羧酸直接与甲醇或乙醇发生酯化反应制得,又 可以被碱水解。 叔丁酯可由羧酸先变为酰氯,再与叔丁醇作用,或者通过羧酸与 异丁烯直接作用而得。它不能氢解,在通常条件下也不被氨解及 碱催化水解 。 苯甲酯可由羧酸与苯甲基卤在碱性条件下反应而得。它除了可在 强酸性或碱性条件下水解,还可以被氢解 。
2-叔丁氧羰基氧亚胺基苯乙腈
N O O N
23
O
NH2 COOH
Boc 2O NaOH, t -BuOH, H 2 O 78%
NH2.HCl HO COOMe
Boc2 O Et3 N 95% HO
NHB
C
H N Boc 2O HN O DMAP, Et N
24
B
N Boc
N
常用脱保护剂:三氟乙酸/CH2Cl2、HF/H2O
25
2、苄氧羰基(Cbz或Z) • 常用保护试剂:苄氧甲酰氯(CbzCl) • 常用脱保护剂:催化氢解、锂氨还原
26
27
3、 9-芴甲氧基羰基(Fmoc):常用于多肽合成 常用保护试剂:Fmoc-Cl(9-fluorenylmethoxycarbonyl-Cl) 常用脱保护剂:NH3, Et2NH(DEA), 哌啶(六氢吡啶) ,吗啡啉
11
5.1.3 生成烷基醚保护基
基团的保护

12.4 基团的保护(P209)保护基应满足下列3点要求(李209):(1) 保护基在温和条件下容易引入所要保护的分子。
(2) 保护基与被保护基形成的结构能够经受住保护阶段所发生的反应的条件,而不起反应。
(3) 保护基易于在温和条件下除去,即可以在不损及分子其余部分的条件下除去,而且对反应物分子不起其他作用(如不会因空间效应而引起立体结构的变化)。
一、羟基的保护醇与酚都容易被氧化、烷基化和酰基化(酚羟基使苯环易于氧化)。
但有不同,仲醇和叔醇常易脱水,有时要加以阻止。
保护醇类ROH 的方法一般是将羟基制成醚类ROR ′或酯类ROCOR ′,前者对氧化剂或还原剂都有相当的稳定性。
这是羟基保护的主要方法。
(一)形成甲醚类(讲)先用碱脱去羟基的质子,再与合成子+CH 3作用,如使用试剂NaH /(CH 3)2SO 4、CH 3I/OH -或(CH 3)2SO 4/OH -。
ROH ROCH 3333对RMgX 、LiAlH 4、CrO 3、碱稳定。
C 6H 5OH C 6H 5OCH 3C 6H 5OH CH 3I 或(CH 3)2SO 4-HI对RMgX 、LiAlH 4、CrO 3、碱稳定。
(二)形成混合型缩醛⑴ 四氢吡喃醚ROTHP (Tetrahydropyranyl )(讲)制备时,使用二氢吡喃与醇类在酸催化下进行加成作用。
对RMgX 、LiAlH 4、CrO 3、碱、金属氢化物稳定。
(前讲义)ROH O ,TsOH,Et O ROH +2欲恢复到醇类,则在酸性水溶液中进行水解,即可脱去保护基团。
(三)形成乙酸酯类(ROCOCH 3)用乙酐在吡啶中将一级、二级醇转变为乙酸酯,吡啶是用来吸收生成的乙酸(巨167):ROH ROCOCH 3K 2CO 3溶液(CH 3CO)2O 吡啶-CH 3OH ROH二、二醇的保护三、羰基的保护 最重要的是形成缩醛和缩酮。
缩醛和缩酮的保护基不与碱、氧化试剂或亲核试剂(如H -,RMgBr)作用,而通常以酸水解回复到羰基。
有机化学-保护基团

MeO MeOOC HO COOMe OH
OMe MeOOC COOMe O O
TsOH
LiAlH4
HOH2C O O
CH2OH
OCH3 OH TsOH O O
OH
糖类,甘油
H2C OH HC OH H2C OH
CH3COCH3 HCl
H2C O HC O H2C OH
脱保护: 稀酸水溶液,rt; 或加热。
O (CH3CO)2O, Py
O
HO
AcO
O (CH3CO)2O, Py HO AcO
O
苯甲酸酯类似乙酸酯可用于羟基的保护。适用于有机 金属试剂(如有机铜)、催化氢化、硼氢化物还原、路 易斯酸、氧化反应等时的羟基保护。就水解而言,苯 甲酸酯作为保护基比乙酸酯稳定。苯甲酸酯的裂解去 保护同样一般采用碱性水解或醇解,有时也可以用锂 铝氢还原法去保护。
苯甲酸酯的裂解去保护同样一般采用碱性水解或醇解有时也可以用锂铝氢还原法去保护27三形成缩酮上述的甲醚苄醚叔丁基醚等简单醚保护基在上保护基或去保护时常常需要酸性条件这对于一些含有对酸敏感的基团的化合物显然是不合适的
第七章 保护基团 (protective groups)
参考文献: T. W. Greene, Protective groups in organic synthesis, third edition
ROCH2Ph
优先保护伯醇
Br
BnBr, NaH, DMF -70-40oC
Br
H OH
OH
97%
H OH
OCH2Ph
4.形成硅醚 硅醚保护:Me3Si(TMS), Et3Si(TES), tBuMe2Si(TBDMS), t-BuPh2Si(TBDPS), i-Pr3Si(TIPS).
有机合成课件保护基团

要点二
详细描述
在有机合成中,酮是一种常见的反应物和产物,但它的羰 基容易受到氧化和还原等反应的影响。为了保护酮的羰基 ,可以使用各种保护基团,如甲氧羰基、乙氧羰基、丙氧 羰基等。这些保护基团可以与酮形成稳定的化学键,从而 避免酮参与不必要的反应。
THANKS
谢谢
详细描述
在有机合成中,羧酸是一种常见的反应物和产物,但它的羧基容易受到脱羧和氧化等反应的影响。为了保护羧酸 ,可以使用各种保护基团,如甲酯、乙酯、丙酯等。这些保护基团可以与羧酸形成稳定的化学键,从而避免羧酸 参与不必要的反应。
醛基保护基团的应用实例
总结词
醛基保护基团能够保护醛免受氧化和还原等反应的影响。
保护。
硅氧基
如三甲基硅氧基,常用 于醇的保护,易于脱去
。
磷酸酯基
如磷酸三乙酯、磷酸三 丁酯等,适用于醇的保
护,并可耐强酸。
氨基保护基团
乙酰基
常用于伯胺的保护。
苯磺酰基
适用于仲胺和叔胺的保护,可 在酸性条件下脱去。
甲磺酰基
适用于仲胺的保护,可在酸性 条件下脱去。
丙酮肟基
适用于伯胺的保护,可在酸性 条件下脱去。
羧基保护基团
甲酯基
常用于羧酸的保护,可在碱性条件下脱去。
苯甲酯基
适用于不活泼羧酸的保护,可在碱性条件下 脱去。
乙酯基
适用于羧酸的保护,可在碱性条件下脱去。
氨基甲酸酯基
适用于羧酸的保护,可在酸性或碱性条件下 脱去。
醛基保护基团
烯丙基
常用于醛的保护。
苯甲酰基
适用于醛的保护,可在酸性条件下脱 去。
乙酰基
亲核加成反应
在形成氮-保护基团时,通常发 生亲核加成反应,即试剂进攻有 机物中的硝基、磺酸酯等基团,
举例说明保护基团的作用
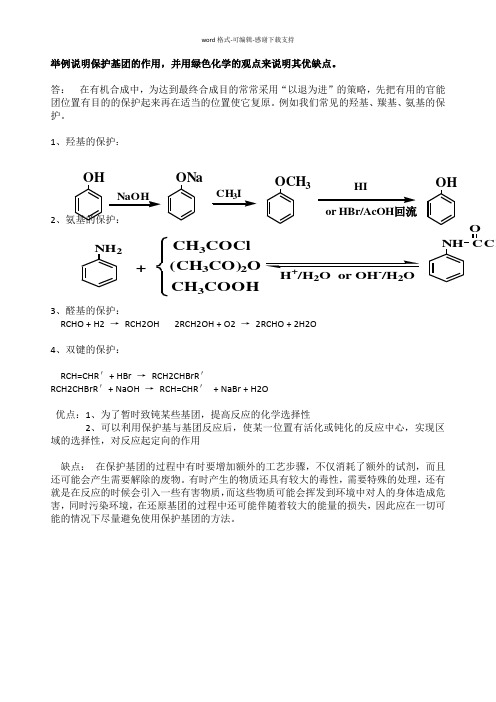
word 格式-可编辑-感谢下载支持
举例说明保护基团的作用,并用绿色化学的观点来说明其优缺点。
答: 在有机合成中,为达到最终合成目的常常采用“以退为进”的策略,先把有用的官能团位置有目的的保护起来再在适当的位置使它复原。
例如我们常见的羟基、羰基、氨基的保护。
1、羟基的保护:
2
、氨基的保护:
3、醛基的保护:
RCHO + H2 →
RCH2OH 2RCH2OH + O2 → 2RCHO + 2H2O
4、双键的保护:
RCH=CHR '+ HBr → RCH2CHBrR ' RCH2CHBrR '+ NaOH → RCH=CHR ' + NaBr + H2O
优点:1、为了暂时致钝某些基团,提高反应的化学选择性
2、可以利用保护基与基团反应后,使某一位置有活化或钝化的反应中心,实现区域的选择性,对反应起定向的作用
缺点: 在保护基团的过程中有时要增加额外的工艺步骤,不仅消耗了额外的试剂,而且还可能会产生需要解除的废物。
有时产生的物质还具有较大的毒性,需要特殊的处理,还有就是在反应的时候会引入一些有害物质,而这些物质可能会挥发到环境中对人的身体造成危害,同时污染环境,在还原基团的过程中还可能伴随着较大的能量的损失,因此应在一切可能的情况下尽量避免使用保护基团的方法。
NH 2+CH 3COCl (CH 3CO)2O CH 3COOH NH CCH
O H /H 2O or OH /H 2O OH ONa OCH 3HI or HBr/AcOH 回流OH。
保护基团方法大全

醛酮的保护
O,O-acetals: 1,3-dioxalane (5-number ring) and 1,3-dioxane (6-number ring) Catalyst: p-TsOH, CSA, PPTs
MTM AgNO3/2,6-dimethylpyridine; HgCl2/CaCO3 MEM ZnBr2/CH2Cl2;HBr/THF;TiCl4/CH2Cl2; MeBBr/CH2Cl2 BOM Na/NH3/EtOH, H2/Pd(OH)2/C;Raney-Ni/EtOH;BF3/PhSH/CH2Cl2 SEM HCl/MeOH; Lewis acid; THP(四氢吡喃) tetrahydropyrane ether reagents: DHP(3,4-dihydro-2H-pyran) cleavage: HOAc/THF/H2O (4:2:1)
Cleavage
OTBDPS OH OMe
OTBS
HOAc-THF-H2O 3:1:1
OH
OTBDPS OH OMe
87%
OH OH
Marshell, J. A.; Sedrani, R. J. Org. Chem., 1991, 56, 5496.
Cleavage
TBSO
O OH
OPiv OTBS
t-BuPh2Si (tert-butyldiphenylsilyl, TBDPS)
酸水解相对稳定性: TMS(1) < TES(64) < TBDMS(20,000) < TIPS(700,000) < TBDPS (5,000,000)
基团保护方法

基团保护方法
以下是 8 条关于基团保护方法的内容:
1. 嘿,你知道吗,有一种基团保护方法叫酯化保护!就像给基团穿上一件坚固的盔甲。
比如在合成复杂分子时,为了不让某个基团捣乱,我们就可以把它变成酯呀。
这多神奇!
2. 哇塞,还有醚化保护呢!这就好比给基团罩上一个保护罩。
举个例子,在一些反应里,我们把基团醚化,让它乖乖待着,不影响我们想要的反应进行。
3. 听我说呀,酰胺化保护也很厉害哟!就如同给基团找了个安全的小窝。
比如说,特定情况下,把基团变成酰胺,它就安稳啦。
4. 嘿呀,你晓得不,硅烷化保护超有用的呀!它简直是基团的超级保镖。
就像在某些精细合成中,用硅烷化给基团提供强大保护。
5. 哇哦,苄基化保护可是不能小瞧的呢!这就好像给基团围了一道篱笆。
想想看,特定反应需要的时候,苄基化保护能发挥大作用呢。
6. 咦,酰基化保护也很棒呀!它像是给基团戴上了一顶特别的帽子。
比如在某些合成路线里,酰基化保护让反应顺顺利利的。
7. 嘿,还有烷氧基甲基化保护呢!这不就是给基团安排了一个专属房间嘛。
在一些复杂反应体系中,这种保护方法太实用啦。
8. 哎呀呀,卤代保护也不容忽视啊!简直是基团的秘密武器。
像在一些情况下,卤代一下,起到的保护作用可大着呢!总之,基团保护方法多种多样,各有各的神奇之处,我们可得好好掌握呀!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Protecting Groups in Organic Synthesis选择保护基的原则:(1) 保护基的供应来源,包括经济程度。
(2) 保护基团必须能容易进行保护,且保护效率高。
(3) 保护基的引入对化合物的结构论证不致增加过量的复杂性, 如保护中忌讳产生新的手性中心。
(4) 保护以后的化合物必须承受的起以后进行的反应和后处理过 程。
(5) 保护基以后的化合物对分离、纯化、各种层析技术要稳定。
(6) 保护基团在高度专一的条件下能选择性、高效率地被除去。
(7) 去保护过程的副产物和产物能容易被分离。
呼之即来, 呼之即来,挥之即去。
挥之即去。
切莫请神容易, 切莫请神容易,送神难。
送神难。
羟基的保护基1). 酯类保护基 t-BuCO (Piv); PhCO; MeCO; ClCH2CO et al.OH HO OH OHPivCl (1eq) Py-CH2Cl2 0-25 oCHOOO90% Nicolaou, K. C.; Webber, S. E. Synthesis, 1986, 453酯类保护基的除去(cleavage) 碱性条件下水解, 水解能力: t-BuCO(Piv) < PhCO < MeCO < ClCH2CO 常用的碱:K2CO3, NH3, NH2NH2, Et3N, i-Pr2NEt et al 去除Piv一般用较强的强碱体系,如 KOH/H2O, LiAlH4, DIBAL, KBHEt3OTBDMS TBDMSO O O OTBDMSDIBAL(2.5eq) CH2Cl2, -78 oCTBDMSOOH95% Nicolaou, K. C.; Webber, S. E. Synthesis, 1986, 453ClCH2CO的去除可以用硫脲,氨/甲醇,苯,吡啶水溶液, NH2CH2CH2SH, NH2CH2CH2NH2, PhNHCH2CH2NH2 等除去。
O O O O O OBnClOBnOBn HOOBnOBnAcOOBnOBnNH2NH2 (15eq) HOAc-HOMe rt, 12 hAcO OOOBnOBnAcHNAcHNO OBn74% Cook, A. F.; Maichuk, D. T. J. Org. Chem., 1970, 35, 1940.OR AcO O RO O O O OR Ph O O O O H2NHN S SH HO AcOOH O O O O O OH Ph O O ODioxane, i-Pr2NEtAcOAcOR = ClCH2CO40%Smith, A.B.; Hale, K. J.; Vaccaro, H. A.; Rivero, R. A. J. Am. Chem. Soc, 1991, 113, 2112.2). 硅醚保护基 硅醚保护基主要有: Me3Si (trimethylsilyl, TMS); (triethylsilyl, TES); Et3Si t-BuMe2Si (tert-butyldimethylsilyl, TBDMS or TBS) i-Pr3Si (triisopropylsilyl, TIPS) t-BuPh2Si (tert-butyldiphenylsilyl, TBDPS) 酸水解相对稳定性: TMS(1) < TES(64) < TBDMS(20,000) < TIPS(700,000) < TBDPS (5,000,000) 碱水解相对稳定性: TMS(1) < TES(50) < TBDMS = TBDPS (20,000) < TIPS(100,000) 硅醚保护基的除去: (F-Si 142 kcal/mol; O-Si 112 kcal/mol) 通常用 HF / CH3CN; TBAF / THF; HF.Py / CH3CNTMS ether: TMSCl or TMSOTf in pyridine, NEt3, I-Pr2NEt, imidazole, DBUOOHCO2Me COOBu-tO OTMS CO2MeMe3SiCl-Im 100 C, 90 min.oO O OH OTBSCOOBu-t O O O H OTBS100% Kerwin, S. M.; Paul, A. G.; Heathcock, C. H. J. Org. Chem., 1987, 52, 1686TES ether:TESCl/Imid. DMAP; TESOTf / Py. or 2,6-dimethylpyridineOH O H OTES OTESOTf (1.1eq) Py, MeCN, o -50 C, 10 min. 79%HHeathcook, C. H.; Young, S. D.; Hagen, J. P.; Pilli, R.; Badertscher, U. J. Org. Chem., 1985, 50, 2095TBDMS ether: TBDMSCl / imid. / DMF; TBDMSOTf / 2,6-dimethylpyridineOH OBz OBMP O OTBDMSOTf 2,6-di-tert-buylepyridine CH2Cl2, rt, 24 hOTBS OBz OBMP O OHikota, M.; Tone, H., Horita, K.; Yonemitsu, O. J. Org. Chem., 1990, 55, 7.OH OHOH OHDMF, rt,80%Nicolaou, K. C.; Pavia, M. R.; Seitz, S. P. J. Am. Chem. Soc., 1981, 103, 1224.imidazole(2.5 eq)DMF, rt, 48 hJ. Chem. Soc. Perkin. Trans. I , 1991, 1543.87%Marshell, J. A.; Sedrani, R. J. Org. Chem., 1991, 56, 5496.87%, 1989, 111, 2967.85%2MeOO Nakata, T.; Fukui, M.; Oishi, T. Tetrahedron Lett., 1988, 29, 2219.90%OHOTBSCollington, E. W.; Finch, H. Smith, I. J. Tetrahedron Lett., 1985, 26, 681.83%OFK-506, 73%Nakatsuka, M.; Ragan, J. A.; Sammakia, T.; Smith, D. B.; Uehling, D. E.; Schreiber, S. L.J. Am. Chem. Soc., 1990, 112, 5583.reagent: PMBCl; p-MeOC 6H 4CH 2O-C(=NH)CCl 3 cleavage: DDQ, CANTr (三苯甲基醚) reagent: TrCl/Py/DMAP; TrOTf/2,6-dimethylpyridineclaevage: HCO 2H-H 2O; HCO 2H-tert -BuOH; HCl/MeCN; Na/NH 3tert -butyl (叔丁基醚) reagent: isopropene/CH 2Cl 2; t -BuO-C(=NH)CCl 3cleavage: HCO 2H; CF 3CO 2H; HBr-HOAc, FeCl 3; TiCl 4; TMSIallyl (烯丙基醚) reagent: Allyl bromidecleavage: t -BuOK/DMSO/NaOHcleavage : MOM HCl/THF/H 2O(1:2:1); Lewis acid: Me 3SiBr/CH 2Cl 2; Me 2BBr/CH 2Cl 2MTM AgNO 3/2,6-dimethylpyridine; HgCl 2/CaCO 3MEM ZnBr 2/CH 2Cl 2;HBr/THF;TiCl 4/CH 2Cl 2; MeBBr/CH 2Cl 2BOM Na/NH 3/EtOH, H 2/Pd(OH)2/C;Raney-Ni/EtOH;BF 3/PhSH/CH 2Cl 2 SEM HCl/MeOH; Lewis acid;THP(四氢吡喃) tetrahydropyrane etherreagents : DHP(3,4-dihydro-2H -pyran)cleavage : HOAc/THF/H 2O (4:2:1)Silylene derivatives(硅烯衍生物硅烯衍生物)DTBS (d i-tert-butylsilylene)reagent: t-Bu 2SiCl 2/Et 3N/HOBT/MeCN; (HOBT 1-hydroxybenzotriazole )t-Bu 2Si(OTf)2/2,6-dimethylpyridine/CH 2Cl 2Cleavage: HF-Py/THF-Pyridine, rtHO(CH 2)3OHp-TsOH91%Okawara, H.; Nakai, H.; Ohno, M. Tetrahedron lett., 1982, 23, 1087.J. A. J. Am. Chem. Soc., 1990, 112, 1607.HOCH 2CH 2OH TMSCl, rt, 16 hCO 2MeOOOO+ (TMS)2OChan, T. H.; Schwerdtfeger, A. E. J. Org. Chem., 1991, 56, 3294.76%Gerspacher, M.; Rapoport, H. J. Org. Chem., 1991, 56, 3700Me2Me2H2MeKOH (0.95 eq.)MeOH / H 2O95%Tetrahedron Lett., 1991, 22, 2679.Valerio, R. M.; Alewood, P. F.; Johns, R. B. Synthesis , 1988, 786.HOAc-i -PrOH-H 2OH2Me100%J. Org. Chem., 1990, 55, 3068.4:4:1100C, 15 hTsE (2-tosylethyl) Bn (benzyl)allyl (allyl) ester78-87%Org. Synthesis , 1988, Coll. Vol. VI, 418.2H BocO NPhCN80-83%Itoh, M.; Hagiwara, D.; Kamiya, T. Bull. Chem. Soc. Jpn ., 1977, 50, 718.rt, 3 hEt 3N, H 2O,dioxaneOO2 TFA100%Yamashiro, D.; Blake, J.; Li, C. H. J. Am. Chem. Soc., 1972, 94, 2855.NCOOMe CbzCOOMe 100%Sakaitani, M., Ohfune, Y. J. Org. Chem ., 1990, 55, 870.Et 3N, rt, 30 minEt 3SiH, PdCl 2Bergman, M.; Zervas, L. Ber. Deutsch. Chem. Ges., 1932, 65, 1192.N H 91%Hoogerhout, P.; Guis, C. P.; Erkelens, C.; van Boom, J. H.Recl. Trav. Chim. Pays-Bas , 1985, 104, 54.dioxane-H 2O, 0 o C, 4 h, rt. 8 h97%Schultheiss-Reimann, P.; Kunz, H. Angew. Chem. Int. Ed. Engl., 1983, 22, 62.CODcyclooctadiene CODcyclooctadiene Cp cyclopentadieneO SO 3H CSA camphorsulfonic acidCl NC DDQ 2,3-dichloro-5,6-dicyano -1,4-benzoquinone N N OC 2H 5O O C 2H 5O DEAD diethyl azodicarboxylate NIS N -iodosuccinimide O N N O O O DIAD diisopropyl azodicarboxylateoxideClCrO 3N O 3S PPTs pyridinium p -toluenesulfonate SO 3H PTS p -toluenesulfonic acid N Py pyridine TBAF tetrabutylammonium florideN F3ClS OCF 3DIBALH diisobutylaluminium hydride AlH DMAP4-N,N -dimethylaminopyridine N N DMF N,N -dimethylformamide DMPU N,N'-dimethylpropyleneurea 1,3-dimethyl-3,4,5,6-tetrahydro -2(1H)-pyrimidinoneN Im imidazol-1-yl LDA lithium diisopropylamide N NCS N -chlorosuccinimide N O Cl TFA trifluoroacetic acidO OH F F FF TIPSCl triisopropylsilyl chloride TIPSOTf triisopropylsilyl triflate Si O S O O F F F TMSBr trimethylsilyl bromide Si Br TMSCl trimethylsilyl chlorideSi ClO RuO 4Tr trityl triphenylmethyl Ph Bnbenzyl BOM benzyloxymethyl Cbz benzyloxycarbonyl O O Fmoc 9-fluorenylmethoxycarbonyl O Troc 2,2,2-trichloroethoxycarbonyl O O Cl Cl Cl辛烷99壬烷8。
