酸碱平衡PPT课件
合集下载
酸碱平衡专业知识讲解培训课件

滤过面积: 正常成年人为1.5m2。病理情况下,活动的肾 小球数量减少,滤过面积减少,出现少尿、无尿现象。
滤过膜的通透性
机械屏障(分子筛): 分子量〉6900的,不能滤过(血细
胞、
蛋白质)
静电屏障: 膜表面带负电,所以带负电的物质不易滤过。
(蛋白质)
病理情况下,分子筛和静电屏障效应被破坏,导致血浆蛋
酸碱平衡专业知识讲解
17
(四)运动对肾脏泌尿机能的影响
1.运动对尿量及其成份的影响 尿量:
运动时,血液重新分配→肾血流量减少,滤过率下降 →尿量减少
运动时,大量出汗→血浆渗透压升高→刺激下丘脑释放抗利尿 激素→肾小管、集合管重吸收作用↑ →尿↓ 尿的成分:
剧烈运动时,机体产生酸性代谢产物,尿中pH降低。
(一)肾脏的排泄功能
排泄: 指机体将代谢产物、多余的水分和盐类以
酸碱平衡专业知识讲解
6
人体主要排泄途径及排泄物
排泄器官 呼吸器官
排泄物 CO2.水、挥发性药物等
消化道
钙、镁、铁、磷等无机盐, 胆色素,毒物等
皮肤及汗腺
水、盐类、少量尿素等
酸碱平衡专业知识讲解
7
肾的功能解剖
肾 肾小球
小 体 肾小囊
肾 单 位
近球小管 肾
小
近曲小管 袢降粗段
管 髓袢细段
袢降细段
袢升细段
远球小管 袢升粗段
远曲小管
酸碱平衡专业知识讲解
8
尿的生成: 肾小球的滤过 肾小管与集合管的重吸收 肾小管与集合管的分泌或排泄
1.肾小球的滤过作用
指血液流过肾小球 毛细血管时, 除血细 胞和血浆中大分子物 质外, 其余的水分和 小分子物质通过滤过 膜进入肾小囊形成原 尿的过程。
酸碱平衡 ppt课件

经抢救后病人血压逐渐上升至平稳。 心率仍然130-150次/分 呼吸急促 四肢厥冷 意思淡漠,烦躁。
讨论
此时病人可能存在的酸碱平衡失调类型?
代谢性酸中毒
是指细胞外液H+增加和(或)HCO3- 丢失而引起的以血浆HCO3-减少为 特征的酸碱平衡紊乱。
(一)原因和机制 1.HCO3-直接丢失过多 经胃肠道:严重腹泻,肠道瘘管或肠道引流 经肾: Ⅱ型肾小管酸中毒 大量使用碳酸酐酶(CA )抑制剂
肺的调节作用 效能大 几分钟开始,30分钟达最高峰 不能缓冲固定酸
细胞内液 强于细胞外液 2–4小时后开始,引起血钾改变
肾脏的调节作用 发挥较慢 12–24小时后开始 效率高,作用持久
代谢性 酸中毒
单纯性酸 碱平衡紊乱
代谢性 碱中毒
呼吸性 酸中毒
病例1
男性患者,35岁,车祸致右股血管损伤,垂危入院。 入院时查体:意思丧失,血压不能监测。 诊断:?
细胞内碱中毒,尿液呈碱性
予补液,大量输血等抗休克治疗、应用碳酸氢钠纠正酸 中毒后,病人生命体征逐渐稳定。
HCO3-
:(正常值-测得值)×体重×0.4 注意要点:慢 半量
此时容易出现的酸碱平衡失调类型是?
代谢性碱中毒
代谢性碱中毒
是指细胞外液碱增多或H+丢失而引起的以 血浆HCO3-增多为特征的酸碱平衡紊乱类型。
1.呼吸中枢抑制
4.胸廓病变
2.呼吸道阻塞
5.肺部疾患
3.呼吸肌麻痹
6.CO2吸入过多
(五) 防治的病理生理基础 1.病因学治疗 去除呼吸道梗阻及使用呼吸中枢兴奋剂。 2.发病学治疗 要逐步改善通气功能,避免通气过度。 慎用碱性药物。
四、呼吸性碱中毒
第四章酸碱平衡和酸碱平衡紊乱PPT课件

1、血液及细胞内液的缓冲作用
(1)血液的缓冲作用 H+ + HCO3- → H2CO3 → H2O + CO2↑
H+ + Buf - → HBuf (2)细胞内液的缓冲作用
H+
H++Buf- HBuf
HPO42-
Buf - Pr -
K+
K+
Hb-
.
25
2、肺的代偿调节作用 呼吸加深加快,肺的通量增加。几分钟即可出现。
.
17
AB(Acutual Bicarbonate) AB是隔绝空气的血液标本,在实际PaCO2和 血氧饱和度条件下测得血浆HCO3-的含量。 AB受呼吸和代谢两方面因素的影响(见表4-1)
正常:AB=SB AB的意义在于:
①AB与SB差值反映了呼吸性因素的影响
呼吸 ·代谢-代谢=呼吸因素
如果AB>SB 呼吸性酸中毒或代偿后代谢性碱中毒ABBiblioteka SB 呼吸性碱中毒或代偿后代谢性酸中毒
②两者数值等同升降,反映代谢性因素指标
AB↓=SB↓ 代谢性酸中毒
AB↑=SB↑ 代谢性碱.中毒
18
四、BB(Buffer Basc)
BB是指血液中一切有缓冲作用的负离子碱的总和。 BB=[HCO3-]+[Hb-]+[Pr-]··· 正常值:45~52mmol/L,均值:48mmol/L BB 反映酸碱平衡代谢性因素指标(见表4-1) BB↓ 代谢性酸中毒 BB↑ 代谢性碱中毒 在呼吸性碱中毒或呼吸性酸中毒时,经肾脏代偿后, BB也可分别降低或升高。
.
10
管周毛 细血管 近曲小管上皮细胞
Na+
Na+- K+
K+ ATP 酶
H+ NH4+
H2CO3
(1)血液的缓冲作用 H+ + HCO3- → H2CO3 → H2O + CO2↑
H+ + Buf - → HBuf (2)细胞内液的缓冲作用
H+
H++Buf- HBuf
HPO42-
Buf - Pr -
K+
K+
Hb-
.
25
2、肺的代偿调节作用 呼吸加深加快,肺的通量增加。几分钟即可出现。
.
17
AB(Acutual Bicarbonate) AB是隔绝空气的血液标本,在实际PaCO2和 血氧饱和度条件下测得血浆HCO3-的含量。 AB受呼吸和代谢两方面因素的影响(见表4-1)
正常:AB=SB AB的意义在于:
①AB与SB差值反映了呼吸性因素的影响
呼吸 ·代谢-代谢=呼吸因素
如果AB>SB 呼吸性酸中毒或代偿后代谢性碱中毒ABBiblioteka SB 呼吸性碱中毒或代偿后代谢性酸中毒
②两者数值等同升降,反映代谢性因素指标
AB↓=SB↓ 代谢性酸中毒
AB↑=SB↑ 代谢性碱.中毒
18
四、BB(Buffer Basc)
BB是指血液中一切有缓冲作用的负离子碱的总和。 BB=[HCO3-]+[Hb-]+[Pr-]··· 正常值:45~52mmol/L,均值:48mmol/L BB 反映酸碱平衡代谢性因素指标(见表4-1) BB↓ 代谢性酸中毒 BB↑ 代谢性碱中毒 在呼吸性碱中毒或呼吸性酸中毒时,经肾脏代偿后, BB也可分别降低或升高。
.
10
管周毛 细血管 近曲小管上皮细胞
Na+
Na+- K+
K+ ATP 酶
H+ NH4+
H2CO3
酸碱平衡和酸碱平衡紊乱课件.pptx
第26页/共93页
标准碳酸氢盐和实际碳酸氢盐
标准碳酸氢盐 (standard bicarbonate,SB)
正常值:22-27mmol/L(24) 意义: ✓反映代谢性酸碱紊乱
✓呼吸性酸碱紊乱后的肾代偿
标准条件:PaCO2为40mmHg,温度38,血氧饱和度100%。
2024/9/30
第27页/共93页
代酸的分类
AG增高型代酸(血氯正常)
常 除了含氯以外的任何固定酸的血浆浓度增大时的代酸。
见 HCO3-缓冲固定酸H+而消耗,其酸根增高。 原 见于:乳酸,酮症酸,水杨酸中毒。
因
硫酸,磷酸排泄障碍。
AAGG
Na+ HHCCOO33-Cl -
2024/9/30
AG正常型代酸(高血氯)
HCO3 -浓度降低,同时伴有 Cl-浓度
2024/9/30
第18页/共93页
酸碱平衡紊乱
(acid-base disturbance)
概念:病理情况下可引起酸碱超负荷或调 节机制障碍,导致体内酸碱度稳态性破坏, 形成酸中毒或碱中毒,称酸碱平衡紊乱。
2024/9/30
第19页/共93页
酸碱平衡紊乱的类型
酸中毒 pH= 碱中毒
HCO3H2CO3
食物在体内转化或经氧化后生成
第3页/共93页
H+
H ++HCO3-
CA
H2CO3
CO2 + H2O
CA: 碳酸酐酶,------肾小管上皮细胞;红细胞; 肺泡上皮细胞;胃粘膜上皮细胞
CO2:成人安静状态下每天可产生300-400L, 可释放15mol左右H +。 碳酸:体内酸性物质的主要来源。
成人每日固定酸释放出H+达50—100mmol
标准碳酸氢盐和实际碳酸氢盐
标准碳酸氢盐 (standard bicarbonate,SB)
正常值:22-27mmol/L(24) 意义: ✓反映代谢性酸碱紊乱
✓呼吸性酸碱紊乱后的肾代偿
标准条件:PaCO2为40mmHg,温度38,血氧饱和度100%。
2024/9/30
第27页/共93页
代酸的分类
AG增高型代酸(血氯正常)
常 除了含氯以外的任何固定酸的血浆浓度增大时的代酸。
见 HCO3-缓冲固定酸H+而消耗,其酸根增高。 原 见于:乳酸,酮症酸,水杨酸中毒。
因
硫酸,磷酸排泄障碍。
AAGG
Na+ HHCCOO33-Cl -
2024/9/30
AG正常型代酸(高血氯)
HCO3 -浓度降低,同时伴有 Cl-浓度
2024/9/30
第18页/共93页
酸碱平衡紊乱
(acid-base disturbance)
概念:病理情况下可引起酸碱超负荷或调 节机制障碍,导致体内酸碱度稳态性破坏, 形成酸中毒或碱中毒,称酸碱平衡紊乱。
2024/9/30
第19页/共93页
酸碱平衡紊乱的类型
酸中毒 pH= 碱中毒
HCO3H2CO3
食物在体内转化或经氧化后生成
第3页/共93页
H+
H ++HCO3-
CA
H2CO3
CO2 + H2O
CA: 碳酸酐酶,------肾小管上皮细胞;红细胞; 肺泡上皮细胞;胃粘膜上皮细胞
CO2:成人安静状态下每天可产生300-400L, 可释放15mol左右H +。 碳酸:体内酸性物质的主要来源。
成人每日固定酸释放出H+达50—100mmol
酸碱平衡紊乱(本科)PPT课件

讨论点
糖尿病酮症酸中毒的发病机制、临床表现及治疗方法。
案例介绍与讨论
案例三
肾小管性酸中毒
患者情况
肾小管功能异常,导致H+排泄障碍,引发酸中 毒。
讨论点
肾小管性酸中毒的诊断依据、分型及治疗原则。
实践操作演示
操作一
动脉血气分析
步骤
采集动脉血样本,使用血气分析仪测定pH值、PaCO2、PaO2等指 标。
呼吸性碱中毒
由于CO2排出过多或吸入不足 ,导致血浆中H2CO3浓度降低
,体液pH升高。
02
酸碱平衡紊乱病因与发病 机制
酸性物质产生过多
01 组织缺血缺氧:导致无氧糖酵解增强,产生大量 乳酸。
02 糖尿病酮症酸中毒:因胰岛素缺乏,脂肪分解增 加,产生大量酮体。
03 高热、抽搐、剧烈运动:使酸性物质产生增多。
特点
常见原因
血浆HCO3-原发性降低,pH降低。
糖尿病酮症酸中毒、乳酸酸中毒、 尿毒症等。
代谢性碱中毒
定义
由于体内碱性物质产生过多或酸性物质丢失 过多,引起体内HCO3-增多,进而产生一 系列临床表现。
特点
血浆HCO3-原发性增高,pH增高。
常见原因
呕吐、长期胃吸引术、幽门梗阻、持续胃肠 减压等。
注意事项
确保样本采集规范,避免误差;正确解读血气分析结果。
实践操作演示
操作二:补液治疗
步骤:根据酸碱平衡紊乱类型及程度,选择合适的补液方案,如生理盐水、 碳酸氢钠等。
注意事项:遵循个体化治疗原则,根据患者病情调整补液速度和量;密切 监测患者生命体征及酸碱平衡指标变化。
实践操作演示
01
操作三:药物治疗
酸碱平衡紊乱(本 科)ppt课件
糖尿病酮症酸中毒的发病机制、临床表现及治疗方法。
案例介绍与讨论
案例三
肾小管性酸中毒
患者情况
肾小管功能异常,导致H+排泄障碍,引发酸中 毒。
讨论点
肾小管性酸中毒的诊断依据、分型及治疗原则。
实践操作演示
操作一
动脉血气分析
步骤
采集动脉血样本,使用血气分析仪测定pH值、PaCO2、PaO2等指 标。
呼吸性碱中毒
由于CO2排出过多或吸入不足 ,导致血浆中H2CO3浓度降低
,体液pH升高。
02
酸碱平衡紊乱病因与发病 机制
酸性物质产生过多
01 组织缺血缺氧:导致无氧糖酵解增强,产生大量 乳酸。
02 糖尿病酮症酸中毒:因胰岛素缺乏,脂肪分解增 加,产生大量酮体。
03 高热、抽搐、剧烈运动:使酸性物质产生增多。
特点
常见原因
血浆HCO3-原发性降低,pH降低。
糖尿病酮症酸中毒、乳酸酸中毒、 尿毒症等。
代谢性碱中毒
定义
由于体内碱性物质产生过多或酸性物质丢失 过多,引起体内HCO3-增多,进而产生一 系列临床表现。
特点
血浆HCO3-原发性增高,pH增高。
常见原因
呕吐、长期胃吸引术、幽门梗阻、持续胃肠 减压等。
注意事项
确保样本采集规范,避免误差;正确解读血气分析结果。
实践操作演示
操作二:补液治疗
步骤:根据酸碱平衡紊乱类型及程度,选择合适的补液方案,如生理盐水、 碳酸氢钠等。
注意事项:遵循个体化治疗原则,根据患者病情调整补液速度和量;密切 监测患者生命体征及酸碱平衡指标变化。
实践操作演示
01
操作三:药物治疗
酸碱平衡紊乱(本 科)ppt课件
酸碱平衡课件ppt.ppt

呼吸加深加快
CO2排出↑
㈢组织细胞的调节作用
K+ Na+
ClH+
H+
HCO3- K+
H+
H+
Na+
K+
Na+
组织细胞
㈣肾脏的调节
肾脏通过排酸(H+或固定酸)以及重吸 收碱(HCO3-)对酸碱平衡进行调节
近曲小管泌H+和对NaHCO3的重吸收 调
节 方
远曲小管泌H+和对NaHCO3的重吸收
式 近曲小管上皮细胞泌NH4+
实际碳酸氢盐(actual bicarbonate, AB)
隔绝空气的血标本在实际状态下测得的HCO3-含量
✓ 受呼吸和代谢两方面的影响
✓AB,SB 同时升高
代谢性碱中毒
✓AB,SB 同时降低
代谢性酸中毒
• AB> SB,CO2潴留
呼吸性酸中毒
• AB< SB,CO2排出过多 呼吸性碱中毒
㈣缓冲碱(buffer base, BB)
H2O
H+ + Buf -
H2CO3 HBuf
缓冲作用即刻发生,HCO3- ↑↑
细胞内外离子交换的缓冲作用
K+ H+
2-4小时起作用,易引起低钾血 症
肺的调节
H+↓ 外周化学感受器
呼吸中枢 抑制
呼吸频率幅度↓
CO2排出↓
pH↓
[HCO3-]↑ [H2CO3]↑
PaCO2 ↑
✓作用迅速,24小时达高峰 ✓代偿作用极限:PaCO2↑至55mmHg
近曲小管和集合管泌H+、重吸收HCO3-
毛细血管 K+
近曲小管上皮细胞 Na+
Na+H++ HCO3- H2CO3
CA
H2O+CO2
肾小管腔 集合管上皮细胞
无机化学-第五章酸碱平衡课件

H
2
PO
4
(aq)
+
H
2
O(l)
HPO
24
(aq)
+
H
3O
+
(aq)
Ka,2 (H3PO4 ) = 6.2 10-8
H
2
PO
4
(aq)
+
H
2
O
(l)
H3PO 4 (aq) + OH - (aq)
Kb,3 (PO34- ) =
Kw Ka,1(H3PO4 )
1.0 10-14 = 6.7 10-3
= 1.5 10-12
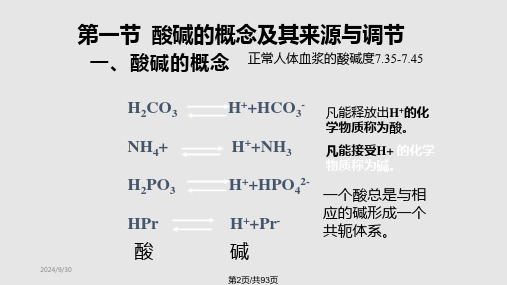
既能给出质子,又能接受质子的物质。
如:HSO
4
,
[Fe(OH)(H
2O)5
]2+
,
HCO
3
,
H
2
O,
HS
-等。
① 酸碱解离反应是质子转移反应。
HF(aq) H+ + F-(aq)
H+ + H2O(l) H3O+(aq)
HF(aq) + H2O(l) 酸(1) 碱(2)
H3O+(aq) + F-(aq) 酸(2) 碱(1)
= 1.0 10 -14 = 2.2 10 -2 4.5 10 -13
x2 + 0.022x - 2.2 10-3 = 0
x = 0.037 即 c(OH - ) = 0.037 mol L-1
pH = 14 - pOH = 14 - (-lg 0.037) = 12.57
3.酸式盐(判断溶液酸碱性,计算不作要求)
NH4Cl水解:
第三章酸碱平衡理论ppt课件

ceq(OH-) = ceq(H+)+ ceq(HCO3-) +2ceq(H2CO3)
+2H+
如二元弱碱碳酸钠水溶液:
得: H3PO4 H3O+(H+) 零水准: H2PO4- H2O 失: HPO42- PO43- OH- 质子条件式:
电荷平衡式 在平衡状态下,正电荷的总量应等于负电荷的总量,溶液总是呈电中性。 醋酸溶液 氢氧化钠溶液 碳酸钠溶液
质子条件式 在平衡状态下,酸失去质子的总数与碱得到质子的总数应相等。这种平衡的数量关系就是质子条件式。
确立零水准
建立质子条件式
化学反应等温式,标准吉布斯函数与标准平衡常数的关系。
最早的关于化学平衡的概念只是实验事实的总 结,因而得到的是实验平衡常数。以K表示,量纲 为 。在SI和国家标准中不存在K这样的物理量。
严格讲,对于实际溶液的反应,在 表达式中应使用活度 。若不涉及严密的理论处理,一般使用相对浓度 。
-H+
-2H+
-H+
+ H+
+ H+
两性物质溶液- NaH2PO4溶液:
HCl = H+ +Cl- H2O = H+ +OH-
质子条件式:
HCl水溶液:
NaOH = Na+ + OH- H2O = H+ +OH-
质子条件式:
ceq(OH-)= c(NaOH) + ceq(H+)
当 时, , 为主要存在形式。 当 时, 为主要存在形式。 当 时, 为主要形式。
ceq(OH-)=ceq(H+) +ceq(HAc)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.1.1 酸碱质子理论的基本概念
酸:凡是能释放出质子(H+)的任何含氢原
子的分子或离子的物种。 (质子的给予体)
碱:凡是能与质子(H+)结合的分子或离子
的物种。 (质子的接受体)
1.
酸
HAc
H 2 PO 4
HPO 24
NH
4
CH3NH3
Fe(H2O)6 3 Fe(OH)(H2O)5 2
H+ +碱
⑵ 对于二元弱酸 , 当 K1 K2 时,c(酸根离子)
≈ K2 ,而与弱酸的初始浓度无关。
⑶ 对于二元弱酸,若 c(弱酸)一定时,c(酸根离子)与 c
(H3O+) 成反比。
§4.4 缓冲溶液
4.4.1 同离子效应 4.4.2 缓冲溶液 4.4.3 缓冲溶液pH值的计算 * 4.4.4 缓冲范围和缓冲能力
为 0.10 mol·L-1,计算该溶液的 pH值和 HAc的解离度
解: c0/ (mol·L-1)
HAc(aq)+H2O(l) H3O+ (aq)+Ac- (aq)
0.10
0
0.10
ceq / (mol·L-1) 0.10 – x
x
0.10 + x
x (0.10 x) 1.8105 0.10 x
4.4.1 同离子效应
NH4Ac (aq)
NH
4
(aq)
+ Ac– (aq)
HAc (aq) + H2O (l) H3O+ (aq) +Ac– (aq)
同离子效应:
平衡移动方向
弱电解质溶液中,加入与其含有相同离子的易 溶强电解质而使弱电解质的解离度降低的现象
例:在 0.10 mol·L-1 的HAc 溶液中,加入 NH4Ac (s) 的浓度
区分效应:用一个溶剂能把酸或碱的相对强弱区分开来,
称为溶剂的“区分效应”
例如:H2O可以区分HAc,HCN酸性强弱
拉平效应:溶剂将酸或碱的强度的拉平作用,称为溶剂
的“拉平效应”
水对强酸起不到区分作用,水只能同等程度地将 HClO4,HCl,HNO3等强酸的质子全部夺取过来
拉平效应与区分效应
选取比水的碱性更弱的碱,如冰醋酸为溶剂, 对水中的强酸可呈现出区分效应。例如上述强酸在 冰醋酸中不完全解离,酸性强度依次为:
H Ac H HPO42 H PO34 H NH3 H CH3NH2
H Fe(OH)(H2O)5 2 H Fe(OH)2 (H2O)4
2. 酸 → H+ + 碱
例:HAc的共轭碱是Ac- ,
Ac-的共轭酸 HAc ,
HAc和Ac-为一对共轭酸碱
3. 两性物质
既能给出质子,又能接受质子的物质
0.10 ± x ≈ 0.10
x = 1.8×10-5 c(H+) = 1.8×10-5 mol·L-1
pH = 4.74,α = 0.018%
0.10 mol·L-1 的HAc溶液:pH = 2.89,α = 1.3%
4.4.2 缓冲溶液
实验
滴加1滴(0.05ml) 1mol·L-1 HCl
50ml纯水 pH = 7 pH = 3
(4) 非水溶液中酸碱反应
H+
NH4Cl 的生成
HCl
NH 3
NH
4
酸(1) 碱(2)
酸(2)
Cl 碱(1)
液氨中的酸 碱中和反应
H+
NH4Cl NaNH2 2NH3 NaCl
4.1.2 酸/碱的相对强度
酸和碱的强度是指酸给出质子的能力和碱接受质子
能力的强弱。
HAc
HCN
Ka
1.8 105 5.8 1010
pK
w
14
*§4.3 弱酸、弱碱解离平衡
4.3.1 一元弱酸、弱碱的解离平衡 4.3.2 多元弱酸的解离平衡 4.3.3 盐溶液的酸碱平衡
*结论
⑴ 多元弱酸的解离分步进行,一般地 K1 K2 K3 溶液中的 H+主要来自于弱酸的第一步解离,计算 c(H+) 或 pH 时可只考虑第一步解离。
如:HSO
,
4
Fe(OH)(H
2O)5
2
,
HCO3,H2O,HS 等
4. 酸碱反应特征
(1) 酸碱反应是质子转移反应, 如HF在水溶液中的
解离反应是由给出质子的半反应和接受质子的半反应 组成的。
HF(aq) H+ + F-(aq) H+ + H2O(l) H3O+(aq) HF(aq) + H2O(l) H3O+(aq) + F-(aq) (2) 水是两性物质,自身也可以发生质子转移
100℃纯水 Kw 5.431013 T Kw
4.2.2 溶液的pH值
令 根据 即
pH
lg
c(H3O c
)
c(OH )
pOH lg
c
K
w
ห้องสมุดไป่ตู้
c(H3O c
)
c(OH c
)
1.0
1014
lg
c(H ) c
lg
c(OH ) c
lg
K
w
14
pH pOH
酸越强 碱越强
HI HClO 4 HCl H 2 SO 4 HNO 3
其共轭碱越弱 其共轭酸越弱
酸性:HClO4 H2SO4 H3PO4
HAc
H 2 CO 3
NH
4
H2O
碱性:ClO
4
HSO
4
H
2
PO
4
Ac HCO3 NH3 OH
§4.2 水的解离平衡与溶液pH值
4.2.1 水的解离平衡 4.2.2 溶液的pH值
H+
H2O(l)+H2O(l) H3O+(aq) +OH-(aq) 酸(1) 碱(2) 酸(2) 碱(1)
(3) 盐类水解 是酸碱的质子转移反应
NaAc水解
H+
Ac-+H2O OH- + HAc
碱(1) 酸(2) 碱(2) 酸(1)
NH4Cl水解
H+
NH
4
+
H2O
H3O+ + NH3
酸(1) 碱(2) 酸(2) 碱(1)
4.2.1 水的解离平衡
H2O (l) + H2O(l) H3O+ (aq) + OH-(aq)
或:
H2O (l) H+ (aq) + OH-(aq)
Kw
ceq
(H3O c
)
ceq
(OH c
)
或
K
' w
ceq (H3O ) ceq (OH )
Kw— 水的离子积常数,简称 水的离子积
25℃纯水 c(H ) c(OH ) 1.0107 mol L1 Kw 1.0 1014
§4 酸碱理论
§ 4.1 酸碱质子理论概述 § 4.2 水的解离平衡和pH值 § 4.3 弱酸、弱碱的解离平衡* § 4.4 缓冲溶液 § 4.5 酸碱指示剂* § 4.6 酸碱电子理论与配合物概述 § 4.7 配位反应与配位平衡
§4.1 酸碱质子理论概述
4.1.1 酸碱质子理论基本概念 4.1.2 酸和碱的相对强度
