脾脏单个核细胞的制备
小鼠脾脏、胸腺单个核细胞分离

32
33
知识回顾 Knowledge Review
祝您成功!
25
实验步骤:
(三)计算细胞浓度 1ຫໍສະໝຸດ 将上述细胞悬液做一定倍数的稀释; 2. 混匀稀释后,取1滴加至细胞计数板中,计数细胞计数板中4大方格细胞
总数; 3. 计算细胞总数:
细胞总数=平均每个大方格中细胞数(4个大方格细胞总数/4)X104X稀 释倍数。
26
计数池
正面观
支持堤
侧面观
支持堤 计数池 支持堤 1mm (0.1mm缝隙)
胞无反光,则为死亡;而细胞不被染色,晶莹透亮,旋转显微镜 调节钮,细胞明显反光而且有立体感,为活细胞; • 计算细胞活力:计数200个细胞中活细胞的百分率,一般活力应 在95%以上。
31
注意事项:
1. 通常分离细胞是为了下一步实验。有些实验如需要对细胞作进一 步培养,则在分离细胞时一定要严格无菌操作。
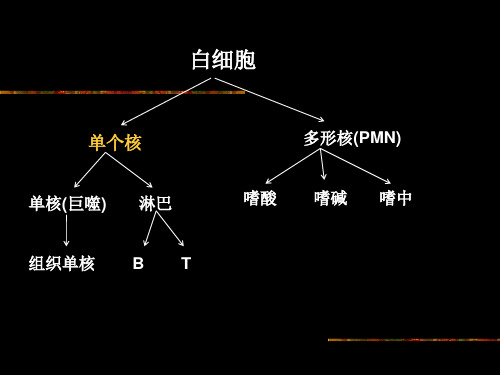
mononuclear cell PBMC)包括淋巴细胞和单核细胞, 其体积、形状和比重与其他细胞不同,利用密度在 1.077±0.001g/L之间近于等渗的Ficoll-Hypaque混合 溶液(称为淋巴细胞分层液)作密度梯度离心时,•各种血液成 分将按密度梯度重新分布聚集。
17
不同细胞密度不同
27
计数时需要遵循一定的方向逐格进行,以免重复或遗漏,对 压线细胞采用数左不数右,数上不数下的原则
28
细胞数量明显增大时可适当加大稀释倍数。 充池时要一次完成,不能产生满溢、气泡
或充池不足的现象。 大小方格内压线细胞的计数遵循数上不数
下、数左不数右的原则,避免多数或漏数。
脾脏单个核细胞的制备

脾脏单个核细胞的制备脾脏单个核细胞的制备: 将5 只小鼠断颈椎处死, 无菌取出脾脏, 分别剪碎, 置200 目无菌尼龙网上, 分次滴入4~ 5 ml RPMI1640 培养液, 轻轻研磨脾脏, 直到脾脏变白;收集细胞悬液( 由于红细胞所占比例很低且对实验影响不大, 故无需作红细胞裂解处理) , 1 000 r/ min( 离心半径17. 5 cm) 离心5 min, 弃上清; 加入2 ml pH7. 4 的PBS, 混匀后1 000 r/ min( 离心半径17. 5 cm) 离心5min, 弃上清; 加入4 ml RPMI1640 培养液, 混匀, 用RPMI1640 培养液稀释200 倍后滴加在细胞计数板上进行细胞计数, 根据计数结果用RPMI1640 将细胞悬液调成2 × 10 / 300 µl 的浓度。
《流式细胞术检测小鼠脾细胞内细胞因子刺激方案的筛选》单细胞悬液的制备:将大鼠颈椎脱位处死后, 置70%乙醇中浸泡5 m in, 无菌取出脾脏和胸腺置于平皿中, 除掉结缔组织, 用生理盐水清洗3次。
加入2 mL RPM I- 1640完全培养液, 用剪刀分别将脾和胸腺剪成1 mm 1 mm 1 mm 碎块后, 用毛玻片轻柔研磨组织碎片, 经8层纱布过滤制成单细胞悬液, 经H anks液离心洗涤后, 将细胞悬浮于含10%小牛血清的RPM I- 1640 培养液。
台盼蓝染色, 计数活细胞在95%以上, 调整细胞数至5×10 cells /L。
《粗江蓠多糖对大鼠淋巴细胞周期的影响》610制备脾细胞悬液脾淋巴细胞的获取:手术刀、解剖剪、解剖镊、止血钳等手术器械,300 目尼龙网等须经消毒处理; 以颈椎脱臼法处死小鼠, 用7 5 % 乙醇浸泡小鼠10-15min 。
沿腹腔中线剪开小鼠胸腔, 取出脾脏置于培养皿中, 剪去脂肪和筋膜组织, 用R PMI-1640培养液漂洗。
粗剪成小块, 用注射器芯轻轻挤压, 加人基础培养液, 混悬, 用300目尼龙网过滤到玻璃离心管中, 再加人基础培养液冲洗网上剩余组织细胞。
单细胞制备实验报告(3篇)

第1篇一、实验目的1. 掌握单细胞制备的基本原理和方法。
2. 熟悉细胞培养的无菌操作技术。
3. 学习使用显微镜观察细胞形态和生长状态。
4. 了解细胞计数和细胞活力检测的基本方法。
二、实验原理单细胞制备是指从组织中分离出单个细胞,以便于进行细胞培养、分子生物学研究等实验。
本实验采用胰蛋白酶消化法进行单细胞制备,该方法能够有效破坏细胞间的连接,使细胞离散成单个细胞。
三、实验材料1. 实验动物:小白鼠2. 实验试剂:胰蛋白酶、Hank's液、DMEM培养基、胎牛血清、青霉素、链霉素、无菌注射器、无菌剪刀、无菌镊子、无菌培养皿、无菌吸管、显微镜、血球计数板等。
四、实验步骤1. 组织块制备:取小白鼠脾脏,用无菌剪刀剪成1mm³大小的组织块,放入无菌培养皿中。
2. 消化:向组织块中加入适量胰蛋白酶,在37℃水浴中消化10-15分钟。
3. 分散:用无菌吸管轻轻吹打组织块,使细胞离散成单个细胞。
4. 计数:用血球计数板计数细胞数量,计算细胞活力。
5. 洗涤:用Hank's液洗涤细胞悬液3次,去除未消化的组织碎片和残留的胰蛋白酶。
6. 调整细胞浓度:用DMEM培养基调整细胞浓度至1×10⁵细胞/毫升。
7. 接种:将细胞悬液接种于无菌培养皿中,放入培养箱中培养。
8. 观察:用显微镜观察细胞的生长状态,包括细胞形态、大小、核质比等。
五、实验结果1. 细胞形态:接种后24小时,可见细胞开始贴壁生长,细胞呈圆形、椭圆形或不规则形。
2. 细胞活力:计数结果显示,细胞活力达到95%以上。
3. 生长状态:接种后3-4天,细胞开始分裂增殖,形成致密的单层细胞。
六、实验讨论1. 胰蛋白酶消化法是单细胞制备的常用方法,具有操作简单、效率高等优点。
2. 消化时间和温度对细胞活力和细胞形态有重要影响。
消化时间过长或温度过高可能导致细胞损伤。
3. 细胞计数和活力检测是评估细胞质量的重要指标。
4. 单细胞制备是细胞生物学研究的重要基础,对于细胞培养、分子生物学研究等实验具有重要意义。
复旦大学免疫实验小鼠脾脏单个核细胞分离及细胞计数

小鼠脾脏单个核细胞分离及细胞计数实验时间:____________ 实验地点:_____________ 实验人:__________________ 1实验原理小鼠脾脏位于上腹部左后侧,体积较大,长条形,属于外周免疫器官。
外周血中淋巴细胞可经再循环驻如脾脏等外周免疫器官的特定区域,所以富含各类免疫细胞。
免疫细胞的分离:采用红细胞裂解法,是根据细胞对渗透压变化的敏感度。
红细胞由于细胞结构较为简单,仅有细胞膜结构,对于膨胀的耐受能力较差,因此绝大部分就会涨破,受到破坏。
是一种比较温和的去除红细胞最简便易行的方法。
2实验材料:1)健康小鼠2)手术器械(剪刀、镊子)、解剖板3)70汇醇4)PBS缓冲液、红细胞裂解液(ACK5)0.2%台盼蓝6)细胞计数板、计数器7)离心机8)显微镜3实验方法:3.1取小鼠脾脏将小鼠颈椎脱位处死,用酒精消毒。
用剪刀剪开背部皮肤,再找到脾脏,用镊子夹出脾脏并剪除周围组织。
3.2制备单个核细胞悬液将取出的脾脏置于盛有3mlPBS缓冲液的平皿中,然后再置于尼龙指套中,用针芯轻轻碾压使得单个核细胞悬浮于平皿中。
吸取平皿中细胞悬液置于刻度离心管(15ml)中,以1500rpm离心10min, 弃去上清液,加入ASK至2-3ml,轻轻吹打混匀并放置2min,以破坏红细胞。
然后加入PBS缓冲液至10ml,以1500rpm离心10min。
弃去上清液,用PBS缓冲液定容至2ml,吹打混匀即为小鼠脾脏单个核细胞悬液。
3.3 计算细胞浓度稀释十倍,随机选取一个大方格计数细胞计数为324个,计算细胞浓度为324X 104X 10=3.24 X 107/ml3.4 计算细胞活力在总计为324个细胞中计数,死亡细胞有16 个,计算细胞活力为:324- 16/324 X 100%=95.1%在理论范围之内4 实验结果4.1 研磨脾脏得到细胞悬液本实验中将小鼠的脾脏放入尼龙指套内,置于少量PBS液中缓慢研磨,获得细胞悬液。
五年制免疫实验课 小鼠脾脏单个核细胞分离-新

E花环分离法
(纯化T细胞)
T细胞表面的CD2分子-绵羊红细胞受体(E受体)
尼龙纤维分离法
B细胞和单核细 胞具有易粘附特性, 将淋巴细胞悬液加 到尼龙纤维上, 37℃作用1-2小时 后,洗脱的为非粘 附性T细胞。
PBMC
B细胞 单核细胞
尼龙纤维 毛柱
T细胞
流式细胞术
(Flow Cytometry,FCM)
一 、 T细 胞 增 殖 试 验
1. 形态学检查
T细胞增殖试验 原毒的行正理刺分常素激裂:)人后的T、转细能淋非化胞转巴率特体化为母异(外为细7性形0受体%胞有态特积左,丝学异较右以分示性大。此裂意抗、测原原图代定(物)谢T如质细旺P(胞盛HA的如、、功细且C能菌能on类进。A) 4P8H~A72刺小激时
NOTE:尽量少吸分层液;
6、每管加 PBS 到1ml,重悬细胞,3000转离心5分钟。
7、计数:吸弃上清,用100ml PBS重悬细胞,取出20ml加入新 的EP管中,再加入20ml细胞计数液,混匀后取出10ml,加到 计数板内,显微镜下计数。
细胞计数方法
4
查出四个大方格的总细胞数(X) 算出每个大方格的平均细胞数:Y=X/4 每个大方格的体积为V=1mm×1mm×0.1mm=0.1mm3=10-4ml 制备的细胞悬液的细胞浓度(/ml)=Y×104×稀释倍数
2.
3 H-TdR掺 入 法 T细胞增殖试验 原激胞养腺DD淋素NN活巴经进理液嘧AAβ后入细:中中啶的,胞-S淋加,液核原期进对巴入根体苷,料入刺细据闪3H细(被(细激T胞同烁标胞d摄胞物3位仪被RH记合入)周的素检-有,的T成期应细掺测d丝则DDR进答入胞。N分N掺3H行水A细A,裂入合-明有平胞T原掺法成d显丝。的RC入)原分掺增量o新n作料加裂入则A合为或脱,的,可成合P当同在氧推H细位的培成测胸A
医学免疫学实验四 小鼠脾脏、胸腺单个核细胞分离及流式染色实验

NK细胞表面标志
人类细胞表面标志主要以 CD16、CD56来 认定,临床上将CD3-CD56+CD16+淋巴 细胞认定为NK细胞。
流式细胞术(FCM)
流式细胞术(FCM)是一种对处在液流中的单个细胞或其它生物微 粒(如细菌)等进行快速定量分析和分选的技术,它将免疫荧光 与细胞生物学、流体力学、光学和电子计算机等多种学科的高新 技术结合,进行细胞和分子水平的基础理论与临床应用研究。
MACS
磁性微珠是20世纪80年代初以高分子材料和金属离子(如Fe3O4 )为原料聚合而成的一种以金属离子为核心、外层均匀地包裹高 分子聚合体的固相微粒。
以磁性微珠为载体,包被上针对某种细胞表面抗原的特异性抗体 即可制成免疫磁性微珠。
通常有二种分离方式:阳性分离和阴性分离。 基本原理及步骤:首先将抗特异细胞表面抗原的抗体致敏到磁珠
胸腺功能: (1)产生T淋巴细胞 (2)产生和分泌胸腺素和激素类物质
免疫细胞分离方法
1. 根据不同免疫细胞表面标志:FAC: 1)根据细胞比重差异:自然沉降法、密度梯 度离心法、改变细胞密度法 2)根据细胞黏附特性:B细胞黏附于尼龙棉 3)根据细胞对渗透压变化的敏感度:红细胞 对低渗敏感
(二)制备单个核细胞悬液:
1. 将取出的脾脏置于盛有PBS缓冲液(10ml)的平皿中,然后再 置于尼龙指套中。用针芯轻轻碾磨使单个核细胞通过尼龙指 套悬浮于平皿中;
2. 吸取平皿中细胞悬液置于15ml离心管中,再取5mlPBS冲 洗培养皿后移入15ml离心管。以1500rpm离心5min。弃 去上清,轻轻弹散细胞沉淀,加红细胞裂解液ACK至2-3ml ,轻轻吹打混匀并放置3-4min,以破坏红细胞。然后加 PBS缓冲液至10ml,以1500rpm离心5min;
动物脾脏单个核细胞分离液试剂盒使用说明

动物脾脏单个核细胞分离液试剂盒使用说明规格:3×200mL/kit保存:动物脾脏单个核细胞分离液试剂盒对光敏感,应该室温避光储存,保质期2年。
无菌开封后,保存于室温。
组成:各种动物脾脏单个核细胞分离液200mL全血及组织稀释液200mL细胞洗涤液200mL单个核细胞分离方法1.制备脾脏的单细胞悬液。
2.取一支适当的离心管,加入与脾脏单细胞悬液等量的分离液(分离液最少不得少于3mL,总体积不能超过离心管的三分之二,否则会影响分离效果)。
3.小心吸取单细胞悬液加于分离液液面上,注意保持两液面界面清晰。
(可以使用巴氏德吸管吸取单细胞悬液,然后小心的平铺于分离液上,因为两者的密度差异,将形成明显的分层界面。
)4.室温,500~900g,离心20~30min。
(根据脾脏单细胞悬液的量确定离心条件,单细胞悬液量越大,离心力越大,离心时间越长,具体离心条件可以自行摸索,以达到最佳分离效果)。
5.离心后,此时离心管中由上至下细胞分四层。
第一层为稀释液层;第二层为环状乳白色单个核细胞层;第三层为透明分离液层;第四层为红细胞层。
6.用吸管小心吸取第二层环状乳白色单个核细胞层至另一洁净的15mL离心管中,向离心管中加入10ml细胞洗涤液洗涤白膜层细胞,250g,离心10min。
7.弃上清,5mL的PBS或细胞清洗液重悬细胞,250g,离心10min。
8.重复步骤79.弃上清,细胞重悬备用。
分层示意图脾脏单细胞悬液的制备方法脾脏研磨的方法:1.无菌条件下摘取脾脏,撕去脾脏被膜,用眼科剪将脾脏剪成小块。
2.将尼龙筛网或者是细胞过滤筛放置于平皿上,加入少量全血及组织稀释液(保证脾脏及获得的细胞处于液体环境中)。
3.将脾脏放置于筛网上,使用注射器活塞或者是无菌镊子来研磨脾脏(尽量控制研磨力度,保持筛网悬空,避免在皿底上直接研磨而造成大批细胞死亡)4.研磨完全后使用全血及组织稀释液冲洗筛网,收集细胞悬液,再经滤网过滤。
小鼠脾脏单个核细胞分离
-
特异性 敏感性
优点
缺点
细胞生物 低 学方法 免疫学方 高 法
分子生物 高 学方法
高
可确定活 性
易操作, 可大量检 测 既可定量 又可定位
繁琐费时 不能确定是 否有活性
不能反映浓 度和活性
较高
高
小鼠脾单个核细胞的分离—密度梯度离心法
原理 根据物理学中颗粒沉降原理,不同密度的物质颗 粒在其沉降运动中可因其比重的差别而处于不同 的分布位置。利用此原理可设计一定密度的液体 界面,将各种不同密度的细胞通过离心沉降而达 到使其彼此分离的目的。已知小鼠淋巴细胞和单 核细胞的密度大约在1.088之间,而红细胞与粒细 胞 的 密 度 均 大 于 1.088 。 因 此 , 若 用 密 度 为 1.088±0.001 的分离液则可通过密度梯度离心方 法,在分离液界面上收集单个核细胞。
T:表达CD2(SRBC受体) B:不表达CD2
免疫细胞功能检测
淋巴细胞转化试验
细胞毒试验
细胞因子检测 溶血空斑实验
T
PHA, ConA,PWM
或Ag
形态学观察Lc 与淋巴母细胞 的比值
3H-TdR掺入法测cpm值
细胞因子检测
细胞生物学方法: CK细胞敏感株
密度梯度离心法
聚蔗糖—泛影葡胺 Ficoll-Hypaque: 1.088±0.001
LC, M :1.088 RBC, 粒细胞:>1.092
在1ml小鼠脾脏细胞悬液混匀,然后用滴管沿盛有 2ml淋巴 细胞分离液的试管壁轻轻铺于分离液面上。 将该试管置水平式离心机中离心(1800rpm)15分钟。 用滴管小心地直接插入白色絮状的细胞层(含单个核细 胞),吸出界面层细胞,移入另一试管内。 在该细胞收集管内加入生理盐水,用滴管轻轻上下冲洗混 匀,然后在离心(1000rpm)10分钟,弃去上清液,将沉 淀细胞充分摇匀,再用生理盐水离心洗涤1次。 用0.3ml生理盐水(约6滴)将沉淀细胞稀释,摇匀。 取细胞悬液一滴加入等量白细胞稀释液于另一试管中充分 混匀,用计数板在显微镜下计数,计算单个核细胞浓度 (个/ml)。 检查细胞活力:取细胞悬液一滴加入等量锥兰溶液于另一 试管中充分混匀,用载玻片在显微镜下计数100~200个单 个核细胞中着色的死细胞数
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
脾脏单个核细胞的制备: 将5 只小鼠断颈椎处死, 无菌取出脾脏, 分别剪碎, 置200 目无菌尼龙网上, 分次滴入4~ 5 ml RP MI1640 培养液, 轻轻研磨脾脏, 直到脾脏变白; 收集细胞悬液( 由于红细胞所占比例很低且对实验影响不大, 故无需作红细胞裂解处理) , 1 000 r/ min( 离心半径17. 5 cm) 离心5 min, 弃上清; 加入2 ml pH7. 4 的PBS, 混匀后1 000 r/ min( 离心半径17. 5 cm) 离心5min, 弃上清; 加入4 ml RPMI1640 培养液, 混匀, 用RPMI1640 培养液稀释200 倍后滴加在细胞计数板上进行细胞计数, 根据计数结果用RPMI1640 将细胞悬液调成2 × 106 / 300 µl 的浓度。
《流式细胞术检测小鼠脾细胞内细胞因子刺激方案的筛选》
单细胞悬液的制备:将大鼠颈椎脱位处死后, 置70%乙醇中浸泡5 m in, 无菌取出脾脏和胸腺置于平皿中, 除掉结缔组织, 用生理盐水清洗3次。
加入2 mL RPM I- 1640完全培养液, 用剪刀分别将脾和胸腺剪成1 mm 1 mm 1 mm 碎块后, 用毛玻片轻柔研磨组织碎片, 经8层纱布过滤制成单细胞悬液, 经H anks液离心洗涤后, 将细胞悬浮于含10% 小牛血清的RPM I- 1640 培养液。
台盼蓝染色, 计数活细胞在95%以上, 调整细胞数至5×1010 cells /L。
《粗江蓠多糖对大鼠淋巴细胞周期的影响》
制备脾细胞悬液脾淋巴细胞的获取:
手术刀、解剖剪、解剖镊、止血钳等手术器械,300 目尼龙网等须经消毒处理; 以颈椎脱臼法处死小鼠, 用7 5 % 乙醇浸泡小鼠10-15min 。
沿腹腔中线剪开小鼠胸腔, 取出脾脏置于培养皿中, 剪去脂肪和筋膜组织, 用R PMI-1640培养液漂洗。
粗剪成小块, 用注射器芯轻轻挤压, 加人基础培养液, 混悬, 用300目尼龙网过滤到玻璃离心管中, 再加人基础培养液冲洗网上剩余组织细胞。
收集滤过的细胞悬液, 加人0.83 % 的氯化铵到滤过的细胞中, 静置5 min , 以除去血红细胞。
用RPM-ll640 培养液离心( 2500 r/min,10min) 洗涤细胞3 次, 以除去剩余的氯化铵将上述收集到的脾脏细胞置于玻璃培养瓶中, 在37 ℃、5 % C O: 培养箱中静置培养2 h , 以除去贴壁细胞, 收集未贴壁的细胞悬液即获得脾淋巴细胞。
计数接种培养。
台盼蓝染色计数, 活细胞数大于95 % 。
《从Ca2+通路研究紫草多糖促进小鼠淋巴细胞增殖的机制》
,
14日龄健康鸡,无菌取脾脏,Hanks'液洗3 次,卡介苗注射器芯研磨,200 目筛网过滤,制成单细胞悬液,离心( 1000r/min) ,弃上清,Tris-NH4Cl 破解红细胞,冰水浴放置10min,离心( 1000 r /min) ,弃上清,Hanks'液洗3 次。
加入无酚红1640 培养液重悬细胞,计数,调整细胞浓度为1 × 106 cell /mL。
于96 孔细胞培养板培养。
《马尾藻多糖对鸡脾脏淋巴细胞增殖及氧化应激影响的实验观察》
1. 3 鼠脾淋巴细胞的制备小鼠脱颈处死, 于75% 酒精中浸泡5 min, 在超净工作台中无菌打开腹腔, 取出脾脏, 用含有高浓度青链霉素( 青霉素300 IU/ ml+ 链霉素300μg/ ml) 的PBS液洗涤2-3 次, 剥去脾脏周围结缔组织。
将处理好的脾脏移入一无菌青霉素瓶中, 加入适量的RPMI1640 完全培养液( RPMI1640+ 10%胎牛血清+ 青霉素100 IU/ ml+ 链霉素100 μg /ml) , 眼科剪剪碎, 400 目网筛过滤, 收集滤液并叠加于等体积的小鼠淋巴细胞分离液上, 2000 rpm 离心15 min。
用无菌吸管取灰白层, 加入适量RPMI1640 完全培养液后, 1 000 rpm 离心5 min、去上清液, 用适量RPMI 1640 完全培养液重悬细胞, 取微量重悬细胞液, 加等体积0.4%台盼蓝染色液, 染色2 min, 计数活细胞后, 用RPMI 1640 完全培养液调整细胞浓度为2 ×106 /ml( 细胞活率95%以上) , 备用。
《苯对母鼠和子鼠脾淋巴细胞的增殖与凋亡影响》
2. 3. 2脾淋巴细胞增殖功能检测。
处死小鼠后,各取脾脏8 个, 轻轻研磨成匀浆, 200 目筛网过滤, 制备脾细胞悬液, 离心, 1500 rm10m in, 弃上清, 加入适量红细胞裂解液( 1m l悬液中加3m l), 螺旋震荡3m in, PBS洗2次, 含10%胎牛血清的RPMI- 1640 培养液重悬, 调整细胞密度为2×106 /ml 加入96 孔U型培养板中, 每孔100μl。
分别加入ConA ( 10μg /m l) 100μl 使其终浓度为5μg /ml 每个标本3个复孔, 5% CO2培养箱中培养64h, 培养结束前4h加入MTT( 5mg /ml) 20μl培养结束后离心1500 rm10m in, 小心吸去上清, 加入DMSO150μl 振荡10m in, 酶标仪550nm 检测各孔吸光度(OD值)。
《复方阿胶浆对移植性肺癌小鼠脾、胸腺重量指数与脾淋巴细胞增殖影响》
1. 2. 2 淋巴细胞悬液制备分离小鼠的派氏结( Peyer S patches, PPs) , 肠系膜淋巴结( mesenteric
lymph nodes, MLNs) , 脾脏( Spleen, SP) , 分别置于3 个盛有预冷PBS的无菌培养皿中, 用研磨棒加适度力度轻轻研磨, 于200 目筛网过滤, 收集细胞, 制备单细胞悬液, 以冷PBS 洗涤细胞两次( 1 200 r/ min, 5 分钟) , 脾细胞以低渗法裂解红细胞, 细胞计数, 将细胞稀释到1×107cells/ ml。
《茯苓多糖对免疫抑制小鼠粘膜淋巴组织及脾脏中CD3+ 和CD19+ 细胞变化的影响》
1.4.3 小鼠脾淋巴细胞增殖的测定小鼠颈椎脱臼处死,无菌取出脾脏,置盛有适量无菌Hank′s 液的小平皿中,用眼科剪轻轻将脾脏剪碎,经200 目筛网碾碎过滤,制成单细胞悬液,用Hank's 液洗3 次,每次离心10 min(1 000 r/min),去上清后加入预冷的0.83%Tris-NH4Cl 裂解红细胞1 min,再用1640 培养液洗涤2-3 次,然后将细胞悬浮于2 mL 完全培养液中,用台盼蓝染色计数活细胞数,调整细胞浓度为1.0×106 个/mL。
将细胞悬液分别加入96 孔培养板中,每孔100 μL,每组重复3 孔(见表2),各补加完全培养基至200 μL。
置5%CO2培养箱37 ℃培养72 h,培养结束前4 h,弃去上清液,加入100 μL 不含胎牛血清的RPMI1640 培养液,同时加入MTT(5 mg/mL)10 μL/孔,继续培养4 h。
培养结束后,弃上清,每孔加入100 μL DMSO,吹打混匀,使结晶完全溶解。
然后用酶联免疫检测仪,以570 nm 波长检测、630 nm 波长参考,测定光密度值用OD 表示。
1.5 数据分析采用SPSS13. 0 统计软件进行分析,结果以平均数。
《不同组分、不同纯度中药复方多糖对小鼠脾淋巴细胞增殖影响》。
