郑州大学 有机化学8卤代烃 金属有机化合物
大学有机化学第九章卤代烃
❖ 3、反应的进攻试剂(HO-)从离去基团的反面 进攻反应底物,产物的构型翻转(瓦尔登转化)
❖ 4、反应过程中是通过一个过渡态而转化为产 物,没有碳正离子中间体生成,不发生重排, 无重排产物。
2. 单分子亲核取代反应(SN1):
C2H5
4-乙基-6-氯-2-己烯
二. 卤代烃的物理性质
❖ 常温常压下:CH3Cl,C2H5Cl及CH3Br Gas ❖ 其它常见RX Liquid
❖ >C15
Solid
❖ RX:分子极性小,不溶于水,易溶于许多有机化
合物(做溶剂)。如:氯仿(CHCl3)
❖ 卤代烷:X数增加,可燃性降低。CCl4为灭火剂
CH3
CH3 C Cl + NaOH
CH3
CH3 C CH2 +NaCl + H2O
CH3
CH2 CH2 Cl ,
Cl
x 几乎不反应
❖ C、由于多数RX由相应的醇制备,因此用此
法制备醇在合成上意义不大。但少数醇可以 用此法。例如:
CH3 Cl2 hv
CH3CH=CH2
Cl2 hv
CH2Cl H2O/NaOH 加加
加热才沉淀
7、与炔钠的反应 (亲核试剂:RC≡C-)
RC≡CH NaNH2 RC≡CNa
液NH3
10 R’X
RC≡CR’
注意:NaNH2是强碱,不能使用叔(30)卤烷,否则 将主要得到烯烃。乙烯型卤代物,卤苯型化合物在
该条件下反应几乎不发生。
二、亲核取代反应历程及立体化学
δR δX + Nu 反应物 亲核试剂
按②:
第七章_卤代烃_有机金属化合物

CHF3 氟仿(fluroform) CHCl3 氯仿 (chloroform) CHBr3 溴仿(Bromoform) CHI3 碘仿(Iodoform)
一级卤代烷: (CH3)2CHCH2Cl Br 二级卤代烷: CH3CH2CHCH3 三级卤代烷: (CH3)3C-I
CH3 H CH3CH2CH C2H5
三 偶极矩与有机分子的极性 有机分子的偶极矩大,极性大。
四 电负性与键的分类
C (2.5) F (4.0) Cl (3.16) Br (2.96) I (2.66)
差值
1.5
0.66
0.46
0.16
极性共价键,极性逐渐减弱
五、卤代烷的构象
Cl H H H Cl H
1,2-二氯乙烷的构象
Cl H H Cl H H
应用一:制备高级炔烃
CH3CH2CH2MgBr + CH3CCH CH3C C MgBr + CH3CH2CH3 CH2=CHCH2X CH3CCCH2CH=CH2
应用二:在分子中引入同位素 RMgX + D2O RD
3. 格氏试剂、有机锂试剂、二烃基酮锂 与卤代烃的偶联
(1) RMgX + R’X
I + C4H9Li
Li + C4H9I
(3) 二烃基铜锂的制备
RLi + CuX RLi + RCu
RCu + LiX R2CuLi
2. 格氏试剂、有机锂试剂 与O2、CO2、H2O的反应。
(1) 与O2的反应 RMgX + O2 RMgX RLi + O2 ROOMgX
2ROMgX
ROOLi
R X
第六章--卤代烃

• 溶剂的影响(不讲) • 溶剂的极性增加对SN1历程有利,对SN2历程不 利。
H2O C6H5CH2Cl OH
-
SN1 丙酮 SN2
C6H5CH2OH + Cl-
R3C-X
叔卤代烃 三级卤代烃 3° ( )
Professor: Zhang Yan-Bing, E-mail: zhangyb@
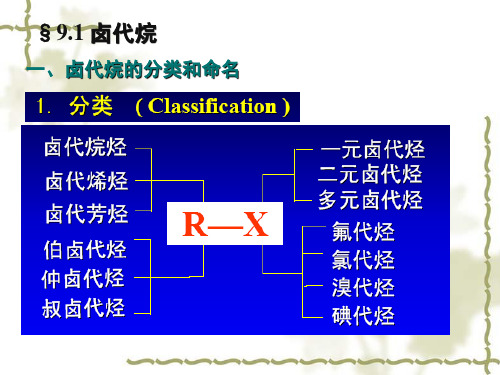
二.命名
• 简单的卤代烃用普通命名或俗名,(称为卤代某 烃或某基卤)
CHCl3 CH3CH2CH2Cl (CH3)CHCl 2
3 (CH3) CBr
有机化学
郑州大学化学系
Professor: Zhang Yan-Bing, E-mail: zhangyb@
第六章 卤代烃
• 烃分子中的一个或多个氢原子被卤素原子 取代后生成的化合物,称卤代烃 (halohydrocarbon)。 • 卤代烃在自然界存在的数目很少(主要是合 成),但是有很多实际用途,如灭火剂、高 分子材料、杀虫剂、制冷剂、麻醉剂等, 也是重要的有机合成原料。
4.影响亲核取代反应的因素
• 卤代烃结构的影响(重点)
Professor: Zhang Yan-Bing, E-mail: zhangyb@
• 离去基团的性质(不讲) 无论是SN1还是SN2离去基团的碱性越弱,越易离 去,反应越容易进行。 碱性很强的基团(如 R3C 、R2N 、RO 、HO 等) 不能作为离去基团进行亲核取代反应,象R-OH、 ROR等,就不能直接进行亲核取代反应。
位 能
HO + CH3Br
E
H CH3OH + Br
《卤代烃》 讲义

《卤代烃》讲义一、卤代烃的定义和分类卤代烃是烃分子中的氢原子被卤素原子取代后所形成的化合物。
根据卤素原子的种类,可以分为氟代烃、氯代烃、溴代烃和碘代烃。
根据分子中卤素原子的数目,又可以分为一卤代烃和多卤代烃。
常见的一卤代烃有氯甲烷(CH₃Cl)、溴乙烷(C₂H₅Br)等。
多卤代烃如二氯甲烷(CH₂Cl₂)、三氯甲烷(CHCl₃)等。
从烃基的结构来看,卤代烃还可以分为饱和卤代烃(如卤代烷烃)、不饱和卤代烃(如卤代烯烃、卤代炔烃)和芳香卤代烃。
二、卤代烃的物理性质卤代烃的物理性质通常与其结构和分子间作用力有关。
在常温常压下,一氯甲烷、氯乙烷等是气体,其余的一卤代烃多为液体,而高级卤代烃则是固体。
卤代烃的沸点随碳原子数的增加而升高。
同碳原子数的卤代烃,沸点的高低顺序为:RI>RBr>RCl>RF。
这是因为相对分子质量越大,分子间的范德华力越大,沸点也就越高。
卤代烃的密度通常大于相应的烃。
一氯代烃的密度一般小于水,而多氯代烃的密度则大于水。
卤代烃大多不溶于水,能溶于有机溶剂,如乙醇、乙醚等。
三、卤代烃的化学性质卤代烃的化学性质比较活泼,这是由于卤素原子的电负性较大,使得碳卤键具有较强的极性。
1、取代反应卤代烃中的卤素原子可以被其他原子或基团取代。
例如,溴乙烷与氢氧化钠水溶液共热时,发生水解反应,生成乙醇:C₂H₅Br +NaOH → C₂H₅OH + NaBr这是一个典型的亲核取代反应,氢氧化钠中的羟基(OH⁻)作为亲核试剂进攻卤代烃中的碳原子,取代了卤素原子。
2、消去反应在一定条件下,卤代烃分子中的卤素原子和相邻碳原子上的氢原子可以脱去,生成不饱和烃。
例如,溴乙烷与氢氧化钠的乙醇溶液共热时,发生消去反应,生成乙烯:C₂H₅Br + N aOH → C₂H₄↑ + NaBr + H₂O消去反应的发生需要满足一定的结构条件,即与卤素原子相连的碳原子的相邻碳原子上必须有氢原子。
3、与金属反应卤代烃可以与金属镁在无水乙醚中反应,生成格氏试剂。
04卤代烃、有机金属化合物

k2’=2k2
实验结果
Nu + C L 反应坐标
Nu C + L
27
28
Xiezx
4.4 一卤代烷的化学反应
-Lzu
SN2的特点小结
*1、这是一个一步反应,只有一个过渡态。过渡态的结构
特点是:中心碳是sp2杂化,它与五个基团相连,与中心碳
相连又未参与反应的三个基团与中心碳原子处于同一平面
上,进攻基团 (亲核试剂) 和离去基团处在与该平面垂直且
4、溶解度:所有的卤代烃均不溶于水,易溶于乙 醇、乙醚等有机溶剂。
5、密度:一氟代烃、一氯代烃的密度小于1,其它 卤代烃的密度大于1。
11
Xiezx
4.2 卤代烷的物理性质
-Lzu
6、可极化性:一个极性化合物,在外电场的影响下,分
子中的电荷分布可产生相应的变化,这种变化能力称为可
极化性。
影响可极化性的因素:
(R)-CH3(CH2)CHCH3 + I*- SN2 (S)-CH3(CH2)CHCH3 + I -
I
I*
C
能 Nu
线 图E
C L (b)
: (a) 反应物
过渡态 (c)
(d) Nu C
L
(e) 产物
同位素交换速率:k2 外消旋化速率: k2’
正面进攻:k2’=0
背面进攻:k2’=2k2 两面进攻:k2’=k2
Br
慢
R1 R2 C
R3
Br
-Br-
反应物
过渡态
R2 R1
Nu-
C+ 快
R3 中间体
R1
R2 C
Nu
R3
过渡态
有机化学第八章卤代烃ppt课件

II. 卤代烃的命名
“某基卤〞或
1). 简单卤代烃——普通命名法 “卤(化/代)某烃”
CH3I
碘甲烷
(CH3)2CHCl
异丙基氯
CH2 Br 苄基溴 (溴化苄)
俗名: CHCl3
氯仿
CHI3
碘仿
CF2Cl2 氟立昂(Freon)
CF2ClBr 剂
-[CF2-CF2]n-
1211 灭火
聚四氟乙烯
氟利昂 ——几种 氟 氯代甲烷和 氟氯 代 乙烷的总称 : CCl3F〔F-11)、CCl2F2 〔F-12)、 CClF3〔F - 13)、 CHCl2F (F - 21)、CHClF2〔F - 22)、 CFCl2CClF2〔F –113)、 CF2ClCClF2( F - 114 ) 。
Ag2O, H2O
Walden转换
O
O
HOCCH2CHCOH
OH (+ )-苹 果 酸
由于中心碳上所连基团的立体效应是影响反应速度 的重要因素,故按SN2历程的相对速度顺序为:
CH3Br > CH3 CH2Br>(CH3)2CHBr
>
伯
仲
>(CH3)3CBr 叔
单分子历程SN1:反应速率只决定 于卤代烃, 部分仲卤代烷〔RR′CHX〕 和叔卤代烃
卤代烷的鉴别:
AgNO3 /乙醇
R3C-X
R3C-ONO2 + AgX
(3°RX)
立即沉淀
R2CH-X AgNO3 /乙醇 R2CH-ONO2 + AgX
(2°RX)
几分钟后沉淀
RCH2-X AgNO3 /乙醇 RCH2-ONO2 + AgX
(1°RX)
【基础有机化学】第7章 卤代烃有机金属化合物
19%
81%
CH3 CH3CHCHCH2
H Br H
叔卤代烷
C2H5ONa, C2H5OH
CH3
CH3 CH= C(CH3)2+ CH3CH2C=CH2
71%
29%
4. Zaitsev(查依采夫)规律
(1875年俄国化学家Zaitsev总结了当时已知的大量实验事实, 得出以下经验结论.)
在一消去反应 中, 从含氢最少的碳原 子上脱去氢原子而生成的烯烃的量最多.
的反应称为卤代烷的消除反应。( 又称一消去反应 )
2.通式:
c c
碱,
cc
HX
HX
3. 实例:
伯卤代烷
CH3CH2CH2Br C2H5ONa, C2H5OH
CH3CH=CH2+ NaBr
仲卤代烷
CH2CHCHCH3 C2H5ONa, C2H5OH
H Br H
CH2 = CHCH2CH3+ CH3CH=CHCH3
(伯卤代烷)
Br
CH3CH2CHCH3 二级卤代烷
(仲卤代烷)
(CH3)3C-I 三级卤代烷
(叔卤代烷)
7.2 卤代烷的结构
7.2.1 卤代烷中碳卤键的特点
极性共价键,成键 电子对偏向X.
+
Csp 3
-
Xsp 3
C—H C—F C—C C—Cl C—Br C— I 110 139 154 176 194 214 (pm)
取代与消除可由同一试剂进攻引起,这两种反应相互竞 争。如下图:
E2
Nu
H
SN2
CC
X
SN1 E1
H CC
+
《卤代烃》课件
结论和要点
卤代烃是一类有机化合物,具有较高的密度和较低的挥发性。可应用于溶剂、药物和农药以及防火材料等工业 领域。
了解卤代烃的定义、命名规则、物理性质、化学性质、制备方法和工业应用,有助于我们更好地理解和应用这 类有机化合物。
卤代烃的命名规则
卤代烃的命名根据取代碳上的卤素种类和数量进行命名,常见的命名规则有 IUPAC命名法和常用名称法。
例如,氯代烷根据卤素在碳链上的位置和数量,可以命名为氯甲烷、二氯甲 烷、三氯甲烷等。
卤代烃的物理性质
卤代烃具有较高的密度和较低的挥发性,常见的卤代烃通常是无色液体或固体。 卤代烃的溶解度较低,不易溶于水,但可溶于有机溶剂如醇类、醚类等。
卤代烃的化学性质
卤代烃在化学反应中表现出与饱和烃不同的性质,常见的化学反应包括取代 反应、消除反应和亲核取代反应。
由于卤代烃中的卤素原子具有较高的电负性,使得卤代烃在化学反应中具有 较高的活性。
卤代烃的制备方法
直接卤代
通过将烃与卤素进行反应,直接替换烃中的氢原子。
间接卤代
通过将烷烃与卤素化合物反应,间接制备卤代烃。
自由基卤代
通过在有机反应中引入自由基,实现卤素与烃的取代反应。
卤代烃在工业中的应用
1
溶剂
卤代烃常被用作有机溶剂,用于化学合成和物质提取等工业过程。
2
药物和农药
一些卤代烃化合物被应用于药物和农药的Байду номын сангаас产,具有重要的医药和农业价值。
3
防火材料
由于其具有良好的阻燃性能,卤代烃被应用于制造防火涂料和防火塑料等产品。
《卤代烃》PPT课件
欢迎阅读《卤代烃》PPT课件,本课件将介绍卤代烃的定义和特征,命名规 则,物理性质,化学性质,制备方法,工业应用等内容。
(完整版)郑州大学有机化学8卤代烃金属有机化合物
8.1 Classification (分类), Nomenclature (命名), Structure (结构) and Physical Properties (物理性质)
按卤素所连接的烃基的结构分类
Saturated halohydrocarbons (饱和卤代烃) Unsaturated halohydrocarbons (不饱和卤代烃) Aromatic halohydrocarbons (芳香卤代烃)
Allylic halides (烯丙型卤代烃, 烯丙基卤)
+O
H3CH2C
HH
Racemization
CH2CH2CH3 C CH3 + HBr
CH2CH3
H3C C2H5
H2O
Cl
C2H5OH
(CH2)3CH(CH3)2
(R)-6-Chloro2,6-dimethyloctane
H3C C2H5 OH + HO
(CH2)3CH(CH3)2
40% R (retention)
Propgarpyl halides (炔丙型卤代烃)
Benzylic halides (苄型卤代烃, 苄基卤)
Vinylic halides (乙烯型卤代烃, 乙烯基卤)
Aryl halides (芳型卤代烃, 芳基卤)
按与卤素相连的碳原子的级数分类
伯(1º)卤代烃
RCH2X
仲(2º)卤代烃 叔(3º)卤代烃
fast
C Nu
Multistep reaction (多步反应)
第八章卤代烷与金属有机化合物
第八章卤代烷与金属有机化合物基本要求:1、了解卤代烃的分类,掌握命名方法;2、掌握卤代烃的取代,消去和与金属的反应,3、理解并掌握亲核取代反应的S N1和S N2历程,了解它们的立体化学特征,动力学特征和影响因素。
理解并掌握消去反应的历程,立体化学特征和消去的查伊采夫(Satyzeff)规则等;了解取代与消去两种竞争反应条件的区别。
了解离子对理论和邻基参与的反应。
4、掌握卤代烃的制备方法与用途。
5、掌握Grignard(格利雅)试剂及其它有机金属试剂与卤代化合物或羰基化合物的反应与应用。
6、了解多卤代烃,氟代烃的特性和应用。
内容提要:1、卤代烃是有机合成的重要中间体,其反应主要有亲核取代反应,消去反应和与金属的反应三类。
通过卤代烃的亲核取代反应可以转换成各种重要官能团(如醇、醚、酯、硫醇、硫醚、胺、肼、腈等);通常烯丙基卤烃和苄基卤烃反应最快,饱和卤代烃的反应速度居中,而乙烯式和芳基卤烃基本不取代。
但邻位或对位有硝基或其他吸电子基团取代的卤苯的卤素也较易被取代,甚至在液氨中,有氨基钠或类似强碱存在下,烷基卤苯的卤素也能被取代;2、饱和卤代烃的取代可能有两种历程——S N1和S N2。
S N1历程是卤代烃的碳卤键首先断裂生成正碳离子(第一步),然后正碳离子再与试剂结合生成产物(第二步)。
这种历程的立体化学特征表现为外消旋化。
第一步涉及共价键的断裂,通常反应速度较慢,是决定反应速度的步骤,所以共价键容易断裂的反应速度快。
各种卤代烃反应速度如下:R—I > R—Br > R—Cl > R—F当卤素一定时,不同结构的卤代烃的反应速度取决于生成正碳离子的稳定性:3ºR—X > 2ºR—X > 1ºR—X由于正碳离子中间体的生成,这种反应常常伴有重排。
在SN2历程中,卤代烃的碳卤键断裂和与试剂结合生成产物是一步完成的。
试剂总是从碳卤键的另一侧进攻中心碳原子,这种历程的立体化学特征表现为构型翻转。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
按卤素所连接的烃基的结构分类
Saturated halohydrocarbons (饱和卤代烃) Unsaturated halohydrocarbons (不饱和卤代烃) Aromatic halohydrocarbons (芳香卤代烃)
Allylic halides (烯丙型卤代烃, 烯丙基卤) Propgarpyl halides (炔丙型卤代烃) Benzylic halides (苄型卤代烃, 苄基卤)
Stereochemistry
Nu C back side attΒιβλιοθήκη ckNu-C+
Nu-
front side attack
C
Nu
H3CH2CH2C H3C H3CH2C C
H2O H3CH2CH2C Br C H3C acetone H3CH2C
O H
+ H
O
CH2CH2CH3 + HBr C CH3 CH2CH3
Polarizability (可极化度): the ease with which the electron distribution around an atom is distorted by a nearby electric field(核外电子分布受外界电场影响而 发生扭曲变形)
Larger atoms are more polarizable. I > Br > Cl > F S>O
O H C N CH3 CH3
O CH3 S CH3
DMF
DMSO “Naked” anions are highly reactive both as bases and nucleophiles (裸露的负离子具有很强的亲核 性和碱性).
在偶极溶剂中亲核性顺序: F- > Cl- > Br- > I(与碱性顺序一致)
60% S (inversion)
Ion-pair Mechanism(离子对机理)
RL
R+LClose ion-pair (紧密离子对)
R+‖ Lloose ion-pair (松散离子对)
R+ + Lfree ions (自由离子)
Energy Diagram
R3CX
Side Reaction
O ROH H3C OSOCH3 碱 O
CH3OR
硫酸二甲酯是个很好的甲基化试剂, 常用于和醇反应得到甲基醚
O R OS O
CNCH3 RCN
OSO2
G C2H5OH
OC2H5
SN1
G = OCH3 CH3 H Cl NO2 速率 1.0 1.6 3.1 8.4 55
8.2.1.2.3 The nucleophile
v= k[CH3Br][OH-] second order
bimolecular nucleophilic substitution (双分子亲核取代)
Mechanism
≠ Nu: + C L
Nu C L
Nu C
+
:L
Stereochemistry
single-step reaction(一步反应)
8.2.1.2.1 The structures of alkyl groups
SN2 Substituent Methyl 1° 2° Neopentyl 3° Steric effect Compound CH3X CH3CH2X (CH3)2CHX (CH3)3CCH2X (CH3)3CX Relative Rate 30 1 0.02 0.00001 ~0
RX
Formation of Organomatelic Compounds (形成金属有机化合物)
8.2.1 Nucleophilic Substitution (亲核取代)
8.2.1.1 SN1 and SN2
SN2
CH3Br + OH-
80%C2H5OH 55℃
CH3OH + Br-
Kinetics
NuNu
+ CH3Br
HS– CN–
NuCH3 + BrI– CH3O–
SN2 HO– 16,000 Cl– 1,000 NH3 700 H2 O 1
Relative 125,000 125,000 100,000 25,000 reactivity In aqueous ethanol
Polar aprotic solvents(偶极溶剂, 极性非质子溶剂)
The nucleophile attacks the carbon bearing the leaving group from the BACK SIDE.
Inversion of configuration(构型翻转): Walden inversion
Energy Diagram
Side Reaction
Rearrangement and E1
8.2.1.2 Factors affecting SN1 and SN2 • The structures of alkyl groups (烃基的结构)
• Leaving groups (离去基团)
• The nucleophile (亲核试剂) • The solvent (溶剂)
Racemization
H3C C2H5 Cl H3C C2H5 OH 40% R (retention) + HO C2H5 CH3
H2O
C2H5OH (CH2)3CH(CH3)2 (R)-6-Chloro2,6-dimethyloctane
(CH2)3CH(CH3)2
+ HCl (CH2)3CH(CH3)2
8.2 Reactions
Nucleophilic Substitution (亲核取代):SN1/SN2)
Nu -+ R X
Nu R + X-
Elimination Reactions (消除反应): E1/E2
B- +
Reduction (还原)
H C C X
[H] RH
C C + HB + X-
Vinylic halides (乙烯型卤代烃, 乙烯基卤)
Aryl halides (芳型卤代烃, 芳基卤)
按与卤素相连的碳原子的级数分类
伯(1º )卤代烃 仲(2º )卤代烃 叔(3º )卤代烃
RCH2X
R2CHX
R3CX
按分子中卤素的数目分类
一卤代烷 多卤代烷(邻二卤代烷 偕二卤代烷)
CH2Cl2 二氯甲烷
8.2.1.2.2 Leaving groups
离去基团对SN2和SN1具有类似的影响,但对SN1影响程度更大
Good L (好的离去基团)
Stable (稳定) Weakly basic (碱性弱)
HL Strong acid (强酸)
离去能力
-I > -Br > -Cl >> -F
其它常见的离去基团
-OTs -OMs -ONs -OSO2OR
N N
O OS O O OSCH3 O O OS O
O O S O O R
CH3
对甲基苯磺酸酯基 -OSO2C6H4CH3-p
甲基磺酸酯基
NO2
对硝基苯磺酸酯基 -OSO2C6H4NO2-p 烷基硫酸酯基
NR3
OH2
OR2
Leaving group Relative reactivity
TsO– 60,000 ×
I– 30,000
Br– 10,000
Cl– 200 √
F– 1
HO–, H2N–, RO– ~0
离去基团的离去顺序: -N+≡N > -O+R2 > -OSO2C6H4NO2-p > -OSO2Ph > -OSO2C6H4CH3-p > -OSO2CH3 > -I > -O+H2 > -Br > -Cl
对SN2反应,偶极溶剂比质子溶剂有利
N3 + CH3CH2CH2CH2Br
Solvent Relative reactivity HMPA
Solvent
CH3CN
CH3CH2CH2CH2N3 +
DMF 2,800 DMSO 1,300 H2O 6.6
Br
200,000 5,000
3) Sterically hindered nucleophiles are poor ones (位阻大的试剂亲核性差) 亲核性顺序:CH3O- > CH3CH2O- > (CH3)2CHO- > (CH3)3CO(与碱性顺序相反) SN2
(CH3)2CHOH 12
SN2反应速度: PhCH2X, CH2=CHCH2X > CH3X > 1º RX > 2º RX > 3º RX >> CH2=CHX, PhX
SN1反应速度: PhCH2X , CH2=CHCH2X > 3º RX > 2º RX > 1º RX > CH3X >> CH2=CHX, PhX
对于苄基卤、烯丙基卤, SN1和SN2均容易发生;对于乙烯型卤、芳基卤,SN1 和SN2均难以发生;使用非常强的碱,如NaNH2,将使其发生消除反应,分别 得到炔烃、苯炔(会进一步发生加成) (CH3)3CCH2Cl为何既难以发生SN2又难以发生SN1?
Br + CH3ONa
×
OCH3
?
SN2 ONa + CH3Br
