第十四章 周环反应
周环反应

-
-
-
-
+
-
顺旋
+ +
+
-
结论:加热下,顺旋成键。 结论:加热下,顺旋成键。 成键
光照下
分子处于激发态, 分子处于激发态,其HOMO为ψ3 为
hν 对旋
+ +
hν
+
顺旋
-
-
-
-
+
-
hν 对旋
+ +
不成键
结论:光照下,对旋成键 结论:光照下,对旋成键
CH3 H H CH3
(E,E)-2,4-hexadiene
加热条件
+ ll
165℃ 90MPa
HOMO
LUMO
LUMO [ 4+2 ] 环加成反应(热 应) 热反
HOMO
HOMO*
LUMO
LUMO [ 4+2 ] 环加成光反应禁阻
HOMO*
• 参与加成的是一个分子的 参与加成的是一个分子的HOMO和另一个分子的 和另一个分子的LUMO, 电子 和另一个分子的 由一个分子的HOMO流向另一个分子的 流向另一个分子的LUMO; 由一个分子的 流向另一个分子的 ; 正常的D 反应由双烯体提供HOMO, LUMO。 正常的D-A反应由双烯体提供HOMO, 亲双烯体提供 LUMO。 吸电子基可降低亲双烯体LUMO能量 给电子基可升高双烯体 能量; 吸电子基可降低亲双烯体 能量 HOMO能量 两者均使反应容易进行。 能量, 两者均使反应容易进行。 能量
第十七章
周 环 反 应
Pericyclic reaction
自由基反应:反应中间体为自由基( 1、自由基反应:反应中间体为自由基(R· ) 离子型反应: 2、离子型反应:反应中间体为离子 周环反应:反应过程中,无中间体生成, 3、周环反应:反应过程中,无中间体生成,反应中 化学键的断裂和生成同步进行。过渡态是环状的协 化学键的断裂和生成同步进行。 同反应。 同反应。
周环反应

关于2,4-己二烯的电环化反应总结如下:
CH3 H H CH3 CH3
顺旋
CH3 H H CH3
hν
对旋
CH3
顺旋
H CH3 H
H CH3 H
hν
对旋
总:若开链共轭烯有4个或4m个Π电子,加热顺旋关环, 加热顺旋开环。光照对旋关环,光照对旋开环。 练习:写出下列反应的产物或中间产物
Ph
Ph
Ph H H
[1,5] H迁移
H D CH 3 C2H5 (2)
D CH3 H (3) CH3
H H 3C
CH3 D C2H5 (1)
H3C
CH3 D C2H5 H
CH3
[1,5] H迁移
C2H5
2. [ 3,3 ]迁移 结论: 在加热时[ 3,3 ]迁移是轨道对称性允许的 。
以1, 5--己二烯为例:在加热时发生[ 3,3 ]迁移 2 3 1 2 3 1 CH2 CH CH2 CH2 CH CH2
i= 1 Z C 5
注:[ i, j]表示迁移后σ键所连接的两个原子的位置。 i, j 的编号分别从反应物中以σ键连接的两个原子开始编号。
1 H CD2 5 CH 4 CH 3 CH 2 CH2 1 H CD2 CH CH CH CH2
[1, 5] H 迁移
C--H键σ迁移
CH3 3 2 CH CH CH2 3 CH 2
9
℃
40 ℃
CH3
Br
(3)
Br
RMgX
R
R
(
)
R R
Br
(4)
Br
2C6H5S-
Sφ Sφ
二. 环加成 在光或热的作用下在两个 Π电子共轭体系的两端同 时生成两个σ键而闭合成环的反应叫环加成反应。 分类:由两个Π电子体系中参与反应的Π电子的数 目分类。
周环反应

例1
CH3 H CH3 CH3
非键张力小 比
H H H
快 103倍
H
CH3 H3C C (H3C)3C
反 -1.3-戊 二 烯
例3
H3C H
比
快 27倍
例2
Ph H
H Ph
H
S-顺 式 构 象 ( 稳 定 )
S-反 式 构 象
快 102-103倍
H
比
H H H
反 -1-苯 基 -1.3-丁 二 烯
其 HOMO为 1
C C C
△
对旋
即:
例:1967年Kirmse发现下列实例
断裂
Ph H
△ -N2
N
Ph H H
H C Ph C
CH2
H
CH2OCH3 C C H
CH3OH Ph
H
N
4. 戊二烯基正负离子的电环化(正离子顺旋开环,负离子对旋开环)
O OH O
H3PO4
CHH 3 3C CHH 3 3C
四. 电环化反应
1.定义:在一定条件下,链状共轭多烯分子的两端构成一个 键形成 环状分子的反应及其逆反应,称电环化反应。 2.电环化反应的一般选择性规则
含偶数碳原子共轭体系的电环化反应的选择性规则 共轭体系的π电子数 4n(n=1、2、3……) 4n+2(n=0、1、2……) 例1
Ph CD3 Ph CH3 Ph Ph Ph
v
HOMO π( S) <2> 对称性匹配(允许)易反应
v
例3 (2+2)环加成,基态时
LUMO
π*( A)
HOMO
v
周环反应的特点

周环反应的特点
周环反应是一种有机化学反应,其特点独特而瞩目。
在周环反应中,通过选定合适的专用试剂,可将一端含有双键或亚胺官能团的化
合物转化为含有多环芳香环的化合物。
周环反应的特点之一是具有高度的立体选择性。
这意味着在周环
反应中,产物的立体构型往往可以在反应开始之前就被预测出来。
这
种立体选择性是由于反应中所涉及的反应试剂和底物之间的空间关系
所决定的。
通过精确控制反应条件和试剂的选择,可以有效地控制产
物的立体构型,从而实现有机合成中的立体选择性。
另一个特点是周环反应具有广泛的底物适应性。
周环反应可以用
于合成各种具有特殊结构和多环芳香环的有机化合物,包括多环芳香烃、蒽、菲等。
这使得周环反应成为有机化学合成中非常有用的工具,尤其在天然产物合成和药物合成中得到广泛应用。
此外,周环反应还可以通过合理选择反应条件和试剂,实现反应
的高效率和高收率。
许多周环反应具有快速的反应速度和较高的化学
选择性,从而使得反应可以在相对温和的条件下进行,减少了副反应
的发生。
同时,优化反应体系和控制反应条件还可以提高反应的收率,实现原料的高转化率。
总的来说,周环反应在有机化学合成中具有独特的特点和广泛的
应用性。
通过精确控制反应条件和试剂的选择,可以实现立体选择性、广泛的底物适应性以及高效率和高收率的反应。
这为有机化学家提供
了实现复杂结构有机分子的合成目标的无限可能,也为有机合成领域的发展提供了强大的支持和借鉴。
周环反应(北大教材)

22
3)前线轨道理论对[4 +2]环加成反应的解析
HOMO
LUMO
LUMO 4+2环加成,同面允许
HOMO
4)结论: 电子数 4n 4n+2
2019/3/31
加热 禁阻 允许
光照 允许 禁阻
23
The Diels–Alder cycloaddition reaction is a pericyclic
位移方式
牵涉到的电子数
[1,3]
4n 禁阻 允许 实立 际体 不障 行碍 大
[1,5]
4n+2 允许 禁阻
[1,7]
4n 禁阻 允许
[1,9]
4n+2 允许 禁阻
同面位移
异面位移
2019/3/31
38
H
例题
H3C
H
D C2H5
CH3 [1,5]位移 H3C
CH3
D C2H5
CH3
CH3 CH2 CH3 CH3
见书评1038,23.5.2
CH3 CH3
CH2 H
V D 3
40
VD3
2019/3/31
3) 其它原子或原子团的位移
构型保留的 1,3烷基同面 位移禁阻 异面允许, 构型翻转的 1,3烷基 同面位移允许,
2019/3/31
41
4n+2 同面允许 构型保留
构型翻转 同面禁阻
构型翻转
异面允许
2019/3/31 42
2019/3/31
13
b. 己三烯的电环化反应
对旋
hν
顺旋
2019/3/31
14
Example: Electrocyclic Interconversions With Octatriene
周环反应的理论解释PPT课件

有机反应的类型 离子型反应
分子型反应(周环反应、协同反应)
分子型反应的基本特征: 1. 反应过程中不产生离子或自由基等活性中间体. 2. 反应不受溶剂极性的影响,一般也不被酸或碱所催化。 3. 反应为一步到位过程且只经过一个多中心环状过渡态。 4. 旧键的断裂和新键的形成是同步发生的。
(3) 反应有显著的立体选择性,生成空间定向产物。
R hv
R
R
R
R
R = - COOCH3
R
(一) 分子轨道对称性守恒原理(Conservation of orbital symmetry)
1. 原理的提出:
1965年伍德沃德和霍夫曼(R . B . Woodward , R . Hoffmann)在 系统研究大量协同反应的试验事实的基础上从 量 子 化 学 的 分 子 轨 道 理 论 出 发提出了分子轨道对称性守恒原理。 1971年福井谦一 提出了完整的前线轨道(ontier orbital)理论。
SO2
1,3-偶极加成: CH2 N N
CHCO2Me CHCO2Me
N N
CO2Me CO2Me
[4+2]环加成: CH2 CH CH CH2 CH2 CH2
对称允许的[4π+2π]热环化加成反应
Ψ2(A) Ψ2(A)
Ψ3(S) Ψ1(S)
对称禁阻的[2 π +2 π]热环化加成反应
前线轨道 (FMO)理论认为,在双分子光反应中,两 组分均为具有两个成单电子的激发态分子,单电子占据 的MO又称为SOMO,。故光照下的环加成方式为: 两组分能量较高的两个SOMO组合形成一个σ单键; 两组分能量较低的两个SOMO组合形成另一个σ单键。 两组分相互组合的SOMO必须具有相同的对称性且能量相 近才能重叠。若对称性不同则不能发生环加成反应
周环反应课件

H OCOCH3 DH
300 ℃
CH3 1
3
2
[1,3 ]σ键烷基迁移 (同面 / 翻转)
H OCOCH3 HD
CH3 1
3
2
C[ 1, 5] 迁移(4n+2 π 电子) :
加热下,同面迁移构型保持,异面迁移构 型翻转;光照下,同面迁移构型翻转,异面 迁移构型保持保持。
CH3 CH3
[1,5]碳移位
H
A BD
R 同 面 迁 移 1 ,3H B D
(4) C[ i, j ] 迁移 [3,3]迁移:
① Cope重排
NC
NC
EtOOC
[3, 3]
EtOOC
1, 5-二烯类化合物在加热条件下发生的 [3,3] 迁移, 生成取代基更多、更稳定的烯烃。
i C 1 C 2 C 3
j
o CC
1' 2' 3'
对
H
Ph Ph
H
H
Ph
Ph
H
H 3 C CH 3 H Ph
Ph
顺
Ph
H Ph
H
CH 3 H H CH 3
HH
HH
练习
CH3
o
(1)
H
175
H
顺旋
CH3
CH3
(2)
顺旋
CH3
CH3
CH3
H
+
H
CH3
CH3
H
CH3 CH3 H
CH3
对旋
(3) hv
CH3
顺旋
CH3
CH3 CH3
CH3
(5) (6)
在化学反应过程中,能形成环状过渡态的协同反 应称为周环反应。所谓协同反应的含义是:在一个 反应中,有两个或两个以上的化学键相互协调地同 时破裂和形成,所以协同反应是一种基元反应。
第十四章 周环反应
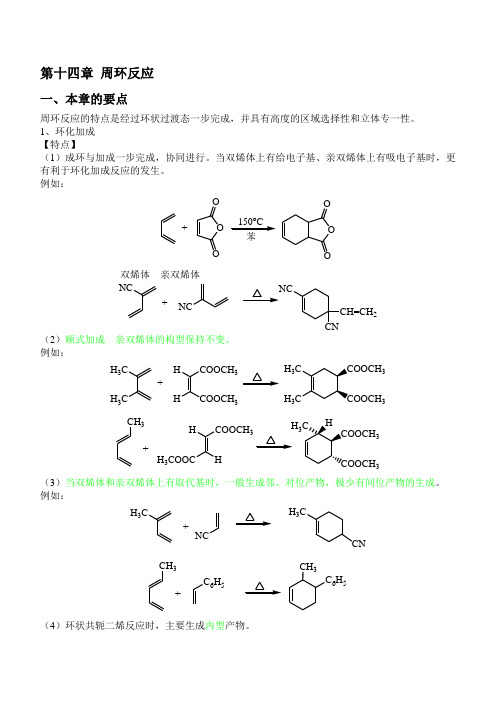
第十四章 周环反应一、本章的要点周环反应的特点是经过环状过渡态一步完成,并具有高度的区域选择性和立体专一性。
1、环化加成 【特点】(1)成环与加成一步完成,协同进行。
当双烯体上有给电子基、亲双烯体上有吸电子基时,更有利于环化加成反应的发生。
例如:+O OO150o C 苯O O双烯体 亲双烯体 NC+NCNCCH=CH 2CN(2)顺式加成 亲双烯体的构型保持不变。
例如:+H 3CH 3CCOOCH 3HHCOOCH 3H 3C H 3CCOOCH 3COOCH 3+CH 3COOCH 3HH 3COOCHH 3CHCOOCH 3COOCH 3(3)当双烯体和亲双烯体上有取代基时,一般生成邻、对位产物,极少有间位产物的生成。
例如:NCH 3CCN H 3C++CH3C 6H 5CH 3C 6H 5(4)环状共轭二烯反应时,主要生成内型产物。
例如:+OCOCH 3OCOCH 3H+O OOO OO2、电环化反应开链共轭烯烃关环生成环烯烃及其逆反应都叫电环化反应。
例如:CH 3H CH 3H (E,E)-2,4-己二烯光照对旋HCH 3CH 3H加热顺旋CH 3HCH 3H 顺-3,4-二甲基环丁烯反-3,4-二甲基环丁烯光照对旋加热顺旋H CH 3CH 3H (Z,E)-2,4-己二烯(Z,Z,E)-2,4,6-辛三烯光照对旋加热顺旋反-5,6-二甲基环己二烯光照对旋加热顺旋CH 3H CH 3HCH 3H HCH 3H H CH 3CH 3(E,Z,E)-2,4,6-辛三烯H CH 3HCH 3顺-5,6-二甲基环己二烯热反应只与基态有关,在反应中起关键作用的是HOMO 。
光照情况下分子发生跃迁,处于激发态。
此时,分子的HOMO 是基态时的LUMO 。
电环化反应规律如下所示。
共轭 电子数 反应实例 热反应 光照反应4n顺旋 允许对旋 允许4n+2对旋 允许顺旋 允许3、Claison 重排和Cope 重排它们都属于[3,3]迁移反应,其特点是在加热条件下进行,有六元环状过渡态。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十四章 周环反应一、本章的要点周环反应的特点是经过环状过渡态一步完成,并具有高度的区域选择性和立体专一性。
1、环化加成 【特点】(1)成环与加成一步完成,协同进行。
当双烯体上有给电子基、亲双烯体上有吸电子基时,更有利于环化加成反应的发生。
例如:+O OO150o C 苯O O双烯体 亲双烯体 NC+NCNCCH=CH 2CN(2)顺式加成 亲双烯体的构型保持不变。
例如:+H 3CH 3CCOOCH 3HHCOOCH 3H 3C H 3CCOOCH 3COOCH 3+CH 3COOCH 3HH 3COOCHH 3CHCOOCH 3COOCH 3(3)当双烯体和亲双烯体上有取代基时,一般生成邻、对位产物,极少有间位产物的生成。
例如:NCH 3CCN H 3C++CH3C 6H 5CH 3C 6H 5(4)环状共轭二烯反应时,主要生成内型产物。
例如:+OCOCH 3OCOCH 3H+O OOO OO2、电环化反应开链共轭烯烃关环生成环烯烃及其逆反应都叫电环化反应。
例如:CH 3H CH 3H (E,E)-2,4-己二烯光照对旋HCH 3CH 3H加热顺旋CH 3HCH 3H 顺-3,4-二甲基环丁烯反-3,4-二甲基环丁烯光照对旋加热顺旋H CH 3CH 3H (Z,E)-2,4-己二烯(Z,Z,E)-2,4,6-辛三烯光照对旋加热顺旋反-5,6-二甲基环己二烯光照对旋加热顺旋CH 3H CH 3HCH 3H HCH 3H H CH 3CH 3(E,Z,E)-2,4,6-辛三烯H CH 3HCH 3顺-5,6-二甲基环己二烯热反应只与基态有关,在反应中起关键作用的是HOMO 。
光照情况下分子发生跃迁,处于激发态。
此时,分子的HOMO 是基态时的LUMO 。
电环化反应规律如下所示。
共轭 电子数 反应实例 热反应 光照反应4n顺旋 允许对旋 允许4n+2对旋 允许顺旋 允许3、Claison 重排和Cope 重排它们都属于[3,3]迁移反应,其特点是在加热条件下进行,有六元环状过渡态。
二、 例题例1、完成下列反应:(1)CH 3HCH 3H ?H H CH3CH 3hv?(2)?HH(3)?HH(4)C C H 3CHCH3H 2hv?(5)+O OO室温?150o C?OO O?(6)H3C?(7)?O CH2CH CHCH3(8)+CH2CCCOOCH3COOCH3[8+2]环加成??[4+2]环加成解答:(1)顺旋,CH3 CH3 HH(2)hv 对旋(3)hv 顺旋(4)HCH3CH3HHCH3CH3H+HCH3CH3HCH3HHCH3(5)OOOOOOO OOOOO(6)H 3C(7)OHCH CH 3CH CH 2(8)[8+2]环加成:[4+2]环加成:COOCH 3COOCH 3CH 2H 3COOCCOOCH 3例2、写出下列反应(每一步)的类型:(1)( 为叔丁基)CH3CH 3CH3CH 3CH 3CH 3(3)CH 3CH3CH 3CH 3CH3CH 3CH 3CH 3H 3CCH 3CH 3H 3C(4)CH 3CH 3解答:(1)为叔丁基( )4n 体系的电环化反应光照对旋hv≡注:1,2,4—三叔丁基苯只能在光照下转化成杜瓦(Dewar )苯加热条件下不能进行反应。
(2)CH3CH3CH 3CH3CH 3CH 3[1,5]H 迁移[1,5]H 迁移1122334455HH321(3)CH 3CH 3CH3CH 3CH3CH 3CH 3CH 3H 3CCH 3CH 3[4n+2]电环化[1,5]C 迁移[4n+2]电环化开环45H 3C21(4)CH 3CH 3[1,5]H 迁移4n 体系电环化CH 2 __H453例3、4-溴-2-环戊烯酮在环戊二烯存在下与碱加热反应,其副产物中有两个分子式为C 10H 10O 的化合物A 和B,写出它们的结构式并用反应式说明。
解答:BrOOH -△OO+△O(A )O(B)+例4、化合物A (C 10H 16O 2)在气相热裂得到产物B 和C 。
其中B 的IR 在1725,1665,968cm -1有强的特征吸收。
B 的1HNMR 数据为δ1.24(三重峰,3H), δ1.88(双峰,3H), δ4.13(四重峰,2H), δ5.81[单峰(低分辨仪器不裂分),1H], δ6.95(单峰,1H),写出B,C 的结构并说明反应机理。
解答:CH 3COCH 2CH 3O△+a b cd e ABCNMRa . 1.88 双峰 3Hb . 5.81 单峰 1Hc . 6.95 单峰 1Hd . 4.13 四峰 2He . 1.24 三峰 3H H H CH 3COCH 2CH 3=OIR1725cm -1酯羰基的吸收1665cm -1双键的伸缩振动吸收968cm -1顺式烯烃C-H 键的面外弯曲振动例5、 由指定原料合成:(1) 由丙烯腈和其它开链化合物合成环己胺。
(2) 由苯、丙烯和其它必要试剂合成:OHCH(CH 3)2CH 2CH 2CH 2OH解答:(1)+CN△CN H 3+O CNH 2OBr 2-NaOHNH 2H 2NiNH 2(2)1.浓H 2SO 42.Na 2SO 3NaOH △-ONa +OHH +CH 3CH=CH 2OHH 3PO 4OHCH(CH 3)2NaOH O -Na +CH(CH 3)2CH 2=CHCH 2ClOCH 2CH=CH 2CH(CH 3)2△OHCH(CH 3)2CH 2CH=CH 2OHCH(CH 3)2CH 2CH 2CH 2OH 1.NaBH 42.H 2O 2/-OH三、习题和参考答案1、推测下列化合物的电环时产物的方法:(1)(2)H HH 3C CH 3HHH 3C CH 3(3)hv(4)(5)CH 3HCH 3H解答:(1)对旋(2)H HCH 3CH3对旋(3)HHCH 3CH 3对旋hv(4)顺旋HH(5)CH 3HCH 3H对旋CH3CH3顺旋HHCH 3CH32、推测下列化合物的环加成时产物的结构:+OO(1)(2)R+X(3)+O(4)N C +N-PhPh+PhPh解答:+O O(1)OO(2)R+XRXRX+(主)( 次)(3)+OO(4)N C +N -PhPh+Ph PhN NPhPh PhPh3、马来酸酐和环庚三烯反应的产物如下,请说明这个产物的合理性。
+OOOOOOH H HH解答:OOO对旋HH O OOH HHH4、说明下列反应过程所需的条件:HH(1)HHHHHH (2)HHHH解答:HH(1)H H HHHH (2)HHHH对旋顺旋hv顺旋hv对旋5、说明下列反应从反应物到产物的过程:RHDD?D HDR解答:RHDDDHDR 3211,3HDDR1,36、自选原料通过环加成反应合成下列化合物。
OO(1)OCHO(2)解答:OO(1)OCHO(2)+OOO+O7、加热下列化合物会发生什么样的变化?R(1)(2)解答:R (1)(2)R8、下面的反应按光化学进行时,反应产物可得到哪一种(Ⅰ或Ⅱ)?(1)hv或III(2)hv或II I解答:(1)hv I对旋(2)hv I I顺旋9、通过怎样的过程和条件,下列反应能得到给出的结果。
OOOOOPhPhOPhPh解答:OOOOOPhPhOPhPhhv对旋PhPh10、通过什么办法把反-9,10-二氢萘转化为-9,-10-二氢萘。
反-9,10-二氢萘顺-9,10-二氢萘解答:反-9,10-二氢萘顺-9,10-二氢萘hv 顺旋对旋11、确定下列反应在加热反应时所涉及的电子数:(1)H -H-(2)H+CH 3CH 3CH 3CH 3+(3)NCH 2N+_H 3CCH 3+HCH 2CCHCH H CCH 3CH 3(4)+NCNCCNCNCN CNCNNC解答:(1) 涉及的π电子数为6个 (2) 涉及的π电子数为4个 (3) 涉及的π电子数为6个 (4) 涉及的π电子数为16个 12、解释下列现象:(1)在狄尔斯-阿尔德反应中,2-丁叔基-1,3-丁二烯反应速率比1,3-丁二烯快许多。
解答:在狄尔斯-阿尔德反应中,1,3-丁烯为双烯体。
研究表明,双烯体上连接给电子取代基时,可以提高其HOMO 轨道的能量。
从而使HOMO 轨道 与亲双烯体的LUMO 能量更加接近,反应速递加快。
(2)在此-78o C 时,下面反应中(b )的反应速率比(a)的快1022倍。
NNNN+N 2+N 2(a)(b)解答:反应(a )属于环加成[2+2]的逆反应,而反应(b)属于[2+4]环加成的逆反应。
根据前线轨道理论,[2+2]环加成的热反应是禁阻的,而[4+2]环加成的热反应是允许的。
因此,在-78℃下反应(b )反应速递要比反应(a)的快很多。
(3)化合物CH2重排成甲苯放出大量的热,但它本身却相当稳定。
解答:化合物CH2为线性共轭多烯,不具有芳香性,分子的能量水平要远比芳香分子甲苯的高,因此它重排成甲苯时会释放出大量的热能。
另一方面,该烯烃重排成甲苯时,主要通过分子内[1,3]或[1,7]σ迁移反应来实现的。
根据σ迁移反应的轨道对称性原理,[1,3]和[1,7]同面迁移属于禁不住阴反应,异面迁移则会受到分子的环状结构的限制,因此,该重排反应的活化能很高,所以化合物CH2本身相当稳定。
四、小结(1)轨道对称性守恒原理和前线轨道理论;(2)电环化反应的规律;(3)环加成反应的规律;(4) 迁移反应,氢迁移和碳迁移。
Claison重排和Cope重排。
