基于CRISPR Cas9技术基因敲除小鼠(Cas9-KO)的制作方法-2018-2-28
基因敲除小鼠的制作方法

基因敲除小鼠的制作方法基因敲除小鼠是一种常用的遗传工具,在科学研究中被广泛应用于功能基因组学和疾病模型研究。
基因敲除是指通过特定技术手段,将小鼠体内的目标基因完全沉默或失活,从而研究该基因在发育、生理以及疾病机制中的功能。
本文将介绍基因敲除小鼠的制作方法,包括设计目标基因的敲除载体、胚胎干细胞的筛选和注射、外显子敲除策略的选择等。
1.设计目标基因的敲除载体敲除载体是嵌入目标基因的重要工具。
它通常包含正向与反向的同源臂(homology arms)以及选择标记(如抗生素抗性基因)。
同源臂的长度通常在2-5 kb之间,确保在同源重组时准确而有效地替代目标基因。
此外,敲除载体中还应该包含可诱导甲基化的Cre-loxP重组体系或者FLP-FRT重组体系,以用于后续的基因定向敲除或基因重新组装。
2.筛选胚胎干细胞胚胎干细胞是从内胚层发育而来的多潜能细胞,可以分化为整个鼠体的各种组织和器官。
敲除载体首先需要通过电转或霰粒枪等手段转染到胚胎干细胞系中。
转染后,胚胎干细胞需要进行抗生素筛选,以过滤未转染的细胞。
为了确保目标基因的敲除率,可以使用增强绿色荧光蛋白(eGFP)等标记基因,通过荧光显微镜观察转染细胞的表达情况。
3.敲除载体注射到小鼠受精卵中一旦确认胚胎干细胞中存在敲除载体,接下来就是将胚胎干细胞植入小鼠受精卵。
这个步骤一般由经验丰富的研究人员或者专业公司进行。
首先,选择合适的受精卵(通常为C57BL/6J小鼠品系),然后利用显微操作技术,将敲除载体注射到受精卵的核酸注入腔。
注射后,将受精卵转入对应营养液中培养一定时间,以期达到最佳着床率。
4.敲除鼠胚移植到配子体内经过培养后,将敲除的胚胎植入雌性激素准备好的代孕小鼠(通常为白色的株系,如ICR)。
移植后,将代孕小鼠继续养育,直至分娩。
5.验证敲除小鼠的敲除效果通过提取敲除小鼠的DNA,可以利用PCR、Southern blot和DNA测序等技术验证敲除效果。
《2024年利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系》范文

《利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系》篇一一、引言基因编辑技术近年来在生物学和医学领域取得了巨大的突破,其中CRISPR-Cas9系统因其高效、精确的特性,已成为基因编辑的主要工具之一。
本文旨在探讨利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系的方法和过程,为基因编辑技术的进一步应用提供参考。
二、DUSP9基因与小鼠胚胎干细胞DUSP9基因是一种重要的蛋白磷酸酶基因,其编码的蛋白在细胞信号传导过程中具有重要作用。
小鼠胚胎干细胞(Mouse Embryonic Stem Cells, mESCs)是研究发育生物学和基因编辑的重要工具。
通过构建DUSP9基因敲除的小鼠胚胎干细胞系,可以研究DUSP9基因在细胞发育、分化以及疾病发生过程中的作用。
三、CRISPR-Cas9系统简介CRISPR-Cas9系统是一种基于细菌免疫系统的基因编辑技术,其原理是通过将特定的RNA与Cas9蛋白结合,形成复合物,然后识别并切割DNA序列,从而实现对基因的敲除或修改。
CRISPR-Cas9系统具有精确度高、效率高、成本低等优点,是现代基因编辑的主要手段。
四、构建DUSP9基因敲除小鼠胚胎干细胞系的步骤1. 载体构建:设计并合成针对DUSP9基因的特异性gRNA 序列,并将其与Cas9蛋白的表达载体一起构建成CRISPR-Cas9表达系统。
2. 细胞培养与转染:将小鼠胚胎干细胞培养至适当状态,然后利用转染技术将CRISPR-Cas9表达系统导入细胞中。
3. 基因编辑:通过CRISPR-Cas9系统识别并切割DUSP9基因的DNA序列,实现DUSP9基因的敲除。
4. 克隆筛选与鉴定:筛选并培养获得成功的DUSP9基因敲除小鼠胚胎干细胞克隆,通过PCR、测序等方法鉴定敲除效果。
5. 细胞系建立与保存:将成功构建的DUSP9基因敲除小鼠胚胎干细胞系进行保存与扩大培养,以备后续研究使用。
《利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系》范文

《利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系》篇一一、引言随着基因编辑技术的发展,CRISPR-Cas9系统已成为一种强大的工具,用于在生物医学研究中精确地编辑基因组。
DUSP9基因作为一种重要的基因,其功能在多种生物学过程中起着关键作用。
因此,构建DUSP9基因敲除小鼠胚胎干细胞系,对于研究DUSP9基因的功能及其在疾病发生发展中的作用具有重要意义。
本文旨在详细介绍利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系的过程。
二、材料与方法1. 材料小鼠胚胎干细胞(mESCs)、CRISPR-Cas9系统、相关基因编辑工具、培养基、生长因子等。
2. 方法(1)设计CRISPR-Cas9系统:根据DUSP9基因的序列信息,设计合适的CRISPR-Cas9系统,包括sgRNA和Cas9蛋白。
(2)制备mESCs细胞:培养mESCs细胞至合适的状态,以便进行基因编辑。
(3)转染与编辑:将CRISPR-Cas9系统转染至mESCs细胞中,利用Cas9蛋白对DUSP9基因进行切割。
(4)筛选与鉴定:通过PCR、Western blot、qRT-PCR等方法,筛选出成功敲除DUSP9基因的mESCs细胞,并进行鉴定。
三、实验过程1. 设计并构建CRISPR-Cas9系统,选择合适的sgRNA序列和Cas9蛋白表达载体。
2. 培养mESCs细胞至合适的状态,进行转染。
3. 观察转染后的细胞生长情况,确保Cas9蛋白的表达。
4. 利用PCR、Western blot、qRT-PCR等方法筛选出成功敲除DUSP9基因的mESCs细胞。
5. 对筛选出的细胞进行扩增培养,并保存于液氮中备用。
四、结果与讨论1. 结果(1)成功构建了CRISPR-Cas9系统,并将其转染至mESCs 细胞中。
(2)成功筛选出敲除DUSP9基因的mESCs细胞,并通过PCR、Western blot、qRT-PCR等方法进行了鉴定。
基于CRISPRCas9技术的基因敲入敲除策略

基于CRISPRCas9技术的基因敲入敲除策略一、本文概述随着生物科技的飞速发展,基因编辑技术已成为现代生物医学研究的重要工具。
其中,CRISPR-Cas9技术以其高效、精确的特性,在基因敲入敲除策略中展现出了巨大的潜力。
本文旨在全面介绍基于CRISPR-Cas9技术的基因敲入敲除策略,包括其原理、应用、优缺点以及未来的发展趋势。
通过对这一技术的深入剖析,我们期望为科研人员提供一个清晰、全面的视角,以更好地理解和应用CRISPR-Cas9技术,推动生物医学领域的研究进展。
二、CRISPR-Cas9技术的基本原理CRISPR-Cas9(Clustered Regularly Interspaced Short Palindromic Repeats-CRISPR associated protein 9)技术是一种强大的基因编辑工具,它源自细菌的自然防御机制,即CRISPR系统。
这一系统允许细菌存储并记忆过去遭遇过的病毒DNA片段,以便在未来遇到相同病毒时,能够识别并切割这些病毒DNA,从而抵抗病毒感染。
CRISPR-Cas9系统通过这一机制被改造为一种精确的基因编辑工具,用于在真核细胞(如人类细胞)中进行基因敲除和敲入操作。
CRISPR-Cas9技术的基本原理可以分为三个主要步骤:目标识别、DNA切割和修复。
一个由RNA和Cas9蛋白组成的复合物被设计用来识别特定的DNA序列。
这个RNA分子,通常被称为单链导向RNA(sgRNA),能够与Cas9蛋白结合,并指导Cas9蛋白在目标DNA序列上定位。
sgRNA的设计是关键,它必须能够准确地与目标DNA序列配对,以确保Cas9蛋白能够在正确的位置进行切割。
一旦Cas9蛋白在目标DNA序列上定位,它就会切割DNA双链,产生一个双链断裂(DSB)。
细胞对DSB的修复机制有两种主要方式:非同源末端连接(NHEJ)和同源重组(HR)。
NHEJ是一种错误易发的修复方式,它通常会导致DNA序列的插入、删除或替换,从而导致基因功能的丧失,这种机制常被用于基因敲除。
《利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系》范文

《利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系》篇一一、引言随着基因编辑技术的发展,CRISPR-Cas9系统已成为现代生物医学研究中常用的基因编辑工具之一。
它为科研人员提供了强大的基因敲除、插入或突变的能力,在多种模型动物制备及疾病研究领域具有广泛的应用前景。
本文旨在介绍利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系的过程,为相关研究提供技术参考。
二、材料与方法1. 材料(1) CRISPR-Cas9系统相关组件(包括Cas9蛋白、sgRNA 等);(2) 小鼠胚胎干细胞系;(3) DUSP9基因特异性敲除载体;(4) 培养基、试剂及其他实验耗材。
2. 方法(1) 设计并构建DUSP9基因敲除载体;(2) 准备小鼠胚胎干细胞系并进行细胞培养;(3) 将DUSP9基因敲除载体与胚胎干细胞共培养,实现基因编辑;(4) 筛选并扩增成功敲除DUSP9基因的胚胎干细胞;(5) 对敲除细胞进行鉴定及保存。
三、实验过程1. DUSP9基因敲除载体的构建根据DUSP9基因序列,设计并合成sgRNA序列,构建DUSP9基因敲除载体。
通过PCR扩增获得目的片段,将其克隆至载体中,构建成功后的载体通过测序验证其准确性。
2. 小鼠胚胎干细胞的培养与准备将小鼠胚胎干细胞置于适宜的培养条件下进行培养,待细胞生长至适宜状态时进行后续实验。
3. 基因编辑及筛选将DUSP9基因敲除载体与小鼠胚胎干细胞共培养,通过CRISPR-Cas9系统实现DUSP9基因的敲除。
随后,通过PCR、测序等方法筛选出成功敲除DUSP9基因的胚胎干细胞。
4. 鉴定与保存对筛选出的成功敲除DUSP9基因的胚胎干细胞进行鉴定,包括细胞形态观察、生长曲线绘制、基因型鉴定等。
将鉴定合格的细胞进行保存,以备后续实验使用。
四、结果与讨论1. 结果通过CRISPR-Cas9系统成功构建了DUSP9基因敲除小鼠胚胎干细胞系,并筛选出成功敲除DUSP9基因的细胞。
基于CRISPRCas9技术的TRPS1基因敲除小鼠模型的构建

38基于CRISPR/Cas9技术的TRPS1基因敲除小鼠模型的构建李腾雁,刘文杰,赵宏,蔡建强*(国家癌症中心/ 国家肿瘤临床医学研究中心/ 中国医学科学院北京协和医学院肿瘤医院肝胆外科,北京 100021)李腾雁 博士研究生中国医学科学院北京协和医学院肿瘤医院肝胆外科目的:基于CRISPR/Cas9技术构建敲除TRPS1基因的杂合子小鼠,并进行鉴定。
方法: C57BL/6N小鼠自行交配后,使用Cas9/sgRNA注射受精卵的方法构建基因敲除小鼠,对可遗传的小鼠基因型进行鼠尾检测,TRPS1杂合子敲除小鼠分别与野生型小鼠交配,获得具有稳定基因型的小鼠。
结果:本实验通过使用Cas9/sgRNA注射受精卵的方法,所有繁殖小鼠经鼠尾基因型鉴定,证实成功构建了18只TRPS1基因敲除的杂合子小鼠。
结论:基于CRISPR/Cas9技术成功构建了敲除TRPS1基因的杂合子小鼠。
关键词:CRISPR/Cas9;TRPS1;结直肠癌;基因敲除小鼠摘要基金支持:国家自然科学基金(81672461) ;国家自然科学基金(81972311) ;深圳市“医疗卫生三名工程”(SZSM202011010)首都卫生发展科研专项项目(2018-1-4021);中国医学科学院医学与健康科技创新工程(2016-I2M-1-001,2017-12M-4-002) *通信作者:蔡建强************************Generation of TRPS1 knockout mice by CRISPR/Cas9-mediated gene targetingAbstractObjectives: This study aimed to construct and identify heterozygous mice knocked out of TRPS1 gene based on CRISPR/ Cas9 technology.Methods: After self-mating of C57BL/6N mice, TRPS1 knockout mice were constructed by injecting fertilized eggs with Cas9/sgRNA, and the mouse genotypes of heritable mice were detected by tail. TRPS1 heterozygous knockout mice were mated with wild-type mice to obtain mice with stable genotypes.Results: In this experiment, the fertilized eggs were injected with cas9 / sgRNA, all breeding mice were identified by tail genotype, 18 TRPS1 knockout heterozygous mice were successfully constructed.Conclusion: In this study, we successfully constructed TRPS1 knockout heterozygous mice based on CRISPR / cas9 technology, which provided a research platform for further research on the role of TRPS1 in the occurrence, development and possible liver metastasis of colorectal cancer at the animal level.Keywords: CRISPR/Cas9; TRPS1; Colorectal cancer; Gene knockout mouseLi Tengyan, Liu Wenjie, Zhao Hong, Cai Jianqiang*(National Department of Hepatobiliary Surgery, National Cancer Center/National Clinical Research Center for Cancer/ Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China)我国结直肠癌(colorectal cancer,CRC)的发病率和死亡率均保持上升趋势。
crispr-cas9基因敲除小鼠原理
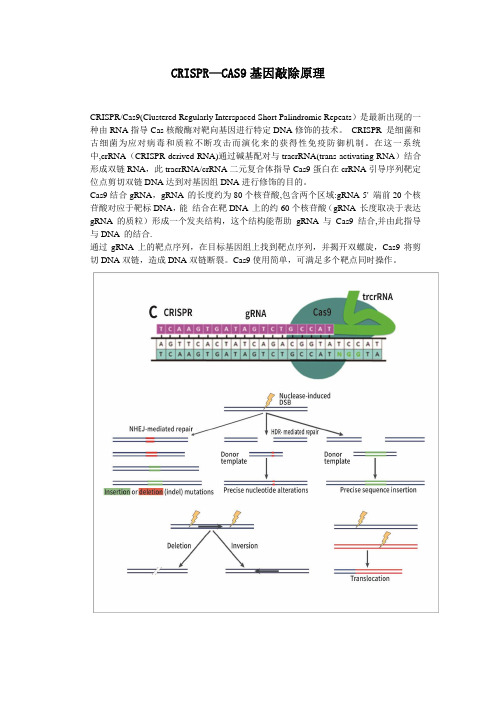
CRISPR—CAS9基因敲除原理
CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeats)是最新出现的一种由RNA指导Cas核酸酶对靶向基因进行特定DNA修饰的技术。
CRISPR 是细菌和古细菌为应对病毒和质粒不断攻击而演化来的获得性免疫防御机制。
在这一系统中,crRNA(CRISPR-derived RNA)通过碱基配对与tracrRNA(trans-activating RNA)结合形成双链RNA,此tracrRNA/crRNA二元复合体指导Cas9蛋白在crRNA引导序列靶定位点剪切双链DNA达到对基因组DNA进行修饰的目的。
Cas9结合gRNA,gRNA 的长度约为80个核苷酸,包含两个区域:gRNA 5' 端前20个核苷酸对应于靶标DNA,能结合在靶DNA 上的约60个核苷酸(gRNA 长度取决于表达gRNA 的质粒)形成一个发夹结构,这个结构能帮助gRNA 与Cas9结合,并由此指导与DNA 的结合.
通过gRNA上的靶点序列,在目标基因组上找到靶点序列,并揭开双螺旋,Cas9将剪切DNA双链,造成DNA双链断裂。
Cas9使用简单,可满足多个靶点同时操作。
Insertion /deletion NHEJ HDR
gRNA
Cas9
Donor vector
基因敲除小鼠流程:。
使用 CRISPR-Cas9 创建转基因小鼠的方案

使用 CRISPR-Cas9 创建转基因小鼠的方案虽然近年来已经开发了几种基因组编辑工具,包括锌指结构和 TALENs(转录激活物样效应物核酸酶),但没有一种能像CRISPR/Cas9系统那样高效,该系统由一个RNA引导的DNA内切酶 (Cas9) 和对应的引导RNA(CRISPR) 组成。
利用该系统,研究人员能够实现一步敲除多个基因的等位基因的突变小鼠1。
只需两三周的时间,即可创造出子携带条件性等位基因和报告基因的小鼠2,并且该方案。
特别要注意的是,该过程不需要创建修改的小鼠ES细胞过程,该过程有时会十分困难3。
随着 Cas9 敲入和敲除小鼠的发展,预计越来越多的实验室将选择 CRISPR/Cas9 系统来生成转基因小鼠模型。
使用CRISPR-Cas9创建转基因小鼠的方案动物学研究。
2016 年 7 月 18 日;37(4): 205–213.利用 CRISPR/Cas9 和单倍体胚胎干细胞系统产生基因修饰的小鼠。
图 1.在小鼠胚胎上使用 CRISPR/Cas9 基因组编辑创建转基因小鼠的示意图。
通过共注射 Cas9 mRNA 和向指导 RNA,多个基因靶标可以在小鼠胚胎中一次敲除。
(改编自Yang H,Wang H 和 Jaenisch R. Nat Protoc。
2014 年 8 月;9(8):1956-68.)Sigma-Aldrich 是为基因组编辑提供工具和定制服务的领导者,包括 ZFN 和CRISPR/cas9。
默克还提供了广泛的小鼠胚胎验证培养基和试剂组合,用于储存、转移和扩增用于在EmbryoMAX™名下创建转基因小鼠模型的小鼠胚胎。
浏览所有的基因组编辑产品浏览所有经小鼠胚胎验证的试剂小鼠胚胎和ES细胞培养基小鼠ES细胞培养基实验方案和过程成功的小鼠模型项目的提示1.了解实验目的并开展研究。
生成正确的小鼠需要完全理解被测试依据的假设。
例如,研究者可能希望验证这样的假设:突变肝脏中的转运蛋白可能会减轻特定药物的肝毒性作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
基于CRISPR Cas9技术基因敲除小鼠(Cas9-KO)的制作方法
一、CRISPR/Cas9靶向基因敲除小鼠制作的基本技术原理:
通过CRISPR/Cas9基因敲除技术,crRNA通过碱基配对与tracrRNA(trans-activating RNA)结合,形成双链RNA。
这一tracrRNA:crRNA二元复合体指导Cas9蛋白在crRNA引导序列靶标的特定位点剪切双链DNA。
在与crRNA引导序列互补的位点,Cas9蛋白的HNH核酸酶结构域剪切互补链而Cas9 RuvC-like 结构域剪切非互补链,实现敲除目的基因的功能,制备基因敲除小鼠模型。
二、具体步骤如下:
一)模型制作策略制作:利用生物信息学手段(NCBI&IMPC&MGI),分别仔细分析目的基因敲除后小鼠的生存能力及繁育能力,并结合邻近基因的影响,最终选择合适的敲除区域进行敲除方案的设计,出具相应的制作策略。
二)载体的设计和构建:使用麻省理工学院的CRISPR Design工具
(/),依据中靶Score的高低及脱靶Score的高低设计一对长度为20bp的针对靶标DNA的寡聚核苷酸链序列用于制备sgRNA,并在该靶区域设计引物用于后续阳性小鼠的基因鉴定。
1、制备sgRNA的实验方法步骤:
1)线性化pUC57-GDNA-T7载体
中提pUC57-GDNA-T7载体,用BsaI线性化过夜。
胶回收保存备用。
2)引物退火及加磷酸
将上下游引物(干粉)稀释,再进行引物退火及加磷酸。
3)连接&阳性菌落筛选
取步骤二中的加磷酸产物与线性化载体pUC57-GDNA-T7进行连接,该连接反应在干式恒温器中进行。
对连接产物进行转化,涂板,37°C培养箱过夜培养。
再用PCR&测序的方法筛选阳性克隆,再将测序正确的克隆进行甘油菌保种,-80°C保存备用
4)制备转录模板
以构建好的sgRNA载体为模板进行PCR扩增,将PCR产物切胶回收,回收产物离心后倒掉上清留DNA沉淀,再溶解DNA。
再吸1 μl测DNA浓度,浓度应介于300-500ng/μl,OD260/280介于1.8-2.0范围内。
5)最后进行sgRNA转录,将得到的sgRNA测浓度,跑电泳,分装保存。
三)Cas9/sgRNA的显微注射:将转录好的Cas9 mRNA,sgRNA混合使用显微操作仪将混合物显微注射到小鼠受精卵的胞浆中,再将受精卵移植到假孕的母鼠子宫中,等待F0代小鼠出生。
四)F0 小鼠的鉴定:在F0代小鼠出生后5-7天时,采用剪脚趾法标记小鼠,并将剪取鼠尾组织用在靶区域设计的引物进行鉴定,选取PCR阳性的样品进行测序。
五)F0代小鼠的可遗传性检测:将PCR以及测序正确的F0代小鼠与野生型C57BL/6小鼠进行交配,产生F1代小鼠,依据F0代小鼠的鉴定方法对F1代小鼠进行鉴定,获得的阳性F1代杂合子小鼠即可稳定遗传。
