羧酸和取代羧酸亲核加成消除反应
羧酸与取代羧酸

伯醇和仲醇成酯以“酰氧键断裂的机理”:
O CH3 C
-H2O
消除
OH
H+
+ OH HOC2H5
CH3 C OH
CH3
OH C OH
亲核加成 H O+C2H5
Ⅰ
Ⅱ
+ OH
-H+
CH3 C OC2H5
O CH3 C OC2H5
Ⅳ
Ⅴ
OH
+
CH3 C OH2 OC2H5
Ⅲ
11-28
伯醇和仲醇与酸成酯反应的特点: ①反应总的结果是亲核试剂醇分子中的-OR基取代了羧基中的羟基,是羧基的 亲核取代反应。 ②空间位阻对酯化反应的速度影响很大。 上述反应的中间体(Ⅱ)和 (Ⅲ)都是四面体结构,比较拥挤,如果羧酸和醇的α碳上连接的基团越多, 越大,这些中间体越不稳定,酯化反应越难进行。 酸或醇的烃基体积小、数目少,速度快。反应活性顺序如下:
11-13
问题11-2 分离苯甲酸、苯甲醇和苯酚的混合物。
COOH OH CH2OH
NaOH水溶液
水层 通CO2
溶液 H+ 晶体(苯甲酸) 晶体(苯酚)
醇层(苯甲醇)
羧酸酸性的应用: 分离、鉴别羧酸与酚
在制药工业中将羧酸制成钾盐、钠盐增加 药物的水溶性,提高药效
11-14
问题11-3 乙酸中也含有CH3CO基团,但不发生碘仿反应。为 什么?
AC
OH
性增强
O
当D为推电子基团, 酸
D C O H 性减弱
11-15
(1) 诱导效应
酸性排列顺序
HCOOH > CH3COOH >CH3CH2COOH
pKa 3.77
第十四章 羧酸衍生物 酰基碳上的亲核取代反应
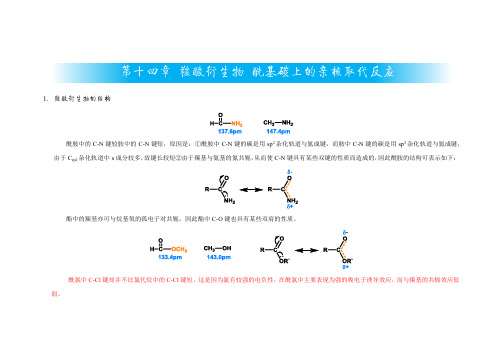
第十四章羧酸衍生物酰基碳上的亲核取代反应1.羧酸衍生物的结构酰胺中的C-N键较胺中的C-N键短,原因是:①酰胺中C-N键的碳是用sp2杂化轨道与氮成键,而胺中C-N键的碳是用sp3杂化轨道与氮成键,由于C sp2杂化轨道中s成分较多,故键长较短②由于羰基与氨基的氮共轭,从而使C-N键具有某些双键的性质而造成的,因此酰胺的结构可表示如下:酯中的羰基亦可与烷基氧的孤电子对共轭,因此酯中C-O键也具有某些双肩的性质。
酰氯中C-Cl键却并不比氯代烷中的C-Cl键短,这是因为氯有较强的电负性,在酰氯中主要表现为强的吸电子诱导效应,而与羰基的共轭效应很弱。
酰胺、酯、酰氯的共振式如下:在酰胺中具有相反电荷的偶系结构是主要的,酯中次之,而在酰氯中这种偶极结构很少。
2.羧酸衍生物的物理性质低级酰氯与酸酐是有刺激气味的液体。
高级的为固体。
低级酯具有芳香的气味,存在于水果中,可用作香料。
十四碳以下的甲酯/乙酯均为液体。
酰胺除甲酰胺外,均是固体,只是因为分子中形成氢键,如果氮上的氢逐个被取代,则氢键缔合减少,因此脂肪族的N-取代酰胺常为液体。
酰氯和酯的沸点因分子中没有缔合,比相应的羧酸低,酸酐与酰胺的沸点,比相应的羧酸高。
(乙酰氯bp:51℃乙酸酐bp:140℃乙酸乙酯bp:77℃乙酰胺bp:222℃)酰氯和酸酐不溶于水,低级的遇水分解;酯在水中的溶解度很小;低级的酰胺可溶于水,N,N-二甲基甲酰胺和N,N-二甲基乙酰胺是很好的非质子性溶剂,可与水以任何比例混合。
乙酸乙酯是很好的有机溶剂,大量用于油漆工业。
3.羧酸衍生物的反应1)酰基碳上的亲核取代反应①酰基碳上的亲核取代反应概述基团离去能力的次序是:I- > Br- > Cl- > -OCOOR > -OR > -OH > -NH2(氨基的碱性比氢氧根强)不管是酸催化还是碱催化的机理,羧酸衍生物亲核取代反应性顺序都是:卤酐醛酮(活泼)酯酸胺腈(较稳定)②羧酸衍生物的水解——形成羧酸a)酰卤的水解在羧酸衍生物中,酰卤的水解速率很快,低分子酰卤水解很猛烈,如乙酰氯在湿空气中会发烟,这是因为乙酰氯水解产生盐酸。
有机化学中的取代反应和消除反应

有机化学中的取代反应和消除反应有机化学是研究碳元素及其化合物的化学性质和变化规律的学科。
在有机化学中,取代反应和消除反应是两种常见的反应类型。
它们在有机合成和药物研发等领域中有着重要的应用。
本文将对取代反应和消除反应进行介绍和讨论。
一、取代反应1.1 取代反应的概念取代反应是指一个原子、离子或官能团被另一个原子、离子或官能团所取代的化学反应。
在有机化学中,常见的取代反应包括亲核取代反应和电子亲攻取代反应。
1.2 亲核取代反应亲核取代反应是指亲核试剂与有机分子中电子不足的部位发生反应,亲核试剂中的亲核试剂取代了有机分子中的某功能团或原子。
典型的亲核取代反应包括酯水解、醇醚化反应和酰基取代反应等。
1.3 电子亲攻取代反应电子亲攻取代反应是指亲电试剂与有机分子中的一个亲电中心发生反应,亲电试剂取代了有机分子中的某个官能团或原子。
典型的电子亲攻取代反应包括芳香取代反应和炔烃加成反应等。
二、消除反应2.1 消除反应的概念消除反应是指有机分子中两个官能团之间的化学键发生断裂,生成一个双键或三键的化学反应。
消除反应可以是单分子反应,也可以是双分子反应。
2.2 β-消除反应β-消除反应是指在有机分子中,发生在邻位(β位)碳上的消除反应。
典型的β-消除反应包括醇酸消除反应和芳香羧酸消除反应等。
2.3 δ-消除反应δ-消除反应是指在有机分子中,发生在δ位碳上的消除反应。
典型的δ-消除反应包括酮醇消除反应和烯烃酮消除反应等。
三、应用和进展3.1 应用领域取代反应和消除反应在有机合成中有广泛的应用。
它们可以用于构建复杂分子的骨架,引入特定官能团,改变分子的立体结构等。
这些反应在药物研发、材料科学和农药合成等领域中扮演着重要的角色。
3.2 进展和研究方向随着有机化学的发展,新的取代反应和消除反应不断被发现和探索。
研究人员不断提出新的催化剂、反应条件和底物设计,以改善反应效率、选择性和绿色性。
此外,有机合成中的计算化学方法和机器学习算法也得到了广泛的应用,为反应的理解和优化提供了新的思路和工具。
第12章 羧酸和取代羧酸

b-酮酸
芳香酸的脱羧反应较脂肪酸容易,尤其是邻、对位 上连有吸电子基,如:
NO 2 O 2N CO2H NO 2
H2O
NO 2 O 2N NO 2 + CO2
六)二元酸的热解反应
二元酸受热后,由于两个羧基的位置不同,而发生不同的 化学反应,有的失水,有的失羧,有的同时失水失羧。
1、乙二酸和丙二酸------脱羧
3、烷基苯氧化:制备苯甲酸及其部分衍生物
CH3 KMnO4 Cl COOH Cl
4、格氏试剂与CO2反应后水解
O RMgX + O=C=O RCOMgX H 3 O+
RCOOH
5、羧酸衍生物水解:酰卤、酸酐、酯、酰胺、腈
O RC L H 2O O L=X, OCR, OR, NH2(R) O RC OH + HL
系统命名法原则与醛相同。
1. 选择含羧基在内的最长碳链为主链
2. 从羧基碳原子开始用阿拉伯数字标明取代基等的位置 3. 按所含碳原子数目称为某酸,取代基及位次写在某酸 之前。
对于简单的脂肪酸也常用 α、β、γ 等希腊字 母表示取代基的位次;羧基永远作为C-1。
CH3 CH3-CH2-CH-CH2-CO2H
15.7 16-19
羧酸酸性的强弱决定于电离后所成的羧酸根负离子 (即共轭碱)的相对稳定性。
诱导效应、共轭效应对酸性的影响
1. 诱导效应的影响
G CH2COOG
酸性增强
CH2COO-
酸性减弱
G CH2COO-
各取代基的吸电子诱导效应的强弱次序:
NO2> CN> F> Cl> Br> I> C≡CH> OCH 3> OH > C6H5> CH=CH2> H
羧酸和取代羧酸

−CH3
4.34
钝化
−CN
3.55 −OCH3 4.46
活化 基团
基团
−CHO
3.75
−OH
4.48
−Cl
4.0
−H
4.19
有机化学(第9版)
三、化学性质
(一)酸性与成盐反应
3. 二元酸:其酸性与两个羧基的相对距离和空间位置有关,低级二元酸的
pKa2 >pKa1。
二元酸
pKa1
HOOCCOOH
1.46
一、羟基酸
(三)化学性质
3. 醇酸的脱水反应:δ、γ-羟基酸加热失水生成内酯。
有机化学(第9版)
一、羟基酸
(三)化学性质
4. 酚酸的脱羧反应:邻位或对位的酚酸加热至熔点以上时,易分解脱羧形成 相应的酚。
有机化学(第9版)
二、酮酸
(一)命名
2-氧丙酸 (α-丙酮酸) 2-oxopropanoic acid
HOOCCH2COOH HOOCCH2CH2COOH HOOC(CH2)3COOH HOOC(CH2)4COOH
2.80 4.17 4.33 4.4
有机化学(第9版)
三、化学性质
(一)酸性与成盐反应
4. 成盐:羧酸可与NaOH、NaHCO3、Na2CO3等碱反应成盐。
有机化学(第9版)
三、化学性质
(malic acid)
3-羧基-3-羟基戊二酸 (柠檬酸) 2-hydroxypropane-1,2,3-
tricarboxylic acid (citric acid)
有机化学(第9版)
一、羟基酸
(二)物理性质
醇酸比相应的羧酸或醇更易溶于水,酚酸为晶体,多以盐、酯等形式存在 于植物中,大多微溶于水。羟基酸的熔点比相同碳原子数的羧酸高。
第八章__羧酸和取代羧酸

在药物合成中常利用酯化反应将药物转变为前药 (prodrug),以改变药物的生物利用度、稳定性等。
O N N S O N OH N H N S O N O N O C O CH7 3 N H
赛他洛尔
丁酰赛他洛尔
赛他洛尔(cetarnolol)为-肾上腺能阻断剂, 可治疗 青光眼和降低眼压,由于极性强和脂溶性差, 难于透过角膜。丁酰赛他洛尔的脂溶性增高,制成 的滴眼剂透过角膜的能力增加了4-6倍,进入眼球 后,经酶水解再生成赛他洛尔而起效。
无机酸 > RCOOH > H2CO3 >
1-2 4-5 6.4(pka1) 9-10
> H2O > ROH
15.7 16-19
羧酸酸性的强弱取决于电离后所形成的羧酸根 负离子(即共轭碱)的相对稳定性 。
HCOOH CH3COOH ClCH2COOH CH3CH2COOH C6H5COOH 3.77 4.74 2.86 4.88 4.20
A:代表各种基团
一般一元羧酸很难直接脱羧。当羧酸分子中-碳原 子上连有吸电子取代基时脱羧反应比较容易进行。
Cl3CCOOH 50℃ CHCl3 + CO2
NO 2 O 2N CO2H NO 2
H2O
NO 2 O 2N NO 2 + CO2
D
丙二酸型化合物的脱羧
Y CH2CO2H Y CH3 + CO 2 比较容易脱羧
P P
ClCH2COOH 一氯乙酸 Cl2CHCOOH 二氯乙酸 Cl3CCOOH 三氯乙酸
P
三卤化磷或红磷是催化量,否则-OH继续被溴取代(P494:147)
控制卤素用量可得一元或多元卤代酸。 - 碘代酸由- 氯(或溴)代酸与KI反应 来制备。 -卤代酸很活泼,常用来制备-羟基酸 和-氨基酸、丙二酸等。
亲电取代和亲核取代例子
亲电取代和亲核取代例子亲电取代和亲核取代是有机化学中常见的反应类型,它们分别是指一个原子或基团被一个亲电试剂取代或被一个亲核试剂取代。
下面将分别列举十个例子来说明这两个反应类型。
亲电取代:1. 醇的酸催化醚化反应:醇与酸催化剂反应生成醚。
例如,乙醇与浓硫酸反应生成乙醚。
2. 卤代烷的亲电取代反应:卤代烷与亲电试剂反应生成取代产物。
例如,溴乙烷与氢氧化钠反应生成乙醇。
3. 酮的氧化反应:酮与亲电氧化剂反应生成酮酸。
例如,丙酮与高锰酸钾反应生成丙酮酸。
4. 脂肪酸的酯化反应:脂肪酸与醇反应生成酯。
例如,乙酸与乙醇反应生成乙酸乙酯。
5. 酸催化的烯烃加成反应:烯烃与亲电试剂反应生成加成产物。
例如,丙烯与溴反应生成1,2-二溴丙烷。
6. 羰基化合物的亲电取代反应:羰基化合物与亲电试剂反应生成取代产物。
例如,醛与氨反应生成胺。
7. 羧酸的酯化反应:羧酸与醇反应生成酯。
例如,乙酸与乙醇反应生成乙酸乙酯。
8. 酰卤的亲电取代反应:酰卤与亲电试剂反应生成取代产物。
例如,酰氯与氨反应生成酰胺。
9. 羟醛的亲电取代反应:羟醛与亲电试剂反应生成取代产物。
例如,甲醛与氨反应生成甲酰胺。
10. 羧酸的酯化反应:羧酸与醇反应生成酯。
例如,乙酸与乙醇反应生成乙酸乙酯。
亲核取代:1. 卤代烷的亲核取代反应:卤代烷与亲核试剂反应生成取代产物。
例如,溴乙烷与氢氧化钠反应生成乙醇。
2. 酮的亲核取代反应:酮与亲核试剂反应生成取代产物。
例如,丙酮与甲胺反应生成N-甲基丙酮胺。
3. 羰基化合物的亲核取代反应:羰基化合物与亲核试剂反应生成取代产物。
例如,醛与氨反应生成胺。
4. 酸催化的醇的酯化反应:醇与酸催化剂反应生成酯。
例如,乙醇与乙酸反应生成乙酸乙酯。
5. 羧酸的亲核取代反应:羧酸与亲核试剂反应生成取代产物。
例如,乙酸与氨反应生成乙酰胺。
6. 羧酸的酯化反应:羧酸与醇反应生成酯。
例如,乙酸与乙醇反应生成乙酸乙酯。
7. 羟醛的亲核取代反应:羟醛与亲核试剂反应生成取代产物。
13-2 羧酸衍生物化学性质讲解
NaCN P2O5
(CH3)3C CN (CH3)3C CN
2019/5/1
17
霍夫曼(Hofmann)酰胺降级反应
酰胺与次卤酸钠的碱溶液作用,脱去羰基生成比原 料少一个碳的胺的反应,称为霍夫曼酰胺降级反应。
O
R C NH2 + NaOX
应用:
+ NaOH
RNH2 + + Na2CO3 NaX + H2O
(十三) 羧酸衍生物
主讲教师:陈霞
1.亲核取代 (1)水解 (2)醇解 (3)氨解 (4)与RMgX反应 2.还原反应 (1)催化加氢 (2)化学试剂还原 3.酰胺N上的反应 (1)脱水反应 (2)霍夫曼酰胺降解反应
羧酸衍生物的化学性质
羧酸衍生物,结构相似,因此化学性质相似; 但四种羧酸衍生物又各自有各自的特点,则表现 为它们的化学性质,也有各自一些不同的性质。
R'MgBr 无水 醚
OMgBr
Br R'
O
-Mg
R C OR''
OR''
RC
R'
R'
R'MgBr 无水 醚
OMgBr R C R'
H3O+
OH R C R'
R'
R'
2019/5/1
11
与RMgX反应成醇
但若采用的是甲酸酯,则得到含两相同烷基的仲醇。
O H C OR
如制备5-壬醇
2 R'MgX 无水 醚
O
C O
NH3
C
O
丁二酸酐
O
C NH2 300℃
羧酸衍生物答案
羧酸衍生物答案1、下列羧酸中,酸性最强的是:A、2-氟丙酸B、2-氯丙酸C、2-溴丙酸D、丙酸答案:2-氟丙酸--------------------------------2、由于p-π共轭的影响,使羧基中的C=O键长较醛、酮羰基键长略有所增长,而其C—O键长较醇中的C—O键长短。
答案:对--------------------------------3、将丙酸转化为2-甲基丙二酸,判断下列合成路线是否合理?答案:-------------------------------- 1、下列化合物俗名为:A、乳酸B、苹果酸C、柠檬酸D、酒石酸答案:柠檬酸-------------------------------- 2、下列化合物,经过Tollens试剂作用,然后在酸性条件下加热,得到产物是。
答案:环戊酮-------------------------------- 1、羧酸衍生物水解反应的活性次序是:酰卤脂肪胺> NH3 >芳香胺答案:对-------------------------------- 3、判断下列反应是否正确:答案:错-------------------------------- 1、吡咯、呋喃、噻吩中的杂原子和碳原子均采用sp2杂化轨道成键,每个环中的杂原子提供两个p电子,每个碳原子提供一个p电子,形成6π电子的芳香体系。
答案:对-------------------------------- 2、判断下列反应是否正确:答案:错-------------------------------- 1、发生亲电取代反应活性最高的是:A.a>b>c>d B.b>a>c>d C.d>c>b>a D.c>b>d>a答案:D-------------------------------- 2、下列化合物命名正确的是:A、4-甲基噻唑B、3-甲基噻唑C、2-甲基噻唑D、5-甲基噻唑答案:4-甲基噻唑--------------------------------3、下列化合物碱性由大到小顺序是:④>③>②>①①>②>③>④④>③>①>②②>③>④>①答案:④>③>①>②--------------------------------1、下列羧酸中,酸性最强的是:A、2-氟丙酸B、2-氯丙酸C、2-溴丙酸D、丙酸答案:2-氟丙酸--------------------------------2、由于p-π共轭的影响,使羧基中的C=O键长较醛、酮羰基键长略有所增长,而其C—O键长较醇中的C—O键长短。
羧酸和取代羧酸亲核加成-消除反应
R CH2OH
1. LiAlH4 2. H2O
直接还原羧酸: LiAlH4用量多, 反应开始剧烈, 后较慢,
先酯化再还原: 反应较易进行,产率较好, 反应条件相对比较温和, LiAlH4用量较少
➢ 合成上由羧酸 制备伯醇,宜先酯 化再还原
补充内容:能被LiAlH4还原的化合物及其产物类型
O R CH
✓ P-π共轭=> C=O键增长:120—>123 pm
✓
C—O键缩短:143—>136 pm
✓ 使得羧基碳原子上的正电性削弱 ✓ —>亲核加成比醛酮难
✓ O—H键极化加大,键变弱,H+易离去—>酸性
✓ α—H受C=O吸电子的影响,仍有酸性,但比醛酮弱
1、酸性:
羧酸根负离子的共振式与稳定性
O
B:
-溴十一碳酸
二、羧酸的物理性质:
1、分子中有两个部位可形成H-键,常以二聚体存在。
R-C
O H-O O-H
O
C-R
1)、b.p很高(比M相近的醇高)
例:
M甲酸 = M乙醇,
b.p 100.7℃ 78.5℃
2)、与水形成H-键=>易溶于水
C1—C4 的酸与水混溶,R增大,水溶性↓
波谱性质:
IR:特征吸收: νC=O: 缔合 1725-1700cm-1 不饱和芳香 1680-1700 cm-1
COOH OCOCH3
阿司匹林 (解热镇痛)
(CH3)2CHCH2—
CH3 CH-COOH
布洛芬(抗炎镇痛)
O CH2–C–NH—
O
S CH3
N
CH3 COOK
青霉素G钾(抗菌剂)
一、分类和命名: O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
13
不溶
Organic Chem
思考题:
如何分离苯酚、苯甲醇和苯甲酸?
COOH CH2OH OH
NaOH
水
CH2OH 油
COONa CO2 ONa
水
COONa
OH 油
可编辑ppt
14
Organic Chem
电子效应对酸性的影响:
诱导效应:X—CH2COOH
➢ -I使酸性增强 X= F Cl Br I CHO NO2
( 末 端 ) C H 2 (C H 2 )9 C O O H B r
-溴十一碳酸
可编辑ppt
6
Organic Chem
二、羧酸的物理性质:
1、分子中有两个部位可形成H-键,常以二聚体存在。
O H-O
R-C
C-R
O
O-H
1)、b.p很高(比M相近的醇高)
例:
M甲酸 = M乙醇,
b.p 100.7℃ 78.5℃
✓ OH氧上带孤对电子,与C=O的π键共轭
✓ P-π共轭=> C=O键增长:120—>123 pm
✓
C—O键缩短:143—>136 pm
✓ 使得羧基碳原子上的正电性削弱 ✓ —>亲核加成比醛酮难
✓ O—H键极化加大,键变弱,H+易离去—>酸性
✓ α—H受C=O吸电子的影响,仍有酸性,但比醛酮弱
可编辑ppt
2)、与水形成H-键=>易溶于水
C1—C可4编的辑pp酸t 与水混溶7 ,R增大,水溶性Org↓anic Chem
波谱性质:
IR:特征吸收: νC=O: 缔合 1725-1700cm-1 不饱和芳香 1680-1700 cm-1
νO-H:缔合二聚体 2500-3300— >3550 cm-1游离
辅助:ν C-O: ~ 1250cm-1
2、命名
a) 俗名: HCOOH
甲酸 — 蚁酸
CH3COOH 乙酸 — 醋酸
OHOH HOOC-CH-CH-COOH
酒石酸
OH CH3-CH-CH2-COOH
苹果酸可编辑ppt
4
OH CH3-CH-COOH
乳酸
CH2COOH
HO CHCOOH
CH2COOH
柠檬酸
Organic Chem
b) 系统命名法 IUPAC命名法:
可编辑ppt
8
Organic Chem
可编辑ppt
9
Organic Chem
可编辑ppt
10
Organic Chem
羧酸的化学性质 羧酸的结构及化学性质分析
羰基不饱和, 可加成、还原
R CH H
羧基可脱去 CO2
O COH
H有酸性
羰基 -H,有弱 酸性,可取代
可编辑ppt
11
OH 可被取代
Organic Chem
R—C—NH2
R C NH2(R)
酰胺
O
HOR' 羧酸衍H+生物 R—C—OR' + H2O
共同的反应历程:
O
O
O
R — C — O H + N u
R — C — O H
R — C — N u +O H
O
消 除 取 代 产 物
可编辑ppt
17
N u=X , R — C — O, N H 2 , O R '
2、羧基中羟基被取代的反应:
PCl3
O
O
H3PO3(200酰C分卤解)
回R流 C X
PCl5
R—C—Cl +POCl3 +HCl
OO RR—CC—OOHH +
羧酸
SOCl2
R
O C
O
O
SO2
CR
+HCl
酸酐
O HO—C—R' OP2O5
O
O
R—C —O— C —R'
R C OR'O来自酯H —NH2 O
通式 : RCOOH or ArCOOH
共同的功能团:COOH (Carboxyl group)
COOH OCOCH3
(CH3)2CHCH2—
CH3 CH-COOH
阿司匹林 (解热镇痛)
布洛芬(抗炎镇痛)
O
CH2–C–NH—
S CH3
N
O
CH3
COOK
可编青辑p霉pt 素G钾(抗菌2 剂)
Organic Chem
选取含取代基的最长碳链——主链 从靠近羧基的一端开始编号 取代基、重键的位置用阿拉伯数字(或希腊字母)标出
4
32 1
CH3-C CH-COOH
CH3
COOH N O2
3-甲基-2-丁烯酸
3-硝基苯甲酸(或间-)
CH3CH2CHCH2COOH
CH3
可编辑pβpt -甲基戊酸(5 3-甲基戊酸)
有
机 化
第十一章 羧酸和取代羧酸
学
亲核加成-消除反应
学习要求:
1、掌握:羧酸的结构、命名,羧酸的酸性,羧酸衍生物的形成,
羧酸的还原及卤代反应,羟基酸、卤代酸的反应;
2、熟悉:羧酸的制备方法,二元酸受热变化规律; 3、了解:一些重要羧酸的俗名,羧酸的物理性质,波谱特征 。
可编辑ppt
1
Organic Chem
Organic Chem
C O O H O H
C H 2 C H 2 C O O H
H 3 C 反-2-丁烯酸
C O O H OC O O H
邻羟基苯甲酸
呋喃甲酸
苯丙酸
巴豆酸
水杨酸
3-苯基丙酸
OO H 3 C O H
-羰基丁酸 乙酰乙酸
H 2 N C H C O O H
C H 2 C O O H -氨基丁二酸
pKa 2.66 2.86 2.90 3.18 3.53 1.68
N(CH3)3
1.83
➢ +I使酸性减弱 HCOOH
pKa 3.75
CH3COOH (CH3)2CHCOOH
4.76
4.86
可编辑ppt
15
Organic Chem
C l
C l
H
H
C l C C O 2 HC l C C O 2 HC l C C O 2 HHC C O 2 H
C l
H
H
H
Ka 23200×10-5
5530×10-5
136×10-5
1.75×10-5
应用:利用羧酸的酸性分离和纯化化合物
混 合 物
水 相
H+
RCO2
R CO2H
OH
+
有 机 溶 剂 萃 取
非 酸 性 化 合 物
有 机 相
非 酸 性 化 合 物
RCO2H
可编辑ppt
16
Organic Chem
12
Organic Chem
1、酸性:
羧酸根负离子的共振式与稳定性
O
B:
R C OH
R
O C
O
O RC
O
有两个完全 等价的共振式
酸性大小:
O RC
O
大多无机酸> 羧酸 > H2CO3 > 苯酚 > ROH pKa(甲酸3.75) 4.75-5 6.37 9.98 16-19
溶于Na2CO3
可编辑ppt
一、分类和命名:
O
1、分类:
R C OH
➢根据分子中羧基的数目:酰 基 (acyl) 羧 基 (carboxyl)
一元酸 mon-
二元酸 di-
多元酸 pl-
➢ 根据R的性质:
饱和烷基 O
芳基
O
R C O H
A r C O H
脂肪酸可编辑ppt
芳香酸3
O
R
C
O H
R '
R "
不饱和酸 Organic Chem
